Los ictus cardioembólicos representan un 20-30% del total de los ictus isquémicos1. Con la introducción en 2014 del término «ESUS» o «ictus embólico de origen indeterminado» y ante el importante número de ictus criptogénicos no lacunares, la hipótesis de una fuente embólica no conocida ha llevado a una búsqueda exhaustiva. Esta incluye la monitorización cardiaca prolongada, lo que aumenta la sensibilidad para identificar arritmias proembolígenas paroxísticas2. Si bien en un inicio no se conocía la capacidad de dichos paroxismos cardiacos para ocasionar eventos isquémicos, estudios paralelos sobre la fisiopatología del ictus cardioembólico han demostrado que fibrilaciones auriculares (FA) paroxísticas de 5-6 min ya aumentan el riesgo de ictus3,4.
La escasa duración de estos episodios y el hecho de que puedan ser asintomáticos y distanciados del momento del cuadro neurológico3,5 explican su inclusión durante el ingreso hospitalario en el conjunto de ictus de etiología indeterminada. La heterogeneidad de dicho grupo, junto con el limitado uso de la monitorización cardiaca prolongada, ya sea por mala tolerancia de los pacientes o por la escasez y disparidad de los dispositivos, ha incentivado la búsqueda de parámetros que se correlacionen con mayor incidencia de FA6 con el objetivo de aumentar la rentabilidad de la prueba. Estos parámetros incluyen aspectos electrocardiográficos, bioquímicos y ecocardiográficos, y en el análisis de muchos de ellos se ha visto su relación, no solo con la FA, sino también su asociación directa con ictus isquémicos o recurrencias1,7.
Presentamos el caso de una paciente con ictus isquémico agudo y signos morfológicos y funcionales de cardiopatía de aurícula izquierda (AI) en ecocardiografía, que se correlacionaban con el hallazgo posterior de FA paroxística.
Se trata de una mujer de 77 años y funcionalmente autónoma que acude a Urgencias por cuadro consistente en hemiparesia derecha y afasia mixta. A su llegada puntúa un 1 en la NIHSS a expensas de la alteración del lenguaje, con recuperación completa a las 3 h de inicio de la clínica. Con TC cerebral basal sin signos de sangrado ni de isquemia aguda y una puntuación en la escala ABCD2 de 7, queda ingresada en la Unidad de Ictus para vigilancia y monitorización cardiaca. Tras 18 h asintomática, presenta un episodio de afasia mixta aislada (NIHSS 4) con nuevo TC cerebral sin cambios: se procede a la fibrinólisis intravenosa, con una progresiva recuperación.
En cuanto al estudio etiológico, se trata de una paciente hipertensa, dislipémica y diabética de tipo 2, con buena adherencia al tratamiento farmacológico y parámetros analíticos en rango objetivo. Portadora desde 2012 de marcapasos cardiaco DDDR por bloqueo auriculoventricular completo con disfunción sinusal, el último control ecocardiográfico de 2016 muestra una hipertrofia ligera de ventrículo izquierdo e insuficiencia mitral, sin alteración de la morfología auricular ni otros datos de cardiopatía estructural. Ante los 2episodios de focalidad brusca, uno de ellos consistente en afasia aislada, se solicitó al Servicio de Cardiología un registro retrospectivo del dispositivo del marcapasos.
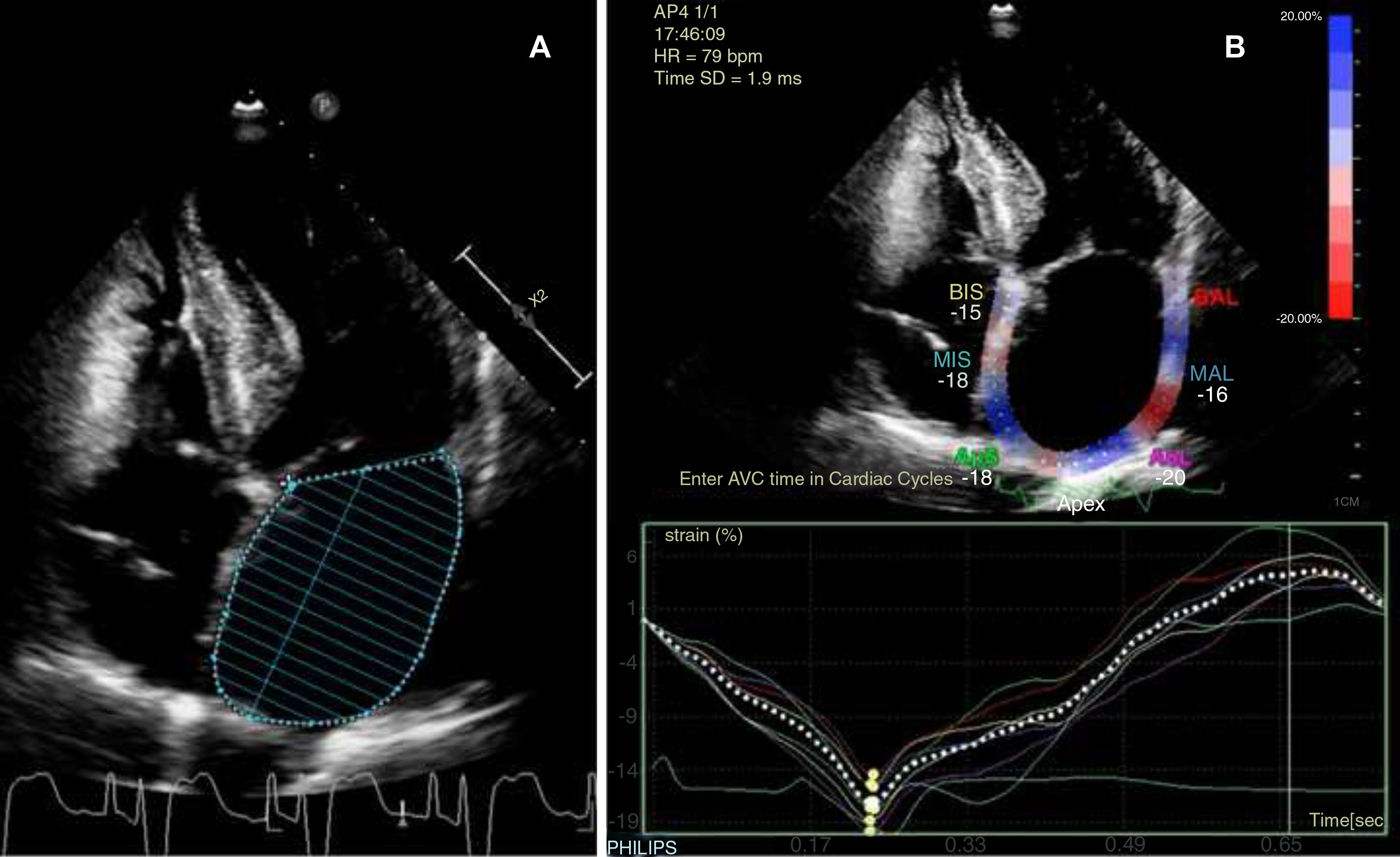
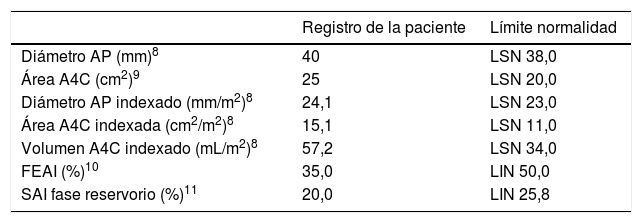
A la espera de los resultados, se continuó con el estudio y se la pasó a planta de hospitalización tras telemetría cardiaca de 24 h en ritmo sinusal y sin episodios de arritmias. La ecografía doppler de troncos supraaórticos mostraba placas de ateroma en ambos territorios carotídeos sin compromiso hemodinámico, mientras que en la valoración transcraneal no se apreciaron estenosis. Se realizó, una ecocardiografía transtorácica (ETT) con los resultados indicados en la tabla 1, ajustados de acuerdo con el área de superficie corporal (1,657 m2). El diámetro y área auricular son compatibles con AI ligeramente dilatada, mientras que los datos de volumen y actividad funcional, como la fracción de eyección de AI (FEAI) y el strain de AI (SAI), indican una afectación más grave de la cámara (fig. 1). Recibidos posteriormente los datos de registro del marcapasos, estos mostraron un episodio paroxístico de FA de 17 h de duración 3 meses antes y otro 4 días después del evento, con ritmo sinusal al momento de la clínica neurológica.
Resultados de la ecocardiografía transtorácica de nuestra paciente, con medición de parámetros morfológicos y funcionales de la aurícula izquierda ajustados a superficie corporal y sexo
| Registro de la paciente | Límite normalidad | |
|---|---|---|
| Diámetro AP (mm)8 | 40 | LSN 38,0 |
| Área A4C (cm2)9 | 25 | LSN 20,0 |
| Diámetro AP indexado (mm/m2)8 | 24,1 | LSN 23,0 |
| Área A4C indexada (cm2/m2)8 | 15,1 | LSN 11,0 |
| Volumen A4C indexado (mL/m2)8 | 57,2 | LSN 34,0 |
| FEAI (%)10 | 35,0 | LIN 50,0 |
| SAI fase reservorio (%)11 | 20,0 | LIN 25,8 |
A4C: proyección de 4 cámaras; AP: anteroposterior; ASC: área de superficie corporal; FEAI: fracción de eyección de aurícula izquierda; LIN: límite inferior de normalidad; LSN: límite superior de normalidad; SAI: strain de aurícula izquierda.
La paciente fue finalmente dada de alta asintomática, con el diagnóstico de ictus isquémico de origen cardioembólico secundario a FA paroxística. Se inició terapia anticoagulante oral; a los 3 meses se mantenía en un estado funcional similar al previo al ingreso hospitalario (puntuación en la mRS de 1).
De acuerdo a lo expuesto en el caso, nos encontrábamos ante una paciente sin datos de ateroesclerosis significativa extra- o intracraneal y telemetría cardiaca de 24 h en ritmo sinusal, y pendientes del registro retrospectivo del marcapasos. Dada la mayor asociación existente entre afasia aislada y arritmias cardioembólicas12, decidimos realizar un estudio exhaustivo de ETT con el objetivo de valorar parámetros que apoyasen una posible monitorización cardiaca prolongada posterior en caso de no encontrar hallazgos relevantes en el registro del dispositivo, dada la ya comentada limitada relación temporal entre episodio de FA y momento del ictus5.
Los parámetros ecocardiográficos habitualmente utilizados en nuestro centro para la caracterización de la AI son el diámetro anteroposterior y el área, indexados cuando es posible al área de superficie corporal para evitar la variabilidad según sexo. Sin embargo, se ha observado que estos tienden a una infraestimación de las dimensiones reales auriculares en comparación con la volumetría, al tratarse de medidas lineales que no permiten registrar la deformación heterogénea de la aurícula en diferentes planos8. Este mayor rendimiento del volumen de AI tenía como contrapartida la dificultad en su correcta medición, pero los avances técnicos han permitido simplificar su cálculo y afianzarlo como el parámetro morfológico recomendado en la práctica clínica, en detrimento de los anteriormente mencionados8,9. Otro dato estructural que podría resultar también de utilidad, pero con hallazgos todavía contradictorios, sería el análisis del apéndice de AI mediante ecocardiografía transesofágica, dada la posible asociación de determinados patrones morfológicos a mayor riesgo de tromboembolia13.
En cuanto a la valoración funcional de la AI, se trata de mediciones menos utilizadas, pero que también se han correlacionado con mayor riesgo de FA e ictus isquémico, independientemente de la situación morfológica de la cámara10,11. Esta asociación, incluso en pacientes con AI de morfología normal, muestra un cambio con respecto al concepto clásico de tipificar el daño auricular solo por la dilatación de la cámara. De estos parámetros podemos destacar la FEAI y el SAI. Este último es una medición de la deformación miocárdica mediante técnicas ecográficas de speckle tracking o «seguimiento de marcas», que informa de la capacidad contráctil auricular y cuya disminución se relaciona con degeneración estructural11.
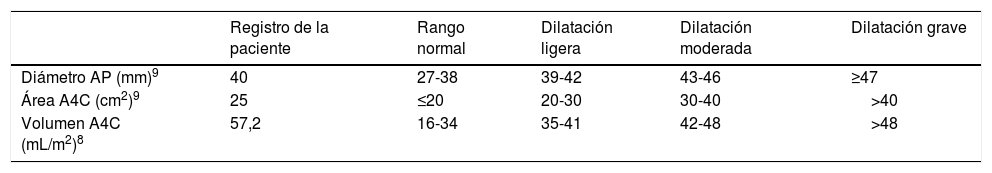
Si analizamos los resultados mostrados en la tabla 1 con las consideraciones aportadas sobre los distintos parámetros ecocardiográficos, un estudio ETT habitual en nuestro centro (valoración de AI a través de diámetro anteroposterior y área) solo hubiera mostrado una cámara ligeramente dilatada, cuando en realidad nos encontramos ante una grave dilatación auricular de acuerdo con los datos volumétricos (tabla 2). Este resultado, que de otra manera hubiéramos pasado por alto, permite asociarlo no solo con una mayor incidencia de FA sino también con recurrencia de ictus14. Por su parte, el descenso de la FEAI por debajo del 50% y un SAI en fase reservorio inferior al 25,8% también enfocarían hacia una posible FA paroxística subyacente10,11.
Resultados morfológicos de aurícula izquierda de nuestra paciente mediante ecocardiografía transtorácica y clasificación según gravedad
| Registro de la paciente | Rango normal | Dilatación ligera | Dilatación moderada | Dilatación grave | |
|---|---|---|---|---|---|
| Diámetro AP (mm)9 | 40 | 27-38 | 39-42 | 43-46 | ≥47 |
| Área A4C (cm2)9 | 25 | ≤20 | 20-30 | 30-40 | >40 |
| Volumen A4C (mL/m2)8 | 57,2 | 16-34 | 35-41 | 42-48 | >48 |
A4C: proyección de 4 cámaras; AP: anteroposterior.
Este interés que han despertado la ecocardiografía y otros indicadores bioquímicos y electrocardiográficos (niveles de pro-BNP, fuerza terminal de la onda P en V1…) en el estudio etiológico del ictus con el objetivo de identificar una probable arritmia proembolígena responden a la teoría clásica de la FA como causa del remodelado cardiaco, estasis venosa y consecuente fuente tromboembólica. Sin embargo, conforme más estudios indagan sobre la asociación entre estos parámetros y la incidencia de FA, más se ha visto la correlación directa de muchos de ellos con la incidencia y recurrencia de ictus isquémico, independientemente de que el paciente presentara o no FA1,7. Como consecuencia, en los últimos años se postula una fisiopatología del ictus cardioembólico más compleja, en la que el concepto de cardiopatía auricular como disfunción capaz de aumentar el riesgo embolígeno per se gana peso, y se mantiene la FA como causa, agravante o consecuencia, según los casos, pero sin tener que ser factor indispensable del ictus cardioembólico1,7,15.
No obstante, con independencia de estas nuevas hipótesis fisiopatológicas de formación del trombo, la FA sigue siendo un factor cardioembólico mayor y su detección guarda una importante relación con el tipo y duración de la monitorización cardiaca realizada15. En este sentido, nuestra paciente ejemplificaría la utilidad de determinados parámetros ecocardiográficos por su relación con una mayor incidencia de FA subyacente, como fue el caso. Es además de especial relevancia que se trate de los únicos factores de nuestra paciente asociados a arritmia proembolígena, teniendo en cuenta el interés que está despertando la ecocardioscopia en la formación del neurólogo.
Como conclusión, destacaríamos que ante ictus isquémicos de etiología indeterminada existen distintas herramientas que permiten sospechar un sustrato proembolígeno. Cuando las más habituales no sean indicativas de ello, el estudio morfológico de la AI mediante volumetría o la valoración funcional a través de la FEAI y el SAI pueden darnos la información necesaria para la selección de pacientes subsidiarios de monitorización cardiaca prolongada que permita un mejor despistaje de FA y la consiguiente implicación terapéutica.