Hemos leído con gran interés el artículo de Velayos-Galán et al.1. Queremos comentar un caso similar de síndrome de Guillain-Barré (GBS, por sus siglas en inglés), después de haber sufrido neumonía bilateral por SARS-CoV-2 y reflexionar sobre lo que se ha publicado sobre esta entidad.
El 4 de mayo de 2020, un varón de 70 años presentó debilidad subaguda en los 4 miembros, que empeoró en 5 días. Había sufrido una neumonía bilateral inducida por SARS-CoV-2, 3 semanas antes: la TC de tórax mostró opacidades en vidrio esmerilado en ambos pulmones, la PCR nasal y orofaríngea fue positiva, y fue tratado con reservorio de oxígeno, hidroxicloroquina, azitromicina, ceftriaxona y dexametasona. No tenía antecedentes patológicos de interés. Su temperatura corporal era de 36,5° C, la saturación basal de oxígeno era del 99%. La auscultación pulmonar no mostró anormalidades. El examen neurológico mostró debilidad asimétrica (Medical Research Council grado 4/5, mano derecha; 4+/5, mano izquierda; 4/5, pierna izquierda y 3+/5, pierna derecha) y arreflexia en piernas y pies. Dos días después del ingreso, sus síntomas progresaron. La fuerza muscular fue de grado 3/5 en brazos y manos y 3/5 en piernas y pies. La sensibilidad al tacto ligero y al pinchazo estaba disminuida distalmente.
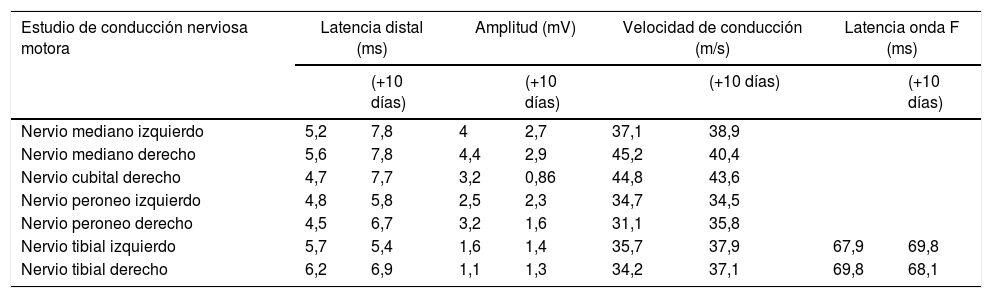
Los resultados de laboratorio al ingreso mostraban linfocitopenia (0,52×103/l; normal: 1,1-3,2×103/l) y trombocitopenia (113×103/l; normal: 125-300×10?/l) Las pruebas de LCR (día 4) mostraron recuentos celulares normales (0×103/l; normal: 0-8×103/l) y un leve aumento del nivel de proteína (49mg/dl; normal: 8-43mg/dl). Los estudios de conducción nerviosa (día 6) exhibieron latencias distales retrasadas y ausencia de ondas F en el curso temprano, en el contexto de polirradiculoneuropatía motora aguda de tipo mixto (axonal y desmielinizante) de intensidad moderada y simétrica en las 4 extremidades, con afectación axonal sensitiva asociada, pérdida de unidades motoras y signos de afectación neurógena en musculatura explorada, sin denervación aguda (tabla 1). Se le diagnosticó de SGB y se iniciaron inmunoglobulinas IV a dosis altas (0,4g/kg/día/durante 5 días) 8h después del ingreso, mostrando mejoría clínica en el tercer día de tratamiento.
Parámetros de conducción motora y sensitiva
| Estudio de conducción nerviosa motora | Latencia distal (ms) | Amplitud (mV) | Velocidad de conducción (m/s) | Latencia onda F (ms) | ||||
|---|---|---|---|---|---|---|---|---|
| (+10 días) | (+10 días) | (+10 días) | (+10 días) | |||||
| Nervio mediano izquierdo | 5,2 | 7,8 | 4 | 2,7 | 37,1 | 38,9 | ||
| Nervio mediano derecho | 5,6 | 7,8 | 4,4 | 2,9 | 45,2 | 40,4 | ||
| Nervio cubital derecho | 4,7 | 7,7 | 3,2 | 0,86 | 44,8 | 43,6 | ||
| Nervio peroneo izquierdo | 4,8 | 5,8 | 2,5 | 2,3 | 34,7 | 34,5 | ||
| Nervio peroneo derecho | 4,5 | 6,7 | 3,2 | 1,6 | 31,1 | 35,8 | ||
| Nervio tibial izquierdo | 5,7 | 5,4 | 1,6 | 1,4 | 35,7 | 37,9 | 67,9 | 69,8 |
| Nervio tibial derecho | 6,2 | 6,9 | 1,1 | 1,3 | 34,2 | 37,1 | 69,8 | 68,1 |
| Estudio de conducción nerviosa sensitiva | Amplitud (μV) | Velocidad de conducción (m/s) | ||
|---|---|---|---|---|
| (+10 días) | (+10 días) | |||
| Nervio mediano izquierdo | 2,4 | 46,9 | ||
| Nervio mediano derecho | 4,4 | 6,2 | 47,3 | 49,7 |
| Nervio cubital derecho | 8,3 | Ausente | 50 | Ausente |
| Nervio sural izquierdo | 4,2 | 2,9 | 46,5 | 45,1 |
| Nervio sural derecho | 4,6 | 3,9 | 48,5 | 48,5 |
Al alta, al decimocuarto día de ingreso, solo tenía debilidad leve en el interóseo de ambas manos (4+/5) y flexores dorsales de ambos pies (4+/5), así como arreflexia generalizada. Al alta la PCR para SARS-CoV-2 fue negativa.
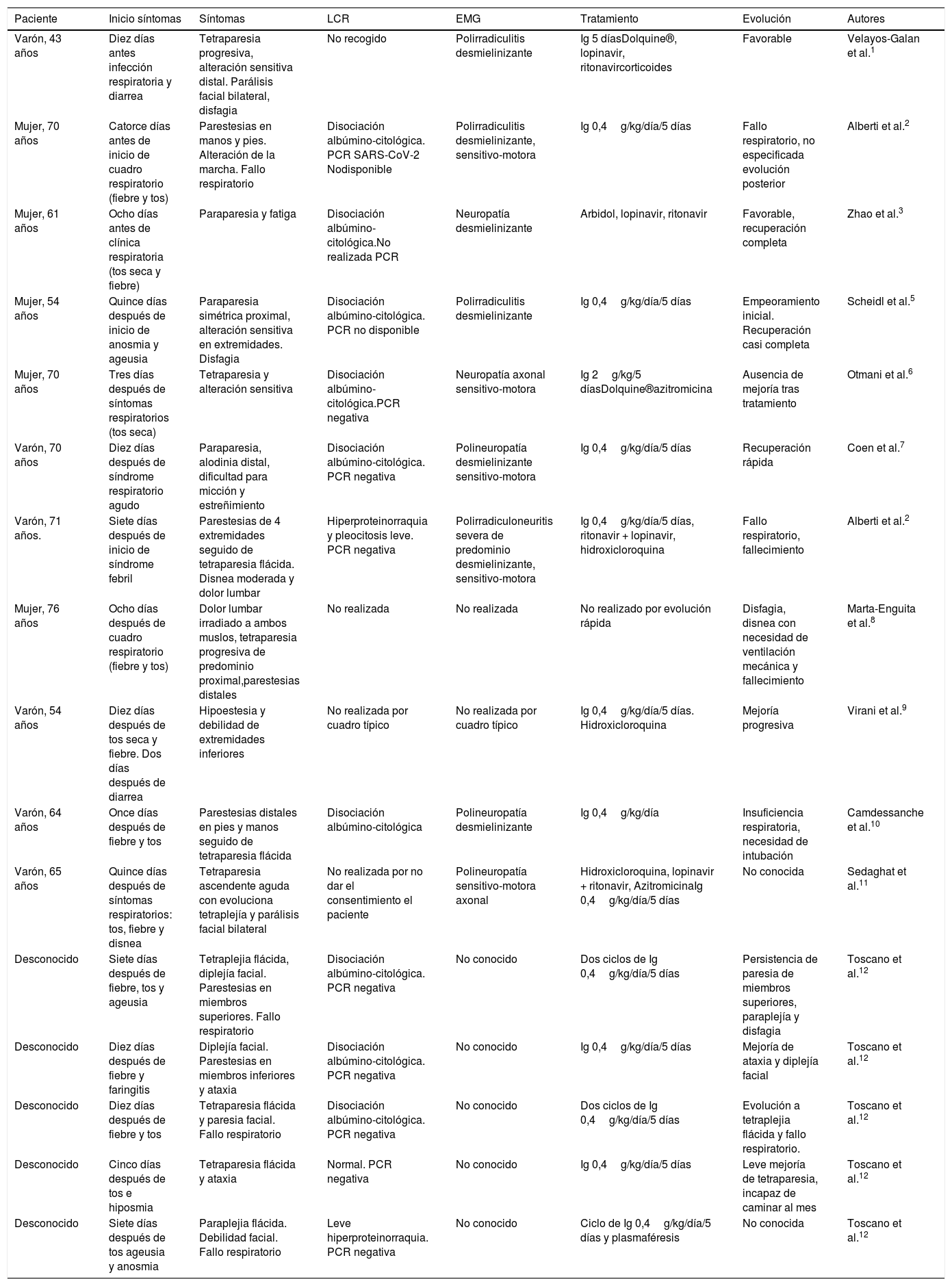
Hasta la fecha y en nuestro conocimiento, se han notificado 3 casos de GBS concomitantes con infección por SARS-CoV-2 y un perfil parainfeccioso1–3 y 13 después de la infección por SARS-CoV-24–12 (tabla 2). Es llamativa la buena evolución de la mayoría de los pacientes que lo sufrieron tras la infección.
Perfil de los pacientes
| Paciente | Inicio síntomas | Síntomas | LCR | EMG | Tratamiento | Evolución | Autores |
|---|---|---|---|---|---|---|---|
| Varón, 43 años | Diez días antes infección respiratoria y diarrea | Tetraparesia progresiva, alteración sensitiva distal. Parálisis facial bilateral, disfagia | No recogido | Polirradiculitis desmielinizante | Ig 5 díasDolquine®, lopinavir, ritonavircorticoides | Favorable | Velayos-Galan et al.1 |
| Mujer, 70 años | Catorce días antes de inicio de cuadro respiratorio (fiebre y tos) | Parestesias en manos y pies. Alteración de la marcha. Fallo respiratorio | Disociación albúmino-citológica. PCR SARS-CoV-2 Nodisponible | Polirradiculitis desmielinizante, sensitivo-motora | Ig 0,4g/kg/día/5 días | Fallo respiratorio, no especificada evolución posterior | Alberti et al.2 |
| Mujer, 61 años | Ocho días antes de clínica respiratoria (tos seca y fiebre) | Paraparesia y fatiga | Disociación albúmino-citológica.No realizada PCR | Neuropatía desmielinizante | Arbidol, lopinavir, ritonavir | Favorable, recuperación completa | Zhao et al.3 |
| Mujer, 54 años | Quince días después de inicio de anosmia y ageusia | Paraparesia simétrica proximal, alteración sensitiva en extremidades. Disfagia | Disociación albúmino-citológica. PCR no disponible | Polirradiculitis desmielinizante | Ig 0,4g/kg/día/5 días | Empeoramiento inicial. Recuperación casi completa | Scheidl et al.5 |
| Mujer, 70 años | Tres días después de síntomas respiratorios (tos seca) | Tetraparesia y alteración sensitiva | Disociación albúmino-citológica.PCR negativa | Neuropatía axonal sensitivo-motora | Ig 2g/kg/5 díasDolquine®azitromicina | Ausencia de mejoría tras tratamiento | Otmani et al.6 |
| Varón, 70 años | Diez días después de síndrome respiratorio agudo | Paraparesia, alodinia distal, dificultad para micción y estreñimiento | Disociación albúmino-citológica. PCR negativa | Polineuropatía desmielinizante sensitivo-motora | Ig 0,4g/kg/día/5 días | Recuperación rápida | Coen et al.7 |
| Varón, 71 años. | Siete días después de inicio de síndrome febril | Parestesias de 4 extremidades seguido de tetraparesia flácida. Disnea moderada y dolor lumbar | Hiperproteinorraquia y pleocitosis leve. PCR negativa | Polirradiculoneuritis severa de predominio desmielinizante, sensitivo-motora | Ig 0,4g/kg/día/5 días, ritonavir + lopinavir, hidroxicloroquina | Fallo respiratorio, fallecimiento | Alberti et al.2 |
| Mujer, 76 años | Ocho días después de cuadro respiratorio (fiebre y tos) | Dolor lumbar irradiado a ambos muslos, tetraparesia progresiva de predominio proximal,parestesias distales | No realizada | No realizada | No realizado por evolución rápida | Disfagia, disnea con necesidad de ventilación mecánica y fallecimiento | Marta-Enguita et al.8 |
| Varón, 54 años | Diez días después de tos seca y fiebre. Dos días después de diarrea | Hipoestesia y debilidad de extremidades inferiores | No realizada por cuadro típico | No realizada por cuadro típico | Ig 0,4g/kg/día/5 días. Hidroxicloroquina | Mejoría progresiva | Virani et al.9 |
| Varón, 64 años | Once días después de fiebre y tos | Parestesias distales en pies y manos seguido de tetraparesia flácida | Disociación albúmino-citológica | Polineuropatía desmielinizante | Ig 0,4g/kg/día | Insuficiencia respiratoria, necesidad de intubación | Camdessanche et al.10 |
| Varón, 65 años | Quince días después de síntomas respiratorios: tos, fiebre y disnea | Tetraparesia ascendente aguda con evoluciona tetraplejía y parálisis facial bilateral | No realizada por no dar el consentimiento el paciente | Polineuropatía sensitivo-motora axonal | Hidroxicloroquina, lopinavir + ritonavir, AzitromicinaIg 0,4g/kg/día/5 días | No conocida | Sedaghat et al.11 |
| Desconocido | Siete días después de fiebre, tos y ageusia | Tetraplejia flácida, diplejía facial. Parestesias en miembros superiores. Fallo respiratorio | Disociación albúmino-citológica. PCR negativa | No conocido | Dos ciclos de Ig 0,4g/kg/día/5 días | Persistencia de paresia de miembros superiores, paraplejía y disfagia | Toscano et al.12 |
| Desconocido | Diez días después de fiebre y faringitis | Diplejía facial. Parestesias en miembros inferiores y ataxia | Disociación albúmino-citológica. PCR negativa | No conocido | Ig 0,4g/kg/día/5 días | Mejoría de ataxia y diplejía facial | Toscano et al.12 |
| Desconocido | Diez días después de fiebre y tos | Tetraparesia flácida y paresia facial. Fallo respiratorio | Disociación albúmino-citológica. PCR negativa | No conocido | Dos ciclos de Ig 0,4g/kg/día/5 días | Evolución a tetraplejia flácida y fallo respiratorio. | Toscano et al.12 |
| Desconocido | Cinco días después de tos e hiposmia | Tetraparesia flácida y ataxia | Normal. PCR negativa | No conocido | Ig 0,4g/kg/día/5 días | Leve mejoría de tetraparesia, incapaz de caminar al mes | Toscano et al.12 |
| Desconocido | Siete días después de tos ageusia y anosmia | Paraplejia flácida. Debilidad facial. Fallo respiratorio | Leve hiperproteinorraquia. PCR negativa | No conocido | Ciclo de Ig 0,4g/kg/día/5 días y plasmaféresis | No conocida | Toscano et al.12 |
EMG: electromiografía; LCR: recolección de líquido cefalorraquídeo; PCR: reacción en cadena de la polimerasa.
En nuestro paciente, la evolución gradual de las manifestaciones neurológicas se asemeja a la de una etiología postinfecciosa. Por lo tanto, especulamos una asociación entre la polirradiculoneuropatía aguda y la infección por SARS-CoV-2. Esta hipótesis está respaldada por la noción de un aislamiento domiciliario previo de 21 días antes del inicio de los síntomas neurológicos y por ser negativos los anticuerpos antigangliósidos. Sin embargo, el inicio postinfeccioso, el curso clínico agudo y los hallazgos neurofisiológicos típicos (polirradiculoneuropatía mixta de las fibras motoras y sensoriales), junto con la historia negativa de antecedentes autoinmunes, neoplásicos o neurológicos, apoyan la etiología postinfecciosa. Otra limitación importante se basa en la falta de disponibilidad de la serología SARS-CoV-2 y la PCR en LCR, en nuestro centro.
Este caso solo sugiere una posible asociación entre el GBS y la infección por SARS-CoV-2, y se necesitan más casos con datos epidemiológicos para respaldar una relación causal. Este caso también sugiere la necesidad de considerar posibles síntomas neurológicos de la infección por SARS-CoV-2.
Los autores coinciden en que se necesita una atención especial a las complicaciones neurológicas de SARS-CoV-2.
Actualmente, la Sociedad Española de Neurología lleva a cabo un estudio observacional nacional sobre presentaciones neurológicas y complicaciones del SARS-CoV-2.