Se describen casos raros de pacientes de epilepsia de lóbulo temporal por esclerosis hipocampal (ELT-EH) unilateral, con actividad ictal contralateral al hipocampo atrófico o de ambos, denominados síndrome de hipocampo quemado (SHQ)1, donde hay falsa lateralización ictal e incongruencia electro-clínica-radiológica, y requieren evaluación invasiva2,3.
Presentamos el caso de un paciente varón de 45 años, diestro, con ELT-EH fármaco-resistente desde los 12 años, trauma cráneo-encefálico leve a los 7 años. Crisis: sensación de intromisión de pensamiento, deseo de salir corriendo, ansiedad, desconexión del medio y automatismos, duración 2min, confusión postictal, frecuencia 2-3 crisis al mes, polimedicado (lacosamida, lamotrigina, fenobarbital y carbamazepina). Resonancia cerebral: EH derecha (fig. 1A). Video-electroencefalografía de superficie (vEEG-s) de 96h actividad interictal epileptiforme temporal bilateral independiente predominio derecha y 8 eventos ictales idénticos con ondas theta rítmicas temporales evolutivas de inicio 6 izquierdas y 2 derechas. Evaluación neuropsicológica fallas leves-moderadas habilidades atencionales y del lenguaje, escala de inteligencia muy baja, moderado compromiso en memoria verbal y viso-espacial. SPECT ictal e interictal no concluyente. Examen físico: ansioso, bradipsíquico, fallas de memoria inmediata, sin otras anormalidades.
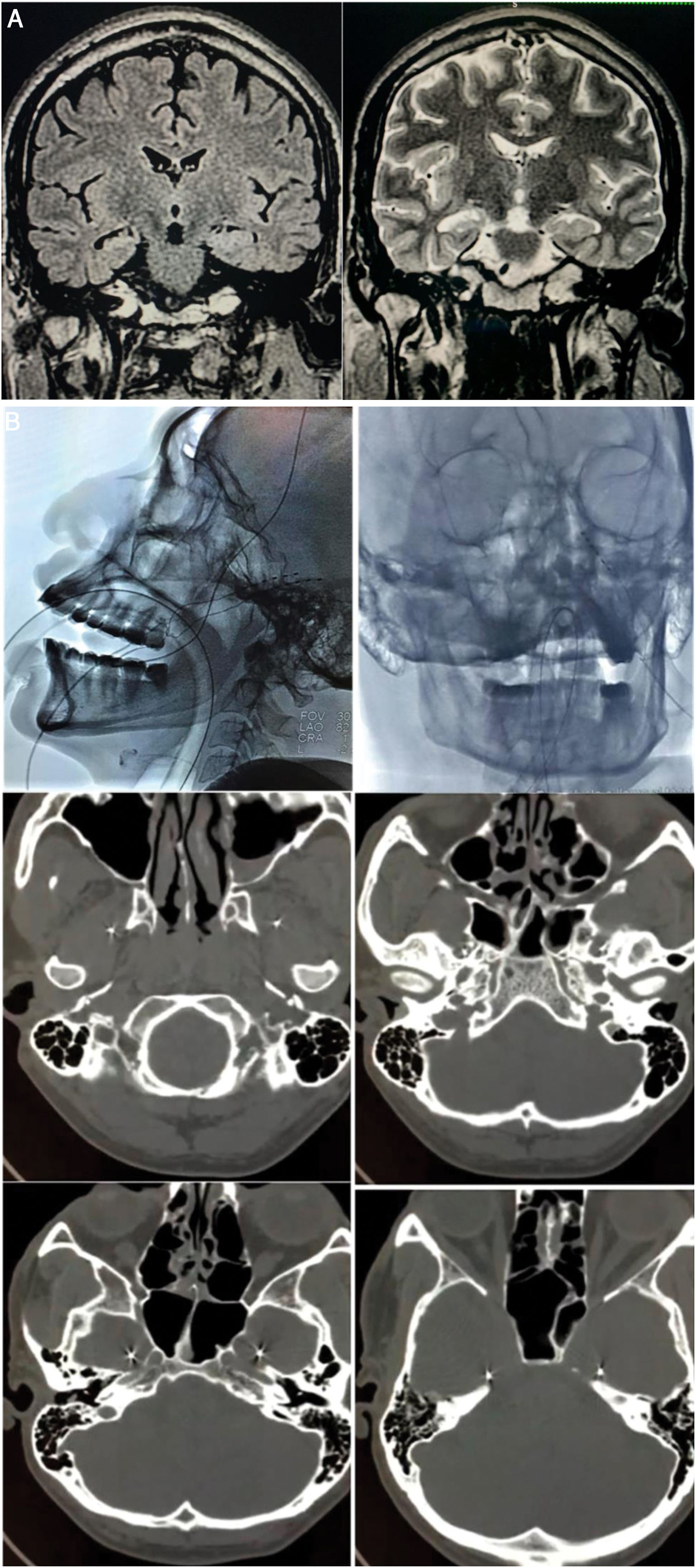
A) Resonancia magnética cerebral de 1.5T preoperatoria: a) Vista coronal T2-FLAIR con hiperintensidad en el hipocampo derecho; b) Vista coronal T2 con disminución de volumen y alteración de la arquitectura del hipocampo derecho. B) Implantación de electrodos de foramen oval (EFO): a) Proyección antero-posterior de guía fluoroscópica EFO izquierdo; b) Radiografía lateral electrodos implantados; c) Posición extracraneal infratemporal; d) Paso por el foramen oval; e y f) Localización intracraneal en aspecto mesial del lóbulo temporal (cisterna ambiens).
Implantamos (electrodos de foramen oval [EFO] 1×5) bilaterales (fig. 1B) y vEEG-s complementaria montaje referencial durante 48h, actividad interictal similar a registros previos, presentó 3 crisis epilépticas estereotipadas eléctricamente idénticas; actividad rápida de baja amplitud en contactos 1-2 del EFO derecho durante 7s, con propagación secundaria a los contactos 1-2 del EFO izquierdo, donde se genera una franca mayor amplitud y posteriormente a electrodos F8-T4-T6 con morfología de actividad theta rítmica evolutiva (fig. 2), confirmándose área epileptogénica en hipocampo derecho. En febrero de 2016 realizamos lobectomía temporal anterior estándar con hipocampo-amigdalectomía derecha, continuó monoterapia con carbamazepina. En marzo de 2018, con EEG rutinario sin actividad epileptiforme, suspendimos antiepiléptico, ha permaneciendo libre de crisis (Engel IA) hasta la fecha, con integración adecuada a su ocupación previa de agricultor.
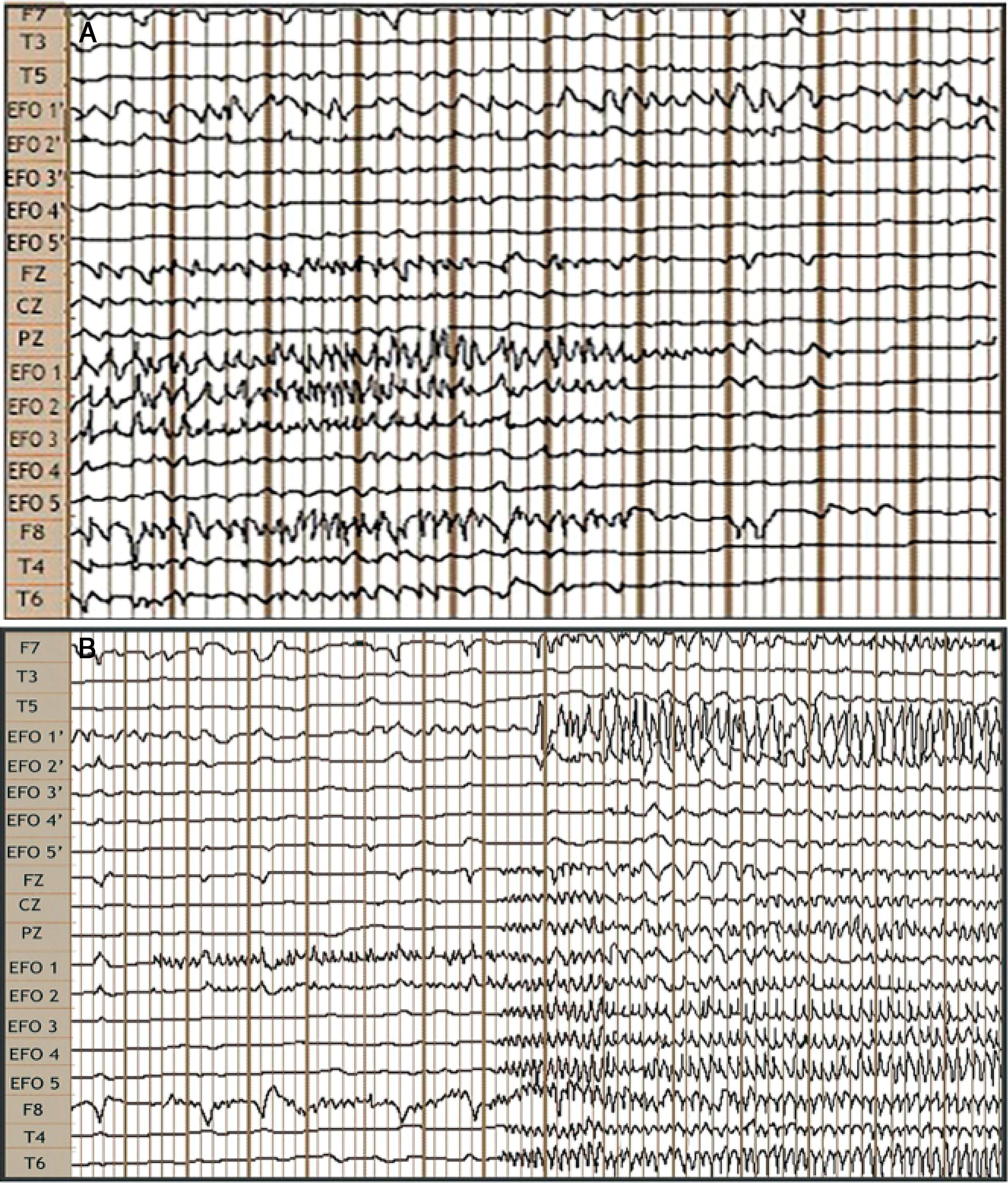
Registros video EEG con EFO bilaterales y de superficie complementario, sistema internacional 10/20 y montaje referencial de izquierda a derecha. A) Interictal: actividad rápida de puntas de mediano voltaje bilaterales de predominio derecho. B) Ictal: inició con actividad rápida de baja amplitud en contactos EFO 1 y EFO 2, la cual se mantiene por 7s, seguida por extensión al hipocampo contralateral generando mayor amplitud, y de igual forma se propaga a todo el temporal derecho.
El ELT se asocia con factores etiológicos como hipoxia perinatal, convulsiones febriles, trauma cráneo-encefálico, neuro-infección2 y es una afección frecuentemente bilateral4, donde los vEEG-s pueden mostrar actividad interictal unilateral, bilateral sincronizada o independiente; ictalmente puede propagarse al lóbulo contralateral en un 30%, sin embargo, en el ELT-EH unilateral solo un 3-7,5%2. Estos hallazgos de descargas bilaterales podrían interpretarse como epilepsia multifocal y así excluir la opción quirúrgica de tratamiento5; usando registros intracraneales se demuestra inicio ictal en el hipocampo anormal con rápida propagación al hipocampo contralateral, siendo esta incongruencia un signo de falsa lateralización4. Mintzer et al. presentan 5 casos de 109 pacientes con ELT implantados con electrodos intracraneales (4,6%), con atrofia hipocampal unilateral en RM y registros ictales de EEG-s con inicio de la mayoría de crisis en el lóbulo temporal contralateral y pocos o ninguna del mismo lado del hipocampo atrófico, lo que denominaron SHQ4. Williamson et al. reportan SHQ en 5/67 pacientes (7,5%)6. En nuestro grupo tenemos 1/13 pacientes (7,7%).
Se postula que la falsa lateralización se debe a la severa pérdida neuronal del hipocampo anormal, haciéndolo incapaz de reclutar suficientes neuronas neocorticales, activándose el hipocampo y neocórtex contralateral vía la comisura hipocampal dorsal, registrándose en el EEG-s descargas ictales contralaterales al hipocampo atrofiado1,2,4,7. Se propone concomitantemente neocórtex estructuralmente dañado incapaz de expresar radialmente hacia la superficie la actividad originada del hipocampo5.
Un factor predictor de falsa lateralización es la presencia de actividad interictal predominante del mismo lado del hipocampo atrófico4, esta al originarse del área irritativa (mayor tamaño) logra reclutar más neuronas y expresarse al neocórtex ipsilateral; en los registros ictales la actividad de rápida frecuencia con bajo voltaje (menor que la generada en el área irritativa), no tiene suficiente volumen para generar campo eléctrico visible en el VEEG-s5.
El abordaje diagnóstico en sospecha de SHQ requiere descartar multifocalidad y confirmar falsa lateralización, mediante la monitorización con electrodos cerebrales profundos (ECP), mallas subdurales (GS) temporo-basales o métodos semi-invasivos como EFO2–4. Se plantea al SPECT ictal-interictal y la PET como métodos no invasivos que podrían ayudar a solucionar este conflicto4. En nuestro paciente se decidió implantar EFO, técnica costo-efectiva, dado su bajo precio, menor complejidad, adecuada seguridad y óptima precisión8-10.
Los pacientes con SHQ alcanzan con la cirugía libertad de crisis hasta en un 80%4,11,12. Los mejores resultados estarían sujetos a la confirmación de foco epileptógeno único5. Serán necesarios más estudios antes de poder afirmar que los pacientes con sospecha de SHQ pueden ser llevados a tratamiento quirúrgico sin evaluación neurofisiológica invasiva. El uso de EFO podría ser una alternativa eficaz y segura al momento de decisiones prequirúrgicas.
FinanciaciónLos autores declaran no haber recibido ayudas para la realización de este trabajo.
Por su gentil y valiosa colaboración en la revisión y en el análisis de nuestro artículo, una especial mención y agradecimiento para el Dr. Daniel Sanjuan Orta, neurólogo epileptólogo y neurofisiólogo clínico, Jefe del Departamento de Investigación Clínica, Instituto Nacional de Neurología y Neurocirugía, México y a la Dra. Nhora Patricia Ruiz Alfonzo, neuróloga epileptóloga, Neurológicas Internacional, Piedecuesta, Colombia.
El trabajo se realizó por el Programa de Cirugía de Epilepsia del Instituto Neurológico del Hospital Internacional de Colombia, Piedecuesta, Santander, Colombia.