La supervivencia de los pacientes con cáncer ha aumentado en los últimos años. Pese a ello, el pronóstico global del cáncer de pulmón continúa siendo pobre, especialmente en estadios avanzados1; la presencia de metástasis cerebrales requiere el tratamiento con radioterapia en la mayoría de las situaciones2. El contrapunto ha sido y es el aumento de efectos secundarios tardíos de la radioterapia craneal (RTc) como la leucocenfalopatía y necrosis por radiación3. Desde que Shuper et al.4 describieran el primer caso de síndrome de Stroke-like Migraine Attacks after Radiation Therapy (SMART) en 1995, se han reportado no más de un centenar de casos en todo el mundo5. A pesar de que se trata de una entidad extremadamente rara, el aumento en la supervivencia de los pacientes oncológicos ha generado y, muy probablemente, generará un aumento de su frecuencia. Por ello, creemos de interés exponer el caso de una mujer que desarrolló un síndrome de SMART (sd. SMART) tras el tratamiento con RTc.
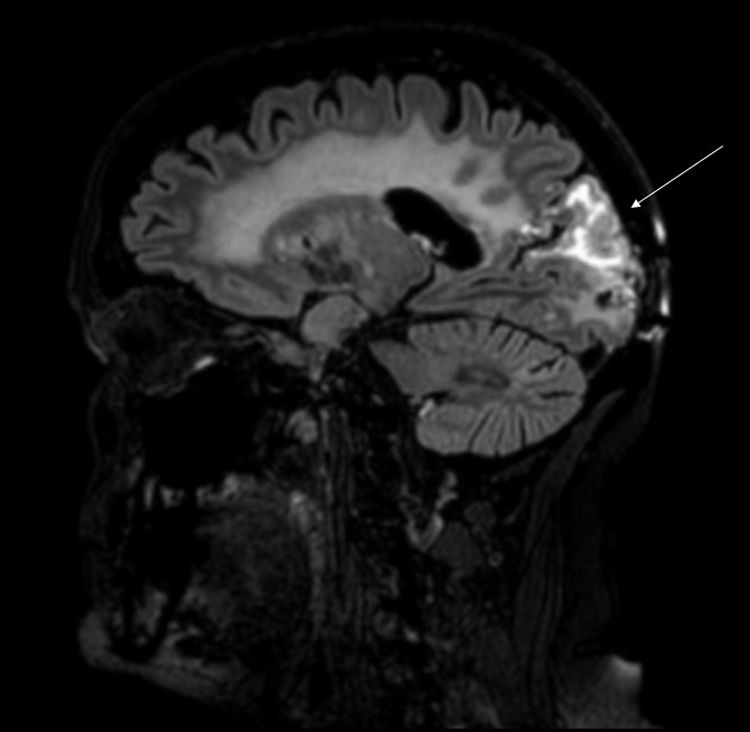
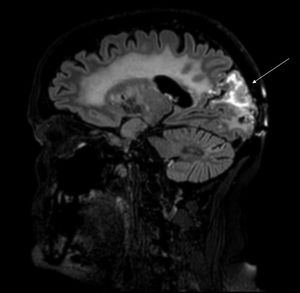
Mujer de 62 años, fumadora de 40 paquetes/año con antecedentes personales de adenocarcinoma papilar de pulmón estadio IIA (pT2bN0M0) en 2013. Fue tratada mediante lobectomía y quimioterapia adyuvante (4 sesiones de cisplatino y docetaxel). En 2015 presentó progresión tumoral y fue diagnosticada de 3 metástasis cerebrales. Se realizó cirugía de la lesión occipital derecha y se indicó radioterapia holocraneal (30Gy en 10 sesiones). Tres años más tarde consultó por alteración visual y episodios semanales de 4 a 12 h de duración de cefalea holocraneal, de cualidad pulsátil, intensidad 7-8/10 en escala verbal analógica, con fotofobia pero sin fonofobia ni osmofobia y con clinofilia y mecanosensibilidad. Además de pérdida de visión indolora, describía debilidad progresiva y mantenida de extremidades izquierdas. En la exploración física estaba afebril, normotensa y destacó la presencia de una hemianopsia homónima izquierda, agnosia visual y hemiparesia de miembro superior e inferior izquierdos. El hemograma, bioquímica y autoinmunidad fueron normales. El electroencefalograma fue normal. En la resonancia magnética cerebral se evidenciaron cambios posquirúrgicos en polo occipital derecho y por encima de esta localización en hemisferio derecho, con afectación parietal y occipital, existe un área patológica consistente en engrosamiento e hiperintensidad de señal T2 cortical con edema subcortical y realce de tipo giral prominente (fig. 1). Se inició tratamiento con dexametasona (4mg/cada 6 h iv) con mejoría de la clínica visual y motora.
La fisiopatología del sd. SMART es poco conocida. En todos los casos reportados existía el antecedente de RTc e inicialmente se relacionó con dosis superiores a 50Gy, sin embargo se han reportado casos con radiaciones inferiores6,7 pero todos ellos en un rango de radiación de 15 a 64Gy8. La neurotoxicidad altera la barrera hematoencefálica, daña las células endoteliales, genera proliferación del músculo liso y necrosis fibrinoide de la pared del vaso, que posteriormente conduce a la oclusión vascular. Por ello, se atribuyó a estos factores la génesis del sd. SMART. Sin embargo, en la serie publicada por Black et al.9 no se demostró alteraciones vasculares sino gliosis inespecífica en las biopsias cerebrales. Se ha propuesto como explicación el menoscabo del sistema trigeminovascular y la disfunción neuronal tras la radiación, por lo que la patogenia del sd. SMART puede estar más cerca de la migraña o la epilepsia que de las enfermedades cerebrovasculares7.
El intervalo medio de tiempo entre la RTc y el diagnóstico del sd. SMART fue de 10 años, pero el intervalo en la distintas series varió de uno a 35 años5.
La presentación clínica se caracteriza por el inicio subagudo de déficits neurológicos —afasia, hemianopsia o pérdida visual completa, hemiparesia, hemiparestesia, pérdida auditiva—, crisis comiciales, cefalea de fenotipo migrañoso y encefalopatía, que varía desde lentitud psicomotora leve hasta deterioro grave del nivel de consciencia10. En la serie más grande publicada hasta el momento5, la sintomatología más frecuente fueron los déficits neurológicos, seguido de cerca por la cefalea. En la mayoría de los casos hay una recuperación completa, pero en ocasiones hay secuelas residuales y algunos pacientes presentaron más eventos. Por tanto, el curso parece ser remitente y recurrente.
En la RM es característica una señal cortical, unilateral, hiperintensa en secuencia FLAIR y T2 con realce giriforme, predominantemente en lóbulo temporal, parietal, y occipital. El diagnóstico de sd. SMART es clínico-radiológico en un contexto epidemiológico adecuado. En 2015, Zheng et al. revisaron los criterios establecidos por Black et. al11 y propusieron unos criterios diagnósticos (tabla 1). Entre los diagnósticos alternativos, se encuentra la radionecrosis cerebral. Aunque la radionecrosis cerebral puede ocurrir en cualquier momento, su aparición en varias cohortes varía de 10 a 16 meses11–15. Aunque no existen criterios radiológicos patognomónicos específicos en las imágenes para confirmar el diagnóstico, en la resonancia magnética se presenta como lesiones necróticas centrales, generalmente rodeadas de edema, a menudo con un efecto de masa. Estos hallazgos se describen como lesiones de «queso suizo» o «burbuja de jabón»13,16,17. No existe ningún tratamiento dirigido, solo el control de síntomas. Aunque los corticoesteroides pueden mejorar los défcits neurológicos, su uso sigue siendo controvertido7,11,18–21.
Criterios diagnósticos del síndrome de Stroke-like migraine attacks after radiation therapy (SMART) por Zheng et al. (2015)
| A. Historia previa de radioterapia craneal por tumor maligno |
| B. Manifestaciones clínicas prolongadas y reversibles después de años de la radiación que incluyan migraña, convulsiones, hemiparesia, déficit hemisensorial, defectos visuales, afasia, etc. |
| C. Hiperintensidad anormal cortical en secuencias T2 y FLAIR y realce cortical unilateral en la RMN en la región afectada de forma transitoria y reversible |
| D. Eventual recuperación parcial o completa de la clínica en horas, días o semanas después de su presentación |
| E. Negatividad completa de evidencia de tumor o recurrencia tumoral por medio de exámenes paraclínicos |
| F. Hallazgos no atribuibles a otra enfermedad |
Fuente: Zheng et al.10.
Para finalizar creemos que el diagnóstico de sd. SMART debe considerarse en todo paciente con antecedente de RTc, déficit o disfunción neurológica y alteraciones parietoocciptales en la RM.