Introducción La pérdida neuronal/axonal progresiva se considera la causa más importante de discapacidad neurológica en la esclerosis múltiple (EM). El sistema visual está frecuentemente afectado en esta enfermedad y su accesibilidad a test funcionales y estructurales ha permitido que se convierta en un modelo para estudiar in vivo la patogenia de la EM. La ecografía orbitaria permite evaluar, de forma no invasiva y en tiempo real, las diversas estructuras de la órbita, incluido el nervio óptico.
Material y métodosSe ha llevado a cabo un estudio observacional ambispectivo en pacientes con EM recogiéndose datos evolutivos de la enfermedad. La ecografía orbitaria se realizó en todos los pacientes según el principio de mínima potencia necesaria (ALARA). También se recogieron los datos de tomografía de coherencia óptica (OCT) en aquellos que tenían realizadas ambas pruebas. El estudio estadístico se efectuó con el programa SPSS 22.0.
ResultadosSe encontraron correlaciones estadísticamente significativas entre las medidas ecográficas y la progresión de la enfermedad (p=0,041 para el ojo derecho y p=0,037 para el ojo izquierdo), y la Expanded Disability Status Scale (EDSS) final en el seguimiento (p=0,07 para el ojo derecho y p=0,043 para el ojo izquierdo). No fue así para los datos referentes a brotes y a otras variables clínicas.
DiscusiónLa medición del diámetro del nervio óptico por ecografía podría utilizarse como medida predictiva en la evolución de la EM, ya que la disminución del mismo se asocia con progresión clínica y mayor discapacidad, medidas con la EDSS.
Progressive neuronal and axonal loss are considered the main causes of disability in patients with multiple sclerosis (MS). The disease frequently involves the visual system; the accessibility of the system for several functional and structural tests has made it a model for the in vivo study of MS pathogenesis. Orbital ultrasound is a non-invasive technique that enables various structures of the orbit, including the optic nerve, to be evaluated in real time.
Material and methodsWe conducted an observational, ambispective study of MS patients. Disease progression data were collected. Orbital ultrasound was performed on all patients, with power set according to the ‘as low as reasonably achievable’ (ALARA) principle. Optical coherence tomography (OCT) data were also collected for those patients who underwent the procedure. Statistical analysis was conducted using SPSS version 22.0.
ResultsDisease progression was significantly correlated with ultrasound findings (P=.041 for the right eye and P=.037 for the left eye) and with Expanded Disability Status Scale (EDSS) score at the end of the follow-up period (P=.07 for the right eye and P=.043 for the left eye). No statistically significant differences were found with relation to relapses or other clinical variables.
DiscussionUltrasound measurement of optic nerve diameter constitutes a useful, predictive factor for the evaluation of patients with MS. Smaller diameters are associated with poor clinical progression and greater disability (measured by EDSS).
La esclerosis múltiple (EM) es la enfermedad inflamatoria desmielinizante autoinmune más común del sistema nervioso central. Se caracteriza por la presencia de procesos patológicos que incluyen inflamación, desmielinización, degeneración axonal y pérdida neuronal1-3. En los últimos años, se ha reconocido que la pérdida neuronal y axonal contribuyen, en gran medida, a la discapacidad en EM.
El nervio óptico (NO) es una de las estructuras que con mayor frecuencia se afecta en el curso de la enfermedad4 y es una de las causas de mayor discapacidad en estos pacientes por afectar negativamente a su calidad de vida5. El desarrollo de técnicas no invasivas, como la tomografía de coherencia óptica (OCT), ha permitido identificar la pérdida axonal en la vía visual anterior y el NO ha emergido como un modelo accesible para el estudio de la patogenia de la enfermedad y la monitorización de estos cambios6.
En 1999 se publicó el primer estudio de OCT aplicado a la EM, demostrando una reducción de la capa de fibras nerviosas de la retina (CFNR) de pacientes con neuritis óptica previa respecto a sujetos sanos y al ojo no afectado del mismo paciente7. También se ha demostrado que el adelgazamiento de la CFNR se relaciona con los cambios en la escala Expanded Disability Status Scale (EDSS)8,9.
En los últimos años, se está demostrando que el grosor de la CFNR se correlaciona con la atrofia cerebral y clínicamente con la disfunción visual, lo que permite que el ojo pueda ser un modelo apropiado para estudiar los mecanismos de neurodegeneración e incluso puede servir para detectar la neuroprotección en EM10-12. Por ello, los ensayos clínicos de EM han incorporado la OCT como resultados exploratorios con la intención de acumular conocimientos sobre la relación entre los cambios en la estructura retiniana y la función visual de los pacientes13. También se ha observado una disminución progresiva durante el curso de la enfermedad, incluso en aquellos ojos que no han presentado previamente una neuritis óptica14.
Actualmente, el auge de los ultrasonidos en las enfermedades neurológicas nos ha permitido aplicar esta técnica a la EM con la ecografía orbitaria y la medición del grosor del NO. En estudios realizados con ecografía del NO se obtuvieron diferencias entre el diámetro del NO de pacientes con EM y controles sanos, independientemente de si presentaron neuritis óptica aguda con anterioridad o no. Esta observación lleva a considerarla como una técnica útil para monitorizar la pérdida axonal asociada a EM, siendo una técnica sencilla, sensible y reproducible15.
Pacientes y métodosSe llevó a cabo un estudio observacional analítico ambispectivo, con una cohorte de pacientes concurrente. Se recogieron los datos de pacientes atendidos en la Unidad de Esclerosis Múltiple del Hospital Universitario Virgen Macarena de Sevilla a los que se les realizó ecografía orbitaria con medición del grosor del NO. El estudio fue aprobado por el Comité de Ética e Investigación del hospital. Todos los datos de estos pacientes se recogieron previa firma del consentimiento informado para tal fin.
Los criterios de inclusión fueron: edad comprendida entre 18 y 75 años, ambos inclusive; diagnóstico de EM, en cualquiera de sus formas evolutivas (síndrome clínico aislado, remitente recurrente, primaria progresiva o secundaria progresiva); pacientes que hubieran otorgado su consentimiento informado para participar en el estudio. Los criterios de exclusión fueron: pacientes menores de 18 años o mayores de 75 años; patología oftalmológica grave (glaucoma, maculopatía, etc.) y pacientes que no hubieran otorgado su consentimiento informado.
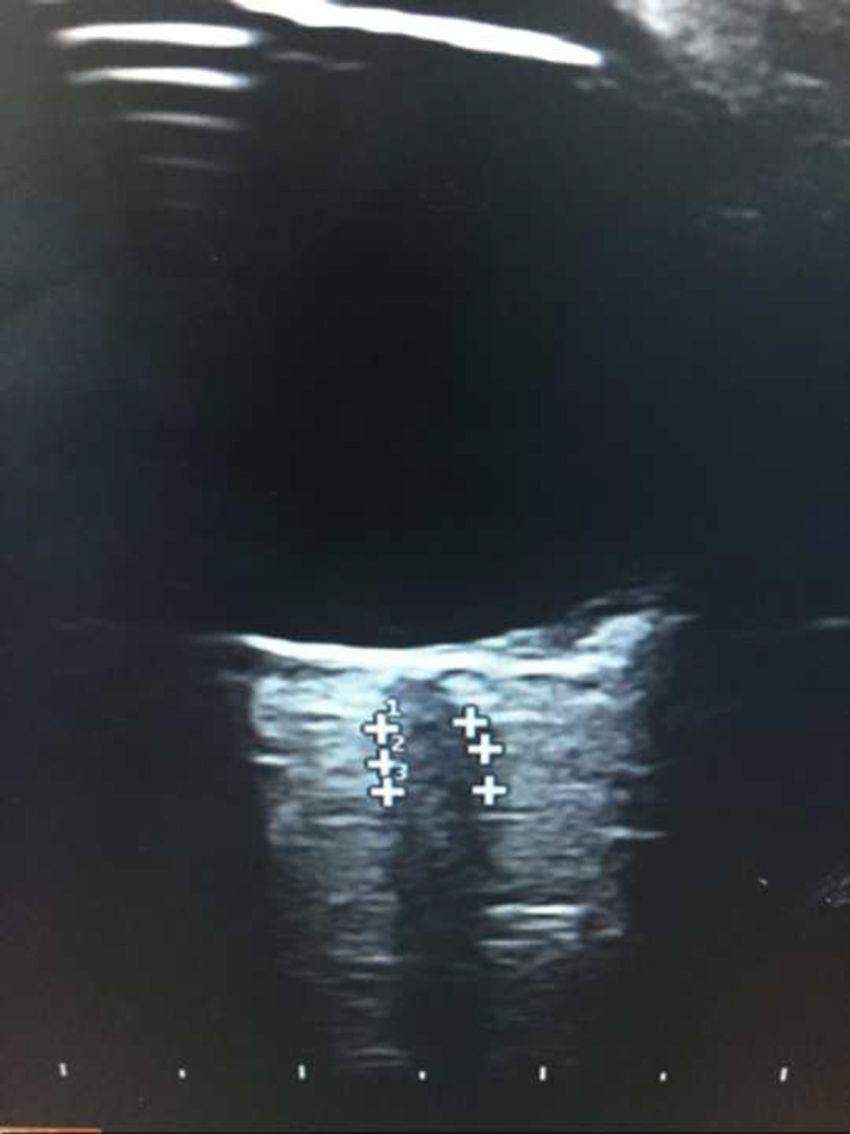
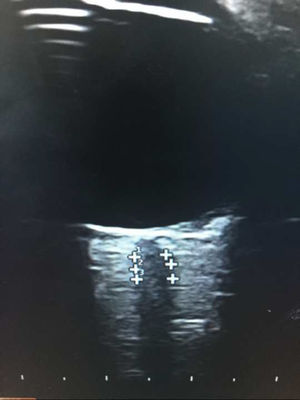
Para el estudio se usó el transductor lineal de 7,5Hz del equipo ecográfico Esaote®. El nivel de potencia del ultrasonido se ajustó según el principio ALARA (as low as reasonably achievable)16 y la medición del NO (visión longitudinal) se hizo a unos 3mm de la papila15. En nuestro caso se usó la medición junto a las cubiertas, por la difícil diferenciación entre axón y cubiertas en la mayoría de los pacientes (fig. 1).
Se recogieron datos demográficos y datos retrospectivos y prospectivos sobre la enfermedad. En el estudio prospectivo se definió progresión como un aumento sostenido mayor de 0,5 puntos en la escala EDSS durante más de 3 meses. También se recogieron datos de la OCT en aquellos pacientes que tenían realizadas ambas pruebas.
El análisis estadístico se efectuó con el programa SPSS, versión 22.0. En todos los contrastes de hipótesis se consideró un nivel de significación de 0,05.
ResultadosSe incluyeron 63 sujetos con EM a los cuales se les realizó una ecografía orbitaria para la medición del NO. El seguimiento medio de los pacientes desde la realización de la ecografía fue de 9,16 meses (máximo [máx.] 18, mínimo [mín.] 3; desviación estándar [DE]: 4,37; intervalo de confianza al 95% [IC 95%]: 8,06-10,26). No se perdieron pacientes en el seguimiento.
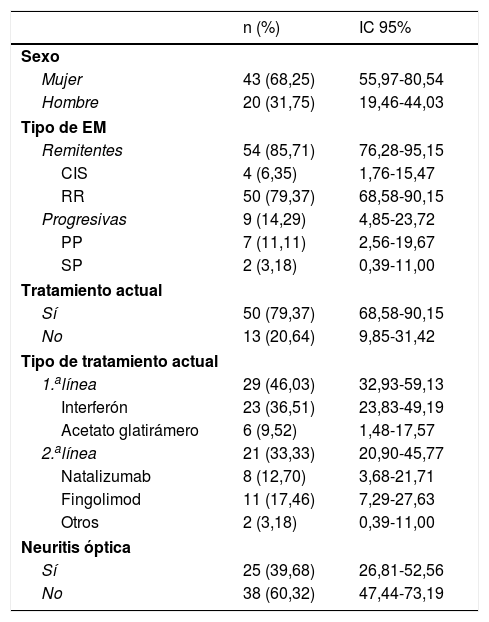
Las características basales de los enfermos se describen en la tabla 1. La edad media al diagnóstico fue de 35,5 años (mín. 17, máx. 58; DE: 10,06; IC 95%: 32,83-37,9).
Características basales
| n (%) | IC 95% | |
|---|---|---|
| Sexo | ||
| Mujer | 43 (68,25) | 55,97-80,54 |
| Hombre | 20 (31,75) | 19,46-44,03 |
| Tipo de EM | ||
| Remitentes | 54 (85,71) | 76,28-95,15 |
| CIS | 4 (6,35) | 1,76-15,47 |
| RR | 50 (79,37) | 68,58-90,15 |
| Progresivas | 9 (14,29) | 4,85-23,72 |
| PP | 7 (11,11) | 2,56-19,67 |
| SP | 2 (3,18) | 0,39-11,00 |
| Tratamiento actual | ||
| Sí | 50 (79,37) | 68,58-90,15 |
| No | 13 (20,64) | 9,85-31,42 |
| Tipo de tratamiento actual | ||
| 1.alínea | 29 (46,03) | 32,93-59,13 |
| Interferón | 23 (36,51) | 23,83-49,19 |
| Acetato glatirámero | 6 (9,52) | 1,48-17,57 |
| 2.alínea | 21 (33,33) | 20,90-45,77 |
| Natalizumab | 8 (12,70) | 3,68-21,71 |
| Fingolimod | 11 (17,46) | 7,29-27,63 |
| Otros | 2 (3,18) | 0,39-11,00 |
| Neuritis óptica | ||
| Sí | 25 (39,68) | 26,81-52,56 |
| No | 38 (60,32) | 47,44-73,19 |
CIS: clinical isolated syndrome (síndrome neurológico aislado); EM: esclerosis múltiple; IC: intervalo de confianza; PP: primaria progresiva; RR: remitente recurrente; SP: secundaria progresiva.
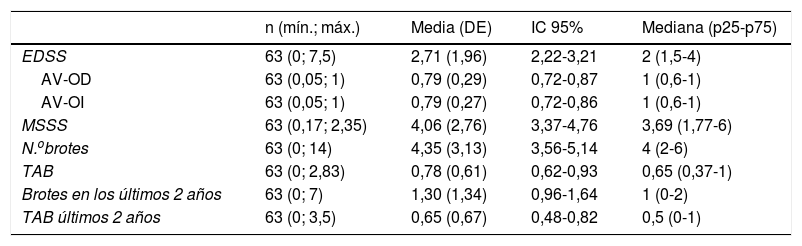
Los datos retrospectivos de la enfermedad se presentan en la tabla 2.
Características de la enfermedad
| n (mín.; máx.) | Media (DE) | IC 95% | Mediana (p25-p75) | |
|---|---|---|---|---|
| EDSS | 63 (0; 7,5) | 2,71 (1,96) | 2,22-3,21 | 2 (1,5-4) |
| AV-OD | 63 (0,05; 1) | 0,79 (0,29) | 0,72-0,87 | 1 (0,6-1) |
| AV-OI | 63 (0,05; 1) | 0,79 (0,27) | 0,72-0,86 | 1 (0,6-1) |
| MSSS | 63 (0,17; 2,35) | 4,06 (2,76) | 3,37-4,76 | 3,69 (1,77-6) |
| N.obrotes | 63 (0; 14) | 4,35 (3,13) | 3,56-5,14 | 4 (2-6) |
| TAB | 63 (0; 2,83) | 0,78 (0,61) | 0,62-0,93 | 0,65 (0,37-1) |
| Brotes en los últimos 2 años | 63 (0; 7) | 1,30 (1,34) | 0,96-1,64 | 1 (0-2) |
| TAB últimos 2 años | 63 (0; 3,5) | 0,65 (0,67) | 0,48-0,82 | 0,5 (0-1) |
AV: agudeza visual; DE: desviación estándar; EDSS: Expanded Disability Status Scale; IC: intervalo de confianza; MSSS: Multiple Sclerosis Severity Scale; OD: ojo derecho; OI: ojo izquierdo; TAB: tasa anualizada de brotes.
El diámetro medio del ojo derecho (OD) fue de 4,54mm (mín. 2,29; máx. 6,66; DE: 0,95; IC 95%: 4,30-4,78) y el del ojo izquierdo (OI) de 4,63mm (mín. 2,13; máx. 5,89; DE: 0,79; IC 95%: 4,43-4,83). También se calculó la diferencia entre ambos diámetros (asimetría), con un valor medio de 0,69mm (mín. 0; máx. 2,20; DE: 0,59; IC 95%: 0,54-0,84).
El tiempo medio de seguimiento tras la realización de la ecografía y el resto de pruebas paraclínicas fue de 9,16 meses (máx. 18, mín. 3; DE: 4,37; IC 95%: 8,06-10,26). El 15,9% (n=10) de los pacientes presentaron algún brote en el seguimiento posterior. Se registraron una media de 0,24 brotes (mín. 0, máx. 3; DE: 0,56; IC 95%: 0,10-0,38) con una tasa anualizada de brotes (TAB) promedio de 0,26 (mín. 0, máx. 2,40; DE: 0,61; IC 95%: 0,11-0,41). El tiempo medio en aparecer el primer brote en el seguimiento fue de 7,80 meses (mín. 0,30, máx. 17,80; DE: 4,46; IC 95%: 6,68-8,92). La EDSS media registrada al final del estudio fue de 2,81 (mín. 0, máx. 7,5; DE: 2,07; IC 95%: 2,29-3,33).
Se encontró una progresión mantenida con un aumento mayor de 0,5 puntos en la EDSS en el 27% (n=17) de los pacientes. El tiempo medio en aparecer esta progresión fue de 7,90 meses (mín. 1,87; máx. 17,84; DE: 4,17; IC 95%: 6,85-8,95).
En el análisis retrospectivo no se encontraron diferencias significativas entre las medidas ecográficas y las variables clínicas. No hubo diferencias en cuanto a la presencia de neuritis óptica previa.
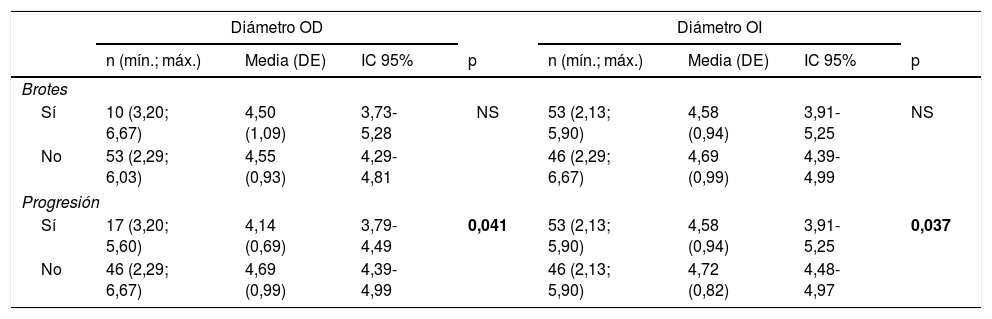
Se analizaron los datos ecográficos en función de la presencia de brotes y de progresión mantenida, y los resultados se detallan en la tabla 3. El análisis, junto con los datos evolutivos en el periodo de seguimiento, se presenta en la tabla 4.
Correlación entre datos ecográficos y presencia de brotes y progresión
| Diámetro OD | Diámetro OI | |||||||
|---|---|---|---|---|---|---|---|---|
| n (mín.; máx.) | Media (DE) | IC 95% | p | n (mín.; máx.) | Media (DE) | IC 95% | p | |
| Brotes | ||||||||
| Sí | 10 (3,20; 6,67) | 4,50 (1,09) | 3,73-5,28 | NS | 53 (2,13; 5,90) | 4,58 (0,94) | 3,91-5,25 | NS |
| No | 53 (2,29; 6,03) | 4,55 (0,93) | 4,29-4,81 | 46 (2,29; 6,67) | 4,69 (0,99) | 4,39-4,99 | ||
| Progresión | ||||||||
| Sí | 17 (3,20; 5,60) | 4,14 (0,69) | 3,79-4,49 | 0,041 | 53 (2,13; 5,90) | 4,58 (0,94) | 3,91-5,25 | 0,037 |
| No | 46 (2,29; 6,67) | 4,69 (0,99) | 4,39-4,99 | 46 (2,13; 5,90) | 4,72 (0,82) | 4,48-4,97 | ||
DE: desviación estándar; IC: intervalo de confianza; NS: no significativo; OD: ojo derecho; OI: ojo izquierdo.
En negrita está el valor de p que es estadísticamente significativo (p < 0,05).
Correlación entre los datos ecográficos y la evolución clínica posterior
| Diámetro-OD (r) | p | Diámetro-OI (r) | p | Asimetría-media (r) | p | |
|---|---|---|---|---|---|---|
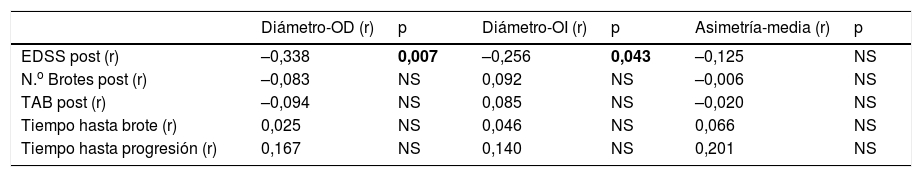
| EDSS post (r) | –0,338 | 0,007 | –0,256 | 0,043 | –0,125 | NS |
| N.o Brotes post (r) | –0,083 | NS | 0,092 | NS | –0,006 | NS |
| TAB post (r) | –0,094 | NS | 0,085 | NS | –0,020 | NS |
| Tiempo hasta brote (r) | 0,025 | NS | 0,046 | NS | 0,066 | NS |
| Tiempo hasta progresión (r) | 0,167 | NS | 0,140 | NS | 0,201 | NS |
EDSS: Expanded Disability Status Scale; NS: no significativo; OD: ojo derecho; OI: ojo izquierdo; r: correlación de Pearson; TAB: tasa anualizada de brotes.
En negrita está el valor de p que es estadísticamente significativo (p < 0,05).
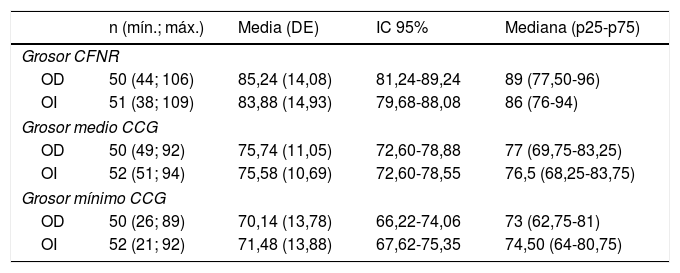
Se realizaron 52 estudios de OCT, pero solo pudieron recogerse datos de ambos ojos en 50 pacientes. En los otros 2 pacientes no pudo completarse el estudio en el otro ojo por imposibilidad técnica (nistagmo intenso que no permitía fijar la vista). Los datos se exponen en la tabla 5. Los resultados del estudio realizado buscando una correlación entre los datos ecográficos y los de OCT se muestran en la tabla 6.
Datos de tomografía de coherencia óptica (OCT)
| n (mín.; máx.) | Media (DE) | IC 95% | Mediana (p25-p75) | |
|---|---|---|---|---|
| Grosor CFNR | ||||
| OD | 50 (44; 106) | 85,24 (14,08) | 81,24-89,24 | 89 (77,50-96) |
| OI | 51 (38; 109) | 83,88 (14,93) | 79,68-88,08 | 86 (76-94) |
| Grosor medio CCG | ||||
| OD | 50 (49; 92) | 75,74 (11,05) | 72,60-78,88 | 77 (69,75-83,25) |
| OI | 52 (51; 94) | 75,58 (10,69) | 72,60-78,55 | 76,5 (68,25-83,75) |
| Grosor mínimo CCG | ||||
| OD | 50 (26; 89) | 70,14 (13,78) | 66,22-74,06 | 73 (62,75-81) |
| OI | 52 (21; 92) | 71,48 (13,88) | 67,62-75,35 | 74,50 (64-80,75) |
CCG: capa de células ganglionares; CFNR: capa fibras nerviosas de la retina; DE: desviación estándar; IC: intervalo de confianza; OD: ojo derecho; OI: ojo izquierdo.
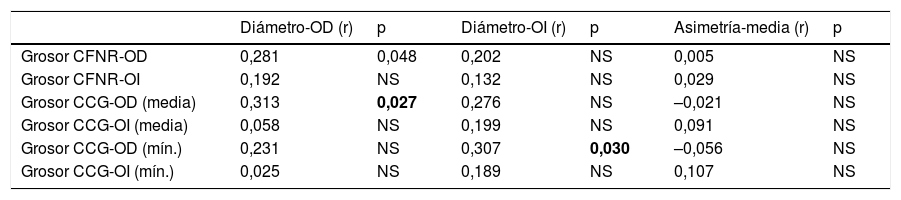
Correlación entre los datos ecográficos y la OCT
| Diámetro-OD (r) | p | Diámetro-OI (r) | p | Asimetría-media (r) | p | |
|---|---|---|---|---|---|---|
| Grosor CFNR-OD | 0,281 | 0,048 | 0,202 | NS | 0,005 | NS |
| Grosor CFNR-OI | 0,192 | NS | 0,132 | NS | 0,029 | NS |
| Grosor CCG-OD (media) | 0,313 | 0,027 | 0,276 | NS | –0,021 | NS |
| Grosor CCG-OI (media) | 0,058 | NS | 0,199 | NS | 0,091 | NS |
| Grosor CCG-OD (mín.) | 0,231 | NS | 0,307 | 0,030 | –0,056 | NS |
| Grosor CCG-OI (mín.) | 0,025 | NS | 0,189 | NS | 0,107 | NS |
CCG: capa de células ganglionares; CFNR: capa fibras nerviosas de la retina; NS: no significativo; OCT: tomografía de coherencia óptica; OD: ojo derecho; OI: ojo izquierdo; r: correlación de Pearson.
En negrita está el valor de p que es estadísticamente significativo (p < 0,05).
Las lesiones del sistema nervioso central detectadas en la EM se caracterizan por la disrupción de la barrera hematoencefálica, inflamación, desmielinización, pérdida de oligodendrocitos, gliosis reactiva y degeneración neuronal/axonal1,17,18. La pérdida neuronal/axonal progresiva se considera la causa más importante de discapacidad neurológica en la EM y es detectable desde estadios iniciales19.
La ecografía orbitaria ha sido usada con anterioridad para valorar el NO en condiciones de hipertensión intracraneal20 y para valorar la neuritis óptica aguda21. También ha sido comparada con resonancia magnética de 3 teslas, encontrando una buena precisión en la medida, con reproducibilidad y buena relación interobservador e intraobservador22. Los valores ecográficos obtenidos en nuestro estudio son similares a los encontrados en la literatura previamente23, así como los datos referentes a la enfermedad y su evolución.
En el seguimiento de los pacientes, encontramos una puntuación EDSS media al final del estudio ligeramente mayor que al inicio del estudio, cambio esperable por la evolución de la enfermedad24,25. Encontramos una correlación negativa estadísticamente significativa entre los diámetros de ambos ojos y esta EDSS, de tal manera que a menor diámetro de NO, mayor puntuación en la escala al final del estudio.
En nuestro estudio también encontramos diferencias estadísticamente significativas entre pacientes con progresión y sin progresión, siendo menores los diámetros en el grupo con progresión para ambos ojos. No obtuvimos el mismo resultado para la presencia de brotes, número de brotes, la TAB y el tiempo transcurrido hasta el primer brote. Este hecho viene sustentado por el carácter inflamatorio subyacente al desarrollo de brotes. Sin embargo, cuando hablamos de progresión, al igual que la EDSS y la discapacidad, se relaciona en función de cambios de neurodegeneración y pérdida axonal26, cambios que pueden ser valorados con la ecografía, de igual manera que el grosor de la CFNR y/o el volumen cerebral han sido designados como marcadores subrogados27.
Hasta la actualidad no se ha estudiado la relación entre los grosores del NO medido por ecografía y la OCT en pacientes con EM, debido, por un lado, a la reciente incorporación de esta técnica a este campo y, por otro, a que aún se encuentra en fase de estudio. Sí se ha prestado atención a los parámetros hemodinámicos de la órbita, principalmente en relación con la neuritis óptica28-32. En nuestro estudio encontramos una relación positiva estadísticamente significativa entre el grosor del diámetro del NO medido por ecografía, la CFNR y el grosor medio de la capa granulosa en el OD. Esta relación positiva (a mayor grosor de nervio por ecografía, mayores grosores en las capas medidas por OCT) apunta a que la ecografía es capaz de medirlo de forma simple y menos precisa, al no poder diferenciar entre capas. Esta medida, sencilla de adquirir, puede darnos una idea aproximada de la integridad del nervio en estos enfermos. La disparidad entre ambos ojos puede deberse a que hay mayor presencia de neuritis ópticas previas en el OD (20,6% vs. 15,9%); sin embargo, confirmar esta hipótesis requeriría de más estudios.
La medición del diámetro del NO por ecografía podría utilizarse como medida predictiva en la evolución de la enfermedad, ya que la disminución del mismo se asocia con progresión clínica y mayor discapacidad, medidas por la EDSS en el seguimiento. A falta de un «patrón oro» para la evaluación de la neurodegeneración y del daño axonal, la ecografía del NO puede servir como una herramienta útil en la evaluación de los pacientes con EM, aunque serían necesarios más estudios para corroborarlo.
Conflicto de interesesNo existe conflicto de intereses en ninguno de los autores.
El trabajo ha sido presentado parcialmente en las siguientes reuniones: LXVIII Reunión de la Sociedad Española de Neurología (presentación tipo póster y comunicación oral); 32nd Congress of ECTRIMS (presentación tipo póster); 22nd Meeting of the European Society of Neurosonology and Cerebral Hemodynamics (presentación tipo póster).