La relación entre la corteza entorrinal y el hipocampo ha sido estudiada por diferentes autores, que han destacado la importancia de las células de cuadrícula, las células de posicionamiento y la conexión trisináptica en los procesos que regulan: la persistencia de la memoria espacial, explícita y reciente, y su posible afección con el envejecimiento.
ObjetivoObservar si existen diferencias en el tamaño y número de células de cuadrícula contenidas en la lámina iii de la corteza entorrinal y en la capa granular del giro dentado del hipocampo de pacientes mayores.
MétodosRealizamos estudios posmortem del cerebro de 6 sujetos de edades comprendidas entre los 56 y 87 años. Los cortes de cerebros que contenían el giro dentado del hipocampo y la corteza entorrinal adyacente se tiñeron con el método de Klüver-Barrera, después se midió, mediante el programa Image J, el área neuronal individual, el área neuronal total, así como el número de neuronas, contenidas en cuadrículas rectangulares a nivel de la lámina iii de la corteza entorrinal y la lámina ii del giro dentado y se llevó a cabo un análisis estadístico.
ResultadosSe ha observado una reducción de la población celular de la capa piramidal externa de la corteza entorrinal, así como de las neuronas de la capa granular del giro dentado relacionada con el envejecimiento.
ConclusiónNuestros resultados indican que el envejecimiento produce una disminución en el tamaño y la densidad neuronal en las células de cuadrícula de la corteza entorrinal y de posicionamiento del giro dentado.
The relationship between the entorhinal cortex and the hippocampus has been studied by different authors, who have highlighted the importance of grid cells, place cells, and the trisynaptic circuit in the processes that they regulate: the persistence of spatial, explicit, and recent memory and their possible impairment with ageing.
ObjectiveWe aimed to determine whether older age causes changes in the size and number of grid cells contained in layer III of the entorhinal cortex and in the granular layer of the dentate gyrus of the hippocampus.
MethodsWe conducted post-mortem studies of the brains of 6 individuals aged 56-87 years. The brain sections containing the dentate gyrus and the adjacent entorhinal cortex were stained according to the Klüver-Barrera method, then the Image J software was used to measure the individual neuronal area, the total neuronal area, and the number of neurons contained in rectangular areas in layer III of the entorhinal cortex and layer II of the dentate gyrus. Statistical analysis was subsequently performed.
ResultsWe observed an age-related reduction in the cell population of the external pyramidal layer of the entorhinal cortex, and in the number of neurons in the granular layer of the dentate gyrus.
ConclusionOur results indicate that ageing causes a decrease in the size and density of grid cells of the entorhinal cortex and place cells of the dentate gyrus.
El giro dentado (GD) constituye una región del hipocampo que se fusiona con la superficie enrollada del asta de Amón y abraza de esta manera las eferencias de las neuronas piramidales de esta. Medialmente se separa del giro parahipocampal por el surco del hipocampo y de la fimbria por el surco fimbriodentado (figs. 1-5)1.
En el GD (figs. 1-5) se produce un fenómeno denominado potenciación a largo plazo, que consiste en el fortalecimiento de las conexiones sinápticas después de la estimulación repetida de forma duradera2. También es uno de los lugares del sistema nervioso junto con el bulbo olfatorio donde se produce el fenómeno de la neurogénesis adulta. Algunos estudios plantean la hipótesis de que los nuevos recuerdos podrían utilizar preferentemente células dentadas recién formadas, lo que proporciona un mecanismo potencial para distinguir múltiples demandas de eventos similares o múltiples llegadas a la misma ubicación3. El GD está formado por 3 capas: polimórfica, granular y molecular; y participa en el circuito trisináptico4. Recibe aferencias desde la corteza entorrinal (CE) por la vía perforante (procedente principalmente de la lámina iii) pues no recibe aferencias de otras estructuras corticales5,6. Las eferencias del GD constan de los axones de las células granulares denominados fibras musgosas que conectan con las neuronas piramidales de CA3 en el hipocampo y posteriormente desde CA3 se conectan con CA1 por las colaterales de Shaffer7,8.
Por otro lado, en el GD, que es una de las regiones encefálicas donde, como hemos referido anteriormente, hay neurogénesis adulta, se ha descrito que los glucocorticoides y la acción del sistema nervioso simpático (situación de estrés) inhiben este proceso de neurogénesis9. Igualmente hay evidencias que indican que la práctica de ejercicio aeróbico aumenta dicha neurogénesis10. Además, el GD está implicado en la memoria espacial ya que si se destruían un 90% de las neuronas granulares del GD de ratas estas mostraban una gran dificultad para maniobrar en un entorno por el que ya habían pasado11. Estas neuronas granulares se corresponderían con las células de posicionamiento, que son cruciales para discriminar conductualmente memorias espaciales similares, prediciendo que las células posicionamiento (CP) del GD cambian y reasignan su ajuste espacial relativo para la discriminación de memoria12.
Corteza entorrinalLa CE (figs. 1-5) es un área localizada en la parte medial del lóbulo temporal situada entre el subículo y la corteza perirrinal13,14 y constituye la principal fuente de aferencias y eferencias del hipocampo2,13,14. La CE cobra una gran importancia para los procesos de memoria reciente y percepción temporal donde desempeñan un papel significativo las conexiones desde su lámina piramidal externa (lámina iii), ya que son los lugares de las eferencias principales de la vía perforante, al GD. La CE a su vez recibe eferencias de la corteza prefrontal, perirrinal y parahipocampal15 .Las capas profundas, principalmente la capa v, reciben una de las 3 eferencias principales del hipocampo y, a su vez, las conexiones recíprocas de otras áreas corticales que se proyectan a la CE superficial. Las neuronas en la CE lateral exhiben poca selectividad espacial16. Las neuronas de la CE medial presentan diversos «campos de lugar» adoptando un patrón rectangular o hexagonal denominándose células en cuadrícula17–19.
Se piensa que en el hipocampo se inician procesos mnemónicos de todo el sistema a través de la reactivación de los rastros de memoria espacial y episódica adquiridos previamente, que pueden reclutar a la CE como una primera etapa de la redistribución de la memoria a otras áreas del encéfalo. La reactivación del hipocampo se produce durante la oleada de ondas agudas, en las que se dispara la red que sincroniza y codifica secuencias de los lugares20. Se ha estudiado la coordinación de esta sincronización y codificación registrando la actividad de ensamblaje simultáneamente en la región CA1 del hipocampo y las capas superficiales de la CE medial. Así, se ha descrito que los ensamblajes de células entorrinales pueden reproducir trayectorias independientemente en el hipocampo, donde se observan oleadas de las ondas agudas con picos de la actividad de las células de cuadrícula espaciotemporalmente aleatorias y diversas21. Esto indica que el hipocampo no es el único iniciador de la reactivación de rastreo de memoria espacial y episódica20–23.
Durante la vida diaria, se depende de los recuerdos de las experiencias pasadas para planificar el comportamiento futuro. Estos recuerdos están representados por la actividad de grupos neuronales específicos o «engramas»24,25. Los engramas neuronales se ensamblan durante el aprendizaje mediante modificación sináptica, y la reactivación del engrama representa la experiencia memorizada24. Los engramas de recuerdos conscientes se almacenan inicialmente en el hipocampo durante varios días y luego se transfieren a las áreas corticales25. En el GD del hipocampo, las células granulares agrupadas en células de posicionamiento12 transforman entradas ricas desde las células de cuadrícula de la CE en una salida escasa, que se envía a la red celular piramidal formada por las células de posicionamiento altamente interconectada en el área del hipocampo CA3. Así se indica que los grupos sinápticos a lo largo del circuito trisináptico del hipocampo se reasignan constantemente para apoyar la formación de representaciones dinámicas en las áreas a lo largo del hipocampo en base a un código estable proporcionado por el GD26.
Teniendo en cuenta: -que la CE es donde se localizan las células de cuadrícula que envían conexiones a los grupos neuronas de posicionamiento del GD (figs. 1-3), -que estas conexiones emiten pulsos de electricidad en un patrón regular para mapear el movimiento de un animal, - que es el inicio de la conexión trisináptica crucial en el circuito Papez (fig. 4)1 y que forman parte de los elementos funcionales de la memoria espacial y la memoria reciente, el propósito del presente trabajo es observar y describir en 6 cerebros humanos de 56 a 87 años, las variaciones de las neuronas contenidas áreas rectangulares de la lámina iii de la CE (donde podrían estar las células de cuadrícula y la lámina ii del GD donde estarían las células de posicionamiento.
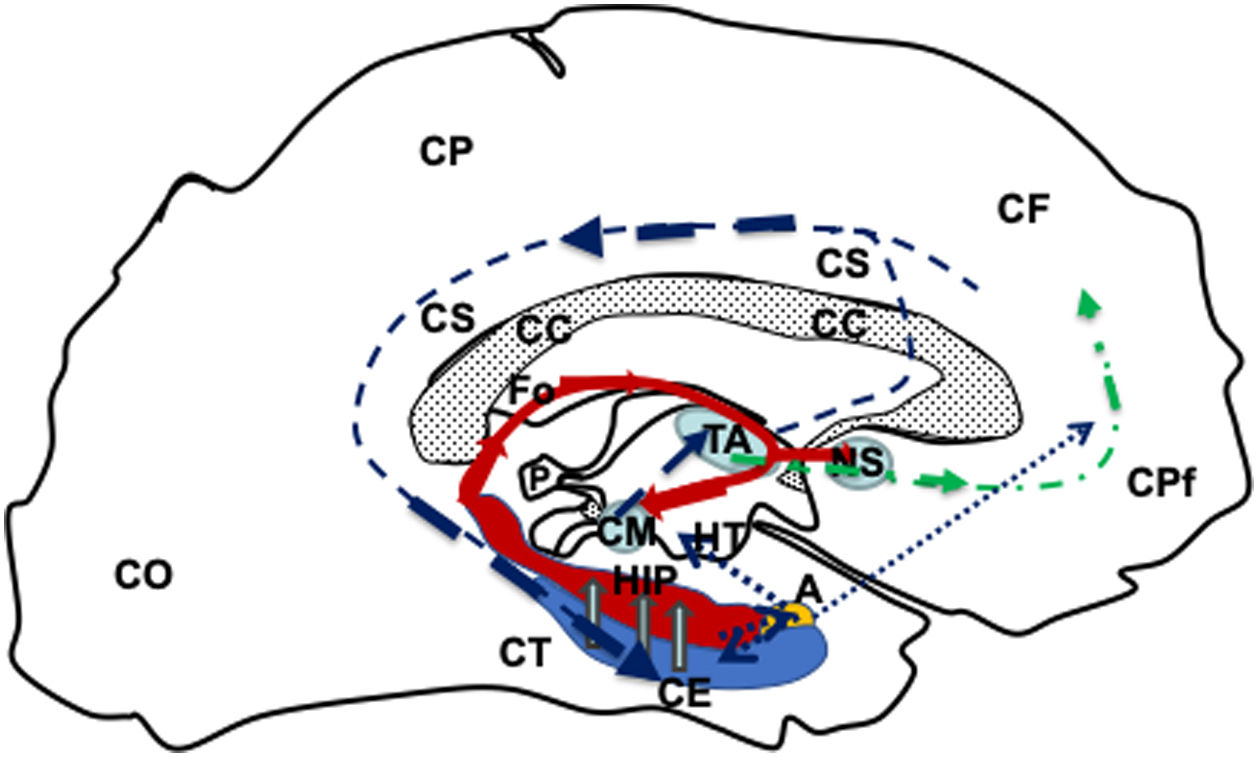
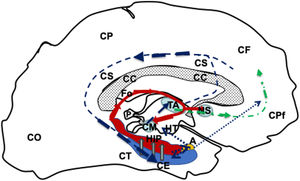
Dibujo esquemático de una visión medio sagital del telencéfalo izquierdo donde se representa el circuito de Papez; modificado de Kahle y Frostcher1.
El circuito se iniciaría en la CE (azul), seguiría (flechas huecas grises) hacia el HIP (rojo) por el fornix (línea roja continua), llegaría al CM (azul) que conectarán con el TA (azul), mediante el haz mamilo-talámico (línea azul oscura discontinua), desde el TA conectaría con las cortezas CPf y CCi para llegar a la corteza entorrinal nuevamente y cerrar el ciecuito (línea azul oscura discontinua). Además, el fornix (Fo) conectaría con en fornix contralateral a travez de lo comisura del fornix (CFo) y con los núcleos septales (N y homolaterales y contralaterales por la CBa y corteza prefrontal (línea verde discontinua de puntos y rayas). Por ultimo el hipocampo y corteza entorrinal también conecta con el complejo amigdalino y este a su vez con el hipotálamo y la corteza prefrontal (línea azul de puntos).
A: complejo amigdalino; CBa:comisura blanca anterior; CC:cuerpo calloso; CCi:corteza cingular; CE:corteza entorrinal; CF:corteza frontal; CFo:comisura del fórnix; CM:cuerpo mamilar; CO:corteza occipital; CP:corteza parietal; CPf:corteza prefrontal; CT corteza temporal; Fo:fórnix; HIP:hipocampo; HT:hipotálamo; NS:núcleos séptales; P:glándula pineal; TA:tálamo.
El tamaño de estas áreas rectangulares o cuadrangulares, donde se encontrarían las células de cuadrícula de la CE, que incluso a veces se estiran o comprimen y posicionamiento del GD, ha sido muy discutido por diversos autores27-29; en vista de los resultados de estos autores y de que no hay un tamaño claro y definido, decidimos hacer las medidas en áreas rectangulares de 200×250μ2.
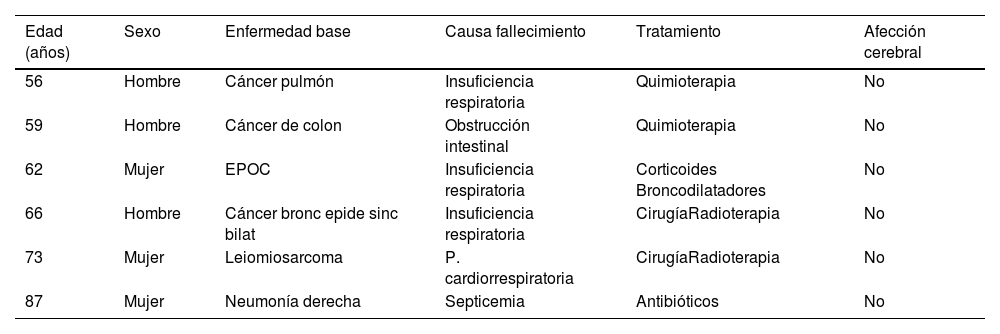
Material y métodosLas muestras fueron obtenidas de cerebros de cadáveres adultos (tabla 1) de 3 hombres de 56, 59 y 66años y 3 mujeres de 62, 73 y 87 años de edad, procedentes de donaciones para la docencia y la investigación de la Unidad Departamental de Anatomía y Embriología Humana de la Universidad de la Laguna. Siguiéndose el protocolo del Departamento, a las 24h del fallecimiento los cadáveres fueron perfundidos con formaldehido al 5%. Inmediatamente se extrajeron los encéfalos mediante la eliminación de la bóveda craneal y se diseccionaron 6 lóbulos temporales mediales que contenían la CE y el hipocampo. Cada pieza fue dividida a lo largo del eje anteroposterior en secciones coronales a través de la cabeza y el cuerpo del hipocampo y la CE subyacente. El comité ético de la Universidad de La Laguna aprobó y supervisó el estudio.
Distribución de los casos (pacientes) por edad, sexo, enfermedad de base, causa del fallecimiento, tratamiento y posible afección cerebral
| Edad (años) | Sexo | Enfermedad base | Causa fallecimiento | Tratamiento | Afección cerebral |
|---|---|---|---|---|---|
| 56 | Hombre | Cáncer pulmón | Insuficiencia respiratoria | Quimioterapia | No |
| 59 | Hombre | Cáncer de colon | Obstrucción intestinal | Quimioterapia | No |
| 62 | Mujer | EPOC | Insuficiencia respiratoria | Corticoides Broncodilatadores | No |
| 66 | Hombre | Cáncer bronc epide sinc bilat | Insuficiencia respiratoria | CirugíaRadioterapia | No |
| 73 | Mujer | Leiomiosarcoma | P. cardiorrespiratoria | CirugíaRadioterapia | No |
| 87 | Mujer | Neumonía derecha | Septicemia | Antibióticos | No |
Las piezas extraídas fueron posfijadas en formol 5%, deshidratadas e incluidas en parafina. Las piezas fueron cortadas en secciones seriados de 10micras de espesor, recogiendo los cortes en 4 series alternas A, B, C y D. Se analizaron 2 series de muestras que fueron teñidas con Klüver-Barrera30, método que combina 2 colorantes: violeta de cresilo (básico) y luxol fast blue (con afinidad por los lípidos de la vaina de mielina), donde se tiñe la mielina de azul y los núcleos y la sustancia de Nissl de violeta. La adquisición de las imágenes se realizó con un fotomicroscopio Leica DM 1000. Todas las imágenes fueron trasladadas en Adobe Photoshop. Asimismo, se utilizó el programa Image J (Java) para el análisis (recuento de células, el cálculo del perímetro, área neuronal individual y área neuronal total que ocupan en cada cuadrícula) de las neuronas contenidas en 7 cuadrículas, con un tamaño de 200×250μm, de varias secciones rostro caudales de cada espécimen, a nivel de la lámina iii de la CE y la lámina granular del GD.
Análisis estadísticoLa información es resumida con medias (desviación estándar) para las variables distribuidas normalmente y con mediana (intervalo del rango intercuartílico) para las que no lo cumplen. Las comparaciones entre CE y GD fueron realizadas con el test de la U de Mann-Whitney. Para estudiar la evolución del recuento de células en función de la zona (CE o GD), sexo y edad (<65 o≥65 años) se aplicó un modelo lineal generalizado con distribución de Poisson y enlace logarítmico, mientras para el área individual y el área total neuronal se utilizó un modelo lineal general. Para ambos modelos se incorporó, cuando fueron significativas, las interacciones entre los diferentes factores considerados.
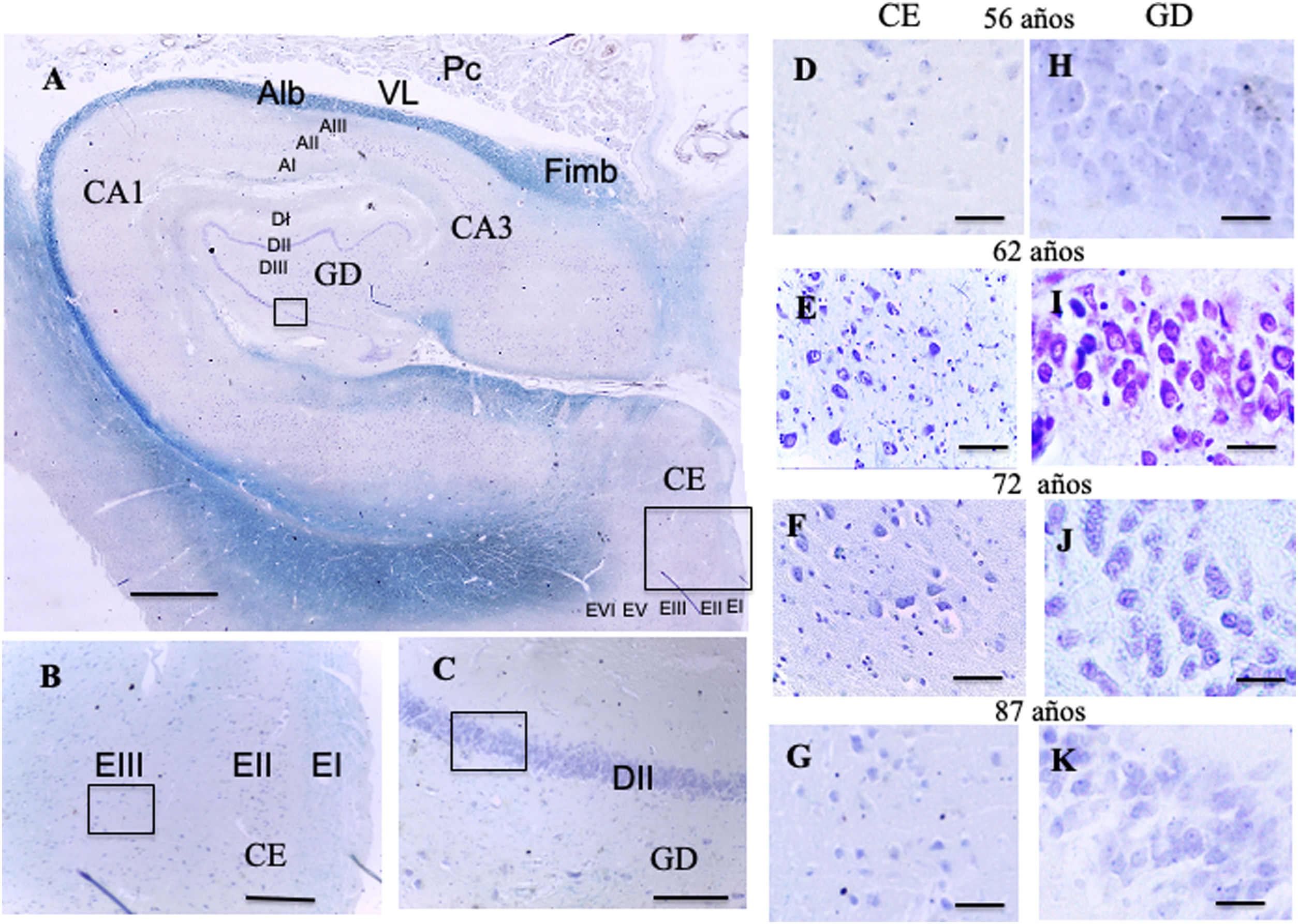
ResultadosCualitativosGiro dentado (figs. 5 A, C)En el grupo de edades de 56 a 62 años se observa en la capa granular una gran densidad de neuronas granulares con núcleos ocupando gran parte del citoplasma y en los que se aprecia un nucléolo central o periférico con escasas variaciones entre las edades de este grupo (figs. 5 H, I).
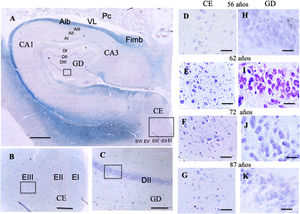
A:Fotografía de una visión panorámica de un corte transversal de hipocampo (giro dentado y asta de Amón) y corteza entorrinal. Barra 1000μm. B:Detalle del recuadro de CE en la fotografía A, barra 250μm, donde el pequeño recuadro se correspondería con la células se cuadrícula de la lámina iii. C:Detalle del recuadro del GD en la fotografía A, barra 250μm, donde el pequeño recuadro se correspondería con la células de posicionamiento de la lámina ii.
D, E, F, G:Microfotografías del la lámina iii de la CE con la posible localización de las células de cuadrícula; H, I, J, K:Microfotografías del la lámina ii del GD con la posible localización de las células de posicionamiento, barra 50μm.
D y H:56 años; E e I:62 años; F y J:72 años; G y K:87 años.
AI:lámina I molecular del asta de Amón; AII:lámina ii piramidal del asta de Amón; AIII:lámina iii polimorfa del asta de Amón; Alb:albeus; CA1, CA3:zonas del asta de Amón del hipocampo; CE:corteza entorrinal; DI:lámina i molecular del giro dentado; DII:lámina ii granular del giro dentado; DIII:lámina iii polimorfa del giro dentado; EI:lámina i molecular de la CE; EII:lámina ii de células estrelladas de la CE;EIII:lámina iii piramidal externa de la CE; EV:Lámina v piramidal interna de la CE; EVI:lámina vi lámina polimorfa de la CE; Fimb:fimbria; GD:giro dentado del hipocampo, Pc:plexos coroideos; VL:ventrículo lateral. Recuadros de GD posible localización de las células de posicionamiento; recuadros de CE posible localización de las células de cuadrícula.
En el segundo grupo de edades desde 66 a 87, en la lámina ii hay una gran densidad de neuronas granulares en las que se observan núcleos grandes que ocupan gran parte del citoplasma con nucléolos que se localizan en disposición central y otros periféricamente. Se aprecian pequeñas diferencias cualitativas con el grupo anterior que se acentúan más en la última edad estudiada (mujer de 87 años), en la capa granular donde cualitativamente parece observarse una menor densidad de neuronas granulares, su núcleo sigue abarcando gran parte del citoplasma y sus nucléolos centrales en disposición preferentemente central (figs. 5 J, K).
Corteza entorrinal (figs. 5 A, B)En el primer grupo, de 56 años a 62 años, se observa una capa piramidal externa (Capa 3) en la que se localizan neuronas piramidales de tamaño mediano y grande agrupadas donde destacan un núcleo prominente ocupando casi la totalidad del citoplasma con una cromatina dispersa y un único nucléolo en posición central. Entre ellas se disponen en menor densidad neuronas pequeñas. Cualitativamente no se parecían diferencias al comparar las edades de este grupo (figs. 5, D, E).
En el siguiente grupo de edades, de 66 a 87 años, a los 66 años de forma parecida al grupo de edades anteriores, la capa piramidal externa muestra una densidad relativamente baja de neuronas piramidales de tamaño medio con núcleos claros que ocupan gran parte del citoplasma. En las siguiente edades hay más variaciones cualitativas que en las edades anteriores, de tal manera que en el caso de la mujer de 73 años la capa piramidal externa tiene una población de células piramidales menos numerosa que se acentúa a los 87 años, donde no se consigue delimitar bien el núcleo, que a veces se dispone central y en otra ocasiones periféricamente (figs. 5 F, G).
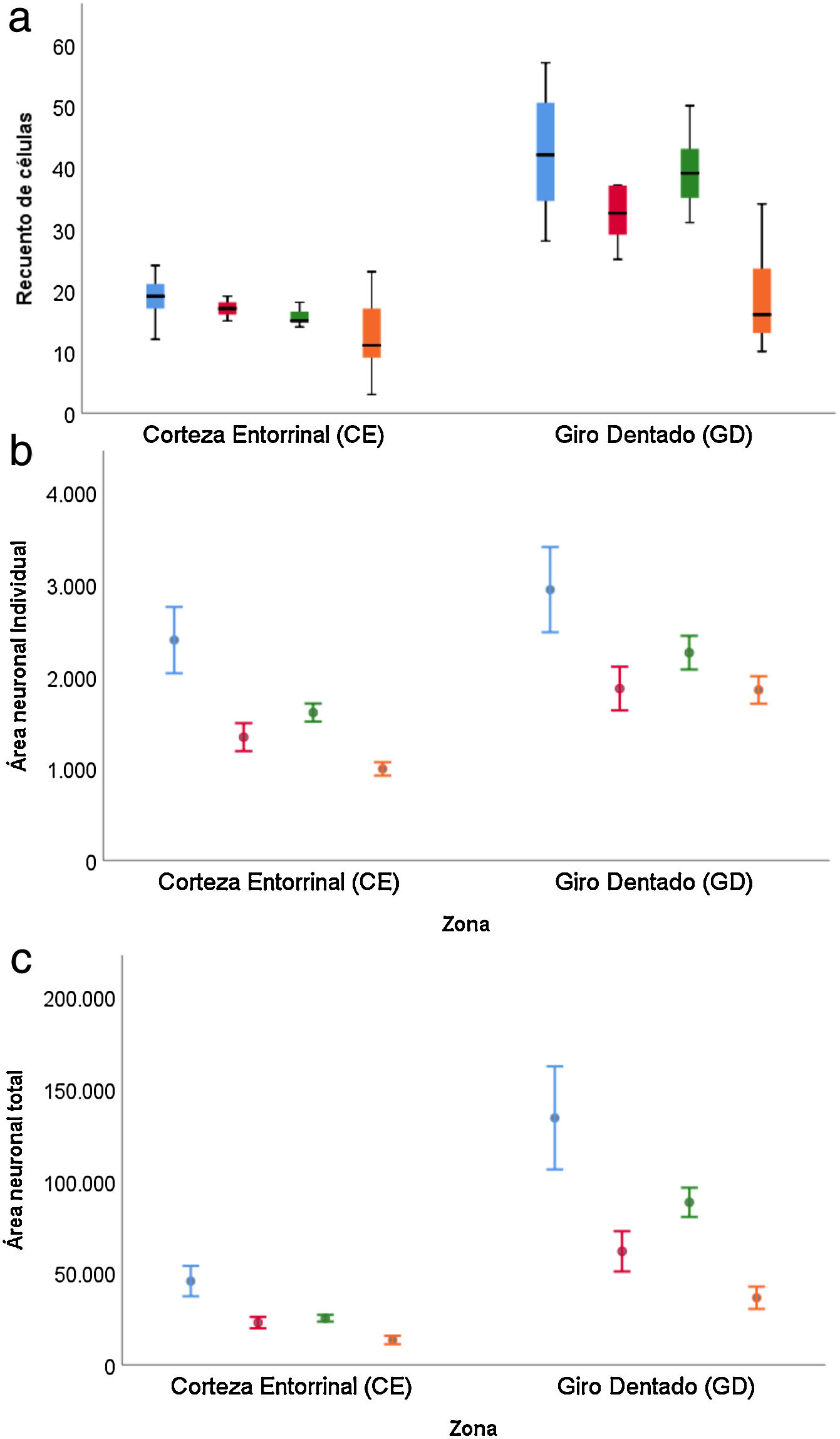
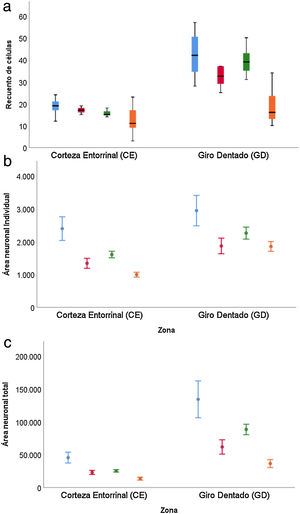
Resultados cuantitativosLa muestra está constituida por 3 hombres y 3 mujeres, con una edad media de 67,5 años (11,36) con 3 individuos superando los 65 años (tabla 1). La tabla 2 muestra la estadística descriptiva de los valores de recuento de células, área individual y área total neuronal en las 2 regiones estudiadas. Para todas ellas los valores en GD fueron superiores a CE de forma significativa (p<0,001).
Estadística descriptiva (mediana e intervalo intercuartílico)
| Corteza entorrinal | Giro dentado | Valor de p | ||
|---|---|---|---|---|
| Recuento de células | 16 (14,2-18,7) | 32,5 (23,5-41,5) | <0,001 | |
| Área neuronal | Individual | 1.295,9 (1090,6-1804,7) | 1.959,8 (1.668,9-2.631,0) | <0,001 |
| Total | 22.389 (16.844-31.276) | 62.472 (38.026-104.335) | <0,001 |
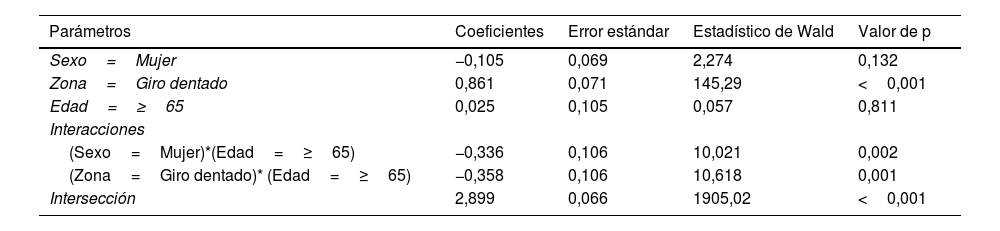
Para el recuento de células (tabla 3), la diferencia entre el GD y CE se ve reducida en el caso de las personas de más de 65 años (p=0,001), observándose además una caída en ambas zonas en el caso de mujeres mayores de 65 años (p=0,002) (fig. 6 a).
Modelo loglineal para el recuento de células
| Parámetros | Coeficientes | Error estándar | Estadístico de Wald | Valor de p |
|---|---|---|---|---|
| Sexo=Mujer | −0,105 | 0,069 | 2,274 | 0,132 |
| Zona=Giro dentado | 0,861 | 0,071 | 145,29 | <0,001 |
| Edad=≥65 | 0,025 | 0,105 | 0,057 | 0,811 |
| Interacciones | ||||
| (Sexo=Mujer)*(Edad=≥65) | −0,336 | 0,106 | 10,021 | 0,002 |
| (Zona=Giro dentado)* (Edad=≥65) | −0,358 | 0,106 | 10,618 | 0,001 |
| Intersección | 2,899 | 0,066 | 1905,02 | <0,001 |
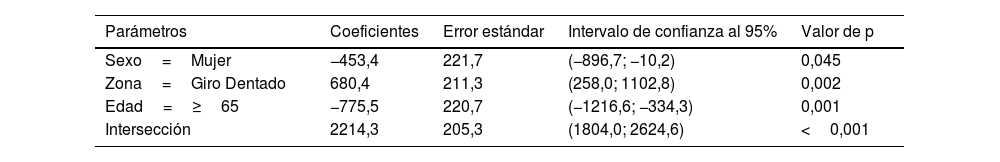
El área neuronal individual (tabla 4) tanto en el GD como el CE mantuvo la misma estructura en función del sexo y grupo de edad, con valores superiores en GD (p=0,002) e inferiores en mujeres (p=0,045) y en personas mayores de 65 años (p<0,001) (fig. 6b).
Modelo lineal general para el área neuronal individual
| Parámetros | Coeficientes | Error estándar | Intervalo de confianza al 95% | Valor de p |
|---|---|---|---|---|
| Sexo=Mujer | −453,4 | 221,7 | (−896,7; −10,2) | 0,045 |
| Zona=Giro Dentado | 680,4 | 211,3 | (258,0; 1102,8) | 0,002 |
| Edad=≥65 | −775,5 | 220,7 | (−1216,6; −334,3) | 0,001 |
| Intersección | 2214,3 | 205,3 | (1804,0; 2624,6) | <0,001 |
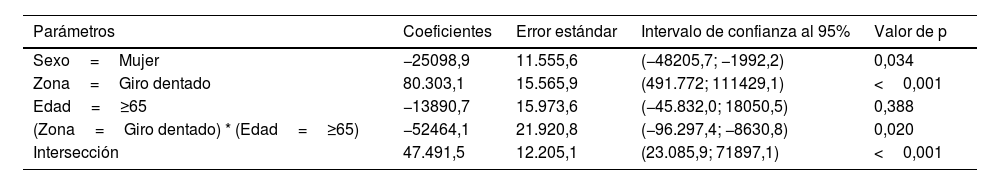
Los resultados del estudio sobre el área total neuronal se muestran en la tabla 5, donde se observa la combinación de los resultados comentados en el caso del recuento de células y área neuronal individual. Los valores son superiores en GD frente a CE (p<0,001), inferiores en mujeres frente hombres (p=0,034) y produciéndose una reducción en la diferencia entre GD y CE cuando estamos con personas mayores de 65 años (p=0,020) (fig. 6c).
Modelo lineal general para el área neuronal total
| Parámetros | Coeficientes | Error estándar | Intervalo de confianza al 95% | Valor de p |
|---|---|---|---|---|
| Sexo=Mujer | −25098,9 | 11.555,6 | (−48205,7; −1992,2) | 0,034 |
| Zona=Giro dentado | 80.303,1 | 15.565,9 | (491.772; 111429,1) | <0,001 |
| Edad=≥65 | −13890,7 | 15.973,6 | (−45.832,0; 18050,5) | 0,388 |
| (Zona=Giro dentado) * (Edad=≥65) | −52464,1 | 21.920,8 | (−96.297,4; −8630,8) | 0,020 |
| Intersección | 47.491,5 | 12.205,1 | (23.085,9; 71897,1) | <0,001 |
Indudablemente estos resultados deben ser tomados con cautela, debido al número de muestras y los rangos de edades en los que se ha realizado el estudio.
DiscusiónHoy en día, las consecuencias para la salud pública de las enfermedades que afectan la memoria y la navegación espacial son altas y crecen a medida que la población envejece, lo que lleva a centrarse en seguir explorando estas regiones del encéfalo31, como son la CE, el hipocampo y sus células de cuadrícula y posicionamiento.
Las células de cuadrícula, localizadas en la lámina iii (lámina piramidal externa) de la CE27,32 es el lugar de origen de las aferencias a las células de posicionamiento situadas en el GD y asta de Amón del hipocampo. Sin embargo, las localizaciones y conexiones de estas células son discutidas por los autores. Así, por un lado, a las células de posicionamiento se las localiza en las capa granular de GD y en las capas de células piramidales de CA3, CA2 y CA1 que es donde llegan las conexiones directas desde las células de cuadrículas de CE (fig. 1)26,27,32,33. Pero, por otro lado, esto contradeciría otros hallazgos34–37 que defienden las conexiones indirectas como son la vía perforante, conexión trisináptica y el circuito de Papez donde las conexiones irían: desde la CE al GD, del GD hacia CA3 y desde CA3 por las colaterales Shaffer a CA1 (fig. 2)31–34. Las conexiones indirectas parecen ser lo más aceptado, y se podría decir que ambos grupos de autores tendrían razón, pero siendo más abundantes las conexiones indirectas que las conexiones directas (fig. 3). De cualquier manera, los cambios que tienen lugar en el GD y CA3 con la edad pueden explicar el aumento de las alteraciones que se producen con el envejecimiento, que también contribuyen a la disminución de la función cognitiva. En cambio, aún no se sabe si este aumento de la susceptibilidad a alteraciones como convulsiones o deterioro cognitivo es causa o efecto de estos cambios en dichas estructuras relacionados con la edad38. De tal manera que en un estudio realizado con técnicas de imagen mediante resonancia magnética se observó que la atrofia se produce en mayor medida en CA1 y GD durante el envejecimiento38–42.
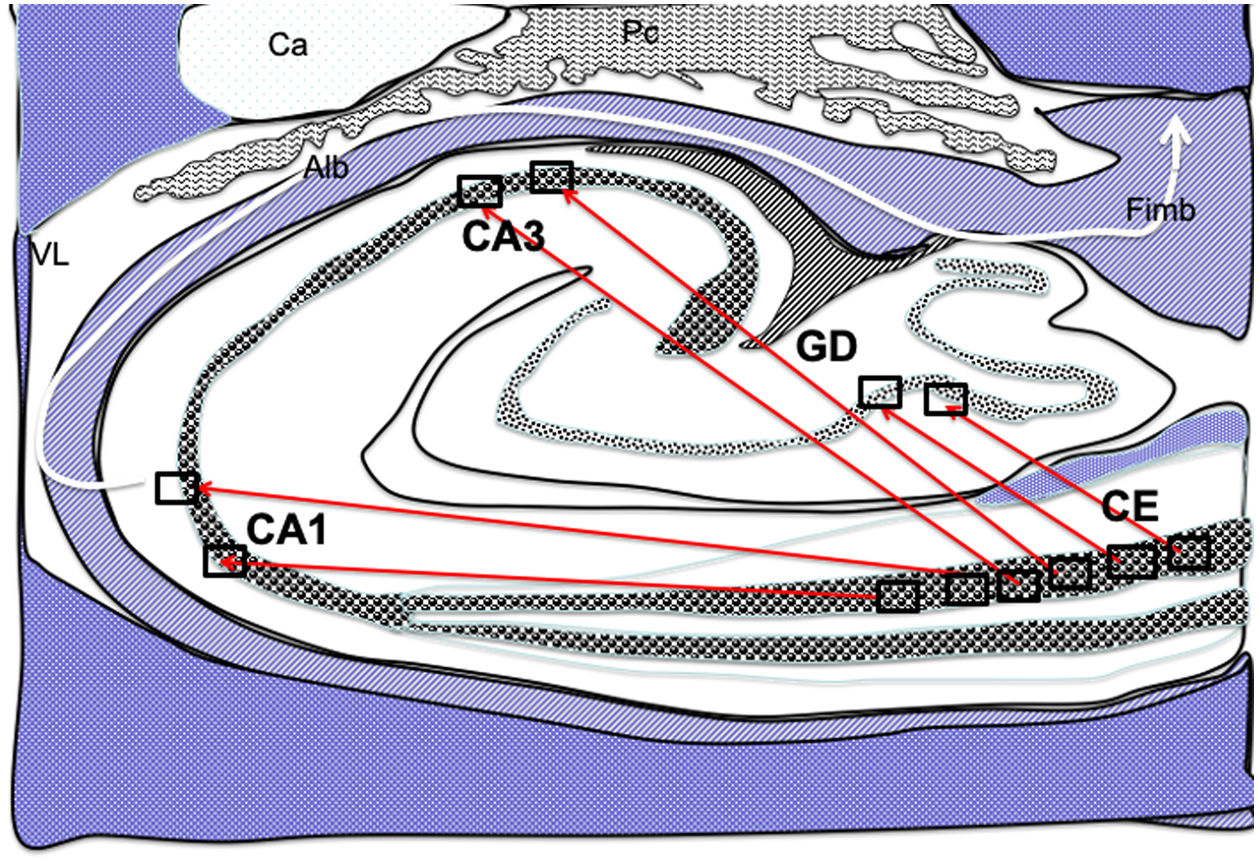
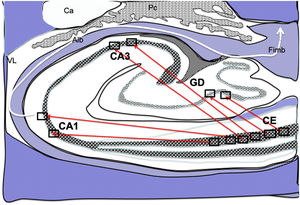
Dibujo esquemático de un corte transversal del hipocampo a nivel del cuerno temporal del ventrículo lateral derecho, donde la flechas señalarían las conexiones directas (flechas rojas de línea continua) desde las células de cuadrícula de la corteza entorrinal a las células de posicionamientos del GD, CA1 y CA3 y después hacia el albeus y fimbria (flecha blanca) 26–30.
Alb:albeus; Ca:cola del caudado; CA1, CA3:zonas del asta de Amón del hipocampo; CE:corteza entorrinal; Fimb:fimbria; GD:giro dentado del hipocampo; Pc:plexos coroideos; VL:ventrículo lateral. Recuadros de GD, CA3 y CA1 posible localización de las células de posicionamiento; recuadros de CE posible localización de las células de cuadrícula.
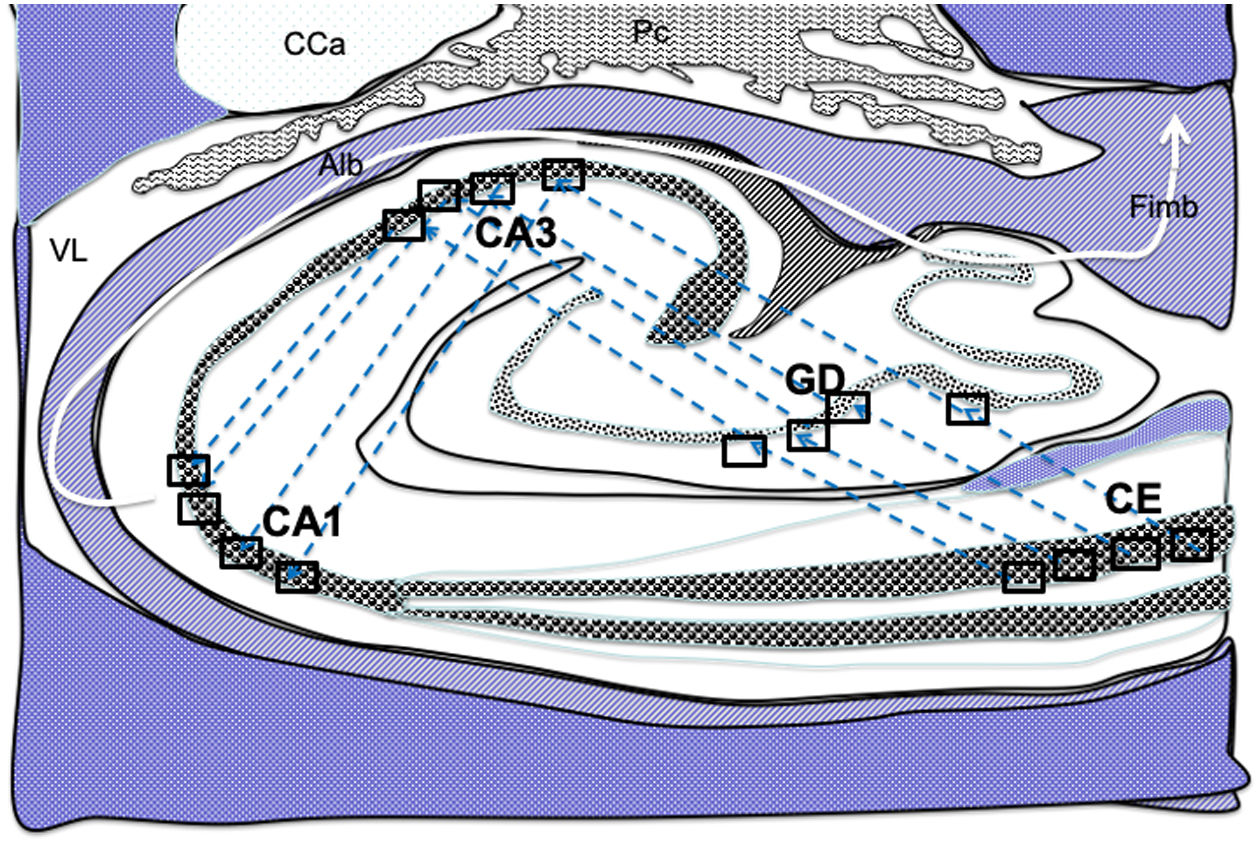
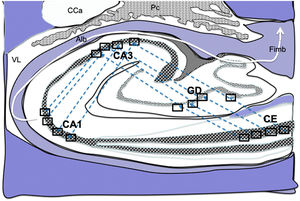
Dibujo esquemático de un corte transversal del hipocampo a nivel del cuerno temporal del ventrículo lateral derecho, donde la flechas señalarían las conexiones indirectas (flechas azules, de línea discontinua) desde las células de cuadrícula de la corteza entorrinal a las células de posicionamientos del hipocampo, de tal manera que en primer lugar estas conexiones van desde la CE al GD, después del GD a CA1, seguido de CA1 a CA3 y por último hacia el albeus y fimbria (flecha blanca)31–34.
Alb:albeus; Ca:cola del caudado; CA1, CA3:zonas del asta de Amón del hipocampo; CE:corteza entorrinal; Fimb:fimbria; GD:giro dentado del hipocampo; Pc:plexos coroideos; VL:ventrículo lateral. Recuadros de GD, CA3 y CA1 posible localización de las células de posicionamiento; recuadros de CE posible localización de las células de cuadrícula.
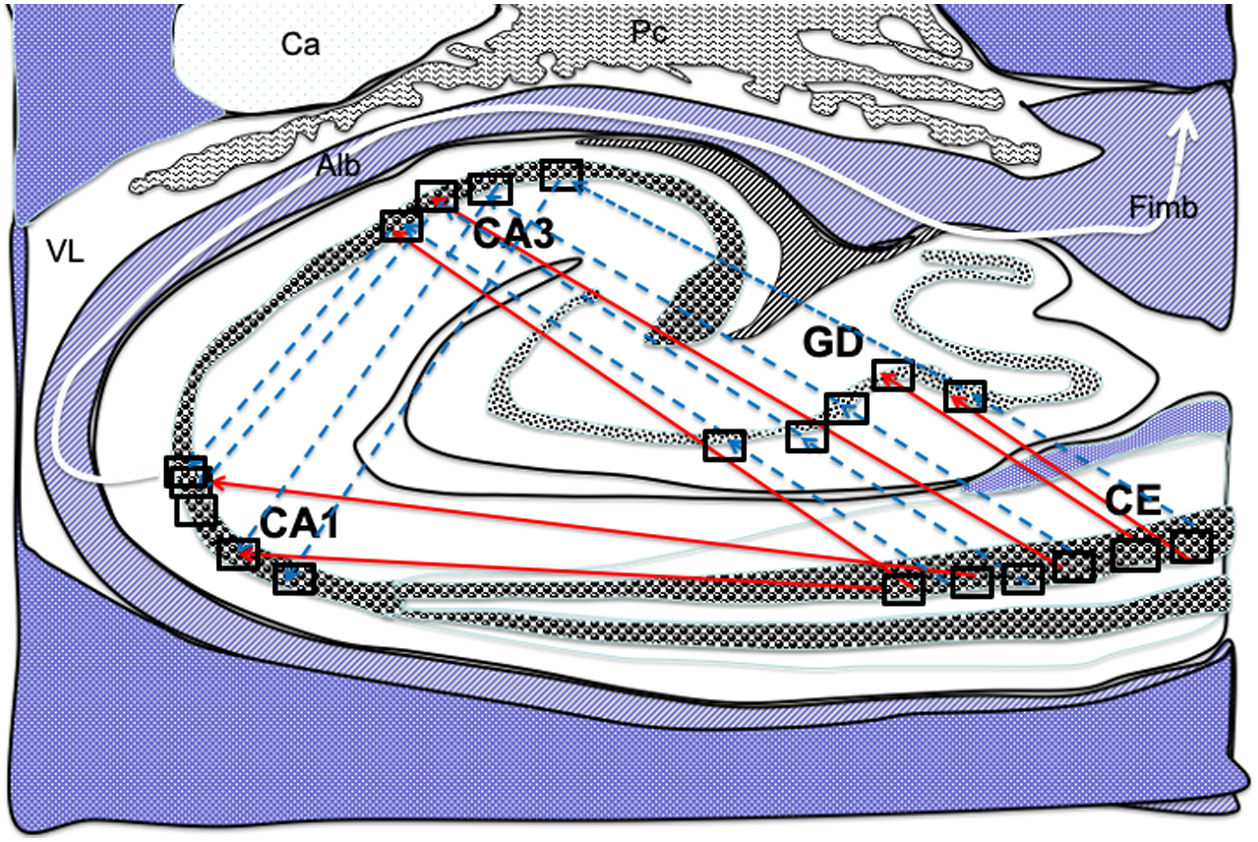
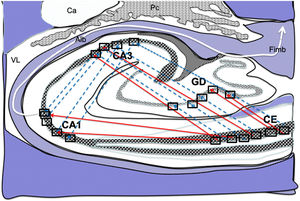
Dibujo esquemático de un corte transversal del hipocampo a nivel del cuerno temporal del ventrículo lateral derecho, donde la flechas señalarían ambas conexiones, directas (flechas rojas de línea continua) e indirectas (flechas azules de línea discontinua) desde las células de cuadrícula de la corteza entorrinal a las células de posicionamientos del GD, CA1 y CA326–34.
Alb:albeus; Ca:cola del caudado; CA1, CA3:zonas del asta de Amón del hipocampo; CE:corteza entorrinal; Fimb:fimbria; GD:giro dentado del hipocampo; Pc:plexos coroideos; VL:ventrículo lateral. Recuadros de GD, CA3 y CA1 posible localización de las células de posicionamiento; recuadros de CE posible localización de las células de cuadrícula.
Estos resultados descritos anteriormente38–42 concuerdan parciamente con los resultados en el presente trabajo donde hemos observado una disminución significativa del número y tamaño neural de las neuronas granulares del GD. También, mediante resonancia magnética de difusión42, se ha descrito una atrofia lineal en CA2, CA3 y GD proporcionalmente a la edad. Pero, otro estudio43 explica que esta disminución tenía lugar en el subículo y no en GD ni CA1.
Lo que está claro es que la mayoría de los autores han observado38,43,44 la asociación entre la edad avanzada y la disminución del tamaño o afectación de CA3 y GD. Por lo tanto, los cambios vistos pueden contribuir a los déficits mnemónicos observados con la edad al debilitar el procesamiento de información novedosa y reciente, y al fortalecer el procesamiento de la información previamente almacenada.
Como podemos comprobar, nuestros resultados en el GD podrían confirmar los hallazgos descritos por varios autores en las diferentes partes del hipocampo, por lo tanto, parece claro que el envejecimiento afecta el GD y el hipocampo en general produciendo una disminución de la superficie que ocupan las células de posicionamiento en las zonas estudiadas.
En la enfermedad de Alzheimer, que es un trastorno neurodegenerativo progresivo y afecta al 60-80% de todos los casos de demencia en la población anciana en todo el mundo, donde perderse es uno de los primeros síntomas cognitivos que surgen en los pacientes con dicha enfermedad. Se ha visto que el inicio temprano del deterioro amnésico ocurre primero en la CE y luego se extiende al hipocampo, lo que hace que la localización de las conexión entorrinal-hipocampal, o sea desde las células de cuadrícula a las células posicionamiento, sea la región más vulnerable ya que se ha descrito una clara pérdida neuronal tanto de las células de cuadrículas como de posicionamiento en modelos roedores de la enfermedad de Alzheimer45. Por otro lado, en décadas recientes se ha podido demostrar que la neurogénesis posnatal46,47 es un proceso que dura hasta la edad adulta que persiste en la vejez, en el anciano e incluso en pacientes con la enfermedad de Alzheimer48. Asimismo, se ha visto que el ejercicio físico voluntario aumentaba la neurogénesis en el GD en ratas adultas10,49. También y muy importante, se ha demostrado que dichas neuronas neoformadas migran a los lugares dañados, que son los nichos origen de vías nerviosas, cobrando gran importancia en procesos de aprendizaje y memoria50. En base tanto a nuestro resultado como a los del resto de los autores anteriormente citados, e independientemente del grado de neurogénesis que haya habido en nuestros casos, se podría decir que en edades avanzadas hay cuantitativamente una pérdida neuronal.
El lugar de localización de las células del hipocampo son un sistema modelo de cómo el cerebro construye representaciones cognitivas y de cómo estas representaciones apoyan el comportamiento complejo, el aprendizaje y la memoria16,49,50. En este sentido se ha visto en ratas que varias de estas unidades individuales de localización, las neuronas del hipocampo, estarían relacionadas principalmente con células de cuadrículas de la CE medial16,51. También, mediante resultados de experimentos en plataformas robóticas se ha propuesto un modelo entorrinal-hipocampal que puede construir mapas cognitivos con éxito; igualmente se han desarrollado más cognitivos inspirados en experimentos neurobiológicos49,50. Además, se ha descrito que estas células de cuadrícula de poblaciones de neuronas de la CE lateral representan el tiempo inherentemente a través de la codificación de la experiencia. Esta representación del tiempo episódico se puede integrar con las entradas espaciales de la CE medial en el hipocampo, lo que permite al hipocampo almacenar una representación unificada de qué, dónde y cuándo15.
Actualmente se está discutiendo, con más frecuencia, sobre el efecto del envejecimiento en la CE ya que hasta hace poco tiempo los estudios del envejecimiento se centraban más en el GD y las distintas regiones del asta de Amón. En nuestro trabajo tratamos de describir los efectos del envejecimiento no solo en el GD, sino que hemos querido hacer énfasis en la CE (lámina iii) que es origen de las eferencias la vía trisináptica y/o circuito de Papez. Así, se ha descrito44 una disminución, con la edad, de las conexiones entre la CE y el GD como consecuencia de la pérdida de la densidad de las espinas dendríticas en las neuronas granulares del GD (lugar de las aferencias de la vía perforante); y en otro estudio en humanos, mediante resonancia magnética, se ha descrito que el espesor de la CE varía a lo largo de la vida; va a ir aumentando hasta que alcanza su pico máximo aproximadamente a los 44 años para luego disminuir con el envejecimiento52.
Los resultados de estos trabajos sobre la disminución de las conexiones y la reducción del espesor de la CE estarían apoyados por los resultados de nuestro trabajo, que muestran la gran sensibilidad de las neuronas de la CE al envejecimiento, donde describimos alteraciones cualitativas que se ponen de manifiesto claramente a los 87 años de edad, y también alteraciones cuantitativas donde vemos una disminución del número de neuronas en las cuadrículas estudiadas, en las que hipertrofia neuronal compensatoria no consigue evitar la pérdida de densidad neuronal de las cuadrículas.
ConclusionesSe podría concluir que, en nuestros casos, se producen alteraciones cualitativas y cuantitativas tanto en la CE como en el GD que alcanzan su máxima expresión a la mayor edad estudiada, 87 años. Estas alteraciones se producen en las áreas rectangulares estudiadas descritas, que se podrían corresponder con las células de cuadrículas de la CE y las células de posicionamiento del GD. En general, podemos decir que los resultados obtenidos en nuestro limitado material concuerdan bastante con lo descrito en la bibliografía sobre los efectos negativos del envejecimiento sobre la CE y el GD.
FinanciaciónEste trabajo ha sido subvencionado por la Fundación Canaria Instituto de Investigación y Ciencias (INIPRO), proyecto: N.o 03/14
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.