Las enfermedades infecciosas y alérgicas son las principales causas de morbimortalidad en la primera infancia en Colombia. Entre las opciones estudiadas para su prevención y control, se encuentran los suplementos nutricionales a base de probióticos, elementos de traza, antioxidantes y ácidos grasos de cadena larga.
MétodosSe realizó una revisión de la literatura en las bases de datos PubMed y EMBASE, buscando estudios que relacionaran el uso de suplementos nutricionales y el desempeño del sistema inmunitario en niños. Se emplearon los términos: “Dietary supplements” AND “Immune System” AND (“infant” OR “child” OR “adolescent”).
ResultadosLa búsqueda inicial arrojó un total de 255 referencias, 54 de las cuales se utilizaron para extraer información. Hay un número importante de publicaciones sobre los beneficios de los ácidos grasos de cadena larga, micronutrientes y probióticos para el sistema inmunitario de los niños, y miden diversos desenlaces (muchos de ellos «intermedios») y con tamaños de muestra pequeños.
ConclusionesEl uso de suplementos nutricionales podría tener un beneficio para el paciente pediátrico desde el punto de vista inmunológico. Se requieren más estudios sobre el tema
Infectious and allergic diseases are major causes of morbidity and mortality in early childhood in Colombia. Among the options considered for prevention and control are nutritional supplements based on probiotics, trace elements, antioxidants, and long chain fatty acids.
MethodsA literature review was conducted in the PubMed and EMBASE databases, looking for studies that had analysed the use of nutritional supplements and the performance of the immune system in children. The terms used were: “Dietary supplements” AND “Immune System” AND (“infant” OR “child” OR “adolescent”).
ResultsThe initial search yielded a total of 255 references, 54 of which were used to extract information. A significant number of publications on the benefits of long-chain fatty acids, micronutrients and probiotics on the immune system in children, measured different outcomes (many of them “intermediate”), and had small sample sizes.
ConclusionsThe use of nutritional supplements could have a benefit, from the immunological point of view, in the paediatric patient. Further studies on the subject are required
Las entidades infecciosas y los trastornos nutricionales son algunas de las principales causas de morbimortalidad infantil en Colombia1. Entre estos condiciones se destacan la infección respiratoria aguda, que es la principal causa de consulta a los servicios de urgencias, y la enfermedad diarreica aguda, que es la cuarta causa de muerte de menores de 1 año y la tercera de niños de 1–4 años1. Los procesos alérgicos son otro motivo de consulta frecuente. En este grupo se encuentran la rinitis alérgica, la dermatitis atópica y el asma, a la que se considera la enfermedad crónica más frecuente en la niñez, con una prevalencia mundial de entre el 2 y el 20%1.
El sistema inmunitario es el punto en que confluyen las enfermedades transmisibles y los procesos alérgicos, de ahí la importancia de plantear estrategias para fortalecerlo en este grupo de edad. Una de las estrategias propuestas es el empleo de suplementos nutricionales2, entre ellos probióticos, vitaminas, cinc y hierro, productos que han mostrado impacto en la regulación de procesos alérgicos e infecciosos, principalmente en pacientes con algún grado de desnutrición2–5. El propósito de este trabajo es revisar la literatura al respecto.
Material y métodosSe hizo una búsqueda bibliográfica de artículos que relacionaran el uso de suplementos nutricionales con el sistema inmunitario en el paciente pediátrico. Para ello, se emplearon las bases de datos PubMed y EMBASE. Los términos de búsqueda de PubMed fueron MeSH:“Dietary supplements” AND “Immune System” AND (“infant” OR “child” OR “adolescent”). En EMBASE, las búsquedas se hicieron con los términos: ‘immune system’/exp AND ‘diet supplementation’/exp AND ‘infant’/exp.
Se seleccionaron estudios clínicos, revisiones sistemáticas de la literatura, metanálisis, estudios de cohortes, estudios de casos y controles y estudios transversales. No hubo restricción por fechas ni por idioma. Tras descartar los estudios considerados irrelevantes a partir del título y el resumen, se obtuvo la versión de texto completo de los artículos seleccionados y se recogió la información sobre la población específica estudiada, el país del estudio, la intervención/exposición, el desenlace medido, la forma en que se midió el desenlace y el resultado principal de cada estudio.
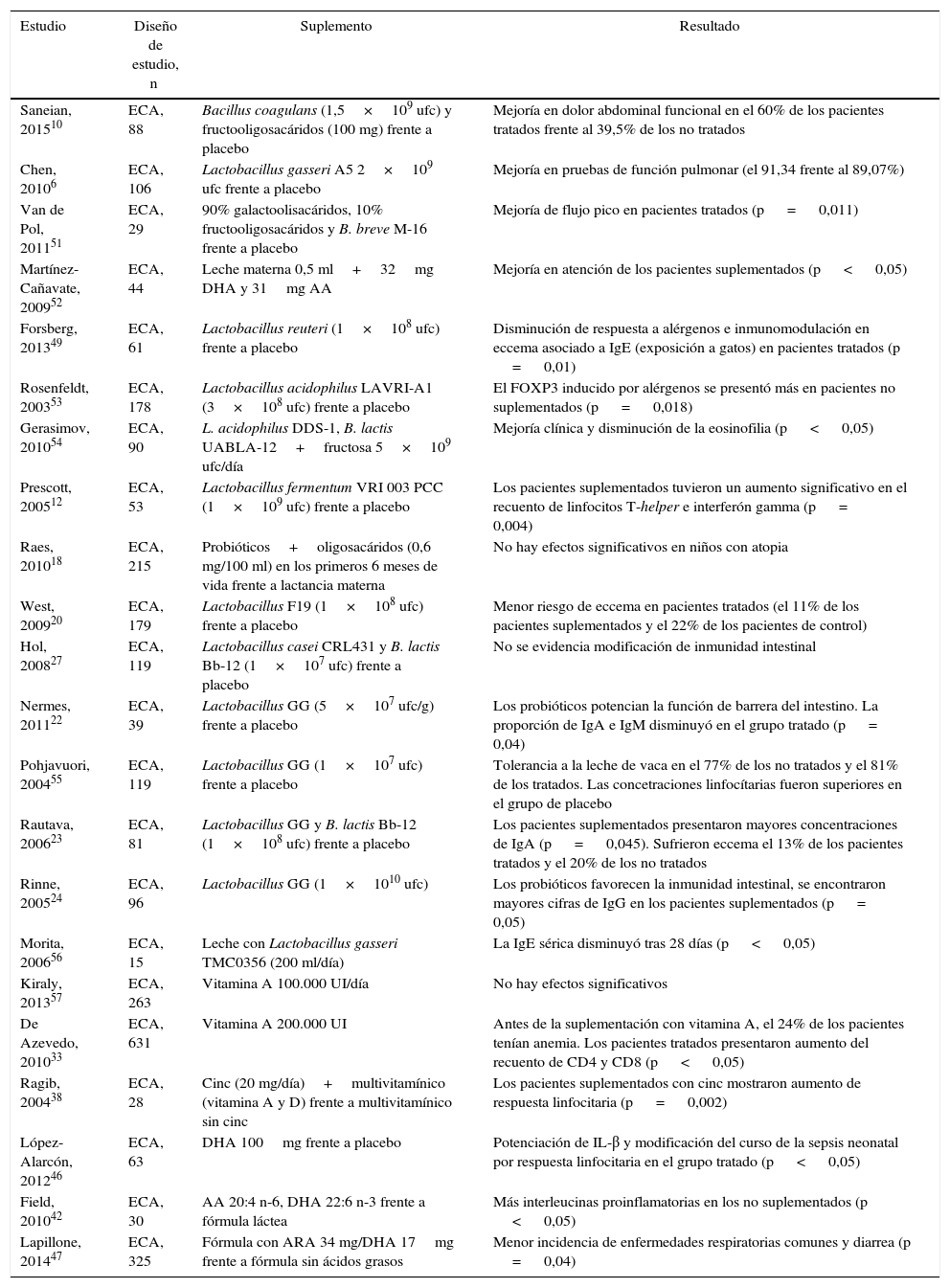
ResultadosDe los 255 artículos inicialmente identificados y los 242 evaluados en texto completo, se extrajo información de 51 publicados entre 1998 y 2015 y provenientes de 28 países (2 de Norteamérica, 2 de África, 2 de Oceanía, 3 de Latinoamérica, 4 de Asia y 15 de Europa). La mayoría de los estudios (n = 39) eran ensayos clínicos acerca del beneficio de suplementos nutricionales con probióticos y ácidos grasos de cadena larga, mientras que otros (n = 14) abordaban la utilidad de micronutrientes como el cinc y las vitaminas. Aunque la población estudiada incluía las edades de 0 a 18 años, el énfasis de las investigaciones es en niños en etapa escolar. La tabla resume los hallazgos de algunos estudios clínicos aleatorizados.
Evidencia clínica del uso de micronutrientes o suplementos como inmunomoduladores en población pediátrica
| Estudio | Diseño de estudio, n | Suplemento | Resultado |
|---|---|---|---|
| Saneian, 201510 | ECA, 88 | Bacillus coagulans (1,5×109 ufc) y fructooligosacáridos (100 mg) frente a placebo | Mejoría en dolor abdominal funcional en el 60% de los pacientes tratados frente al 39,5% de los no tratados |
| Chen, 20106 | ECA, 106 | Lactobacillus gasseri A5 2×109 ufc frente a placebo | Mejoría en pruebas de función pulmonar (el 91,34 frente al 89,07%) |
| Van de Pol, 201151 | ECA, 29 | 90% galactoolisacáridos, 10% fructooligosacáridos y B. breve M-16 frente a placebo | Mejoría de flujo pico en pacientes tratados (p = 0,011) |
| Martínez-Cañavate, 200952 | ECA, 44 | Leche materna 0,5 ml+32mg DHA y 31mg AA | Mejoría en atención de los pacientes suplementados (p < 0,05) |
| Forsberg, 201349 | ECA, 61 | Lactobacillus reuteri (1×108 ufc) frente a placebo | Disminución de respuesta a alérgenos e inmunomodulación en eccema asociado a IgE (exposición a gatos) en pacientes tratados (p = 0,01) |
| Rosenfeldt, 200353 | ECA, 178 | Lactobacillus acidophilus LAVRI-A1 (3×108 ufc) frente a placebo | El FOXP3 inducido por alérgenos se presentó más en pacientes no suplementados (p = 0,018) |
| Gerasimov, 201054 | ECA, 90 | L. acidophilus DDS-1, B. lactis UABLA-12+fructosa 5×109 ufc/día | Mejoría clínica y disminución de la eosinofilia (p < 0,05) |
| Prescott, 200512 | ECA, 53 | Lactobacillus fermentum VRI 003 PCC (1×109 ufc) frente a placebo | Los pacientes suplementados tuvieron un aumento significativo en el recuento de linfocitos T-helper e interferón gamma (p = 0,004) |
| Raes, 201018 | ECA, 215 | Probióticos+oligosacáridos (0,6 mg/100 ml) en los primeros 6 meses de vida frente a lactancia materna | No hay efectos significativos en niños con atopia |
| West, 200920 | ECA, 179 | Lactobacillus F19 (1×108 ufc) frente a placebo | Menor riesgo de eccema en pacientes tratados (el 11% de los pacientes suplementados y el 22% de los pacientes de control) |
| Hol, 200827 | ECA, 119 | Lactobacillus casei CRL431 y B. lactis Bb-12 (1×107 ufc) frente a placebo | No se evidencia modificación de inmunidad intestinal |
| Nermes, 201122 | ECA, 39 | Lactobacillus GG (5×107 ufc/g) frente a placebo | Los probióticos potencian la función de barrera del intestino. La proporción de IgA e IgM disminuyó en el grupo tratado (p = 0,04) |
| Pohjavuori, 200455 | ECA, 119 | Lactobacillus GG (1×107 ufc) frente a placebo | Tolerancia a la leche de vaca en el 77% de los no tratados y el 81% de los tratados. Las concetraciones linfocítarias fueron superiores en el grupo de placebo |
| Rautava, 200623 | ECA, 81 | Lactobacillus GG y B. lactis Bb-12 (1×108 ufc) frente a placebo | Los pacientes suplementados presentaron mayores concentraciones de IgA (p = 0,045). Sufrieron eccema el 13% de los pacientes tratados y el 20% de los no tratados |
| Rinne, 200524 | ECA, 96 | Lactobacillus GG (1×1010 ufc) | Los probióticos favorecen la inmunidad intestinal, se encontraron mayores cifras de IgG en los pacientes suplementados (p = 0,05) |
| Morita, 200656 | ECA, 15 | Leche con Lactobacillus gasseri TMC0356 (200 ml/día) | La IgE sérica disminuyó tras 28 días (p < 0,05) |
| Kiraly, 201357 | ECA, 263 | Vitamina A 100.000 UI/día | No hay efectos significativos |
| De Azevedo, 201033 | ECA, 631 | Vitamina A 200.000 UI | Antes de la suplementación con vitamina A, el 24% de los pacientes tenían anemia. Los pacientes tratados presentaron aumento del recuento de CD4 y CD8 (p < 0,05) |
| Ragib, 200438 | ECA, 28 | Cinc (20 mg/día)+multivitamínico (vitamina A y D) frente a multivitamínico sin cinc | Los pacientes suplementados con cinc mostraron aumento de respuesta linfocitaria (p = 0,002) |
| López-Alarcón, 201246 | ECA, 63 | DHA 100mg frente a placebo | Potenciación de IL-β y modificación del curso de la sepsis neonatal por respuesta linfocitaria en el grupo tratado (p < 0,05) |
| Field, 201042 | ECA, 30 | AA 20:4 n-6, DHA 22:6 n-3 frente a fórmula láctea | Más interleucinas proinflamatorias en los no suplementados (p < 0,05) |
| Lapillone, 201447 | ECA, 325 | Fórmula con ARA 34 mg/DHA 17mg frente a fórmula sin ácidos grasos | Menor incidencia de enfermedades respiratorias comunes y diarrea (p = 0,04) |
Los probióticos tienen el potencial de modular la respuesta inmunitaria al reducir las citocinas proinflamatorias, principalmente en aspectos relacionados con alergias respiratorias6–8; sin embargo, este comportamiento varía entre estudios in vitro y ex vivo, por lo cual se hizo énfasis en estudios del segundo grupo9.
El estudio experimental de Saneian10 evaluó a 88 niños con dolor abdominal funcional tratados con Bacillus coagulans y fructooligosacáridos, contra placebo, y encontró mejoría de los síntomas en el 60% de los pacientes tratados frente al 40% de los no tratados. Ouwehand11 señaló que la combinación de Lactobacillus acidophilus y Bifidobacterium lactis 5×109 ufc previno la infiltración de eosinófilos en la mucosa nasal de 47 niños con alergia al polen. El estudio de Prescott12 en 53 escolares con dermatitis atópica suplementados con L. fermentum (1×109 ufc) o placebo asoció los probióticos con aumento de la respuesta linfocitaria Th1 al interferón gamma. En contraposición, Shafiei13 y Prescott14 no lograron demostrar su impacto. Taylor15 evaluó la respuesta a alérgenos en 231 niños sanos tras el suministro de L. acidophilus (3×109 ufc) y lo asoció a una mejor respuesta a la vacunación con concentraciones significativamente inferiores de interleucina 10 (IL-10) y mejor respuesta al antígeno del toxoide tetánico del grupo tratado. West16 encontró en 179 lactantes sanos que el uso de Lactobacillus F19 (1×108 ufc) trae efectos en la maduración de las células T. En cuanto a la prevención de aparición de alergias, Taylor17 no encontró diferencias estadísticamente significativas suministrando L. acidophilus (1×109 ufc) o placebo a 178 niños durante los primeros 6 meses de vida, hallazgos similares a los reportados por Raes18. El estudio de Fujii19 encontró que los pacientes pretérmino que recibían B breve (1×109 ufc) tenían un aumento en la señalización del factor de necrosis tumoral TGF-β1. En contraposición, West20 evaluó los efectos de L. F19 (1×108 ufc) comparado con placebo en 179 niños sanos de 4-13 meses, con aparición de eczema en el 11% de los tratados comparado con el 22% de los niños del grupo control.
En cuanto al papel de los probióticos en la inmunología del tracto gastrointestinal, se cuenta con información acerca de la utilidad de Bacillus coagulans para controlar el dolor abdominal y la respuesta inmunitaria mediada por linfocitos T21. Nermes22, Rautava23 y Rinne24 han señalado que el uso de probióticos potencia la función de la mucosa intestinal como una barrera de defensa e incluso pudiera colaborar con la tolerancia a la leche de vaca22–24. El estudio de Wada25 con 42 pacientes sometidos a quimioterapia indica que el uso de B. Breve (1×109 ufc) puede ser efectivo en huéspedes inmunosuprimidos, debido al aumento de linfocitos del tracto gastrointestinal. Por contra, los estudios de Galpin26 y Hol27 reportaron que el uso de lactobacilos no tiene mayor impacto en la inmunidad intestinal. En la misma línea, Llanora28, en un estudio de cohortes de 253 niños en riesgo de alergia seguidos 5 años, indica que el suplemento de probióticos temprano en la niñez no tiene un impacto significativo en las enfermedades alérgicas.
En cuanto a los suplementos vitamínicos, está bastante claro que la respuesta depende de factores del paciente, como el sexo y la edad, así como del tipo de patógeno que se considere29,30. El estudio de Giacomet31, en 48 pacientes con diagnóstico de infección por el virus de la inmunodeficiencia humana (VIH)/sida (tanto niños como adultos jóvenes) suplementados con 100.000 UI de vitamina D o placebo, encontró que el uso de vitamina D puede alterar el fenotipo de LT CD4. Se encontró únicamente un estudio clínico aleatorizado32 que hace referencia al uso de la vitamina C como suplemento, sin información contundente sobre su efecto en la inmunomodulación. El estudio de Azevedo33, en una cohorte de 631 niños suplementados con 200.000 UI de vitamina A, estableció que podría favorecer el reclutamiento de células T y B. Por otro lado, Hypponen34 tuvo en cuenta la relación de la fisiopatología de la preeclampsia con la respuesta TH1, y concluyó que el consumo de vitamina D en la infancia puede afectar a la programación a largo plazo de la respuesta inmunitaria, aunque los autores admiten que sus resultados no son concluyentes. En contraposición, Weisse35 encontró que las altas concentraciones de vitamina D durante el embarazo y al momento del nacimiento se asociaban con mayor riesgo de alergias a alimentos.
Con respecto al uso de vitamina D en la dermatitis atópica, Di Filippo36 describió en un estudio con 39 pacientes reducción de marcadores inflamatorios (IL, factor de necrosis tumoral) tras el tratamiento con vitamina D 1.000 UI/día por 3 meses. En cuanto a la vitamina E, Kaempf37, en un estudio de 14 pacientes pretérmino, concluyó que las concentraciones de vitamina E en esta población son similares a los de pacientes a término después de las primeras 6 semanas de vida, por lo que no necesitan suplemento habitualmente.
Ragib38, en un ensayo clínico controlado aleatorizado de 28 pacientes, reportó que un curso de 14 días de cinc (20 mg/día) durante una shiguellosis aguda aumenta la respuesta de proliferación de linfocitos, favorece la respuesta inmunitaria y mejora la barrera intestinal; los resultados de Rahman39 fueron parecidos en un estudio con similar tamaño de muestra e igual dosificación. Sheikh40, en un estudio de cohortes de 148 lactantes suplementados con 10 mg/día o tratados con 20mg/día, documentó que el uso de cinc promovía la respuesta inmunitaria contra Escherichia coli enterotoxigénica al favorecer el complemento y la fagocitosis y generar cambios en el fenotipo de las células T.
Con respecto al uso de suplementos con ácido araquidónico (ARA)/ácido docosahexaenoico (DHA), algunos estudios concluyeron que los ácidos grasos de cadena larga (PUFA) influyen en la maduración rápida del sistema inmunitario, así como en su activación, y además tienen efectos antiinflamatorios41–44. Hay ensayos clínicos aleatorizados que abarcan esta conducta. El estudio de Vaisman44 exploró la producción de citocinas en sangre periférica en 21 niños de 8-12 años suplementados con aceite de canola 1 g/día o PUFA 300 mg/día+700mg de aceite de canola y encontró que las concentraciones de citocinas proinflamatorias de los pacientes no suplementados eran mayores. Mazurak45 determinó en un estudio de 37 pacientes que el suplemento de DHA 14-21mg/ARA 20-30mg altera los fenotipos de las células inmunológicas, tras hacer seguimiento de anticuerpos séricos y citometría de flujo celular en muestras de sangre. El estudio de López-Alarcón46 en 63 neonatos con diagnóstico de sepsis suplementados con DHA 100 mg/día o placebo encontró que el uso de DHA potencia la respuesta de IL-β1 y puede modificar el curso de sepsis neonatal. Lapillone47 estableció en una cohorte de 325 neonatos y lactantes que las fórmulas con DHA 17 mg/ARA 34mg se asocian con menor incidencia de enfermedades respiratorias comunes y diarrea.
Por último, en un ensayo clínico realizado en África con 321 pacientes48, se estableció que el suplemento de hierro aumenta la morbilidad por enfermedad respiratoria en pacientes ferropénicos; sin embargo, este efecto adverso se atenúa por completo al suministrarlo en combinación con DHA 420mg y ácido eicosapentaenóico (EPA) 80mg. Estos últimos reducen la morbilidad respiratoria y disminuyen el ausentismo escolar.
DiscusiónSe han estudiado múltiples componentes de los suplementos nutricionales que podrían favorecer el sistema inmunitario de los niños; entre ellos, cabe resaltar los probióticos y los PUFA, ya que se cuenta con mayor evidencia que respalde su uso. Según la literatura revisada, los beneficios más destacados de los probióticos, antioxidantes y micronutrientes se verían en lactantes mayores y escolares, y los de los PUFA, en neonatos, lactantes y escolares.
Los probióticos son los suplementos alimenticios que contienen microorganismos vivos que mejoran el equilibro microbiano en el intestino; los más empleados son los lactobacilos y las bifidobacterias. De los resultados obtenidos, se puede inferir que, en pacientes con alergias respiratorias tales como asma y rinitis, los probióticos tienen beneficios inmunomoduladores, demostrados con la mejoría en las pruebas de función pulmonar y del perfil inmunológico medido en sangre. Del mismo modo, se destacan los efectos positivos de estos suplementos en el tratamiento de las atopias cutáneas, reflejados en el seguimiento clínico favorable de los pacientes6,49.
Los probióticos se han estudiado en el tratamiento de múltiples trastornos gastrointestinales debido a sus efectos reguladores de la microbiota. La alteración de la microbiota intestinal se asocia con anormalidades en el sistema inmunitario, permeabilidad epitelial y en la relación entre el tracto gastrointestinal y el sistema nervioso, lo que lleva a dolor abdominal funcional. El estudio experimental de Saneian evaluó a 88 pacientes de 6-18 años con dolor abdominal funcional tratados con el simbiótico compuesto por Bacillus coagulans y fructooligosacáridos (prebiótico) o placebo; concluyó que mejora los síntomas de los pacientes tratados respecto a los no tratados10.
Hay controversia sobre la utilidad de los probióticos para los pacientes sanos, y solo algunos estudios respaldan su papel en la prevención de alergias, principalmente en lo concerniente a la inmunomodulación del tracto gastrointestinal, por lo cual sería de utilidad realizar nuevos estudios para determinar su impacto en esta población26.
En cuanto al suplemento con PUFA, algunos estudios indican una asociación positiva con reducción de las tasas de infecciones prevalentes en la infancia, como diarrea y enfermedades del tracto respiratorio48. Además se reportó su papel en la inmunomodulación y la maduración temprana del sistema inmunitario, e incluso una contribución en el tratamiento de la sepsis neonatal44,46.
Otro grupo importante de suplementos analizados es el de las vitaminas. Se encontró mayor respaldo para el uso de vitaminas D y A, principalmente en pacientes atópicos, con favorecimiento del reclutamiento de células T y B; además, el estudio de Ahmad indicó que la suplementación con vitamina A reduce la prevalencia de infecciones respiratorias graves, gastroenteritis y septicemia en neonatos50. Valdría la pena ampliar los estudios acerca del uso de la vitamina C que se encuentra en gran parte de los suplementos nutricionales del mercado.
Por último, se abarcó la utilidad de los micronutrientes. Se ha indicado mayores beneficios en infecciones de la suplementación con cinc, pues facilita la respuesta inmunitaria y la regeneración del epitelio intestinal. A pesar de estas ventajas evidentes, se desconoce su comportamiento en niños sanos, por lo cual es pertinente realizar mayores estudios al respecto37,39.
Cabe resaltar que la variabilidad en los resultados obtenidos tras el análisis de la información podría atribuirse a las diferentes dosis que se manejan en cada uno de los estudios, además de la diferencia en el tiempo de seguimiento, el tamaño de la muestra, las comorbilidades de los pacientes y la entidad en estudio.
ConclusionesLa evidencia indica un efecto benéfico del uso de suplementos nutricionales en la edad pediátrica con respecto a la inmunomodulación (reacciones alérgicas y respuesta a infecciones gastrointestinales y respiratorias). De ellos, los más estudiados son los probióticos y los PUFA, con beneficios reportados desde la etapa neonatal hasta la etapa escolar. Otros suplementos como la vitamina D y el cinc requieren estudios adicionales para determinar un suministro estándar. Valdría la pena ampliar la información acerca de la utilidad de los suplementos nutricionales con estos componentes en pacientes sanos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Este estudio fue financiado por Lafrancol S.A.S.