La hemorragia intraventricular (HIV) es un importante factor de riesgo de mal resultado del desarrollo neurológico en los neonatos prematuros extremos1,2. Se considera que la regulación anormal del flujo sanguíneo cerebral (FSC) predispone a la HIV3-6. Muchos estudios en animales y en personas han establecido que la presión arterial de dióxido de carbono (PaCO2) es uno de los principales reguladores del FSC7-12, y varios investigadores han demostrado que los valores sumamente bajos o altos de la PaCO2 pueden estar asociados con aumentos de la morbilidad neurológica13-18. Los mayores valores de PaCO2 pueden estar asociados con un aumento del riesgo de HIV en los neonatos de MBPN, posiblemente a causa del aumento del FSC secundario a la hipercapnia19. Los bajos valores de PaCO2 se asocian con el desarrollo de leucomalacia periventricular (LPV) en los neonatos prematuros sometidos a ventilación, quizá a causa de una disminución del FSC y la consiguiente isquemia12,16. Por lo tanto, es necesario determinar los límites superior e inferior de seguridad de la PaCO2 en los neonatos de MBPN, del mismo modo que fijar los objetivos de PaCO2 en las estrategias de ventilación mecánica.
La hipercapnia permisiva o “ventilación mínima”, en la que se toleran valores mayores de PaCO2, se utiliza a menudo en el tratamiento ventilatorio de los neonatos prematuros extremos para intentar disminuir la lesión pulmonar inducida por el respirador y reducir así la displasia broncopulmonar (DBP). Según la nueva definición fisiológica desarrollada por la NICHD Neonatal Research Network, la DBP afecta al 25% de los neonatos de 501-1.249 g de peso al nacimiento20. La nueva definición fisiológica, que utiliza una provocación pautada con aire ambiente en determinados recién nacidos, ha normalizado la definición de DBP y disminuido la variación entre los centros, aunque persiste una significativa variación de la DBP entre los centros20. Los ensayos clínicos de hipercapnia permisiva en los adultos han mostrado una disminución de la mortalidad y del número de días de ventilación21. Se han realizado tres ensayos aleatorizados de control de una estrategia de hipercapnia permisiva en neonatos de MBPN22-24. Uno de ellos23 informó de una disminución de la EPC o la muerte en el subgrupo de neonatos de 501 a 750 gramos. No obstante, un metaanálisis que combinó dos de los ensayos no pudo demostrar un beneficio global significativo de la estrategia de hipercapnia permisiva/ventilación mínima que perseguía la hipercapnia frente a la estrategia rutinaria de ventilación dirigida a la normocapnia, aunque tampoco mostró efectos adversos de la estrategia de ventilación mínima25. Sin embargo, dado el pequeño tamaño de la muestra y la evitación de una PaCO2 alta o baja en estos ensayos, no está claro si este metaanálisis realizó una evaluación con la suficiente potencia de si los extremos de la PaCO2 pueden desembocar en una mayor incidencia de HIV en los neonatos prematuros extremos.
Realizamos este estudio retrospectivo para comprobar la hipótesis de que los valores altos y bajos de la PaCO2, la media de PaCO2 en el tiempo (PaCO2 ponderada en el tiempo) y las mediciones de la fluctuación de la PaCO2 (desviación estándar de la PaCO2 y µ PaCO2 máxima-mínima) en los cuatro primeros días de vida se asocian con un aumento del riesgo de HIV grave.
MÉTODOSEstudiamos a todos los neonatos de 401 a 1.250 g de peso al nacimiento ingresados en la unidad de cuidados intensivos neonatales de nivel III de la University of Alabama at Birmingham entre el 1 de enero de 2000 y el 31 de diciembre de 2003. El comité de ética aprobó el protocolo. Se incluyeron los neo-natos que sobrevivieron al menos hasta las 96 horas de vida y se sometieron al menos a una ecografía craneal durante la estancia hospitalaria después de las 96 horas. La exploración ecográfica inicial se realizó, por lo general, entre los 5 y 7 días de vida, y las exploraciones realizadas antes de las 96 horas no se incluyeron en el análisis. Un técnico diplomado en radiología realizó las ecografías, tomando varias imágenes en los planos coronal, sagital y parasagital. Luego, un radiólogo pediátrico, que pudo tener acceso a los datos clínicos esenciales (peso al nacer, edad gestacional, edad posnatal y problemas clínicos mayores como el síndrome de distrés respiratorio), interpretó las imágenes. Las imágenes no volvieron a ser revisadas para este estudio.
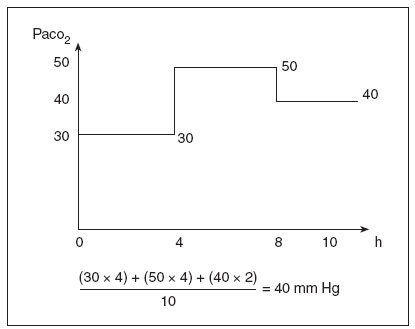
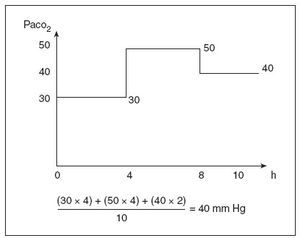
Los datos se tomaron de un archivo electrónico de datos de laboratorio del hospital y de la base de datos de la unidad de cuidados intensivos neonatales (UCIN). Todos los datos de la base de datos de la UCIN fueron recogidos por un especialista entrenado en bases de datos inmediatamente después del alta del recién nacido, y utilizando definiciones estándar. Los datos analizados incluyeron las principales variables perinatales y neonatales que habían demostrado con anterioridad su asociación con la HIV grave1,2, como el peso al nacimiento, la edad gestacional, la hipertensión inducida por el embarazo, la rotura prematura prolongada de las membranas, el empleo de corticoides prenatales, la puntuación de Apgar a los 5 minutos, el empleo de presión positiva continua nasal en las vías respiratorias y el empleo de ventilación mecánica intermitente. Además, se tomaron datos sobre la HIV grave26 (grados III y IV de la clasificación de Papile), la leucomalacia periventricular quística (LPV) y los datos gasométricos de los 4 primeros días de vida. La PaCO2 máxima y mínima se identificó a partir de las gasometrías obtenidas durante las primeras 96 horas de vida. Se calcularon las medidas de la dispersión de la PaCO2 de cada paciente, incluidos la desviación estándar (DE PaCO2) y el rango máximo-mínimo (µ PaCO2). También se calculó la PaCO2 ponderada en el tiempo (fig. 1). Como se puede observar en la figura, el período de tiempo entre dos gasometrías está representado por la PaCO2 de la segunda, en vez de por la media de la PaCO2 en las dos gasometrías, ya que solieron tomarse a intervalos de pocas horas y las condiciones del respirador se cambiaron poco después de la toma de una gasometría. Por lo tanto, como la PaCO2 suele cambiar con rapidez, la mayor parte del período entre dos gasometrías suele corresponder a la asociada con la siguiente gasometría y no a la media matemática de los dos valores de PaCO2.
Fig. 1. Cálculo de la PaCO2 ponderada en el tiempo. En este ejemplo, un neonato tiene tres valores de PaCO2 durante un período de 10 horas. La ecuación muestra cómo se calcula el valor de la PaCO2 ponderada en el tiempo.
Las relaciones entre la máxima mediana, la mínima, la media ponderada en el tiempo, la DE y la µ PaCO2 y la HIV grave se analizaron mediante el test de rank sum de Mann-Whit-ney y por el área bajo la curva (AUC) de la curva ROC. Las curvas ROC presentan la sensibilidad frente a 1-especificidad: cuanto más se aproxime a 1, mayor será el valor de predicción. También se utilizaron diagramas de puntos para mostrar la distribución y el solapamiento de la PaCO2 en los neonatos con y sin HIV grave para cada una de las variables de la PaCO2. Se realizaron análisis similares en el subgrupo de neo-natos que recibió IMV/CPAP (ya que en los neonatos no sometidos a soporte respiratorio no se pudo controlar la PaCO2). También se evaluaron las relaciones entre la máxima mediana, la mínima, la media de PaCO2 ponderada en el tiempo y la HIV leve (grados I y II) para determinar la existencia o no de una dependencia de la dosis en la relación entre la PaCO2 y el grado de HIV. Se realizó un análisis de regresión logística múltiple, en el que la variable dependiente fue la HIV grave, de las variables independientes, incluyendo las principales variables pre y posnatales y la PaCO2 máxima, la mínima y la media ponderada en el tiempo. Todos los análisis estadísticos fueron realizados con SigmaStat para Windows, versión 2.03 (Jandel Scientific, San Rafael, CC) y MedCalc versión 7.6 (MedCalc, Bélgica).
RESULTADOSLos 849 neonatos incluidos en el estudio tuvieron una media (± DE) de peso al nacimiento de 848 ± 212 g, y una edad gestacional de 26 ± 2 semanas (tabla 1). El 21% fue diagnosticado de HIV grave y el 5% de LPV. El 71% necesitó ventilación mecánica y el 79% recibió CPAP, ventilación mecánica, o ambas técnicas. Los neonatos que no necesitaron CPAP o ventilación mecánica mostraron menor incidencia de HIV grave que los que recibieron CPAP/ventilación mecánica (6,3% frente a 24,9%, p < 0,01).
TABLA 1. Demografía de los pacientes
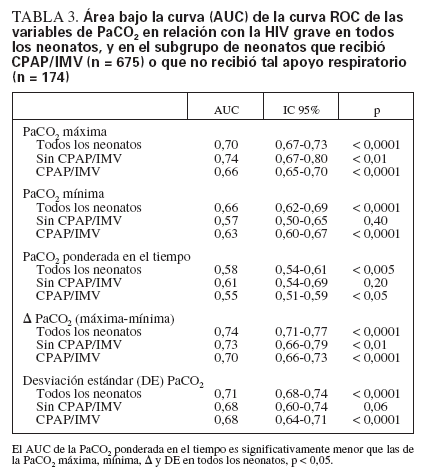
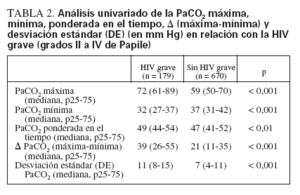
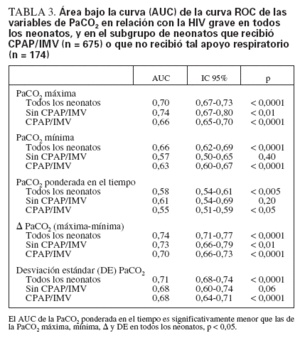
Los neonatos con HIV grave mostraron una PaCO2 máxima y una media de PaCO2 ponderada en el tiempo significativamente mayores, mientras que la PaCO2 mínima fue significativamente menor (tabla 2). El análisis del AUC de las curvas ROC (tabla 3) indicó que ambos extremos de la PaCO2 fueron buenos factores de predicción de la HIV grave. El AUC de las curvas ROC de la DE PaCO2 y la µ PaCO2 fue similar, indicando que la magnitud de la fluctuación de la PaCO2 también fue un buen factor de predicción de la HIV grave. Pese a ser estadísticamente significativa, la PaCO2 ponderada en el tiempo no predijo la HIV grave tan bien como las demás variables de la PaCO2. La PaCO2 máxima y la µ PaCO2 se asociaron significativamente con la HIV grave incluso en los neonatos que no recibieron IMV o CPAP, aunque el tamaño de la muestra de neonatos sin INV/CPAP fue limitado y su incidencia de HIV grave fue menor (n = 174, 11 con HIV grave) (tabla 3). Los neonatos que recibieron soporte respiratorio (IMV o CPAP) mostraron oscilaciones más amplias de su PaCO2 que quienes no recibieron soporte (PaCO2 máxima 65 mm Hg [54-77] en IMV/CPAP frente a 50 mm Hg [45-57] sin IMV/CPAP, PaCO2 mínima 34 mm Hg [29-40] frente a 41 mm Hg [35-45], PaCO2 media ponderada en el tiempo 48 mm Hg [40-49] frente a 45 [4353], µ PaCO2 30 mm Hg [18-44] frente a 8 mm Hg [017], y DE PaCO2 9 mm Hg [6-12] frente a 4 mm Hg [0-6]; todas las p < 0,001).
TABLA 2. Análisis univariado de la PaCO2 máxima, mínima, ponderada en el tiempo, (máxima-mínima) y desviación estándar (DE) (en mm Hg) en relación con la HIV grave (grados II a IV de Papile)
TABLA 3. Área bajo la curva (AUC) de la curva ROC de las variables de PaCO2 en relación con la HIV grave en todos los neonatos, y en el subgrupo de neonatos que recibió CPAP/IMV (n = 675) o que no recibió tal apoyo respiratorio (n = 174)
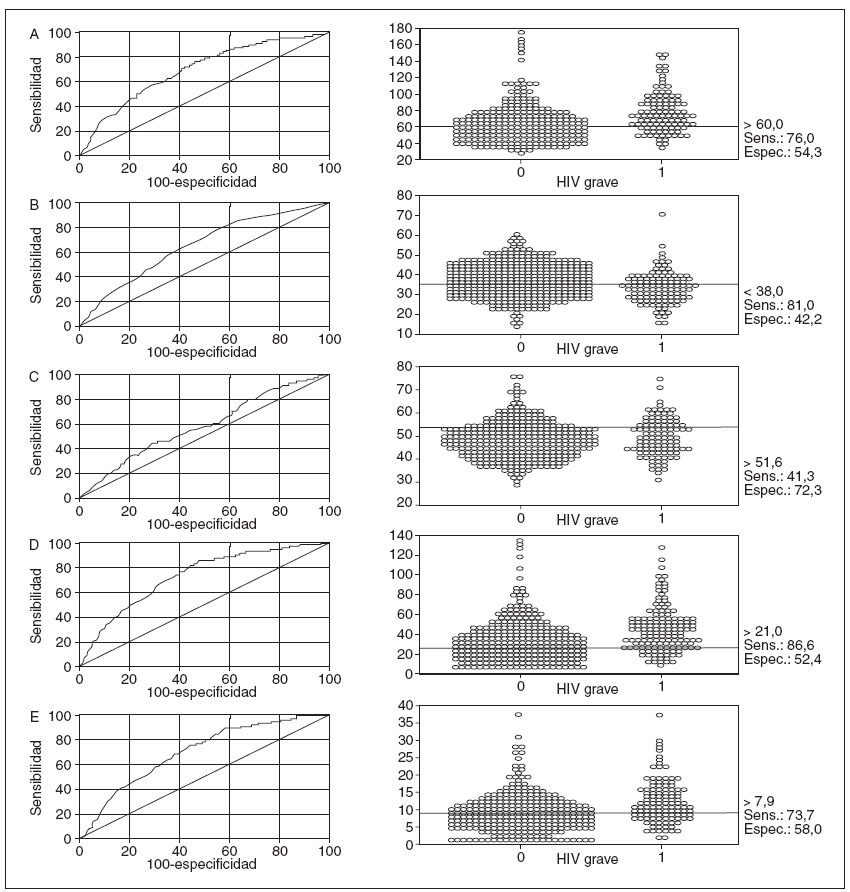
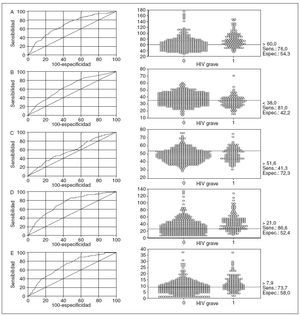
Al utilizar la curva ROC y un diagrama de puntos (figura 2) de la PaCO2 máxima, mínima, ponderada en el tiempo, µ PaCO2 y DE PaCO2, se identificó un umbral óptimo con el que se obtuvo la máxima sensibilidad y la mínima pérdida de especificidad (al aumentar la sensibilidad, la especificidad es menor). El paquete informático MedCalc determinó automáticamente este umbral óptimo, que se confirmó mediante el ajuste manual del umbral al alza y a la baja y la evaluación de la sensibilidad y la especificidad tras estos ajustes. La PaCO2 máxima > 60 mm Hg tuvo una sensibilidad del 76% y una especificidad del 54% para la HIV grave, y la PaCO2 mínima < 39 mm Hg una sensibilidad del 81% y una especificidad del 42%. Una PaCO2 media ponderada en el tiempo > 52 mm Hg tuvo una sensibilidad del 41% y una especificidad del 72% (figura 2). Los neonatos con una PaCO2 máxima > 60 mm Hg (n = 442, 52%) tuvieron una incidencia del HIV grave del 31%, mientras que los neonatos con una PaCO2 mínima < 39 mm Hg (n = 532, 63%) tuvieron una incidencia del 27%. Los neonatos con una PaCO2 máxima > 60 mm Hg y una PaCO2 mínima < 39 mm Hg (n = 282, 33%) mostraron una incidencia del 38%, mientras que los que tuvieron un rango “óptimo” de PaCO2 de 39-60 mm Hg (n = 156, 18%) tuvieron una incidencia de HIV grave de sólo el 3%.
Fig. 2. Curvas ROC (cuadros de la izquierda) y diagramas de puntos (cuadros de la derecha) de la PaCO2 máxima (A), mínima (B), ponderada en el tiempo (C), rango máxima-mínima (D) y desviación estándar (E) en relación con el resultado de la HIV grave (grados III y IV de Papile). Cada diagrama de puntos incluye el umbral óptimo con la sensibilidad y la especificidad para la HIV grave.
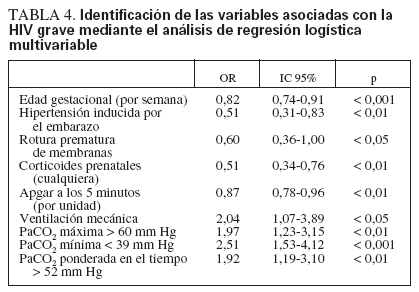
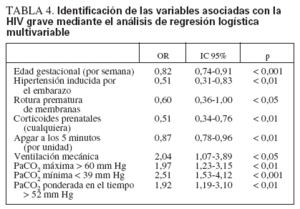
En el análisis de regresión logística múltiple, la PaCO2 máxima, la PaCO2 mínima y la PaCO2 media ponderada en el tiempo (como variables continuas o como variables dicotómicas utilizando los umbrales antes expresados) se asociaron de forma independiente con la HIV grave, además de las variables clínicas de menor edad gestacional, ausencia de hipertensión inducida por el embarazo, ausencia de rotura prematura de las membranas, falta de exposición a corticoides prenatales, menor puntuación de Apgar a los 5 minu
tos y necesidad de ventilación mecánica (tabla 4). Se realizaron otros análisis de regresión logística múltiple con DE PaCO2 y PaCO2 como variables independientes, pero el ajuste global del modelo fue similar, y como la capacidad de predicción estaba dividida entre más variables, la DE PaCO2 y la PaCO2 disminuyeron la significación estadística de la PaCO2 máxima, mínima y media ponderada en el tiempo (datos no ofrecidos).
TABLA 4. Identificación de las variables asociadas con la HIV grave mediante el análisis de regresión logística multivariable
También se analizó la HIV de cualquier grado (I, II, III o IV) en relación con las variables de la PaCO2. Los neonatos con HIV de cualquier grado mostraron una PaCO2 máxima ([cualquier grado frente a sin HIV] 66 frente a 58 mm Hg, p < 0,001) y PaCO2 media ponderada en el tiempo (48 frente a 47 mm Hg, p < 0,05) significativamente mayores que los neonatos sin HIV, mientras que la PaCO2 mínima fue significativamente menor (34 frente a 37 mm Hg, p < 0,001). Sin embargo, estas diferencias fueron debidas principalmente a la HIV grave, ya que no hubo diferencias significativas de PaCO2 entre los neonatos con HIV leve (grados I o II) y los libres de HIV ([HIV leve frente a sin HIV] PaCO2 máxima: 59 frente a 58 mm Hg, p = 0,16; AUC [0,54 (IC 0,50-0,58)]; PaCO2 mínima: 36 frente a 37 mm Hg, p = 0,08; AUC [0,55 (IC 0,51-0,59)]; PaCO2 media ponderada en el tiempo: 47 frente a 47 mm Hg, p = 0,71; AUC [0,50 (IC 0,46-0,54)]). Los lactantes con LPV mostraron valores de PaCO2 significativamente menores (33 frente a 36 mm Hg, p < 0,05), pero la PaCO2 máxima y media ponderada en el tiempo no fueron distintas (66 frente a 61 y 48 frente a 48, respectivamente).
DISCUSIÓNNuestro estudio indica que los valores extremos de la PaCO2, altos o bajos, y la mayor variación de la PaCO2 en un neonato determinado, indicada por la mayor DE o µ PaCO2, se asocian con una HIV grave en los neonatos de muy bajo peso al nacimiento y que esta asociación persiste incluso tras el ajuste respecto a las mayores variables perinatales. Aunque no se pudo inferir la causalidad, sería prudente evitar los extremos de PaCO2 durante el período de riesgo de HIV.
Este estudio retrospectivo tiene limitaciones debidas a los sesgos de confusión con los factores asociados con la disponibilidad de los datos y la imprecisión de las estimaciones debida a la ausencia de un protocolo clínico estándar y a los procedimientos de recogida de datos. Los neonatos más enfermos pueden tener determinaciones más frecuentes de la gasometría, por lo que la probabilidad de obtener valores extremos es mayor. El clínico no pudo controlar la PaCO2 en el 21% de estos neonatos, que no recibió ventilación mecánica o CPAP. Sin embargo, el valor máximo y la DE PaCO2 se asociaron con HIV grave incluso en los neonatos que no recibieron IMV/CPAP, aunque la incidencia de HIV grave en esta población fue menor. La gasometría arterial se tomó, por lo general, de catéteres arteriales permanentes, pero algunos neonatos, especialmente los que no necesitaron ventilación mecánica, o no tuvieron una vía arterial o se les había retirado al cabo de un día o dos del nacimiento. Por todo ello, algunas gasometrías correspondían a sangre capilar arterializada o a una punción arterial directa. La incidencia de HIV grave en este estudio, del 21%, posiblemente sea superior a la esperada, por la práctica del centro de una enérgica reanimación y la muy escasa mortalidad inmediata (2% de los MBPN nacidos vivos en las primeras 24 horas de vida), que condujo a un aumento de la supervivencia inmediata y quizá también a un aumento del número de neonatos en riesgo de HIV.
Nuestro estudio tiene muchos puntos fuertes. El tamaño de la muestra para este estudio y el número de gasometrías analizadas es mayor que el de muchos estudios similares. Además, fueron incluidos los datos de todas las gasometrías de los cuatro primeros días, sin limitar el análisis a determinados momentos. Nuestro estudio no se basó únicamente en las mediciones de la PaCO2 máxima, sino que incluyó las estimaciones tanto de la PaCO2 baja y la PaCO2 ponderada en el tiempo, e identificó umbrales óptimos tanto de la PaCO2 alta como de la baja.
La PaCO2 ponderada en el tiempo no predijo tan bien la HIV grave como el valor extremo de la PaCO2. La PaCO2 ponderada en el tiempo no cambiaría mucho si el mismo neonato tuviera períodos alternantes (fluctuaciones) de PaCO2 alta y baja. La asociación de una mayor DE o µ PaCO2 con HIV grave indica que puede suceder así. Como la PaCO2 media no aumentó en exceso, es probable que los neonatos con HIV no fueran más difíciles de ventilar y, por ello, no tuvieran unos pulmones mucho más enfermos (sugestivos de un mayor grado de inmadurez) que los libres de HIV. Los valores extremos y las fluctuaciones de la PaCO2 se asociaron con HIV grave (grados III y IV), pero no con grados más leves de HIV (grados I y II). Por lo tanto, es posible que los valores anormales de PaCO2 estén implicados en la extensión de una hemorragia previa en vez de en el inicio o el desarrollo de una hemorragia intraventricular. También es posible que la HIV grave pueda desembocar en fluctuaciones del esfuerzo respiratorio espontáneo, lo que provoca fluctuaciones y valores más extremos de la PaCO2. Al contrario que la HIV, la LPV sólo se asoció con un menor valor mínimo de la PaCO2 y no con la PaCO2 elevada, la media ponderada en el tiempo o las fluctuaciones, lo que confirma observaciones anterio-12,13,16,17. Esta diferencia puede deberse a discrepancias de la fisiopatología de la HIV y la LPV.
Nuestro estudio indica que la meticulosa y frecuente, o continua, monitorización de la PaCO2 puede ser importante, y que se debe evitar los valores extremos, o muy fluctuantes, de la PaCO2 en los neonatos de MBPN. En el marco habitual de la unidad de cuidados intensivos neonatales, la oxigenación se monitoriza fácilmente por la oximetría del pulso, pero la PaCO2 sólo se controla de vez en cuando mediante la gasometría. Los métodos alternativos para indicar las tendencias de la PaCO2 como las mediciones transcutáneas o final espiratoria de CO2 no se utilizan habitualmente. Aunque la hipercapnia moderada parece ser segura22-25, los valores más extremos de la hipercapnia durante los períodos de riesgo de HIV no han demostrado su seguridad.
El principal hallazgo de este estudio es que ambos extremos de la PaCO2 se asocian con un aumento del riesgo de HIV grave en los neonatos de MBPN. La sensibilidad y especificidad de los valores extremos de la PaCO2 respecto a la HIV grave no son suficientemente elevadas para su empleo en el marco clínico, pero estos umbrales pueden ser útiles para caracterizar la patogénesis de la HIV grave. Es necesario realizar más estudios para determinar los mecanismos por los que los valores bajos y fluctuantes de la PaCO2 pueden desembocar en una HIV grave. Los posibles mecanismos pueden incluir la isquemia durante el período de hipocapnia, seguida de la hemorragia o la extensión de una hemorragia existente durante el período de repercusión. También es necesario confirmar si las marcadas fluctuaciones de la PaCO2 y, secundariamente, del flujo sanguíneo cerebral, se asocian con una HIV grave. Será necesario realizar ensayos clínicos para demostrar que la evitación de la hipocapnia y de las fluctuaciones extremas de la PaCO2 provoca disminuciones de la HIV grave.
Presentado parcialmente en la Pediatric Academic Societies’ Meeting, Washington, DC, mayo de 2005.
La dirección actual del Dr. Fabres es: Departmento de Pediatría, Pontificia Universidad Católica de Chile, Lira 85, Piso 5, Santiago, Chile 8330074.
Correspondencia: Namasivayam Ambalavanan, MD, 525 New Hillman Building, 619 19th St South, University of Alabama, Birmingham, Alabama 35249. Estados Unidos.
Correo electrónico: ambal@uab.edu