La parálisis cerebral (PC) afecta a 2 de cada 1.000 niños de edad escolar en Estados Unidos1,2, supone una carga económica anual estimada en 5 millardos de dólares sobre la sociedad y es el más gravoso de los defectos de nacimiento importantes en Estados Unidos3. El diagnóstico de PC abarca un grupo heterogéneo de trastornos que se caracterizan por una alteración no progresiva de la función motora a consecuencia de lesiones en el cerebro en desarrollo4. La PC se asocia a menudo con trastornos de la función intelectual, déficits sensoriales, trastornos conductuales y convulsiones. En la mayoría de los casos no se encuentra una etiología específica y el diagnóstico no implica un pronóstico determinado5. Aunque se desconocen los mecanismos que conducen a la PC, diversas pruebas implican a la infección intrauterina o a la inflamación del sistema nervioso central6. La combinación del retraso en el diagnóstico y la diversidad de la fisiopatología limita nuestra capacidad para identificar a los lactantes con riesgo de desarrollar PC y, por lo tanto, para mejorar las estrategias de tratamiento7.
Después de una lesión neurológica, los factores genéticos pueden determinar la gravedad de las lesiones, la capacidad de recuperación y la evolución8. Tras el informe inicial en el que se identificó a la apoliproteína E (apoE) como un factor de susceptibilidad para el desarrollo de la enfermedad de Alzheimer9 (EA), se sabe actualmente que el genotipo APOE es un importante factor determinante de la evolución neurológica en las lesiones cerebrales agudas y crónicas del adulto10. La apoE es una proteína para el transporte de lípidos que se expresa ampliamente en el sistema nervioso central. La proteína tiene tres isoformas, E2, E3 y E4, codificadas por los alelos ε2, ε3 y ε4 en el brazo largo del cromosoma 19. Los individuos con una o más copias del alelo ε4 tienen más riesgo de desarrollar EA familiar de comienzo tardío, así como EA esporádica no familiar11. El estado de portador del alelo ε4 es el gen más validado en otros trastornos neurológicos relacionados con la susceptibilidad genética al ictus isquémico12, con el riesgo de alteración neurológica por lesiones cerebrales traumáticas13 y el envejecimiento14. Sin embargo, se desconoce el papel de la apoE en la patogenia de la PC.
Nosotros hemos llevado a cabo un estudio transversal de los pacientes pediátricos para determinar si los geno-tipos APOE se asocian con la PC. Se investigó la hipótesis de que el genotipo APOE, en particular el estado de portador del alelo ε4, tiene más probabilidades de asociarse con la PC, y que los niños con PC y alteraciones neurológicas más graves presentan una mayor tendencia a ser portadores de dicho alelo. Hasta donde alcanzan nuestros conocimientos, el estudio actual es el primero que se ha realizado sobre estas asociaciones en una población norteamericana.
MÉTODOSSelección de los pacientesSe consideró como candidatos para su inclusión en el estudio a los pacientes consecutivos diagnosticados de PC por el médico que los remitió y controlados en la Orthopedic Clinic of the Department of Physical Therapy at Children’s Memorial Hospital. La PC se definió por una historia de espasticidad motora crónica, con lesiones no progresivas consecutivas a una noxa sufrida por el cerebro fetal o neonatal4. El diagnóstico se confirmó por consulta con el médico, entrevista con los padres y revisión de la historia clínica. Se excluyeron las formas puramente coreoatetósicas y atáxicas de PC, sin espasticidad, debido a la rareza de estos subtipos y para mantener un fenotipo rigurosamente definido. Se excluyó también a los pacientes con trastornos motores estáticos adquiridos posneonatalmente (> 28 días de vida). Los pacientes de control se reclutaron en las clínicas de seguimiento, la mayoría en controles de puericultura y visitas para vacunación. Se excluyó a los controles visitados por cualquier problema neurológico (infección del sistema nervioso central, retraso del desarrollo, trastorno convulsivo, trastorno por déficit de atención con hiperactividad, cefalea migrañosa) o por procesos médicos predefinidos (diabetes juvenil, retraso del crecimiento). Se reclutó a los sujetos entre noviembre de 2003 y julio de 2005. El estudio fue aprobado por la Institutional Review Board local, y todos los sujetos o progenitores otorgaron por escrito su asentimiento o consentimiento.
Cuatro niños con PC y 5 controles elegibles, o sus progenitores, rehusaron participar. De los 239 pacientes remitidos con un diagnóstico de PC, 30 (13%) se consideraron posteriormente no elegibles. Cuatro habían adquirido la PC posnatalmente (p. ej., caídas por las escaleras, accidentes de automóvil) y 26 presentaban déficit motores por síndromes genéticos con rasgos espásticos: síndrome de DiGeorge con deleción 22q, síndrome de Os-ler-Weber-Rendu (n = 6); anomalías óseas y de la deambulación no clasificables como PC, como pie cavo varo, pie equino (n = 8); otras anomalías cerebrales, como quiste de Dandy-Walker o tumor (n = 10), e infección congénita por citomegalovirus (n = 2). Cincuenta y tres controles se visitaron por procesos diferentes de las visitas de puericultura, como infecciones agudas (n = 28), asma o alergias (n = 15), traumatismos (n = 5), dolor inespecífico (n = 4) y obesidad (n = 1).
Datos demográficosSe registraron los datos de sexo, raza, fecha de nacimiento, peso al nacer y edad gestacional. La variable “raza” se obtuvo por entrevista con los padres, preguntándoles: “¿con qué grupo racial se identifica más estrechamente su hijo?”. Las razas incluidas fueron: blanca, negra, hispana, india norteamericana, asiática, de las Indias orientales, otras (razas “mixtas”) y desconocida (p. ej., padre desconocido o progenitor adoptivo desconocedor de la raza del padre biológico).
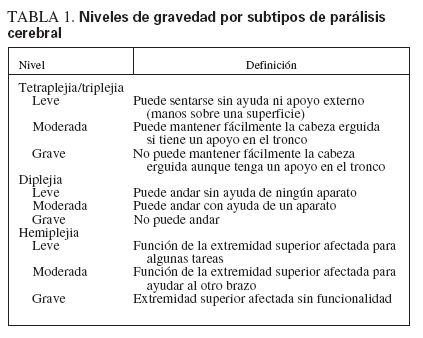
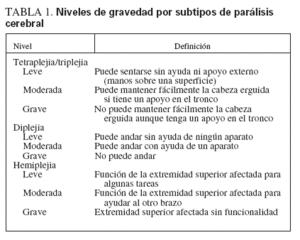
TABLA 1. Niveles de gravedad por subtipos de parálisis cerebral
Asignación de gravedad de la PCLos médicos de plantilla y los fisioterapeutas indicaron el subtipo de PC (tetraplejia/triplejia, diplejia, hemiplejia). Las puntuaciones de gravedad se asignaron por separado, según el subtipo de PC. Para valorar dicha gravedad, los fisioterapeutas desarrollaron un formulario donde se describen los niveles de gravedad de los tres principales subtipos espásticos de PC (tabla 1). Antes de iniciar el estudio se eligió aleatoriamente a 19 pacientes con PC (7 con tetraplejia/triplejia, 8 con diplejia, 4 con hemiplejia). En cada caso, los dos fisioterapeutas que más se ocupaban del paciente puntuaron por separado el subtipo y la gravedad de la PC. Hubo concordancia entre ambos, excepto en 1 paciente. En este caso, la gravedad se puntuó como ligera, pero fue cuestionada por uno de los terapeutas. Así pues, no pudo calcularse el valor kappa, pero hubo concordancia en el 95% de los formularios.
Uno de los investigadores (MMK) midió el perímetro cefálico (PCE), un marcador eficaz del crecimiento cerebral, del desarrollo y de la inteligencia15. El investigador y los terapeutas desconocían los resultados de la puntuación de gravedad y de las mediciones del PCE, respectivamente. Los resultados del PCE se incluyeron en las gráficas de Nellhaus para uno u otro sexo16, que cubren todas las edades pediátricas (hasta los 18 años). Así pues, las mediciones del PCE normalizadas para el sexo y la edad se emplearon para el análisis de los datos.
Para determinar la naturaleza y la frecuencia de los procesos comórbidos en la cohorte de PC, se revisaron las historias clínicas de estos pacientes y se resumieron los datos clínicos según las alteraciones relacionadas con el sistema nervioso central (epilepsia, cognición, visión, lenguaje, audición) o sin afectación del SNC.
Determinación del genotipo de la apolipoproteína EEl ADN se obtuvo por frotis bucal (Swube swab, Becton Dickinson Franklin Lakes, NJ) y se extrajo con reactivos comerciales (Puregene DNA Purification Kit, Minneapolis, MN). El ADN genómico se amplificó mediante la reacción en cadena de la polimerasa (PCR) con estimuladores conocidos (ACAGAATTCGCCCCGGCCTGGTAC 3’ y 5’-TAAGCTTGG-CACGGCTGTCCAAGGA 3’) y se siguió el protocolo de amplificación para el genotipado de APOE17. A continuación, cada autorradiografía fue analizada por dos observadores que desconocían los detalles. En caso de discrepancia entre ambos, se repetía el genotipado. Los investigadores desconocían los resultados del genotipaje hasta haber obtenido todos los datos demográficos, clínicos y aportados por los padres e introducirlos en una hoja de cálculo informático protegida.
ANÁLISIS ESTADÍSTICOLos controles se emparejaron con los casos por sexo y raza. Con fines descriptivos, las variables continuas se expresan en valores de media ± DE; las variables discontinuas, numéricamente y en porcentaje. Las principales etnias estudiadas fueron: blanca, negra e hispana. Dado que el número de sujetos de las categorías restantes era demasiado escaso, se consideraron como un grupo combinado.
Las diferencias entre los casos y los controles en las variables continuas (peso al nacer y edad gestacional) se analizaron con pruebas de la t por parejas, debido al diseño aparejado del estudio. Las diferencias entre los casos y los controles con respecto a la situación de portador de los alelos ε4 y ε2 se investigaron mediante la prueba χ2 de McNemar (χ2McNemar), con la corrección de continuidad de Yates18. En el análisis deductivo para la situación de portador del alelo ε4 no se incluyó a los sujetos portadores del alelo ε2, ya que este último podría ejercer algunos efectos neuroprotectores que compensarían los efectos del alelo ε419,20. Específicamente, se excluía a una pareja de caso-control si uno u otro era portador del alelo ε2. De modo similar, los sujetos portadores del alelo ε4 se excluyeron del análisis deductivo del alelo ε2. Para los riesgos (cocientes de probabilidades) de los datos emparejados (ORMcNemar) y los intervalos de confianza (IC) del 95%, se siguieron los métodos detallados en Fleiss18.
En los niños con PC, las asociaciones del alelo ε4 con la gravedad de la alteración motora se investigaron con la prueba de 2 para la tendencia (χ2tendencia), con la corrección de Yates. La prueba se realizó si había un número suficiente de casos del subtipo de PC en los 3 niveles de gravedad. En los niños con PC se consideró como microcefalia una medición del PCE dos desviaciones estándar por debajo de la media para el sexo y la edad16. La asociación del alelo ε4 con el PCE (dicotomizado como microcefálico o normocefálico) se investigó mediante las pruebas de χ2 o exacta de Fisher, según estuviera indicado.
La muestra de niños con PC se basó en su asistencia a la Division of Rehabilitative Services, con el objetivo inicial de alcanzar un número aproximado de 225-250 niños con PC y de otros tantos controles emparejados. Ello permitió excluir a los sujetos antes detallados y lograr una muestra mínima de 200 casos y controles. En el análisis de potencia estadística se utilizó una probabilidad estricta de error de tipo I (p = 0,001) para permitir comparaciones adicionales por gravedad de la PC y por las mediciones del PCE, y una probabilidad del 25% de portar el alelo ε4 en los controles21 (en la gama media de las distribuciones poblacionales publicadas para este alelo). El estudio tenía una potencia estadística del 90% para detectar un riesgo doble de PC al ser portador del alelo ε4.
Los análisis estadísticos se realizaron mediante el programa Statistical Package for the Social Sciences (SPSS for Windows, versión 11.0.1, 2001, Chicago, IL). Las diferencias se consideraron estadísticamente significativas si p < 0,05.
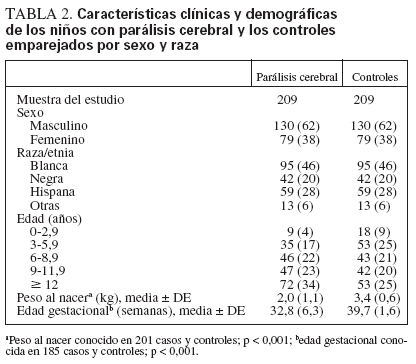
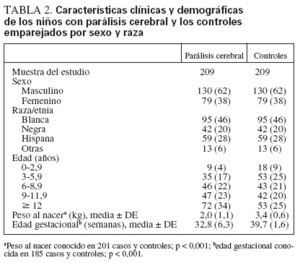
RESULTADOSLa muestra final se componía de 209 niños con PC y 209 controles emparejados (tabla 2). Como se observa en la mayoría de estudios sobre la PC, los sujetos eran en su mayor parte (62%) varones. La distribución racial entre los casos (raza blanca 46%, negra 20%, hispana 28% y otras razas 6%) fue similar a la hallada en la población general de Chicago para la raza hispana (26%) y otras razas (7%). Sin embargo, hubo más sujetos de las razas blanca y negra en la muestra del estudio que en la población general del área de Chicago22 (31% y 36%, respectivamente). La mayoría (96%) de los niños diagnosticados
TABLA 2. Características clínicas y demográficas de los niños con parálisis cerebral y los controles emparejados por sexo y raza
TABLA 3. Comorbilidades en los niños con parálisis cerebral
Un porcentaje significativo (49%) de los niños con PC presentaba también otro proceso o se estudió por sospecha del mismo (tabla 3). Las afecciones neurológicas más comunes fueron las convulsiones (27%) y los problemas visuales (23%). En el grupo con PC, sólo el 10% era portador de una sonda de gastrostomía.
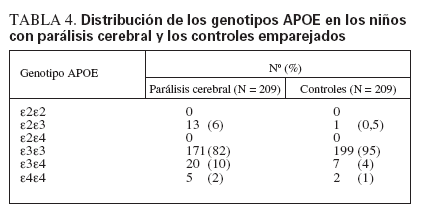
Veinte niños con PC (12%) presentaban al menos un alelo ε4, en comparación con 9 niños (4%) en el grupo de control (tabla 4). La mayoría de los casos (82%) y controles (95%) portaba el genotipo ε3ε3. Había variaciones entre los cuatro grupos raciales. El estado de portador del genotipo ε3ε3 era menor en los casos de raza blanca que en los controles (79% frente a 98%, respectivamente), y en los casos de raza negra que en los controles (74% frente a 91%, respectivamente). El estado de portador del genotipo ε3ε3 era similar en los niños de raza hispana (90% frente a 93%) y en los de otras razas (92% frente a 100%). Ninguno de los sujetos de este estudio (casos o controles) presentaba los genotipos APOE ε2ε2 o ε4ε4.
TABLA 4. Distribución de los genotipos APOE en los niños con parálisis cerebral y los controles emparejados
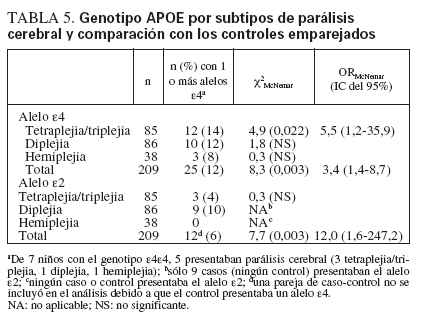
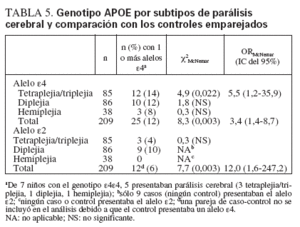
TABLA 5. Genotipo APOE por subtipos de parálisis cerebral y comparación con los controles emparejados
En conjunto, el estado de portador de un alelo ε4 se asociaba con un riesgo superior al triple (tabla 5) de presentar PC, en comparación con los controles emparejados (OR = 3,4, IC del 95% 1,4-8,7). Este riesgo era mayor en los niños con tetraplejia/triplejia (OR = 5,5, IC del 95% 1,2-35,9), pero no en los que presentaban diplejia o hemiplejia. En todo el grupo de estudio (n = 418), 7 presentaban el raro genotipo ε4ε4 (5 casos, 2 controles). En comparación con el grupo de control, la distribución del genotipo APOE en la cohorte PC no presentaba el equilibrio de Hardy-Weinberg23. Para determinar si el peso al nacer contribuía al mayor riesgo en los portadores del alelo ε4, se efectuó un subanálisis restringido a los niños con PC y peso normal al nacer (n = 69, 33% de todos los casos) y sus controles emparejados (también con peso normal al nacer). El riesgo de PC era mayor en los casos nacidos con un peso normal y portadores del alelo ε4 (ORMcNemar = 3,3, IC del 95% 0,9-15,2), ligeramente por debajo de la significación estadística (χ2McNemar p = 0,09).
El estado de portador de un alelo ε2 se asoció con un riesgo 12 veces mayor para la PC (IC del 95% 1,6-247,2). Trece niños con PC (6%) presentaban al menos un alelo ε2, en comparación con un solo niño (0,5%) en el grupo de control (tabla 5). Nueve de los 13 casos con un alelo ε2 presentaban diplejia, pero no había controles con un alelo ε2 para cuantificar el riesgo para este subtipo de PC (tabla 5). Entre los niños nacidos con un peso normal, 5 casos y 1 control eran portadores del alelo ε2 McNemar = 5,0, IC del 95% 0,6-113,1).
Entre los niños con tetraplejia/triplejia, el estado de portador del alelo ε4 aumentó el riesgo de presentar una alteración motora más grave. En la muestra de casos que recibieron fisioterapia en nuestra institución (n = 141), la distribución del alelo ε4 sólo pudo examinarse entre los pacientes con tetraplejia/triplejia (n = 58). En este subtipo de PC, 8 niños eran portadores del alelo ε4, y la frecuencia de dicho alelo aumentó con la gravedad de la alteración motora (χ2tendencia p = 0,007). De 64 niños con diplejia, 7 eran portadores del alelo ε4, y en todos ellos la diplejia era leve. De modo similar, entre 19 niños con hemiplejia, sólo 2 portaban el alelo ε4 (1 con hemiplejia leve y 1 moderada).
El PCE se midió como elemento auxiliar para valorar la inteligencia y el desarrollo neurológico. Ningún control era microcefálico. En cambio, 40 de los 188 niños con PC (21%) de quienes se disponía de datos del PCE eran microcefálicos. En este grupo, 8 (20%) eran portadores del alelo ε4. Entre los 148 niños normocefálicos con PC, 16 (11%) portaban este alelo. El estado de portador de un alelo ε4 y la microcefalia asociada no presentaban significación estadística, pero sugería una posible asociación (prueba exacta de Fisher, valor de p = 0,10).
Un porcentaje mayor de niños con PC presentaba te-traplejia/triplejia (41%) o diplejia (41%), en comparación con la hemiplejia (18%) (tabla 5). Sin embargo, la proporción de niños portadores del alelo ε4 no difería entre los que presentaban tetraplejia/triplejia (12, 14%), diplejia (10, 12%) o hemiplejia (3, 8%). Ello sugiere que, a pesar de que sólo se halló significación estadística en los niños con tetraplejia/triplejia, el riesgo derivado del estado de portador del alelo ε4 podría aplicarse también a los otros subtipos espásticos. La proporción de niños portadores del alelo ε4 fue más elevada sólo en los que presentaban diplejia, lo cual sugiere que el alelo ε4 podría conferir un mayor riesgo para la diplejia que para los otros subtipos.
Hubo una asociación significativa entre el subtipo de PC y la presencia de procesos comórbidos. Entre los niños con PC, la frecuencia global de trastornos convulsivos fue del 27%. Una mayor proporción de niños con tetraplejia/triplejia (41%) presentaba un trastorno convulsivo, en comparación con los niños que sufrían hemiplejia (34%) o diplejia (9%) (χ2 p < 0,001). Entre los niños con PC, 56 presentaban un trastorno convulsivo, de los que sólo 5 (9%) portaban el alelo ε4 (prueba exacta de Fisher, p = 0,29). De modo similar, entre 35 niños con tetraplejia/triplejia y un trastorno convulsivo, sólo 3 (9%) portaban el alelo ε4 (prueba exacta de Fisher, p = 0,18). Los déficit cognitivos eran también más frecuentes en los niños con tetraplejia/triplejia (14%), en comparación con los que presentaban diplejia (12%) o hemiplejia (5%). Los defectos visuales eran más frecuentes en los niños con tetraplejia/triplejia o hemiplejia (cada uno 26%) que en los niños con diplejia (17%). El estado de portador de los alelos ε4 o ε2 no se asoció con la presencia de convulsiones o defectos cognitivos o visuales.
DISCUSIÓNEl estado de portador de los alelos ε4 o ε2 en el geno-tipo APOE aumenta significativamente el riesgo de PC, en comparación con los controles emparejados por sexo y raza. Hubo más niños con PC, particularmente del subtipo tetraplejia/triplejia, que eran portadores del alelo ε4. En los niños con tetraplejia/triplejia, la gravedad de la afectación motora se asoció significativamente con el estado de portador del alelo ε4. De modo similar, entre todos los niños con PC hubo una tendencia hacia un mayor riesgo de microcefalia en los portadores del alelo ε4. Este hallazgo implica que el estado de portador de dicho alelo puede predecir el desarrollo cognitivo15 en los niños con PC, pero esta cuestión requiere estudios ulteriores. El estado de portador del alelo ε2 también aumenta al parecer el riesgo de PC, pero puede afectar sólo al subtipo de diplejia. Además, la asociación debe interpretarse con cautela, dada la rareza del alelo ε2, que se observa tan sólo en el 0,4% de la población21. En conjunto, estos datos implican a los genotipos APOE ε4 y ε2 como factores de susceptibilidad para modular la evolución neurológica después de una noxa cerebral perinatal. Debe señalarse que sólo el 18% de la cohorte PC portaba los alelos ε2 o ε4. Queda por identificar otros factores de susceptibilidad genética en la población más numerosa de niños con PC.
Hasta donde alcanzan nuestros conocimientos, además de nuestro estudio, el único que se ha publicado hasta la fecha sobre los genotipos APOE y la PC fue uno de casos-controles realizado en Brasil, donde se emparejaron los sujetos sólo por sexos y se observó un riesgo de PC 4 veces superior en los individuos con el alelo ε4. No se registró la edad de los sujetos y es posible que se incluyera a pocos niños. El tamaño limitado de la muestra (40 casos y 40 controles) impidió realizar análisis por subtipos y gravedad de la PC24. Sin embargo, nuestros hallazgos amplían los de dicho estudio anterior, y la tasa de portadores del alelo ε4 observada por nosotros es comparable a la descrita en los estudios pediátricos, donde oscila entre 4%25 y 17%26.
La prevalencia de convulsiones y trastornos visuales en este estudio de casos-controles es muy semejante a la mediana de los porcentajes de estas alteraciones en los estudios poblaciones sobre la PC27,28 (25% y 21%, respectivamente). En comparación con los datos poblacionales28, el porcentaje de niños con trastornos del lenguaje y auditivos fue más bajo en nuestra cohorte. Esta diferencia puede reflejar la mayor comodidad que supone para las familias el buscar tratamiento para estos trastornos en un centro próximo. La prevalencia del retraso mental en nuestro estudio es más baja que en los estudios poblacionales publicados29 (límites 31-75%).
Podría considerarse que la asociación de tetraplejia/ triplejia con el genotipo APOE, así como con las convulsiones y los problemas cognitivos y visuales, implica una asociación similar entre el estado de portador de los alelos ε4 o ε2 y dichos procesos comórbidos en los niños con PC. La falta de cualquier asociación estadística-mente significativa entre el estado de portador de los alelos ε4 o ε2 y estos procesos comórbidos en el presente estudio no descarta que el genotipo APOE ejerza algún efecto. El tamaño de la muestra de este estudio no tuvo una potencia estadística suficiente para comprobar esta hipótesis, lo que justifica una investigación a mayor escala.
La patogenia de la PC es multifactorial en el lactante a término1,2,5, pero diversos datos implican a las vías in-flamatorias6,30-32. La apoE se produce en el cerebro33, donde protege frente a las lesiones por múltiples meca-nismos10,25. Esta función es isoforma-específica; a este respecto, la isoforma E4 es menos eficaz que E2 o E3 para atenuar la respuesta inflamatoria a las lesiones ce-rebrales34,35. El mayor riesgo de PC en los portadores del alelo ε4 coincide con un modelo en el que las noxas preoperinatales dan lugar a una respuesta inflamatoria del sistema nervioso central que puede atenuar inicialmente la lesión, pero que no queda regulada eficazmente por la proteína E4.
El genotipo APOE puede estar ligado también a mecanismos vasculares de lesión cerebral que conducen a la PC. Los meta-análisis12 y los estudios neurorradiológicos36 sugieren una mayor susceptibilidad al ictus isquémico en los portadores del alelo ε4. El estado de portador del alelo ε4 puede influir también en la evolución después de un ictus hemorrágico37. Puede ser necesario confirmar estas asociaciones en estudios a mayor escala38.
Otros mecanismos pueden contribuir al aumento del daño neurológico en los portadores del alelo ε4. En un estudio poblacional de casos-controles se halló un mayor riesgo de PC después de la exposición perinatal a virus neurotrópicos, como los de la varicela o del herpervirus humano 6 o 739. Como hecho de interés, los ratones transgénicos portadores del alelo ε4 humano presentan una mayor invasión del sistema nervioso central por el virus 1 del herpes simple, en comparación con los transgénicos ε340. Queda por determinar las consecuencias de estos hallazgos para el tratamiento de la PC, pero son compatibles con un papel de apoE en la regulación de la barrera hematoencefálica41, lo que podría permitir el acceso de los virus neurotrópicos al cerebro en desarrollo.
La contribución del genotipo APOE a la susceptibilidad al daño neurológico puede variar con la edad42 y la naturaleza de la noxa26,43. El alelo ε4 puede modular la progresión de la lesión hacia la cronicidad y, por lo tanto, puede ejercer un efecto más pronunciado sobre la evolución en los pacientes pediátricos42. De hecho, el estado de portador del alelo ε4 se asocia con una mejor evolución en los niños con malnutrición44 o lesiones cerebrales traumáticas45, pero no en la hemorragia intraventricular46. Por lo tanto, es posible que las diferencias en el mecanismo de la noxa inicial sean responsables de la variación en el papel del genotipo APOE, en particular teniendo en cuenta nuestro hallazgo de un mayor riesgo de PC en relación con el alelo ε426,43.
El bajo peso al nacer es un conocido factor de riesgo para la PC, pero no hay pruebas de que el polimorfismo APOE se asocie por sí solo con el bajo peso al nacer. En nuestro estudio, el peso al nacer fue significativamente más bajo en los niños con PC que en los controles, pero los niños con PC que habían nacido con un peso normal también portaban con más frecuencia el alelo ε4. Así pues, es improbable que el peso al nacer sea un factor de confusión en cuanto a la asociación entre el genotipo APOE y la PC. Además, si el alelo ε4 se asocia con un mayor daño neurológico, el fallecimiento más precoz de los lactantes gravemente afectados reforzaría los hallazgos de nuestro estudio, ya que estos niños no se habrían incluido en nuestra población.
El mayor riesgo de PC en los portadores del raro alelo ε2 implica la existencia de mecanismos adicionales en la patogenia de la PC. Por ejemplo, otros autores han informado sobre un mayor riesgo de lesiones neurológicas en adultos con este genotipo, como la demencia en la enfermedad de Parkinson43 y las hemorragias lobares intracerebrales recurrentes47. Sin embargo, se desconocen los mecanismos subyacentes a estas asociaciones de la PC y es probable que difieran de los propuestos para el alelo ε4.
El estudio actual presenta diversas limitaciones. En primer lugar, no es un estudio poblacional y, por lo tanto, no se ha tratado de investigar a todos los niños con PC en el área de Chicago o Midwest. En segundo lugar, los casos se incorporaron a partir de niños con PC remitidos para estudio ortopédico o fisioterapia. Estas cuestiones se afrontaron mediante la confirmación del diagnóstico de PC y con un diseño de casos-controles emparejados. De hecho, la baja tasa de rechazos a la participación sugiere que no hubo una incorporación selectiva de los sujetos, lo que disminuye una posible fuente de sesgo. Finalmente, la gravedad de la PC no se valoró con una escala previamente descrita. Sin embargo, no existe ningún sistema estandarizado que se acepte universalmente para clasificar la gravedad de la discapacidad motora en la PC, y el popular Gross Motor Function Classification System no puntúa adecuadamente la gravedad de la hemiplejia48. La escala que empleamos nosotros es familiar para los fisioterapeutas de nuestra institución y hubo una concordancia excelente entre ellos al valorar los resultados.
CONCLUSIONESEn conclusión, el riesgo y la gravedad de la PC son mayores al parecer en los niños portadores de los alelos ε4 o ε2. Estos datos implican a la apoE y, por lo tanto, a los procesos neuroinflamatorios en la patogenia de la PC. Es necesario realizar nuevos estudios epidemiológicos en otras poblaciones para confirmar estas asociaciones y valorar el papel de apoE en vías patogénicas específicas para el desarrollo de la PC después de una noxa cerebral perinatal.
AGRADECIMIENTOSEstamos en deuda con los niños y sus familias, los médicos, los fisioterapeutas y los analistas de la deambulación en el Department of Physical Therapy, Division of Rehabilitative Services at Children’s Memorial Hospital. Las enfermeras y los médicos del Children’s Memorial Hospital contribuyeron a la incorporación de los controles para el estudio.
El presente estudio fue subvencionado por el Children’s Memorial Research Center Seed Grant Program and United Cerebral Palsy Research and Educational Foundation (R-755-03).
Correspondencia: Mark S. Wainwright, MD, PhD, Division of Neurology, No. 51, Children’s Memorial Hospital, 2300 Children’s Plaza, Chicago, IL 60614, Estados Unidos.
Correo electrónico: m-wainwright@northwestern.edu