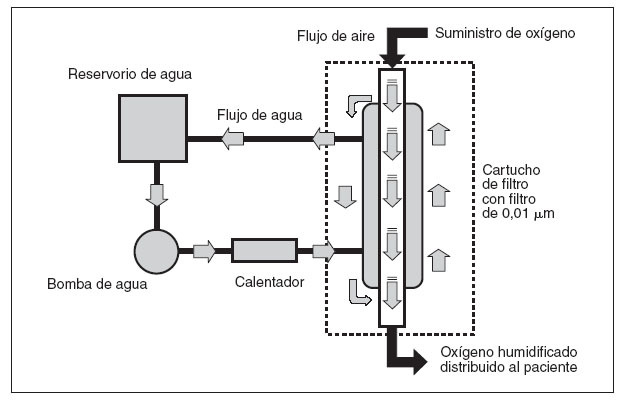
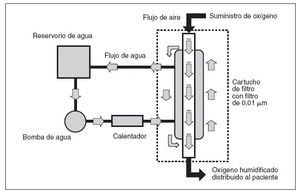
Las especies de Ralstonia son bacilos gramnegativos presentes en general en entornos húmedos, como el agua y el suelo, o en los vegetales. Previamente, se han implicado en brotes asociados a la asistencia sanitaria, sobre todo debido a la contaminación de soluciones usadas en el tratamiento de los pacientes1-3. Estos bacilos son patógenos humanos oportunistas, en particular entre pacientes con inmunocompromiso4-6, y son una causa poco frecuente de infección. Desde enero hasta abril de 2005, se recuperaron especies de Ralstonia de los cultivos respiratorios obtenidos a partir de 5 pacientes en el hospital A, un hospital pediátrico de Filadelfia, PA. En los 2 años previos no se habían recuperado especies de este bacilo entre pacientes de este hospital. Antes del cultivo, 4 de 5 pacientes habían sido tratados con Vapotherm 2000i (Vapotherm, Inc., Stevensville, MD), un dispositivo que distribuye oxígeno calentado, humidificado a través de una cánula nasal. Este aparato portátil de distribución de oxígeno incluye un cartucho de filtro reutilizable de 0,01 µm para separar su compartimiento aéreo del acuoso y los neonatólogos lo utilizaban ampliamente, empleándose en 2005 unas 5.000 unidades en más de 900 hospitales de Estados Unidos. En la figura 1 se muestra un diagrama del dispositivo.
Fig. 1. Diagrama del dispositivo de distribución de oxígeno Vapotherm 2000i. El agua del reservorio se bombea a través de un calentador y, acto seguido, se usa para calentar y humidificar el oxígeno a medida que fluye a través del compartimiento aéreo del cartucho de transferencia de vapor (filtro). El compartimiento aéreo e hídrico están separados por un filtro de membrana de fibra hueca de 0,01 μm.
Originalmente la Food and Drug Administration (FDA) aprobó el dispositivo en agosto de 2000 con la presentación de una notificación previa a la comercialización [exención 510(k)]. Este proceso [510(k)] permite comercializar los nuevos dispositivos médicos partiendo de su comparabilidad con los comercializados legalmente cuyo uso aprobado es el mismo. Esto difiere del proceso de autorización previa a la comercialización (PMA) de la FDA para ciertos dispositivos nuevos o de alto riesgo, que requieren la demostración de un grado razonable de seguridad y eficacia antes de su autorización7. En el 2000, casi el 99% de los nuevos dispositivos médicos aprobados para su comercialización se revisaron a través del proceso de exención8 510(k).
En agosto de 2005, el hospital A de Pensilvania y los departamentos de salud de Filadelfia invitaron a los Centers for Disease Control and Prevention (CDC) a colaborar en la investigación.
PACIENTES Y MÉTODOSInvestigación en el hospital ACondujimos un estudio de casos-controles emparejados en el hospital A para determinar los factores de riesgo de colonización o infección por especies de Ralstonia, asociada a la asistencia sanitaria. Los casos se definieron como cualquier paciente con un cultivo de Ralstonia µ 1 recuperado de una muestra clínica entre el 1 de diciembre de 2004 y el 31 de agosto de 2005. Se excluyeron los pacientes en los que se consideró que el microorganismo estaba presente antes de la hospitalización.
Se seleccionaron 4 controles por cada caso. Los casos y los controles se emparejaron individualmente por la duración de la estancia hospitalaria. Para garantizar que no se seleccionaron como controles los pacientes con colonización no reconocida por Ralstonia, limitamos la selección de los controles a los pacientes en los que se disponía de documentación de un cultivo respiratorio en el que no creció Ralstonia. A partir de las historias clínicas se extrajo información sobre los potenciales factores de riesgo de infección respiratoria.
La evaluación de la asociación entre el estado de los casos y las variables categóricas de la exposición se determinó utilizando el estadístico de Cochran Mantel-Haenszel (CMH), definiéndose los estratos por el grupo de emparejamiento. Para cada exposición se derivó una odds ratio ajustada a través de la estimación del logit9; a cada celda se le añadió 0,5 debido al pequeño tamaño de la muestra específica de estrato10, y en el cálculo no se incluyeron las tablas con una fila o columna que sumara 0. Los análisis estadísticos se efectuaron con el programa SAS versión 9.1 (Statistical Analysis System, Cary, NC).
Partiendo de las observaciones de las estrategias de control de las infecciones en el hospital A, se obtuvieron muestras medio-ambientales de fuentes potenciales de las especies de Ralstonia y se remitieron a los CDC. Incluyeron: agua potable del hospital, hielo de los congeladores, agua estéril, condensado de dos ventiladores mecánicos, soluciones respiratorias estériles, conductos de filtro de Vapotherm usados y no usados y extensiones de la superficie de 4 dispositivos Vapotherm.
Investigación nacionalPuesto que el dispositivo se utiliza en hospitales de todo el país, condujimos un hallazgo de casos nacionales a través de las redes de comunicación de tratamiento respiratorio, enfermedades infecciosas, control de las infecciones y salud pública para identificar a pacientes adicionales con colonización o infección por especies de Ralstonia. Se solicitó a las instituciones que presentaran información de los pacientes y aislamientos clínicos y medioambientales para la identificación y las pruebas moleculares. Los casos probables fueron aquellos en los que se documentó Ralstonia entre el 1 de enero de 2005 y el 1 de marzo de 2006, pero no se dispuso de ningún aislamiento para los exámenes en los CDC. Los casos confirmados disponían de aislamientos clínicos identificados como especies de Ralstonia en los laboratorios de los CDC. Las diferencias entre pacientes infectados y colonizados se determinaron utilizando el estadístico de Mann-Whitney para variables continuas y la prueba de la 2 para variables categóricas.
MicrobiologíaLos cartuchos del filtro Vapotherm se lavaron con 45 ml de agua estéril, suero fisiológico neutralizado con fosfato o caldo neutralizante de Dey-Engley (Becton Dickinson, MD). El eluyente resultante se procesó mediante una filtración de membrana a través de un tamaño del poro de 0,45 µm, un filtro de membrana de éster de celulosa mixto de 47 mm (Millipore Corporation, MA) o por centrifugación a 3.500 g durante 15 minutos. Las extensiones de superficie de los dispositivos se obtuvieron a partir de los puertos de aire en el cartucho del filtro, las conexiones del aire del aparato Vapotherm, y el puerto del aparato que distribuía oxígeno humidificado al paciente. Se obtuvieron muestras de vapor de los dispositivos en funcionamiento conectando el tubo de distribución de oxígeno a un contenedor estéril, cerrado herméticamente y obteniendo el condensado resultante.
Los CDC también efectuaron un cultivo del agua del grifo usada durante la calibración de los nuevos dispositivos Vapotherm fabricados en Irlanda. Se obtuvieron muestras de agua y hielo medioambiental con tiosulfato sódico para neutralizar el cloro residual.
Todas las muestras se sometieron a un cultivo con caldo de soja con Trypticase™ y un 5% de sangre de carnero (BAP, Becton Dickinson), agar II de MacConkey (MAC; Becton Dickinson) y agar R2A. La identificación de las especies del aislamiento se efectuó utilizando el instrumento automatizado Vitek 2 (Biomérieux, Durham, NC) en combinación con una serie de pruebas bioquímicas estándar11.
Tipificación molecularDespués de la digestión del ADN cromosómico con Spe1 se efectuó una tipificación molecular mediante electroforesis en gel de campo pulsado (PFGE), según lo descrito previamente12. Los patrones de PFGE se compararon utilizando el programa estadístico Bionumerics 3.5 (Applied Maths, Austin, TX) y los aislamientos se consideraron afines si la similitud de los coeficientes Dice fue > 80%. Para una comparación, a partir del Research Laboratory and Repository de Burkholderia cepacia (University of Michigan, Ann Arbor, MI) obtuvimos aislamientos de Ralstonia mannitolilytica, recuperados varios años antes del inicio del brote actual. También se usó un análisis PFGE para confirmar la identificación de las especies, demostrando que los aislamientos de R. pickettii eran genéticamente distinguibles de los de R. mannitolilytica.
Pruebas de los nuevos protocolos de reprocesamientoDurante la investigación, Vapotherm Incorporated propuso dos nuevos protocolos de desinfección para sus aparatos y cartuchos. Los CDC evaluaron la eficacia de cada protocolo en un aparato conocido por estar contaminado por Ralstonia. Un protocolo recomendaba la circulación de 200 ppm de dióxido de cloro (dicloro) (ClO2) en el conducto líquido del dispositivo durante 10 minutos con el cartucho del filtro colocado. Para probar este protocolo, se obtuvieron muestras de vapor en tres puntos de tiempo: antes del reprocesamiento, inmediatamente después y al cabo de 7 días de funcionamiento continuo del dispositivo fuera de las áreas de asistencia de los pacientes.
El segundo protocolo recomendaba la circulación de 1.000 ppm de ClO2 en el conducto líquido del dispositivo durante una hora sin el cartucho del filtro. En Stevensville, MD, personal de Vapotherm emprendió este protocolo en un aparato contaminado; el aparato se remitió a los CDC. Se obtuvieron muestras de vapor en 6 puntos de tiempo: antes del reprocesamiento, inmediatamente después, cada 7 días durante 21 días y en el día 30. Durante este período, el aparato funcionó continuamente en un laboratorio de los CDC.
RESULTADOSInvestigación en el hospital ADesde el 1 de enero de 2004 hasta el 1 de septiembre de 2005 se identificaron 5 casos. En los cultivos respiratorios de 3 pacientes creció R. mannitolilytica; en los cultivos respiratorios de dos pacientes creció Ralstonia pickettii. Los casos se asociaron significativamente con la exposición al dispositivo Vapotherm en un plazo de 30 días previos a la recuperación de Ralstonia (OR = 18; IC del 95% = 2,2-140). Ninguna otra exposición, incluida la ventilación mecánica, se asoció significativa-mente con la recuperación de Ralstonia (tabla 1). Se aislaron múltiples especies de Ralstonia a partir de las extensiones de superficie obtenidas de cada uno de los dispositivos que se examinaron (n = 4) mientras que en las muestras de agua potable hospitalaria, agua esterilizada, hielo, los dos ventiladores mecánicos y las soluciones respiratorias estériles no creció Ralstonia. También se recuperaron especies de Ralstonia a partir de 10 de 14 cartuchos de filtros usados (71%) pero no en los 5 cartuchos sin usar.
TABLA 1. Odds ratiosajustadas de la colonización por Ralstonia mannitolilyticaen el hospital A, Pensilvania, del 1 de diciembre de 2004 hasta el 31 de agosto de 2005
Investigación nacionalLos CDC recibieron informes de 45 pacientes procedentes de 20 hospitales de 16 estados a partir de los que se recuperaron especies de Ralstonia. En 9 de 20 hospitales (45%) se documentaron casos múltiples de pacientes infectados por Ralstonia (media = 4 pacientes; límites: 2-7 pacientes), mientras que cada uno de los 11 hospitales restantes (55%) documentó un caso. Los CDC confirmaron los aislamientos de 38 pacientes (84%) como R. mannitolilytica; los aislamientos no estuvieron disponibles para 7 casos. Los 38 casos confirmados fueron pacientes pediátricos (límites de edad 5 días a 7 años) y 35 (92%) se expusieron al Vapotherm antes de la recuperación de Ralstonia.
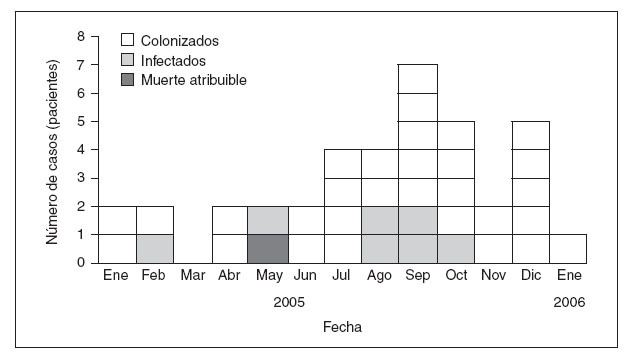
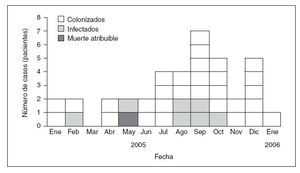
Para pacientes expuestos al Vapotherm, el tiempo mediano de exposición fue de 9 días (1-121 días) y el intervalo mediano entre la última exposición al aparato y el primer cultivo positivo fue de 4 días (límites 0-38 días). En 8 casos (21%) el médico responsable indicó que Ralstonia había provocado una infección mientras que consideró que los casos restantes representaban una colonización. Los pacientes infectados eran significativa-mente más jóvenes (p = 0,002) que los colonizados y tuvieron más probabilidades de presentar fiebre > 38 °C (p = 0,031), desarrollar leucocitosis, de acuerdo con el médico responsable (p < 0,001), mostrar pruebas de neumonía en la radiografía de tórax (p = 0,034) y recibir antibióticos para el tratamiento de la infección (tabla 2). El médico responsable describió que la infección (3%) había complicado el curso de una neumopatía subyacente en un lactante, lo que posiblemente contribuyó a la muerte del paciente. Los casos confirmados se identificaron desde enero de 2005 a enero de 2006, y 24 de 38 (63%) se describieron después de la investigación de campo en el hospital A (fig. 2).
TABLA 2. Diferencias entre casos confirmados infectados (1) y colonizados (2) del brote de Ralstonia mannitolilytica asociado a Vapotherm, 2005-2006
Fig. 2. Curva epidémica de los casos de Ralstonia, Estados Unidos, 2005-2006 (n = 38).
MicrobiologíaLos CDC recibieron 134 aislamientos clínicos y medioambientales de 22 hospitales de 13 estados; 111 (83%) se identificaron como R. mannitolilytica (38 clínicos y 73 medioambientales). En dos hospitales se describió la recuperación de R. mannitolilytica a partir de cartuchos no usados de Vapotherm. En un centro se recuperó R. mannitolilytica a partir de 3 cartuchos no utilizados de un lote individual; los otros centros recuperaron R. mannitolilytica de 3 de 10 cartuchos no usados de 3 lotes diferentes. Los CDC examinaron 26 cartuchos nuevos de 13 lotes separados (incluidos 2 lotes a partir de los que se documentaron cartuchos nuevos contaminados) y no aislaron ningún microorganismo.
El análisis microbiológico de las muestras obtenidas del centro de Irlanda donde se calibraron los aparatos produjo Sphingomonas paucimobilus de los cultivos del agua de grifo y Burkholdera cepacia de las extensiones de superficie del grifo a partir del que se extrajo el agua.
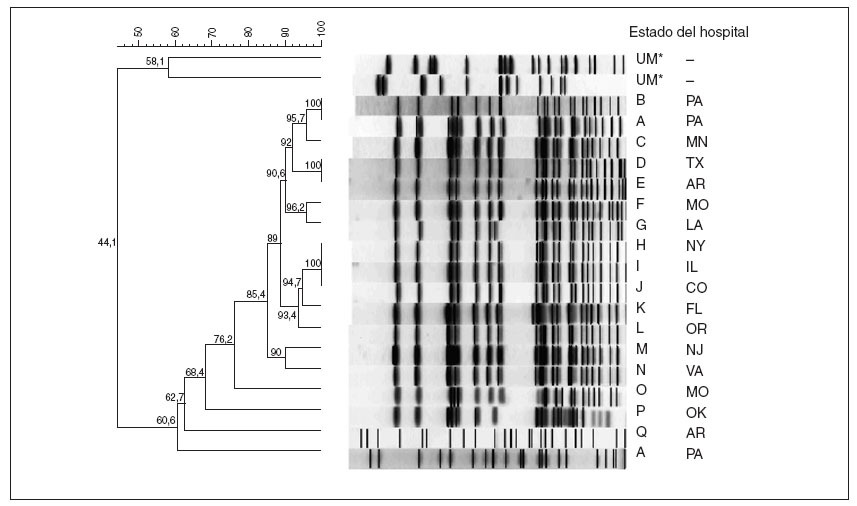
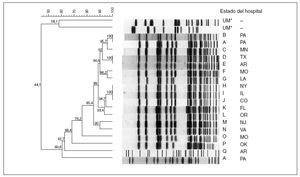
Tipificación molecularLa afinidad para los coeficientes de Dice generados a partir del análisis de los datos PFGE de 111 aislamientos de R. mannitolilytica fluctuó desde el 100% hasta menos del 59%. Los aislamientos clínicos y medioambientales de 18 de 22 hospitales (22%) de 12 estados no contiguos (fig. 3) fueron afines; incluidos los aislamientos de 31 casos confirmados (82%). Ninguno de los 9 aislamientos de referencia de R. mannitolilytica obtenidos antes de que se iniciara el brote guardó relación con estos aislamientos. Los hospitales de 10 estados adicionales documentaron la recuperación de especies de Ralstonia pero ninguno presentó un aislamiento para una confirmación o presentó aislamientos que no eran afines.
Fig. 3. Dendrografía de los aislamientos de Ralstonia mannitolilytica, múltiples estados, 2005-2006. Se muestran los hospitales con aislamientos relacionados con las cepas no afines para una comparación. Múltiples estados incluyeron hospitales con cepas tanto afines como no afines del bacilo. *UM indica aislamientos obtenidos del Research Laboratory de Burkholderia cepacia de la University of Michigan.
Examen de los nuevos protocolos de reprocesamientoInmediatamente después de la desinfección con 200 ppm de ClO2 no se recuperaron microorganismos. No obstante, R. mannitolilytica creció en el dispositivo 7 días después del reprocesamiento. Después de la desinfección con 1.000 ppm de ClO2, de las muestras obtenidas inmediatamente después del reprocesamiento y en el día 3, se recuperaron menos de 10 UFC/ml de especies de Methylobacterium. No se recuperaron microorganismos de las muestras obtenidas en los cultivos a los 7, 14, 21, 30 días después del procesamiento.
DISCUSIÓNLa presente investigación demuestra que la contaminación de un dispositivo de humidificación de gases respiratorios se tradujo en la recuperación de R. mannitolilytica a partir de pacientes procedentes de hospitales de 22 estados. El microorganismo no pudo erradicarse utilizando el protocolo de desinfección recomendado por el fabricante. Aunque, en general, su virulencia es modesta, las especies de Ralstonia pueden provocar infecciones potencialmente graves relacionadas con la asistencia sanitaria3,13,14. La presente investigación, que relacionó epidemiológica y microbiológicamente la transmisión de Ralstonia con el dispositivo de humidificación Vapotherm 2000i, representa el mayor brote documentado asociado con R. mannitolilytica. Las cepas genéticamente relacionadas en lugares geográficos dispares sugieren la contaminación intrínseca del aparato como causa del brote (fig. 3), aunque no se ha identificado el origen de esta contaminación. Puesto que el agua se utiliza para fabricar o calibrar tanto el dispositivo Vapotherm como su cartucho de filtro, la explicación más probable de este brote es la contaminación durante la producción de uno de estos componentes.
Una posibilidad es la contaminación intermitente del cartucho. Aunque los CDC no recuperaron microorganismos de los cartuchos sin abrir examinados, 2 hospitales describieron la recuperación de especies de Ralstonia de cartuchos de filtro sin abrir. Sin embargo, los cartuchos se fabrican usando agua destilada expuesta a una ósmosis inversa y posteriormente experimentan un secado e hibridación a temperaturas elevadas (65,6 °C durante 4 horas, seguido de 121,1 °C durante 40 minutos) lo que disminuye la probabilidad de introducción y supervivencia de microorganismos.
Otra explicación del brote es la introducción del microorganismo en los componentes del Vapotherm durante la fabricación. Antes de la investigación, durante la fabricación, se usaba agua del grifo para calibrar los dispositivos que se introducían en su embalaje para la distribución antes de que se hubieran secado por completo. Durante su transporte y almacenamiento los microorganismos presentes en el agua residual del aparato habrían formado micropelículas en su sistema de tubos15, lo que reduciría su sensibilidad a la desinfección16. Es bien conocido que las especies de Ralstonia manifiestan la formación de una biopelícula en las tuberías de agua de plástico17. Una vez presente en los dispositivos, la bacteria habría persistido debido a una combinación de factores, incluidas las condiciones de calor y
Jhung MA et al. Brote nacional de infección por Ralstonia mannitolilyticaasociado al uso de un dispositivo contaminado de distribución de oxígeno entre pacientes pediátricos humedad durante el funcionamiento, que favorecen el crecimiento bacteriano, la incapacidad del usuario final para reprocesar el dispositivo de manera sistemática y la imposibilidad del proceso de desinfección original del fabricante para erradicar las biopelículas.
Los resultados de la presente investigación adolecen de diversas limitaciones. En primer lugar, no se identificó el origen de la contaminación del aparato. Los CDC no pudieron recuperar microorganismos de los cartuchos sin abrir y no se recuperaron especies de Ralstonia de las muestras de agua obtenidas a partir de la planta de fabricación. Sin embargo, en la fuente de agua usada para la calibración se detectaron tanto S. paucimobilus como B. cepacia, microorganismos afines a Ralstonia. Las muestras de agua enviadas a los CDC se obtuvieron varios meses después de haber ocurrido la inoculación propuesta, un tiempo suficiente para que hubiera cambiado la flora microbiana del agua18, lo que oscurece las pruebas de una contaminación por Ralstonia en un punto de tiempo más precoz.
Una segunda limitación procede de la escasa información que describe la diversidad genética de R. mannitolilytica en Estados Unidos. Si su diversidad sólo es insignificante, el hallazgo de cepas genéticamente relacionadas en diversos estados no implicaría una contaminación intrínseca del dispositivo. Puesto que las especies de Ralstonia son microorganismos medioambientales ubicuos17,19, el brote habría sido consecuencia de la contaminación concomitante, pero no relacionada, por cepas en apariencia afines. No obstante, la presente investigación ayuda a demostrar que esta uniformidad genética es poco probable. En el 22% de aislamientos examinados de R. mannitolilytica se demostró un patrón de PFGE cuya afinidad con la cepa predominante fue < 80%. Además, la comparación de los aislamientos de R. mannitolilytica obtenidos antes del inicio del brote demostró su falta de afinidad con los aislamientos obtenidos durante la investigación.
El Vapotherm 2000i se autorizó para su comercialización a través de un proceso de notificación previa a la comercialización 510(k) con la indicación “para aumentar la humedad y calentar los gases respiratorios que se administran a los pacientes”20. A diferencia de las presentaciones de autorizaciones previas a la comercialización (PMA), que requieren datos que demuestren la falta de riesgos y la eficacia de los dispositivos, en general no se requiere que los fabricantes de dispositivos presentados para una revisión 510(k) incluyan el diseño y datos de las pruebas de fabricación a la FDA21. En lugar de ello, la presentación 510(k) se basa en la demostración de una “equivalencia sustancial” con el “dispositivo en el que se basa” que ya está autorizado para su comercialización. Un nuevo dispositivo se considera sustancialmente equivalente si sus usos y las características tecnológicas son los mismos que los del dispositivo en el que se basa y no suscita nuevas preguntas de seguridad y eficacia7. Los fabricantes de dispositivos que tratan de comercializarlos a través del proceso 510(k) pueden confirmar la eficacia del reprocesamiento si su producto “desde una perspectiva del control de las infecciones es prácticamente idéntico al dispositivo en el que se basa y para el que se ha validado la desinfec-ción”21. La FDA autorizó la comercialización de Vapotherm 2000i partiendo de una comparación con otros humidificadores comercializados de gases respiratorios. No obstante, Vapotherm 2000i se caracteriza por aspectos exclusivos que lo distinguen de otros humidificadores desde una perspectiva del control de las infecciones. En general, los aparatos de tratamiento respiratorio como éste se consideran dispositivos médicos semicríticos, cuyos componentes reutilizables requieren como mínimo una desinfección de alto nivel entre pacientes22. No obstante, las instrucciones de reprocesamiento para los componentes reutilizables del dispositivo recomendaban el uso de una desinfección de bajo nivel entre pacientes. Por otra parte, dado que el aparato empleaba un cartucho de filtro reutilizable de 0,01 µm como “barrera fisiológica” entre el compartimiento aéreo y el acuoso, en el dispositivo se permitía el agua de grifo. En su informe 510(k) de las instrucciones de uso, el fabricante afirmaba que, “en condiciones de funcionamiento normal, no se corre un riesgo de contaminación bacteriana del flujo aéreo nasal”23.
Partiendo de los resultados de la presente investigación, el 20 de diciembre de 2005, la FDA hizo pública una notificación preliminar de salud pública en la que advertía a los médicos que usaran dispositivos alternativos. El 22 de diciembre de 2005, Vapotherm Incorporated retiró el dispositivo 2000i. La FDA clasificó esta acción como retirada de clase 1, que se reserva para productos con probabilidades de provocar problemas graves de salud o la muerte. Hasta octubre de 2006, el Vapotherm 2000i sigue retirado del mercado norteamericano.
Como respuesta al brote y a la investigación, Vapotherm, Inc., introdujo cambios en su proceso de fabricación y desinfección y los parámetros usados para abordar las fuentes potenciales de contaminación del dispositivo (tabla 3). En enero de 2007, la FDA determinó que estas modificaciones satisfacían los requisitos para una presentación 510(k) y se reintrodujo el uso del dispositivo Vapotherm. Los CDC y la FDA recomiendan que los médicos que vayan a usarlo sigan las instrucciones más recientes para el dispositivo y sus componentes que pueden obtenerse contactando con Vapotherm, Inc.
TABLA 3. Fuentes potenciales de contaminación intrínseca del sistema Vapotherm y medidas tomadas por el fabricante como respuesta
La presente investigación destaca la importancia de prestar una atención cuidadosa a los principios del control de las infecciones durante el desarrollo, revisión reguladora y uso de dispositivos médicos. Los nuevos dispositivos pueden tener un rendimiento equivalente a los comercializados en la actualidad pero también plantean nuevos retos de procesamiento cuando se usan en ámbitos clínicos. Como reconocimiento de esto, la FDA ha identificado la esterilización de dispositivos como una de las tres áreas clave para mejorar las presentaciones24 510(k). Todos los dispositivos médicos tienen la posibilidad de contaminarse durante su uso y, por lo tanto, entrañan un potencial de transmisión de enfermedades infecciosas. Para proteger a los pacientes frente a éstas, los fabricantes han de garantizar que los dispositivos reutilizables se reprocesan sistemática y eficazmente entre usuarios. Éstos también deben conocer que en general la revisión de los datos de validación de los métodos de reprocesamiento no se incluye como parte del proceso actual de notificación previa a la comercialización 510(k). Con independencia de cómo se autorizan para comercializarlos, se anima al usuario final a revisar las directrices de control de las infecciones y de reprocesamiento en las condiciones reales de uso para contribuir a minimizar los riesgos del paciente cuando se usan dispositivos médicos.
AGRADECIMIENTOSNuestro grupo de investigación del brote incluyó Corey Robertson, MD (New Jersey Department of Health and Senior Services); Corinne Walentik, MD, Morey Gardner, MD, Brenda Hinson, RN, Amie Keck, RT, y Fran Hixson, RN (St. Mary’s Health Center, St. Louis, MO); James Ripka, RRT, Claudia Castellon, RN, y Lawrence Ross, MD (Childrens’ Hospital LosAngeles, Keck School of Medicine, Los Ángeles, CA); Daniel New, MD, Lori Patterson, MD, Sheila Ware, RRT-NPS, y Caroline Graber, RN (East Tennessee Children’s Hospital, Knoxville, TN); Susan A. Dolan, RN, John F. James, PhD, y Trent Lucas, RRT (Children’s Hospital, Denver, CO); Abbot Laptook, MD (Women and Infants’. Hospital of Rhode Island, Providence, RI); Barbara Stein, RN (Children’s Hospital of The King’s Daughters, Norfolk, VA); Jane Harper, MS, RN, y Kathleen Harriman, PhD (Minnesota Department of Health, St. Paul, MN); Michelle Hulse, MD, y Jane Harper, MS (Children’s Hospitals and Clinics of Minnesota, Mineápolis, MN); Beth Ann Ayala, MS (Christus Santa Rosa Children’s Hospital, San Antonio, TX); Cindy Shifflett, BSN, Susan Latham, MT (ASCP), y Kim Cantrell, RRT-NPS (Spartanburg Regional Health Services District, Inc., Spartanburg, SC); Lynn Semproch, MT (ASCP) (Children’s Hospital of Michigan, Detroit, MI); Joyce Hayes-Berkowitz, RN, Mary Fairchild, RRT-NPS, y Kathy Acton, MT-ASP (Cardinal Glennon Children’s Hospital, St. Louis, MO); Mary Rotar, RN (Children’s Hospital of Wisconsin, Milwaukee, WI); Craig H. Gilliam, BSMT, Nicholas DePalo, BSRRT, Michele Honeycutt, RN, Toni Beavers-May, BSMT (ASCP), Toben Bennett, MSE, Stefan Juretschko, PhD, Gordon Schutze, MD (Arkansas Children’s Hospital, Little Rock, AR); Linda Campagna, RN, Drucy Borowitz, MD, Diane M. Dryja, MT (ASCP) (Women and Children’s Hospital of Buffalo, Buffalo, NY); Janet Eagan, RN (Memorial SloanKettering Cancer Center, Nueva York, NY); Patti Kieffer, RN, Karla Howell, RN, Marla Ovary, CRT, y Kathy Long, CRT (Children’s Hospital of St. Louis, St. Louis, MO); Jolianne Stone Tocco, MPH (Oklahoma State Department of Health); Jeneene Kitz, BSN (OU Medical Center, Oklahoma City, Oklahoma); Barbara Quattlebaum, RN, y Patricia Hudak, MT (Methodist Children’s Hospital of South Texas, San Antonio, TX); Tam Ly, MD, Zacharia Cherian, MD, Joseph Lynott, MS, Nancy Donegan, MPH (Washington Hospital Center, Washington, DC).
Los hallazgos y conclusiones de la presente investigación son los de los autores y no necesariamente representan la opinión de los Centers for Disease Control and Prevention.
Correspondencia: Michael A. Jhung, MD, MPH, Division of Healthcare Quality Promotion, Centers for Disease Control and Prevention, 1600 Clifton Rd., NE MS A-24, Atlanta, GA 30333, Estados Unidos.
Correo electrónico: mjhung@cdc.gov