Los paros cardíacos pediátricos representan algunas de las experiencias clínicas más angustiantes para el pediatra y la familia. Cuando se desarrolló por primera vez en 1998 el curso de soporte vital avanzado pediátrico (SVAP), los resultados de estos paros eran infaustos. Por esta razón, el curso original prestaba atención a su prevención a través del reconocimiento y tratamiento precoces de la insuficiencia respiratoria y el shock más que a su tratamiento. Durante los 25 últimos años, la supervivencia al alta hospitalaria ha mejorado hasta el 27% de los niños tras un paro cardíaco hospitalario, y la mayor parte sobreviven con un pronóstico neurológico favorable1.
En el presente artículo, revisamos los conocimientos actuales sobre paro cardíaco pediátrico: la epidemiología, las cuatro fases del paro cardíaco y las intervenciones apropiadas, los mecanismos del flujo sanguíneo durante la reanimación cardiopulmonar (RCP), los cuidados de soporte después del paro, las circunstancias especiales de reanimación (fibrilación ventricular [FV] pediátrica, después de cirugía para cardiopatías congénitas, RCP con oxigenación por membrana extracorpórea [OMEC]), prevención del paro cardíaco con equipos de respuesta rápida e implementación de programas innovadores de estimulación de la formación.
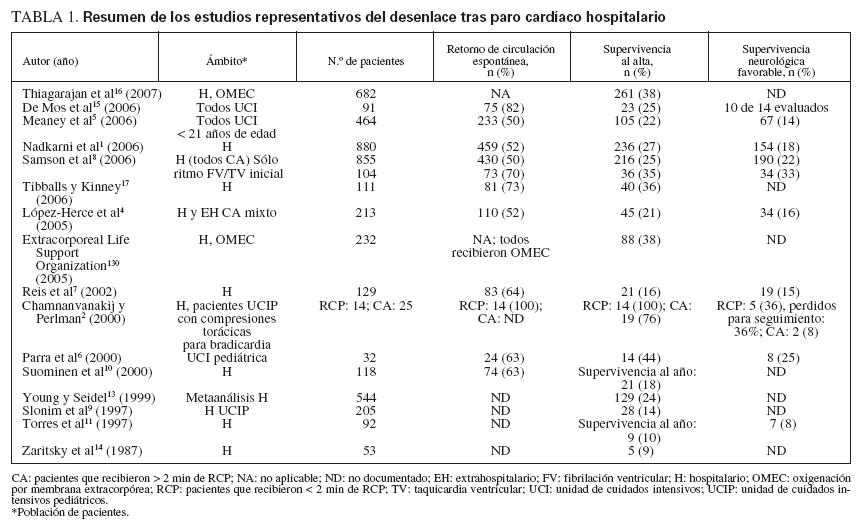
EPIDEMIOLOGÍA DEL PARO CARDÍACO PEDIÁTRICOEn Norteamérica las enfermedades cardiovasculares son la causa más habitual de mortalidad relacionada con enfermedades, dando lugar a alrededor de un millón de muertes anuales. Cada año, aproximadamente 16.000 niños norteamericanos (8-20/100.000 niños/año) experimentan un paro cardíaco. Los factores decisivos que influyen en los resultados de supervivencia incluyen el entorno donde se produce el paro, el estado preexistente del niño, la duración de “falta de circulación” (el período de tiempo en que no está presente flujo pulsátil y el paciente no está sometido a RCP) antes de la reanimación, el ritmo electrocardiográfico inicial detectado, y la calidad de las intervenciones de soporte vital básico y avanzado proveídas. Casi en dos tercios de pacientes pediátricos que son víctimas de un paro cardíaco hospitalario se reanuda la circulación espontánea (RCE) y aproximadamente una cuarta parte de ellos sobrevive al alta hospitalaria, de los que casi tres cuartas partes tienen un pronóstico neurológico favorable1-17 (tabla 1). Los resultados después de un paro pediátrico extrahospitalario son mucho peores que los obtenidos tras un paro hospitalario4,12,13,18-26 (tabla 2). Característicamente, la supervivencia al alta hospitalaria es < 10% de estos niños, y muchos presentan graves secuelas neurológicas. En parte, estos resultados desfavorables se deben a los períodos prolongados de ausencia de flujo, porque muchos de estos paros no son presenciados y sólo el 30% de los niños reciben RCP efectuada por un transeúnte o testigo13. Esta baja tasa de RCP es especialmente infortunada porque es bien conocido que aumenta más del doble las tasas de supervivencia de los pacientes27.
TABLA 1. Resumen de los estudios representativos del desenlace tras paro cardíaco hospitalario
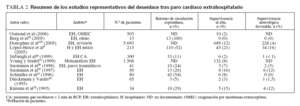
TABLA 2. Resumen de los estudios representativos del desenlace tras paro cardíaco extrahospitalario
Los resultados de supervivencia después de un paro cardíaco hospitalario pediátrico son mayores que en el caso de adultos. Aunque los paros pediátricos son con menos frecuencia arritmogénicos, causados por taquicardia ventricular (TV)/FV (un 10% de los paros pediátricos comparado con un 25% en el caso de los de adultos), el 27% de los niños sobreviven al alta hospitalaria comparado con el 17% de los adultos1 (odds ratio ajustada: 2,3 [intervalo de confianza del 95%: 2,0-2,7]). La tasa global superior de supervivencia pediátrica refleja una tasa de supervivencia sustancialmente mayor entre niños con asistolia o actividad eléctrica sin pulso (AESP) comparado con adultos con asistolia o AESP (24% comparado con 11%). Investigaciones adicionales han demostrado que la tasa de supervivencia superior entre niños es predominantemente consecuencia de una supervivencia mucho mayor entre los lactantes y niños en edad preescolar, comparado con niños más mayores o adultos5. Es posible que, en parte, los resultados superiores en niños más pequeños guarden relación con el mayor flujo sanguíneo miocárdico y cerebral obtenido con la RCP en estos niños pequeños con paredes torácicas distensibles28,29. Además, la supervivencia de la RCP hospitalaria pediátrica es más probable en hospitales cuyo personal está constituido por pediatras18.
FASES DE LA REANIMACIÓN: PRE-PARO, AUSENCIA DE FLUJO, ESTADO DE BAJO FLUJO DE LA RCP Y POST-RCELas intervenciones para mejorar el resultado del paro cardíaco pediátrico deben dirigirse a optimizar los tratamientos de acuerdo con la etiología, momento, duración, intensidad y “fase” de la reanimación, según lo sugerido en la tabla 3. El paro cardíaco tiene, como mínimo, cuatro fases: 1) pre-paro; 2) ausencia de flujo (paro cardíaco no tratado); 3) flujo reducido (RCP) y 4) post-reanimación. La fase pre-paro representa la mayor oportunidad de influir en la supervivencia del paciente y prevenir el paro cardiopulmonar sin pulso. Puesto que su reconocimiento, prevención y anticipación precoces son mejores que su tratamiento, tradicionalmente el curso de soporte vital avanzado pediátrico se ha centrado en el reconocimiento y tratamiento precoces de la insuficiencia respiratoria y del shock para prevenir los paros cardíacos. Con el mismo objetivo, los equipos de urgencias médicas (EUM) (equipos de respuesta rápida) reciben formación para reconocer e intervenir con el objetivo de prevenir los paros cardíacos30,31. La prevención de los accidentes habituales de la infancia con el uso obligatorio de los dispositivos de sujeción para el automóvil y la seguridad en las piscinas puede reducir la incidencia de paro cardíaco. Para prevenir los paros traumáticos, se recomienda el uso de sillas de seguridad para niños y vallas de cierre automático alrededor de las piscinas para prevenir los paros cardíacos asociados al ahogamiento.
TABLA 3. Fases del paro cardíaco y la reanimación
Durante la fase sin flujo del paro cardíaco sin pulso, las intervenciones prestan atención a su reconocimiento precoz y al inicio inmediato de las maniobras de soporte vital básico. El objetivo de la RCP eficaz es optimizar la perfusión coronaria y cerebral y el flujo sanguíneo hasta los órganos críticos durante la fase de bajo flujo. Las medidas de soporte vital básico con compresiones torácicas eficaces casi continuas (p. ej., compresiones fuertes, rápidas permitiendo un retroceso torácico completo, y reducción a un mínimo de las interrupciones y evitación de la ventilación excesiva) son las más importantes de esta fase. Para la FV y la TV sin pulso, son decisivas una determinación rápida del ritmo electrocardiográfico y la desfibrilación inmediata cuando sea apropiado. Para los paros cardíacos que son consecuencia de asfixia y/o isquemia, es importante la provisión de una perfusión miocárdica suficiente y el aporte de oxígeno miocárdico con ventilación titulada con respecto al flujo sanguíneo.
La fase post-reanimación es un período de alto riesgo de lesión cerebral, arritmias ventriculares y extensión de las lesiones de reperfusión. Las células lesionadas pueden morir o recuperar parcial o completamente la función. Durante esta fase, son habituales una disfunción miocárdica e hipotensión aguda32. La lesión de reperfusión se produce después del restablecimiento de la circulación tras un período de isquemia. La reintroducción del flujo sanguíneo puede dar lugar a inflamación y estrés oxidativo y puede originar una lesión secundaria. Las intervenciones, como la hipotermia sistémica durante la fase de post-reanimación inmediata, tratan de reducir a un mínimo la lesión de reperfusión y proporcionar soporte del restablecimiento celular. La fase post-paro puede tener el mayor potencial de avances innovadores en la comprensión de la lesión, muerte, inflamación y apoptosis celular que, en último término, den lugar a nuevas intervenciones. En esta fase puede ser particularmente importante prestar una atención cuidadosa al control de la temperatura (evitar la hipertermia), la glucosa (normoglucemia), presión arterial (normotensión), coagulación y ventilación óptima33 (evitar la hiperventilación).
La fase específica del paro cardíaco y reanimación dictan el momento, intensidad, duración y enfoque de las intervenciones. La comprensión actual de la fisiología y restablecimiento de un paro cardíaco sólo permite la titulación de la presión arterial, el aporte y consumo global de oxígeno, temperatura corporal, coagulación y otros parámetros fisiológicos que tratan de optimizar el resultado. Es probable que las estrategias futuras aprovechen los descubrimientos y conocimientos que están aflorando sobre inflamación celular, trombosis, reperfusión, cascadas de mediadores, marcadores celulares de la lesión y restablecimiento y tecnología del trasplante.
INTERVENCIONES DURANTE LA FASE PRE-PARO: EQUIPOS DE RESPUESTA RÁPIDALa fase pre-paro es la ideal para reducir la mortalidad y morbilidad del paro cardíaco mediante una disminución de su incidencia. Con frecuencia, en la hora previa al acontecimiento, el paciente que es víctima de un paro cardíaco hospitalario presenta parámetros fisiológicos anormales34-36. Además, las causas precipitantes de la mayor parte de los pediátricos son la insuficiencia respiratoria aguda y el shock circulatorio1. Los equipos de respuesta rápida o EUM son los equipos de urgencias hospitalarias destinados a responder a pacientes en peligro inminente de descompensación y, por lo tanto, a prevenir la progresión hasta un paro cardíaco. Diversos estudios (no aleatorizados), efectuados en adultos, han demostrado una mejora de los resultados con la presencia de EUM37,38 pero en un ensayo aleatorizado agrupado, efectuado en adultos, no se demostró una disminución de los paros cardíacos o de la mortalidad39. Hasta la fecha, no se han publicado ensayos prospectivos aleatorizados que hayan establecido que los EUM adultos o pediátricos previenen los paros cardíacos. No obstante, en tres estudios pediátricos se sugiere que la implementación de estos equipos reduce su frecuencia comparado con períodos de control retrospectivos antes de su iniciación30,40,41. En los dos primeros estudios se revelaron tendencias hacia una disminución de los paros cardíacos hospitalarios30,40. Más recientemente, Sharek et al41 demostraron que la implementación de un EUM pediátrico disminuyó la tasa de mortalidad mensual media en un 18% (desde 1,01 a 0,83 muertes por 100 altas; p = 0,007) y la tasa media de códigos mensuales en > 70% en hospitales pediátricos en general. Estos equipos no pueden prevenir todos los paros cardíacos pero en general han de poder trasladar a un niño en estado crítico a una UCI para una mejor monitorización e intervenciones más agresivas que traten de prevenir el paro u ofrecer maniobras inmediatas de soporte vital avanzado si se produce. La implicación de este nuevo paradigma es que cualquier paro cardíaco que no acontece en una unidad monitorizada ha de revisarse como acontecimiento centinela (es decir, potencialmente evitable).
MECANISMO DEL FLUJO SANGUÍNEO CORONARIO DURANTE LA RCPLas arterias coronarias proporcionan el flujo sanguíneo desde la raíz aórtica hasta el miocardio. El corazón que late normalmente es perfundido sobre todo por el flujo sanguíneo coronario durante la diástole. Cuando el corazón se para y no fluye sangre a la aorta, el flujo sanguíneo coronario cesa. Durante las compresiones torácicas, la presión aórtica aumenta al mismo tiempo que la presión auricular derecha. Durante la fase de descompresión de las compresiones torácicas, la presión auricular derecha disminuye con más rapidez e intensidad que la presión aórtica, lo que genera un gradiente de presión que perfunde el corazón con sangre oxigenada durante la “diástole”. Una presión de perfusión coronaria inferior a 15 mmHg durante la RCP es un factor pronóstico desfavorable de RCE42.
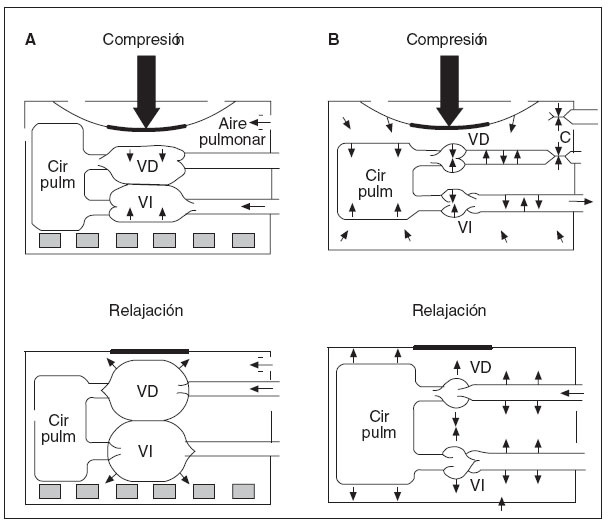
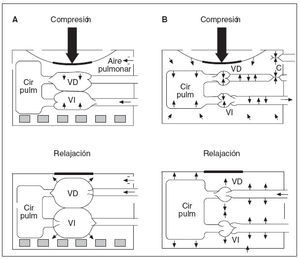
Recientemente se ha redescubierto la importancia de la presión intratorácica negativa en el retorno venoso durante la RCP y, por lo tanto, en la presión de perfusión coronaria y el flujo sanguíneo miocárdico durante la RCP (fig. 1). Durante la fase de descompresión, puede incrementarse la presión intratorácica negativa impidiendo brevemente el flujo de aire a los pulmones (es decir, con un dispositivo de umbral de impedancia inspiratoria [DUI]). El aumento de la presión negativa favorece el retorno venoso, el gasto cardíaco y la presión aórtica media. El DUI es una pequeña válvula desechable que puede conectarse directamente al tubo traqueal o a la máscara facial para aumentar la presión intratorácica negativa durante la fase inspiratoria de la respiración espontánea y la fase de descompresión de la RCP en animales o seres humanos adultos. Impedirá selectiva-mente el flujo aéreo inspiratorio en el paciente cuando la presión intratorácica sea < 0 atm, y, por lo tanto, aumentará el grado de presión intratorácica negativa con cada descompresión torácica43. Se ha demostrado que la aplicación de este concepto en estudios sobre RCP efectuados en animales y en seres humanos adultos mejora las presiones de perfusión orgánica vital y el flujo sanguíneo miocárdico44-47. Pese a los resultados alentadores obtenidos en estudios en animales, en un ensayo aleatorizado, doble ciego, efectuado en seres humanos, no se demostraron diferencias en las tasas de mortalidad entre pacientes tratados con DUI comparado con DUI simulado para FV y paros asistólicos. La tasa de supervivencia fue mayor con el DUI entre un subgrupo de pacientes con AESP48.
Fig. 1. A: compresiones cardíacas directas. B: compresiones de la bomba torácica. Cir pulm: circulación pulmonar; VD: ventrículo derecho; VI: ventrículo izquierdo.
Con estudios sobre un dispositivo de compresión-des-compresión activa (CDA) se han observado pruebas adicionales de que la manipulación de la presión intratorácica durante la RCP puede mejorar la hemodinámica y los resultados. La RCP con CDA consiste en un dispositivo manual fijado mediante aspiración en la pared torácica anterior y, durante la fase de compresión, extrae la sangre del corazón para perfundir los órganos vitales. Cuando se presiona activamente el dispositivo, se crea un vacío dentro del tórax, lo que extrae más sangre del corazón49. La combinación de RCP CDA con DUI mejora todavía más las presiones de perfusión de la arteria coronaria y las presiones arteriales sistémicas sustancialmente en animales y en pacientes en paro cardíaco comparado con la RCP CDA sola. La combinación CDA y DUI da lugar a una disminución más rápida de la presión intratorácica negativa que cualquiera de ambos dispositivos solo45 y se asocia con un mayor retorno de sangre venosa al corazón con cada fase de descompresión.
INTERVENCIONES DURANTE EL PARO CARDÍACO (AUSENCIA DE FLUJO) Y RCP (BAJO FLUJO)Vía respiratoria y respiraciónDurante la RCP, el gasto cardíaco y el flujo sanguíneo pulmonar son µ10%-25% de los valores durante el ritmo sinusal normal. En consecuencia, durante aquélla es necesario un grado mucho menor de ventilación para un intercambio adecuado de gases de la sangre que atraviesa la circulación pulmonar. Los datos procedentes de estudios efectuados en animales y seres humanos adultos indican que, durante la RCP, es frecuente la ventilación excesiva, lo que puede comprometer sustancialmente el retorno venoso y el gasto cardíaco. Y lo más preocupante es que estos efectos hemodinámicos adversos durante la RCP combinados con las interrupciones de las compresiones torácicas para proporcionar tratamiento de las vías respiratorias y respiración artificial pueden contribuir a peores resultados de supervivencia46,50-56.
En modelos animales de paro cardíaco debido a FV súbita, los valores aceptables de PaO2 y PaCO2 persisten durante 4-8 min en el curso de las compresiones torácicas sin respiración artificial. Las concentraciones aórticas de oxígeno y dióxido de carbono no varían de las del estado pre-paro porque no está presente flujo sanguíneo y el consumo de oxígeno aórtico es mínimo. Una oxigenación y ventilación adecuadas pueden continuar sin respiración artificial porque los pulmones sirven de reservorio del oxígeno durante el estado de bajo flujo de la RCP. En diversos estudios retrospectivos sobre paro cardíaco FV presenciado en adultos se ha sugerido también que los resultados son similares tras RCP iniciada por un testigo con compresiones torácicas solas o compresiones torácicas más respiración artificial. En comparación, los estudios efectuados en animales sobre paro cardíaco precipitado por asfixia han establecido que la respiración artificial es un componente decisivo de la RCP satisfactoria57,58. Durante la asfixia, la sangre continúa fluyendo a los tejidos; por lo tanto, las saturaciones de oxígeno arterial y venoso disminuyen mientras que la concentración de dióxido de carbono y lactato aumenta. Además, el flujo sanguíneo pulmonar continuado antes del paro cardíaco produce una depleción del reservorio de oxígeno pulmonar. Por lo tanto, en comparación con la FV la asfixia se traduce en una hipoxemia arterial y acidemia sustanciales antes de la reanimación. En estas circunstancias, la respiración artificial puede salvar la vida.
CirculaciónEn general las maniobras de soporte vital básico con compresiones torácicas eficaces continuas son el mejor medio de proporcionar circulación durante un paro cardíaco. Con frecuencia, las medidas de soporte vital básico son insuficientes o no se proporcionan. En un estudio de publicación reciente, los testigos refirieron que no efectuaron RCP porque se dejaron llevar por el pánico o por el temor de efectuarla incorrectamente59. Los elementos más decisivos son efectuar compresiones intensas y rápidas. Puesto que sin compresiones torácicas no hay flujo, es importante reducir a un mínimo las interrupciones de éstas. Para permitir un retorno venoso adecuado en la fase de descompresión del masaje cardíaco externo, es importante permitir un retroceso torácico completo y evitar una ventilación excesiva. Esto último puede impedir el retorno venoso debido al aumento de la presión intratorácica.
RCP a tórax abiertoLa RCP de referencia excelente a tórax cerrado genera µ10-25% de flujo sanguíneo miocárdico basal y un flujo sanguíneo cerebral que es µ50% de lo normal. En comparación, la RCP a tórax abierto puede generar un flujo sanguíneo cerebral que se acerque a lo normal. Aunque el masaje cardíaco a tórax abierto mejora la presión de perfusión coronaria y aumenta la probabilidad de desfibrilación satisfactoria tanto en animales como en seres humanos, en muchas situaciones la toracotomía quirúrgica no es práctica. Con frecuencia, la RCP a tórax abierto se proporciona a niños tras cirugía cardíaca a corazón abierto y esternotomía. La institución más precoz de RCP a tórax abierto puede justificar una reconsideración en circunstancias de reanimaciones especiales, seleccionadas.
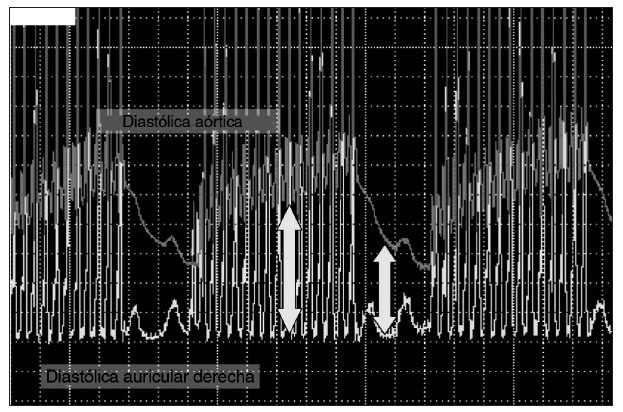
Proporción de compresiones:ventilaciónSe desconoce la proporción ideal de compresiones: ventilación en pacientes pediátricos. Estimaciones fisiológicas recientes60 sugieren que el grado de ventilación necesaria durante la RCP es mucho menor que la necesaria durante el ritmo de perfusión normal porque el gasto cardíaco sólo es un 10-25% del presente durante el ritmo sinusal normal. La proporción ideal de compre-siones:ventilaciones depende de muchos factores, incluida la tasa de compresión, el volumen corriente, el flujo sanguíneo generado por las compresiones y el tiempo en que se interrumpen éstas para efectuar ventilaciones. Una proporción de presión torácica/ventilación 15:2 distribuye la misma ventilación minuto que la RCPcon una proporción de presión torácica/ventilación 5:1 en un modelo de maniquí de RCP pediátrica, pero el número de compresiones torácicas distribuidas fue un 48% mayor con la proporción de 15:261,62. Las compresiones torácicas mantienen una mayor presión aórtica y presión de perfusión coronaria. Cuando las compresiones torácicas cesan, la presión aórtica disminuye rápidamente, lo que reduce la presión de perfusión coronaria (fig. 2). El aumento de la proporción de compresiones:ventilacio-nes reduce a un mínimo estas intervenciones, y, por lo tanto, aumenta el flujo sanguíneo coronario. Es preciso sopesar los beneficios de una ventilación de presión positiva (aumento del contenido arterial de oxígeno y eliminación de dióxido de carbono) frente a las consecuencias adversas de dificultar la circulación.
Fig. 2. Presión de perfusión coronaria (diastólica aórtica a diastólica auricular derecha).
Fármacos usados durante el paro cardíacoAunque los estudios efectuados en animales indican que la adrenalina puede mejorar la eficacia inicial de la reanimación tras paros cardíacos tanto por asfixia como por FV, ningún fármaco individual ha demostrado mejorar el resultado de supervivencia de un paro cardíaco pediátrico. Los fármacos de uso habitual para la RCP en niños son los vasopresores (adrenalina o vasopresina), antiarrítmicos (amiodarona o lidocaína), cloruro cálcico y bicarbonato sódico. Estos últimos son más probablemente beneficiosos durante circunstancias especiales de reanimación (p. ej., paro cardíaco prolongado, después de bypass, hiperpotasemia) pero la administración no selectiva de estos fármacos puede asociarse con peores resultados de supervivencia1,63.
Durante la RCP, el efecto alfaadrenérgico de la adrenalina aumenta la resistencia vascular sistémica, con un incremento de la presión arterial diastólica, que, a su vez, aumenta la presión de perfusión coronaria y el flujo sanguíneo y aumenta la probabilidad de RCE. La adrenalina también aumenta el flujo sanguíneo cerebral total durante la RCP de buena calidad porque la vasoconstricción periférica dirige una mayor proporción de flujo a la circulación cerebral64-66. Datos recientes de estudios efectuados en animales indican que la adrenalina puede reducir el flujo sanguíneo microcirculatorio cerebral local67. El efecto betaadrenérgico aumenta la contractilidad miocárdica y la frecuencia cardíaca y relaja el músculo liso en el lecho vascular del músculo esquelético y en los bronquios, aunque este efecto es de menos importancia. La adrenalina también aumenta la energía e intensidad de la FV, lo que incrementa la probabilidad de una desfibrilación satisfactoria. Durante la RCP, en dosis altas (0,05-0,2 mg/kg) mejora el flujo sanguíneo miocárdico y cerebral más que una dosis de referencia (0,01-0,02 mg/kg) y puede aumentar la incidencia de RCE inicial68,69. No obstante, los estudios prospectivos y retrospectivos han indicado que la administración de dosis altas en adultos o niños no mejora la supervivencia y puede asociarse con un peor resultado neurológico70,71. En un ensayo aleatorizado, controlado, enmascarado sobre administración de dosis altas de adrenalina de rescate, comparado con dosis de referencia, tras la dosis inicial administrada a pacientes pediátricos en paro cardíaco hospitalario, se demostró una peor tasa de supervivencia a las 24 h en el grupo tratado con dosis altas72 (uno de 27 comparado con seis de 23; p < 0,05).
La vasopresina es una hormona endógena de acción prolongada que actúa en receptores específicos mediando una vasoconstricción sistémica (receptor V1) y la reabsorción de agua en el túbulo renal (receptor V2). En los ensayos aleatorizados, controlados sobre paro hospitalario y extrahospitalario en adultos, la vasopresina tuvo una eficacia comparable a la de la adrenalina73,74. Durante un paro cardíaco pediátrico prolongado, su administración puede dar lugar a RCE cuando los fármacos de referencia han fracasado75. Se requiere investigación futura para evaluar con más detalle su eficacia administrada junto con adrenalina en el paro cardíaco pediátrico.
INTERVENCIONES POST-REANIMACIÓNControl de la temperatura corporalLa hipotermia leve inducida es el tratamiento post-re-animación para adultos más reciente y prometedor clínicamente, dirigido al objetivo. En dos artículos fundamentales se ha establecido76,77 que la hipotermia inducida (32-34 ºC) puede mejorar el resultado de adultos comatosos tras la reanimación de un paro cardíaco por FV. En ambos ensayos aleatorizados, controlados, los criterios de inclusión fueron pacientes mayores de 18 años de edad en coma persistente tras reanimación satisfactoria de FV no traumática. Es difícil la interpretación y extrapolación de estos estudios a niños. La fiebre después de paro cardíaco, traumatismo cerebral, ictus y otros procesos isquémicos se asocia con un mal resultado neurológico. En niños después de un paro cardíaco es frecuente la hipertermia78. Es razonable considerar que una hipotermia sistémica inducida leve puede beneficiar a niños reanimados de un paro cardíaco. No obstante, el beneficio de este tratamiento no se ha estudiado ni documentado rigurosamente en niños o en cualquier paciente con paro no debido a FV. Los ensayos efectuados en recién nacidos sobre enfriamiento cerebral selectivo y enfriamiento sistémico que empiezan a aparecer parecen prometedores en la encefalopatía hipó-xica-isquémica neonatal (EHI), lo que sugiere que la hipotermia podría mejorar el resultado79,80.
Soporte miocárdico post-reanimaciónEl aturdimiento miocárdico post-paro y el shock hipotensivo son frecuentes tras reanimación satisfactoria en animales, seres humanos adultos y niños y, en general, son reversibles entre los supervivientes a largo plazo. Este síndrome de aturdimiento miocárdico post-paro es fisiopatológicamente similar a la disfunción miocárdica relacionada con la sepsis y a la disfunción miocárdica tras bypass cardiopulmonar, incluido el aumento de mediadores inflamatorios y la producción de óxido nítrico. Aunque el tratamiento óptimo de la hipotensión y disfunción miocárdica post-paro cardíaco no se ha establecido, los datos sugieren que las medidas de soporte hemodinámico agresivas pueden mejorar el resultado. Los ensayos controlados efectuados en modelos animales han revelado que la dobutamina, milrinona o levosimendan pueden mejorar eficazmente la disfunción miocárdica post-paro cardíaco81-85. En estudios observacionales clínicos, se ha proporcionado reanimación con líquidos para pacientes con hipotensión y disminución concomitante de la presión venosa central, y se han administrado diversas infusiones de fármacos vasoactivos incluida adrenalina, dobutamina y dopamina para la disfunción miocárdica33,76,86-90. Además, las medidas de soporte circulatorio mecánico con OMEC comparado con ausencia de uso se asociaron con una mejora de la supervivencia en un estudio retrospectivo15. Los principios generales de cuidados críticos sugieren que los objetivos terapéuticos apropiados son una presión arterial adecuada y un flujo sanguíneo, miocárdico, cerebral y sistémico y aporte de oxígeno adecuados. Sin embargo, es difícil de establecer la definición de “adecuada”. Las intervenciones razonables del shock vasodilatador con presión venosa central baja incluyen reanimación con líquidos e infusiones de fármacos vasoactivos. Las consideraciones apropiadas para la disfunción miocárdica ventricular izquierda incluyen una euvolemia, infusiones de fármacos inotrópicos y una reducción de la pos-carga.
Control de la glucosaDespués de un paro cardíaco en un adulto la hiperglucemia se asocia con un resultado neurológico desfavorable después de un control para la duración del paro y la presencia de shock cardiogénico91. En modelos animales de asfixia y paro cardíaco isquémico, la administración de insulina y glucosa (pero no de glucosa sola) mejoró el resultado neurológico comparado con la administración de suero salino normal92. En niños no se dispone de datos de la titulación de criterios de valoración específicos basados en la evidencia.
RESULTADOS POST-REANIMACIÓN Y CALIDAD DE VIDALa información sobre factores pronósticos del resultado neurológico después de un paro cardíaco tanto en el adulto como pediátrico es limitada. Los obstáculos para evaluar el desenlace neurológico de niños después de un paro cardíaco incluyen el contexto del desarrollo en cambio constante que tiene lugar con la maduración cerebral. La predicción o pronóstico del estado neuropsicológico futuro es una tarea compleja, en particular después de una agresión neurológica aguda. Apenas se dispone de información sobre el valor predictivo de los exámenes neurológicos clínicos, estudios diagnósticos neurofisiológicos (electroencefalografía o potenciales evocados somatosensoriales), biomarcadores o estudios de diagnóstico por la imagen (tomografía computarizada, resonancia magnética [RM] o tomografía de emisión de positrones) en el resultado final después de un paro cardíaco u otras agresiones hipóxicas-isquémicas globales en niños. La tomografía computarizada no es sensible para detectar una lesión neurológica precoz. Todavía no está claro el valor de los estudios RM tras paro cardíaco pediátrico. Sin embargo, la RM con ponderación de difusión debería proporcionar información valiosa sobre la lesión hipóxica-isquémica en la fase subaguda y de restablecimiento. Los datos que están apareciendo sugieren que el patrón de descarga-supresión en el electroencefalograma después del paro es sensible y específico de un resultado neurológico desfavorable93. En un estudio se demostró que los potenciales evocados somatosensoriales fueron muy sensibles y específicos en pacientes pediátricos después de un paro cardíaco94. No obstante, en la población pediátrica no están estandarizados y son difíciles de interpretar. Muchos niños que experimentan un paro cardíaco presentan problemas neurológicos preexistentes sustanciales1. Por consiguiente, la comparación con la función neurológica previa al paro es difícil y añade otra dimensión/obstáculo a la evaluación y predicción del estado neurológico después del paro.
Los biomarcadores son instrumentos en desarrollo para predecir el resultado neurológico. En un estudio efectuado en adultos, los niveles séricos de enolasa específica de neurona (NSE) y proteína S100-B demostraron un valor pronóstico. Un nivel de NSE > 33 µg/l y un nivel de S100-B > 0,7 µg/l fueron muy sensibles y específicos de un resultado neurológico desfavorable95 (muerte o persistencia de la alteración de la consciencia). En un estudio efectuado en adultos se investigaron los patrones de secreción en pacientes después de un paro cardíaco que se sometieron a hipotermia terapéutica inducida. En el grupo de hipotermia una disminución de los niveles de NSE se asoció significativamente con un resultado favorable 6 meses después del paro96. En una investigación que examinó a nueve pacientes pediátricos después de un paro cardíaco se llegó a la conclusión de que el aumento de los niveles de S100-B podría asociarse con resultados desfavorables97. Recientemente, datos preliminares de un estudio que examinó los niveles de NSE y S100-B después de un paro cardíaco demostraron que el aumento de la primera se asocia con resultados neurológicos desfavorables cuando se determina 48 h después de la RCE98. Están en curso esfuerzos adicionales para determinar si los niveles de los biomarcadores después de un paro cardíaco pediátrico contribuirán a predecir el pronóstico en el futuro.
CIRCUNSTANCIAS DE REANIMACIÓN ESPECIALESFV pediátricaLa FV es un ritmo electrocardiográfico poco frecuente, pero no excepcional durante los paros cardíacos pediátricos extrahospitalarios. En dos estudios la FV se documentó como el ritmo inicial en el 19-24% de los paros cardíacos pediátricos extrahospitalarios tras la exclusión de las muertes por síndrome de la muerte súbita del lactante (SMSL). En los estudios que incluyeron víctimas del síndrome, la frecuencia disminuyó hasta unos límites del 6-10%; sin embargo, característicamente los pacientes SMSL se encuentran en asistolia porque han muerto mucho antes de la llegada de los servicios de urgencias médicas99. La incidencia de FV varía según el contexto y la edad100. En circunstancias especiales, tal como sobredosis de antidepresivos tricíclicos, cardiomiopatía, poscirugía cardíaca y síndromes QT prolongados, la FV es el ritmo más probable durante el paro cardíaco. La commotio cordis o la FV iniciada mecánicamente causada por un impacto en la pared torácica de energía relativamente baja, durante un intervalo estrecho de repolarización (10-30 milisegundos antes del pico de la onda T en modelos porcinos), se documenta predominantemente en niños de 4-16 años de edad. El paro cardíaco por FV extrahospitalaria es poco frecuente en lactantes pero afecta más a niños y adolescentes. Aunque la FV con frecuencia se asocia a una cardiopatía subyacente y, en general, se considera la “causa inmediata” del paro (es decir, paro arritmogénico), también puede desarrollarse “posteriormente” durante los esfuerzos de reanimación (es decir, después de un ritmo inicial de asistolia o AESP). La FV asociada a asfixia también está bien documentada entre pacientes pediátricos que son víctimas de un casi ahogamiento101. Tradicionalmente, la FV y la TV se han considerado ritmos de paro cardíaco “favorables” que se traducen en mejores resultados que la asistolia y la AESP. La supervivencia al alta es mucho más habitual entre niños con un ritmo desfibrilable inicial que entre niños en los que dichos ritmos se producen más tarde durante las maniobras de reanimación8. Los datos sugieren que los resultados tras FV/TV inicial son “favorables” pero que, después de FV/TV ulterior, son sustancialmente peores incluso comparado con una asistolia/AESP inicial sin FV/TV ulterior.
La desfibrilación (definida como la terminación de la FV) es necesaria para la reanimación satisfactoria de un paro cardíaco por FV. La terminación de la fibrilación puede dar lugar a asistolia, AESP o a un ritmo de perfusión. El objetivo de la desfibrilación es la reanudación de un ritmo eléctrico organizado con pulso. Cuando se proporciona desfibrilación inmediata poco después de la inducción de FV en el laboratorio de cateterismo cardíaco, las tasas de desfibrilación satisfactoria y supervivencia se acercan al 100%, y cuando se usan desfibriladores externos automáticos (DEA) al cabo de 3 min de FV en adultos, presenciada, la supervivencia a largo plazo es > 70%102,103. En general, la tasa de mortalidad aumenta en un 7-10% por cada minuto de retraso de la desfibrilación. Las compresiones torácicas inmediatas y eficaces, casi continuas, pueden atenuar el aumento incremental de la tasa de mortalidad con el retraso de la desfibrilación. Puesto que los paros cardíacos pediátricos suelen ser consecuencia de una asfixia progresiva y/o shock, el tratamiento inicial de elección es la RCP inmediata. Por lo tanto, se hace relativamente menos hincapié en el reconocimiento del ritmo que en el caso de los paros cardíacos en adultos. Cuanto antes pueda diagnosticarse la FV, más satisfactoriamente podrá tratarse.
Recientemente, se ha recomendado DEA para niños < 8 años de edad104,105; sin embargo, no hay pruebas suficientes que respalden o rechacen su uso en niños < un año de edad.
Consideraciones en el postoperatorio de las cardiopatías congénitasEl paciente postoperatorio cardíaco puede requerir reanimación debido a un estado persistente de bajo gasto cardíaco pero también puede experimentar una descompensación aguda, como un acontecimiento respiratorio, arritmia, episodio vagal asociado a la alimentación, oclusión del cortocircuito aortopulmonar, crisis hipertensiva pulmonar, o acontecimiento coronario. Durante las 6-18 primeras horas tras la aplicación de una pinza aórtica, se produce un estado de bajo gasto cardíaco que puede progresar hasta hipotensión, presión inadecuada de perfusión coronaria y paro cardíaco. Se ha demostrado que la milrinona reduce la incidencia de síndrome de bajo gasto cardíaco en lactantes y niños106. La hipoxemia persistente en un paciente con shunt bidireccional para corazón univentricular constituye una preocupación por la evolución a una trombosis del shunt. Si se sospecha, está justificada una heparinización sistémica para prevenir la trombosis continuada, el aumento de la resistencia vascular sistémica (bolos de suero y fenilefrina) para favorecer un mayor flujo anterógrado del shunt y un cateterismo cardíaco urgente para establecer un diagnóstico definitivo e instaurar una intervención.
Los pacientes con hipertensión pulmonar persistente e insuficiencia ventricular derecha asociada corren un alto riesgo de paro cardíaco. La presencia de una comunicación intraauricular puede contribuir a mantener el gasto cardíaco sistémico a expensas de la hipoxemia. Los aumentos de la presión intratorácica causados por la ventilación de presión positiva pueden dar lugar a una poscarga inaceptable en el ventrículo derecho, un gasto cardíaco inadecuado y, en último término, un paro cardíaco. La base de la reanimación siguen siendo los inhibidores de la fosfodiesterasa, la regulación del volumen de líquidos, el oxígeno y el bicarbonato sódico, y, específicamente para pacientes con hipertensión pulmonar, la administración de isoproterenol y óxido nítrico inspirado.
Prematuros y recién nacidosEn todo el mundo, alrededor de 4 millones de recién nacidos experimentan asfixia durante el parto, lo que se traduce en µun millón de muertes y un millón de supervivientes con secuelas neurológicas107. Más recientemente, la investigación sobre reanimación después de asfixia perinatal se ha centrado en cómo atenuar la lesión neurológica y la mortalidad con el uso de reanimación con aire ambiente o enfriamiento sistémico y/o del cráneo. La reanimación con aire ambiente se ha estudiado extensamente y puede reducir la tasa de mortalidad global pero carece de efecto sobre las tasas de EHI comparado con pacientes reanimados con oxígeno al 100%107-110. En 2005, el International Liaison Committee on Resuscitation afirmó que “no se dispone de pruebas suficientes para especificar la concentración de oxígeno que debe usarse al inicio de la reanimación”105. No se recomienda la hiperoxia debido al riesgo de lesión oxidativa111. Se requieren ensayos aleatorizados y enmascarados adicionales para obtener pruebas más concluyentes en las que basar las futuras recomendaciones.
Los estudios recientes que han evaluado la utilización de enfriamiento selectivo del cráneo después de asfixia perinatal para reducir la EHI no han demostrado un beneficio en el grupo con encefalopatía grave pero se ha observado un beneficio significativo en aquellos con una de grado moderado79. En un ensayo aleatorizado, controlado, que examinó el enfriamiento corporal total después de asfixia perinatal, se demostró una disminución de la mortalidad y discapacidad en pacientes con encefalopatía moderada y grave112. Las directrices de 2005 publicadas por la American Heart Association sobre cuidados cardiovasculares urgentes y RCP, redactadas antes de la publicación de los estudios previos, no recomendaban el enfriamiento debido a la ausencia de datos suficientes. Recientemente, en una revisión sistemática de ocho estudios se llegó a la conclusión de que, en la población víctima de una asfixia perinatal, el enfriamiento sistémico y craneal comparado con la normotermia no reduce las tasas de mortalidad ni mejora el resultado del desarrollo neurológico113. Están en curso estudios adicionales y el enfriamiento se usa en la práctica clínica105.
RCP OMECLa RCP OMEC es el uso de oxigenación por membrana extracorpórea venoarterial para restablecer la circulación y proporcionar reperfusión controlada después de paro cardíaco. Se han publicado estudios sobre resultados pero no se dispone de estudios prospectivos, controlados. No obstante, en estas series se han descrito resultados extraordinarios con el uso de OMEC como tratamiento de rescate de paros cardíacos pediátricos, en especial a partir de disfunción miocárdica postoperatoria aguda, potencialmente reversible, o arritmias6,114-118. En un estudio, 11 niños que experimentaron paro cardíaco en la UCIP después de cirugía cardíaca se sometieron a OMEC tras 20 a 110 min de RCP. De estos 11 niños, seis sobrevivieron a largo plazo sin aparentes secuelas neurológicas. Y lo que es más importante, Morris et al118 publicaron los resultados de un estudio efectuado en 66 niños sometidos a OMEC durante RCP. La duración mediana de ésta antes de establecerla fue de 50 min, aunque el 35% (23 de 66) de estos niños sobrevivieron al alta hospitalaria. Más recientemente, estos datos se han corroborado en un estudio retrospectivo a partir de la base de datos de la Extracorporeal Life Support Organization, que, durante un período de 13 años, caracterizó a 682 pacientes que recibieron RCP OMEC. Más de un tercio sobrevivieron al alta16. Específicamente para la población sometida a cirugía cardíaca, en pacientes sometidos a anastomosis bidireccional por corazón univentricular que recibieron medidas de soporte con OMEC se demostraron tasas de supervivencia al alta hospitalaria de µ39%18.
Aunque un mayor número de pacientes reciben RCP OMEC, la proporción de los tratados con esta técnica que sobreviven no ha aumentado, lo que implica potencialmente la importancia de seleccionar a pacientes con etiologías reversibles. Es importante destacar que los niños que sobrevivieron a RCP OMEC a pesar de medidas prolongadas de RCP experimentaron breves períodos de ausencia de flujo, una RCP excelente durante el período de bajo flujo y una fase post-reanimación bien controlada. La RCP y la OMEC no son tratamientos curativos. Son simplemente medidas de soporte cardiopulmonar que pueden permitir la perfusión tisular, la optimización del flujo microcirculatorio y la viabilidad hasta el restablecimiento del proceso patológico precipitante.
CALIDAD DE LA RCP E INTERVENCIONES DE REANIMACIÓNA pesar de las directrices basadas en la evidencia, de la extensa formación de los médicos y de su trayectoria en medicina de reanimación, en general, la calidad de la RCP deja mucho que desear. Las directrices recomiendan valores objetivo para parámetros seleccionados de RCP relacionados con la tasa y profundidad de las compresiones torácicas y ventilaciones, la evitación de intervalos sin RCP y la liberación completa de la presión esternal entre compresiones120. Por desgracia, en la práctica clínica, la norma son tasas de compresión lentas, una profundidad insuficiente de la compresión, y pausas sustanciales. Una estrategia de “compresiones intensas, rápidas, reducción a un mínimo de las interrupciones, permitir el retroceso torácico completo y no ventilar en exceso” puede mejorar notablemente la perfusión miocárdica, cerebral y sistémica y probablemente mejorar los resultados50. La calidad del tratamiento post-reani-mación también es decisivamente importante para mejorar la supervivencia33.
Recientemente, se ha vuelto a hacer hincapié en la evaluación de la calidad de la RCP y la evitación de la ventilación excesiva durante la reanimación de un paro cardíaco mediante el consenso del International Liaison Committee on Resuscitation y la American Heart Association121. Aunque es motivo de controversia la cantidad, momento, intensidad y duración correctos de la ventilación necesaria durante la RCP, está claro que es deseable determinar y titular el grado de ventilación con respecto al de perfusión sanguínea. Por lo tanto, una tecnología adicional segura, precisa y práctica mejoraría la detección y la respuesta de la “calidad de la RCP”.
Se ha desarrollado tecnología reciente que monitoriza la calidad de la RCP por medio de sensores de la fuerza y acelerómetros y puede proporcionar una respuesta verbal al responsable de administrar la RCP relativa a la frecuencia y profundidad de las compresiones torácicas y el volumen de las ventilaciones. Datos recientes en pacientes pediátricos ilustran que una formación intensiva y una respuesta correctora en tiempo real pueden contribuir a los objetivos específicos de edad de las directrices de RCP establecidos por la American Heart Association sobre calidad de la compresión torácica122. La mejora de la calidad del tratamiento post-reanimación es otra área fructífera para mejorar la asistencia del paro cardíaco. Los progresos en este ámbito pueden mejorar la supervivencia tras reanimación de un paro cardíaco33.
¿CUÁNDO DEBEN TERMINARSE LAS MANIOBRAS DE RCP?Diversos factores determinan la probabilidad de sobrevivir después de un paro cardíaco, incluido el mecanismo de éste (p. ej., traumático, asfíctico, progresión de un shock circulatorio), ámbito (p. ej., hospitalario o extrahospitalario), respuesta (es decir, presenciado o no presenciado, con o sin RCP practicada por un transeúnte), fisiopatología subyacente (es decir, cardiomiopatía, defecto congénito, toxicidad de fármacos o alteración metabólica), y la reversibilidad potencial de la enfermedad subyacente. Antes de tomar la decisión de terminar los esfuerzos de reanimación han de considerarse todos estos factores. Tradicionalmente la continuación de la RCP se ha considerado inútil después de 15 min o cuando se requieren > dos dosis de adrenalina123. En parte, gracias a la mejora de la calidad de la RCP y del tratamiento post-reanimación, es posible que los mejores resultados de los esfuerzos de RCP hospitalaria más allá de 15 min o dos dosis de adrenalina sean cada vez más la norma1,7. Los datos sobre RCP OMEC descritos previamente16,114,115,119,124 destacan el potencial de resultados excelentes a pesar de maniobras prolongadas de RCP. Al contrario, la decisión de interrumpir prematuramente la RCP es definitiva y no puede revocarse. En la primera década del siglo XXI, no tenemos una respuesta simple a la importante pregunta clínica de cuándo interrumpir la RCP.
PROBLEMAS ESPECIALES EN LA SIMULACIÓN, EDUCACIÓN AVANZADA E IMPLEMENTACIÓN DE PROGRAMASLos conceptos de formación justo a tiempo y justo en el lugar se desarrollaron en función de los estudios y revisiones recientes de expertos para la formación en reanimación. La formación justo a tiempo es el adiestramiento en habilidades psicomotoras específicas, tal como la reanimación y tratamiento de la vía respiratoria, justo antes de que sea probable que se usen (es decir, antes de la intubación endotraqueal electiva o mientras se espera la llegada del niño en paro cardíaco). La formación justo en el lugar enseña a los médicos habilidades específicas en el lugar donde las usarían. Las habilidades psicomotoras y la función del equipo son las habilidades primarias necesarias durante la reanimación; sin embargo, éstas se deterioran al cabo de 6 semanas de la formación en reanimación125. La formación de recuerdo justo a tiempo y justo en el lugar parece razonable para mejorar el rendimiento operativo y la seguridad de los pacientes. Esta formación puede incorporar algunas de las ventajas de la simulación (p. ej., habilidades para planificar y modelar oportunidades de formación), proporcionar un entorno seguro tanto para pacientes como para estudiantes, brindar la oportunidad de prepararse para los acontecimientos clínicos poco frecuentes pero complicados y la de representaciones repetidas126 (práctica). DeVita et al127 evaluaron la eficiencia de la formación del equipo de código (equipo de gestión de la crisis) con maniquís de simulación adultos de alta precisión. Determinaron la supervivencia del maniquí en un escenario simulado y la tasa de tareas completadas como variables de resultado en tres sesiones de formación simuladas. El rendimiento del equipo demostró una mejora en la supervivencia de simulación global y de las tasas de tareas completadas desde un 0 a un 90% y desde un 31 a un 89%, respectivamente. Hunt et al128,129 usaron una simulación de paro cardíaco y códigos simulados de estabilización de traumatismos para identificar satisfactoriamente las deficiencias en el tratamiento de niños con paros cardíacos y traumatismos. Es probable que estas simulaciones determinen la implementación de la reanimación en el futuro.
DIRECCIONES FUTURAS Y OBSTÁCULOS POTENCIALESLos fascinantes nuevos estudios epidemiológicos, como el National Registry of Cardiopulmonary Resuscitation de los paros cardíacos hospitalarios, y el estudio multicéntrico, a gran escala, sobre paros extrahospitalarios Resuscitation Outcome Consortium, financiado por el National Heart, Lung and Blood Institute, proporcionan nuevos datos para orientar las estrategias de reanimación y generar hipótesis que contribuyan a mejorar los resultados. Los datos epidemiológicos del Resuscitation Outcome Consortium se obtienen en pacientes de todas las edades pero los estudios intervencionistas iniciales sólo reclutan a pacientes > 15 años de edad. Es cada vez más evidente que, en general, tanto en ámbitos extrahospitalarios como hospitalarios no se proporcionan medidas excelentes de soporte vital básico. Los progresos técnicos innovadores, como la respuesta directiva y correctiva proporcionada en tiempo real, pueden aumentar la probabilidad de un soporte vital básico eficaz. Además, la formación dinámica de un equipo y la información del rendimiento pueden mejorar sustancialmente la autoeficacia y la implementación funcional. Las intervenciones mecánicas, como la OMEC u otros sistemas de bypass cardiopulmonar, ya son modalidades habituales durante los paros cardíacos hospitalarios prolongados. Es probable que los progresos técnicos mejoren todavía más nuestra capacidad para proporcionar dicho soporte mecánico.
Antaño, el concepto de recomendaciones para el paro cardíaco pediátrico basadas en la evidencia parecía fantasioso. Las recomendaciones se basaban en datos extrapolados de estudios efectuados en animales y en seres humanos adultos. Se han iniciado ensayos clínicos sobre paro cardíaco pediátrico con dosis altas de adrenalina comparado con dosis de referencia como tratamiento de rescate de paros cardíacos pediátricos hospitalarios. Se requieren ensayos clínicos para efectuar recomendaciones apropiadas basadas en la evidencia para el tratamiento del paro cardíaco pediátrico. Es probable que la evolución de sistemas, como los “centros de paro car díaco”, similares a los centros de traumatología, ictus e infarto de miocardio, facilite los cuidados intensivos apropiados para niños que requieren asistencia post-rea-nimación especializada.
CONCLUSIONESLos resultados del paro cardíaco y la RCP pediátricos parecen estar mejorando. La evolución de la práctica clínica para integrar la fisiopatología y el momento, intensidad, duración y variabilidad de la agresión hipóxi-ca-isquémica puede dar lugar a un tratamiento más específico del paciente y dirigido al objetivo específico de tiempo, al igual que mejores resultados. Los fascinantes descubrimientos en los laboratorios de ciencia básica y aplicada están en el horizonte inmediato para las subpoblaciones específicas de víctimas de paros cardíacos. Prestando estratégicamente atención al tratamiento de la fase específica del paro cardíaco y de la reanimación y la fisiopatología en evolución, constituye una gran promesa que las intervenciones de cuidados críticos muestren el camino de una reanimación cardiopulmonar y cerebral más satisfactoria en niños.
Conflictos de interés: los Dres. Berg y Nadkarni reciben ayudas sin restricciones para investigación de los National Institutes of Health y una beca de investigación sin restricciones de la Laerdal Foundation for Acute Care Medicine; la Dra. Topjian no ha declarado conflictos de interés.
Correspondencia: Alexis A. Topjian, MD, University of Pennsylvania School of Medicine, Critical Care and Pediatrics, Department of Anesthesia and Critical Care Medicine, Chil-dren’s Hospital of Philadelphia, 34th Street and Civic Center Boulevard, Filadelfia, PA, 19104, Estados Unidos.
Correo electrónico: topjian@email.chop.edu