Las infecciones febriles de las vías urinarias (IVU) se consideran las más habituales de las infecciones bacterianas importantes de la lactancia y la primera infancia en el mundo desarrollado1. El 15% de los casos se asocia con cicatrización renal2, que es responsable de las consecuencias médicas a largo plazo3-5 (proteinuria, hipertensión, lesión renal crónica). La frecuencia de la reinfección durante el primer año tras una IVU se ha estimado en hasta el 30%6-8. Se ha utilizado ampliamente la profilaxis antibiótica pese a la debilidad de las pruebas en apoyo de su eficacia.
En 3 estudios (n = 153) de los años setenta, la administración de antibióticos a largo plazo (de 10 semanas a 12 meses) disminuyó el riesgo de reiterados urinocultivos positivos (riesgo relativo [RR]: 0,4 [intervalo de confianza –IC– del 95%: 0,26-0,62]) comparado con el placebo o la ausencia de profilaxis9-11. Sólo un estudio informó de un aumento del riesgo (RR: 1,93 [IC 95%: 0,63-5,92]) de recurrencia de IVU sintomática en los 27 niños que recibieron profilaxis respecto a los 32 que recibieron placebo9. En estos 3 ensayos, la población de estudio (principalmente chicas y unos pocos pacientes con anomalías de las vías urinarias) fue pequeña y no reflejó la población pediátrica a la que se suele administrar la profilaxis. No se tuvo en cuenta la resistencia bacteriana.
Un estudio aleatorizado12 no apoyó el papel de la profilaxis para disminuir la frecuencia de las IVU en los pacientes con pielonefritis aguda. Este ensayo demostró que el empleo de una profilaxis antibiótica no sólo era ineficaz, sino también nociva: en los niños con reflujo vesicoureteral (RVU) se observaron IVU agudas recurrentes en 7 de los 55 pacientes, frente a sólo 1 de los 58 pacientes con profilaxis (p = 0,0291). En los 7 casos, la bacteria agresora mostró resistencia al antibiótico utilizado para la profilaxis. En este estudio, el tratamiento antimicrobiano del episodio agudo no estuvo normalizado, no se realizó análisis por intención de tratamiento (ITT) y la gama de edad fue muy amplia. Realizamos un ensayo controlado, aleatorizado, de no inferioridad, para determinar si la ausencia de profilaxis en los niños de 2 meses a 7 años de edad tras una primera IVU febril, con o sin presencia de un RVU no intenso, es similar a la profilaxis antimicrobiana durante 12 meses en la disminución de la recurrencia de las IVU febriles.
MÉTODOSEl estudio es un ensayo sin ocultación, multicéntrico, aleatorizado, controlado, de grupos paralelos. Inicialmente fue diseñado como un ensayo de 3 grupos y posteriormente se convirtió en un estudio de no inferioridad entre 2 grupos. Fue realizado entre mayo de 2000 y agosto de 2006 en 22 unidades pediátricas situadas en el noreste de Italia, y coordinado por la Unidad de nefrología, diálisis y trasplante del Departamento de Pediatría de Padua. Cada uno de los comités de Ética de los centros participantes aprobó el protocolo. Los padres de cada niño firmaron un consentimiento informado antes de su participación.
Criterios de inclusión y exclusión de los pacientesLa población de estudio se reclutó de los niños con un primer episodio de IVU febril, con o sin RVU primario no intenso (de primer a tercer grado). El reclutamiento se limitó a los niños de 2 meses a 7 años de edad con función renal normal13. Los criterios de exclusión fueron las malformaciones urológicas complejas, el daño renal intenso (función relativa de un riñón en la gammagrafía con ácido dimercaptosuccínico [DMSA] < 30%).
El diagnóstico de una primera IVU febril a la presentación se estableció por la presencia de fiebre µ38 ºC, piuria (2 resultados consecutivos del ensayo concordantes con µ25 leu-cocitos/µl) y urinocultivo (2 pruebas consecutivas concordantes con crecimiento de µ100.000 colonias de un solo microorganismo/ml). La orina se tomó con una bolsa de orina estéril; fueron necesarios 2 análisis de orina y urinocultivos consecutivos concordantes para reducir al mínimo el riesgo de falsos positivos. Los niños también debieron tener al menos 2 de los siguientes signos: fiebre µ38 ºC, aumento de los índices inflamatorios en las primeras 48 h (velocidad de sedimentación globular µ30 mm en la primera hora o proteína C reactiva µ3 veces superior al límite superior del valor normal, o ambos) y recuento de neutrófilos por encima de los valores normales para la edad.
Estudios por la imagenAntes de la asignación aleatoriaSe realizaron la ecografía y la gammagrafía renal con DMSA durante los 10 días siguientes al inicio del tratamiento antibiótico de la IVU febril. Las áreas focales o difusas de hipocaptación en la primera gammagrafía con DMSA, sin evidencia de pérdida cortical, se consideraron indicadores de pielonefritis aguda.
La cistouretrografía miccional (CUMS; radiología, con 1 llenado) se realizó antes de transcurridos 2 meses de la IVU.
Tras la asignación aleatoriaLa repetición de la gammagrafía con DMSA se planificó a los 12 meses de la asignación aleatoria o, cuando se produjo un nuevo episodio de IVU febril, al menos 6 meses después de la infección. La cicatrización renal fue definida como una disminución de la captación con distorsión de los contornos o como el adelgazamiento cortical con pérdida del volumen parenquimatoso. Dos médicos especializados, que desconocían los resultados de la prueba de los pacientes, interpretaron de forma independiente las gammagrafías. Las discrepancias se resolvieron mediante un análisis conjunto de los asesores.
Tratamiento antibiótico de la IVU febrilEl tratamiento antibiótico de la IVU inicial fue ceftriaxona intravenosa durante 3 días, seguida de amoxicilina/clavulánico por vía oral durante 7 días o sólo tratamiento oral con amoxici-lina/clavulánico durante 10 días. Tras finalizar el tratamiento, todos los niños recibieron profilaxis hasta realizar la VUCG.
Asignación aleatoriaEl esquema de asignación aleatoria fue generado informática-mente por el centro coordinador. La asignación aleatoria, 1:1:1 para los 3 grupos, fue estratificada por centro, sexo y grupo clínico según la presencia o ausencia de RVU y de localización parenquimatosa de la IVU aguda. Hubo 3 grupos: 1) DMSA aguda positiva sin RVU, 2) DMSA aguda negativa con RVU y 3) DMSA aguda positiva con RVU. Cada centro participante recibió 6 series con códigos de asignación. Las series fueron de uno para cada grupo, y cada serie contuvo 12 sobres opacos sellados. Cada sobre estuvo numerado con una cifra secuencial. Cada uno de los centros participantes asignó al niño incluido a un estrato (según el sexo y el grupo clínico). Luego se otorgó el código de asignación para ese niño, abriendo el siguiente sobre de ese estrato.
En la segunda parte del estudio se generó automáticamente un esquema de asignación aleatoria 1:1, estratificada como antes, que se mantuvo en el centro coordinador. Tras asignar al niño a un estrato, los centros recibieron la asignación a tratamiento del centro coordinador. Antes y durante el estudio se organizaron reuniones de investigadores para unificar la buena práctica clínica.
Intervenciones del estudioLos pacientes incluidos fueron asignados al grupo A, sin profilaxis, o al grupo B, profilaxis (cotrimoxazol o amoxicilina/cla-vulánico, ambos a una dosis de 15 mg/kg y día). Se realizaron urinocultivos ambulatorios mensuales durante los 6 primeros meses y luego cada 2 meses; las visitas ambulatorias fueron a los 6 y 12 meses. La DMSA pautada a los 12 meses finalizó el seguimiento de todos los pacientes. Los niños que experimentaron 2 IVU febriles recurrentes fueron pasados a la profilaxis si estaban asignados a la ausencia de profilaxis, y a otro antibiótico o fueron remitidos a cirugía del RVU cuando ya había estado asignado a la profilaxis. Los datos recogidos fueron los signos y síntomas de la IVU (análisis de orina, urinocultivo), el cumplimiento del tratamiento y los efectos adversos y la resistencia al antibiótico profiláctico en los urinocultivos positivos. El cumplimiento se evaluó mediante la actividad antimicrobiana en la orina en los urinocultivos de rutina y mediante un cuestionario con una escala analógica visual de la evaluación de los padres de la “dificultad” de seguir el tratamiento.
Mediciones del resultadoEl resultado principal fue la primera recurrencia de IVU febril en los 12 meses siguientes a la asignación aleatoria. La IVU recurrente estuvo definida por la presencia de fiebre (> 38 ºC), piuria y urinocultivo, como se indica en los criterios de inclusión. Así pues, las recurrencias adicionales y los cambios de grupo no se contaron como “fallos” por sí mismos.
El resultado secundario fue la tasa de nuevas cicatrices renales, definidas como cicatrización, en un lugar distinto al de la pielonefritis inicial, al cabo de 12 meses. También se realizaron análisis exploradores para valorar el riesgo de repetir los urinocultivos positivos y la tasa de cicatrización en el punto de la infección inicial como posibles resultados.
Diseño del estudio y tamaño de la muestraEl estudio fue diseñado como un ensayo controlado, aleatorizado, sin ocultación, de 3 grupos paralelos, que comparó la ausencia de profilaxis, la profilaxis con cotrimoxazol y la profilaxis con amoxicilina/clavulánico. Se planeó una primera comparación entre la ausencia y la presencia de profilaxis, con una segunda comparación entre los 2 antibióticos si la profilaxis mostrara un mejor resultado.
El estudio trató de incluir a 660 pacientes con una proporción1:1:1 entre los 3 grupos. La inclusión fue más lenta que lo pre-visto, y alcanzó los 237 pacientes en agosto de 2003 (asignados de forma pareja a la ausencia de profilaxis, a cotrimoxazol o a amoxicilina/clavulánico). Así, según la recomendación del Data and Safety Monitoring Committee de procurar poder finalizar la inclusión en un período razonable de tiempo, decidimos modificar el diseño del estudio, manteniendo el objetivo principal (comparación entre profilaxis y ausencia de profilaxis) y abandonando la comparación entre los 2 regímenes antibióticos.
El nuevo tamaño de la muestra para el ensayo de no inferioridad entre 2 grupos se calculó en 313 pacientes (redondeado a 340, por los posibles abandonos), fijando la potencia al 70% y el error µen 0,05 (unilateral), manteniendo la suposición de una incidencia de recurrencia del 20%, y considerando un límite superior de confianza del 30% para la no inferioridad en el brazo sin profilaxis, con una razón final esperada de 1:1:5.
Análisis estadísticoEn el análisis por ITT se consideraron 2 situaciones para los pacientes que abandonaron el estudio (por pérdida de seguimiento): 1) todos “fallos” y 2) todos “éxitos”. La comparación de eficacia entre la “profilaxis” y la “ausencia de profilaxis” se realizó teniendo en cuenta las diferencias entre los tratamientos y el IC 95% de esta diferencia. Las medidas binomiales del resultado se estudiaron mediante el test µ2(test de Fisher y test de Pearson); las medidas numéricas del resultado se estudiaron mediante el test t de Student o el test de Mann-Whitney, según fuera oportuno. Se realizó un análisis multivariado de supervivencia mediante el modelo de riesgos proporcionales de Cox. Estos análisis de supervivencia se integraron mediante la evaluación de las curvas de Kaplan y Meier, los tests de long-rank, el test de Wilcoxon, o una combinación de ellos, para detectar diferencias significativas en las curvas. El número de pacientes a ser tratados se calculó como se indicó anteriormente14.
Para el análisis estadístico se utilizó el paquete informático Stata 9.0 (Stata Corp, College Station, TX). Se realizó un análisis secundario que comparó la eficacia del tratamiento profiláctico en los subgrupos de pacientes definidos por la edad, el sexo y el grado de reflujo.
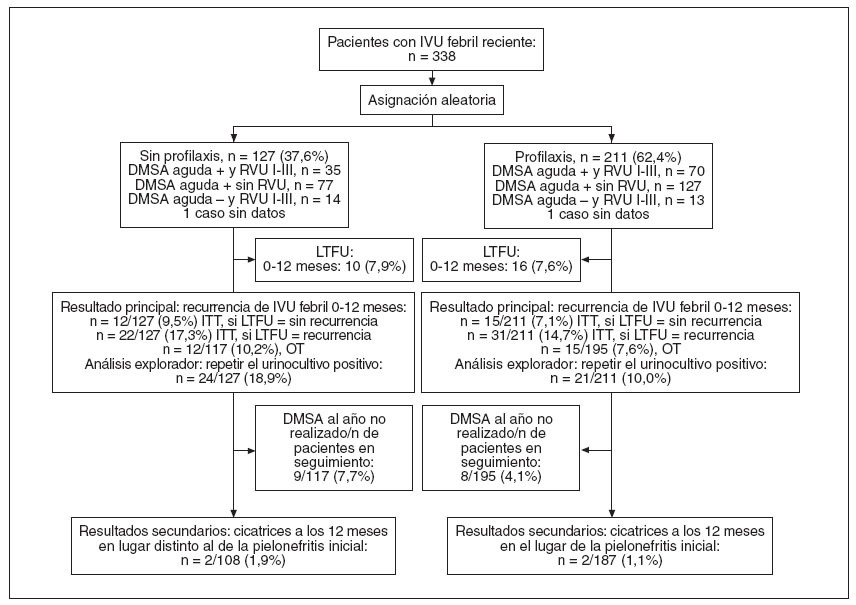
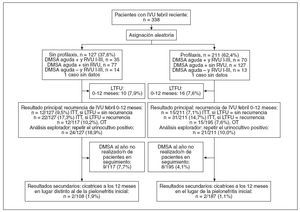
RESULTADOSEntre julio de 2000 y septiembre de 2005, 22 centros incluyeron y asignaron aleatoriamente a 338 pacientes: 127 (37,6%) a la ausencia de profilaxis y 211 (62,4%) a profilaxis (113 [54%] a amoxicilina/clavulánico y 98 [46%] a cotrimoxazol). La razón final de aleatorización fue 1:1,7 (esperada 1:1,5). El seguimiento finalizó en agosto de 2006. Tres pacientes fueron incluidos por error (2 no completaron el estudio de detección sistemática; y otro era mayor de 7 años). El seguimiento del protocolo fue bueno: los 26 pacientes con pérdida de seguimiento estaban igualmente distribuidos en los 2 brazos (10 [7,9%] de 127 y 16 [7,6%] de 211). En la figura 1 se observa la asignación de pacientes y el cumplimiento del protocolo.
Fig. 1. Diagrama del flujo de pacientes. DMA: ácido dimercaptosuccínico; ITT: intención de tratamiento; IVU: infecciones febriles de las vías urinarias; LTFU: pérdida de seguimiento; OT: análisis durante el tratamiento; RVU: reflujo vesicoureteral.
La infección aguda fue tratada con antibióticos intravenosos iniciales en 151 (45%) pacientes y con tratamiento oral completo en 183 (55%), desconocido en 4. La distribución del tratamiento oral y el intravenoso fue similar en los 2 grupos (p = 0,22). Todos los niños recibieron un régimen profiláctico de amoxicilina/clavuláni-co hasta realizar la CUMS, durante una mediana (rango intercuartil [RIC]) de 40 días (33-50); ausencia de profilaxis: 40 (32-51); profilaxis: 41 (34-50). Las características iniciales de los niños asignados aleatoriamente a los 2 grupos fueron similares (tabla 1).
TABLA 1. Características iniciales
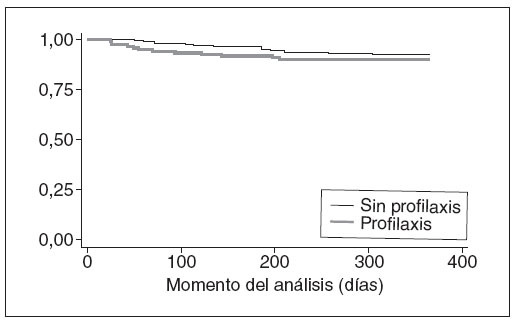
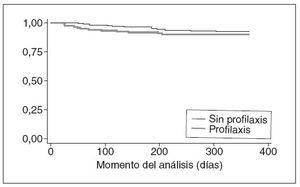
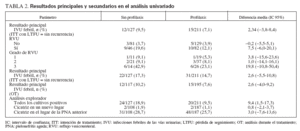
Resultado principalLas IVU febriles no fueron significativamente distintas entre los 2 grupos durante el seguimiento: 12 (9,45%) de 127 en el grupo sin profilaxis y 15 (7,11%) de 211 (diferencia de riesgo: 2,34% [IC 95%: 3,8-8,4%]; tabla 2). Estos resultados siguen siendo ciertos al estratificar a los pacientes por el grado de RVU (tabla 2). Estos datos se obtuvieron en el análisis por ITT, considerando a los pacientes con pérdida de seguimiento antes de la visita de los 12 meses como libres de recurrencia. En la figura 2 se observan los datos como una curva de Kaplan y Meier del intervalo sin episodios. La mediana del intervalo (RIC) hasta las recurrencias febriles fue de 113 días (57-192), sin diferencia significativa entre los 2 grupos (test de long-rank, p = 0,36). Encontramos resultados similares al contar a todos los pacien-tró que la tasa de urinocultivo positivo reiterado y de tes con pérdida de seguimiento como si hubieran tenido análisis de orina concomitante positivo fue significativa-una recurrencia durante los 12 meses y con un análisis mente distinta entre los 2 grupos: 24 (18,9%) de 127 sin del tratamiento (tabla 2). El análisis explorador demos-profilaxis y 20 (9,5%) de 211 con profilaxis (p = 0,02).
Fig. 2. Curva de Kaplan y Meier del intervalo libre hasta el episodio (IVU febril).
TABLA 2. Resultados principales y secundarios en el análisis univariado
El análisis bivariado tuvo en cuenta la edad, el sexo, el grado de RVU, el tratamiento de la IVU inicial (oral frente a intravenoso) y la profilaxis: la menor edad y el grado de RVU se asociaron con la recurrencia de la IVU febril. La edad media fue de 7,1 meses, frente a 14,6, en los niños con recurrencia frente a los libres de ella (p = 0,02). La tasa de recurrencia aumentó con el grado de RVU, desde 8 (3,8%) de 210 pacientes son RVU a 2 (6,7%) de 30, 5 (8,6%) de 58 y 12 (30%) de 40 pacientes con RVU de grado I, II y III, respectivamente (p < 0,01). En el modelo de riesgos proporcionales de Cox, la ausencia de profilaxis no fue un factor de riesgo de recurrencia de la IVU febril; la mayor edad se confirmó protectora y el reflujo de grado III como factor de riesgo (tabla 3). El número de pacientes a tratar para evitar una recurrencia febril fue de 41,7 niños durante 1 año.
Resultados secundariosEl 87% (295) de los pacientes incluidos se sometió a una gammagrafía con DMSA al año, con una mediana (RIC) del intervalo hasta DMSA de 351 días (329-385) tras la inclusión. Se encontró una nueva cicatriz renal (en un lugar distinto al de la pielonefritis inicial) en 4 (1,4%) de 295 pacientes (tabla 2); las nuevas cicatrices se produjeron en un riñón sin reflujo, un riñón con reflujo de grado II y 2 riñones con reflujo de grado III. No se encontró diferencia entre la ausencia (2 [1,9%] de 108) y la presencia de profilaxis (2 [1,1%] de 187; diferencia de riesgo: 0,8% [IC 95%: –2,1%-3,7%]). El análisis explorador encontró resultados similares al comparar la tasa de cicatrices en el asiento de la primera pielonefritis: 31 (28,7%) de 108 frente a 48 (25,7%) de 187 (tabla 2) y al considerar la tasa de nuevas cicatrices en los niños con recurrencias (2 [17%] de 12 sin profilaxis y 2 [13%] de 15 con profilaxis).
UrinocultivosSe realizaron 2.422 urinocultivos y análisis de orina de rutina. La causa de 27 recurrencias fue similar en los 2 grupos, y se atribuyó a Escherichia coli en 19 (70%) de 27, Proteus mirabilis en 2 de 27 (7%), Enterobacter en 2 de 27 (7%); Pseudomonas aeruginosa, Klebsiella oxytoca, Klebsiella pneumoniae y Citrobacter en 1 (4%) de 27 cada uno. Ocho de las 9 recurrencias atribuidas a bacterias resistentes correspondieron al grupo de profilaxis, y la que pertenecía al grupo sin profilaxis se produjo en un niño que había sido trasladado a profilaxis. Las bacterias resistentes aisladas fueron E. coli en 6 casos y P. mirabilis, Enterobacter y K. pneumoniae en 1 caso cada uno.
Otros antibióticos utilizadosCuarenta y cinco de 338 pacientes cambiaron el grupo o antibiótico asignado: 9 asignados a ausencia de profilaxis cambiaron a profilaxis (7 por recurrencia de la IVU, 2 por razones desconocidas); 15 cambiaron de amoxicilina/clavulánico a otros antibióticos y 3 la abandonaron; 12 pasaron de cotrimoxazol a otro antibiótico y 6 lo abandonaron. Un paciente se sometió a intervención quirúrgica por el RVU.
CumplimientoSe estudió la actividad antimicrobiana en 340 de los 851 urinocultivos del grupo sin profilaxis y en 578 de 1.571 en el de profilaxis: 10 (2,9%) y 411 (71,1%), respectivamente, fueron positivos. El cumplimiento informado (cuestionario de escala analógica visual) fue bueno en el 86% de los pacientes.
Acontecimientos adversosVeinticinco (7,3%) niños experimentaron efectos adversos menores durante los 12 meses de seguimiento. Todos los pacientes estaban en profilaxis: 15 con amo-xicilina/clavulánico y 10 con cotrimoxazol. Los acontecimientos adversos fueron principalmente vómitos o intolerancia gastrointestinal.
ANÁLISISLos niños con IVU febril, RVU, o ambas patologías, suelen recibir antibióticos profilácticos pese a no haber pruebas de que este enfoque proteja contra la cicatrización renal o las complicaciones médicas a largo plazo6,15. Además, la resistencia bacteriana a antibióticos se está convirtiendo en un importante tema mundial, reconociéndose cada vez más el consumo de antibióticos como la principal fuerza productora de esta resistencia16,17. Un estudio demostró que los niños fueron los principales consumidores de antibióticos, con tasas de consumo 3 veces mayores que la de los pacientes mayores, lo que aumenta su exposición al riesgo de resistencia bacteriana18. En consecuencia, en nuestro estudio, el mayor riesgo de resistencia correspondió al grupo de profilaxis; por lo tanto, el posible beneficio de los antibióticos debe sopesarse con el alto riesgo de seleccionar las bacterias resistentes.
Según nuestra definición de no inferioridad, este estudio demostró que, durante un período de 12 meses, la ausencia de profilaxis no tuvo mayor riesgo de IVU febril recurrente que la profilaxis. Al finalizar el estudio se había incluido a 338 niños, lo que dio una razón final de aleatorización de 1:1,7 y ofreció, posthoc, una potencia del 72%, frente al 70% pretendido. El número de niños con pérdida de seguimiento fue pequeño (7,7% en el seguimiento a los 12 meses) y tuvo una distribución uniforme entre los 2 grupos del estudio. Esto, junto con el escaso número de IVU febriles recurrentes, hace poco probable que los datos omitidos pudieran influir sobre la diferencia de riesgo de la tasa de recurrencia. Una debilidad de nuestro estudio es que no fue de doble ocultación ni controlado con placebo. Creemos que el diseño de nuestro estudio no permite grandes sesgos, ya que tiene resultados objetivos: el diagnóstico de IVU recurrente tiene criterios precisos, los pacientes y sus médicos recibieron las adecuadas instrucciones para sospechar las infecciones recurrentes y la presencia de cicatrices fue evaluada a ciegas por 2 especialistas.
Los resultados de nuestros estudios están de acuerdo con el estudio de Garin et al12 en la ausencia de beneficio de la profilaxis y al detectar la mayor prevalencia de resistencias en el grupo de profilaxis. De todas maneras, en nuestro estudio, los niños con reflujo de grado III y sin profilaxis experimentaron un mayor número de infecciones recurrentes, aunque no son estadísticamente significativas, mientras que, en el estudio de Garin et al12, el tratamiento no sólo fue ineficaz, sino incluso nocivo. Es necesario realizar más investigaciones, diseñadas específicamente, sobre una población mucho mayor con reflujo.
Existe un número significativamente mayor de urinocultivos positivos repetidos en el grupo sin profilaxis (diferencia media: 9,4 [IC 95%: 1,5-17,3]), lo que ha sido la fuerza impulsora del empleo de antibióticos profilácticos; sin embargo, creemos que los repetidos urinocultivos positivos, en ausencia de fiebre u otros síntomas de localización parenquimatosa de la infección, no son clínicamente relevantes y no producen cicatrices renales. Así lo confirma que el número de nuevas cicatrices es escaso: 1,4%. Vale la pena destacar que es el primer estudio en distinguir entre las cicatrices como consecuencia de las infecciones repetidas y las que son consecuencia de la pielonefritis inicial. Estas últimas son mucho más frecuentes (70 [27%] de 295). Estos resultados de la primera IVU no están relacionados con la profilaxis ni difirieron entre los 2 grupos de estudio. Aunque el riesgo de IVU febril repetida es del 8,3% anual en nuestra población, lo que concuerda con un reciente estudio de cohorte19 que demostró una recurrencia anual del 12%, el riesgo de daño renal por las infecciones repetidas es muy escaso y, por sí mismo, no justifica la necesidad de profilaxis en nuestra población.
La profilaxis se asoció con un mayor número de IVU febril como consecuencia de la resistencia bacteriana. Cotrimoxazol y amoxicilina/clavulánico son 2 antibióticos antiguos y utilizados con frecuencia en nuestra área. Los nuevos antibióticos, con un mejor perfil de resistencias, podrían haber permitido un menor número de recurrencias en el grupo de profilaxis.
Vale la pena recordar que, según el protocolo, todos los niños se mantuvieron en profilaxis hasta la cistografía (mediana: 40 días) desde la infección aguda; por lo que carecemos de datos sobre un protocolo totalmente carente de profilaxis, y no podemos comentar el papel de la profilaxis antibiótica en la prevención de las infecciones durante este período temprano tras la IVU. El estudio demuestra que la profilaxis, realizada durante µ1 mes en todos los niños, puede retirarse luego con seguridad. El estudio recién publicado de Garin et al12 parece no tener esta fase de tratamiento. En todo caso, el artículo no comenta las repetidas IVU durante este período sin profilaxis y si se excluyó a algún paciente del ensayo por infecciones antes de la CUMS. Para contar con recomendaciones adicionales sobre el papel de un régimen totalmente libre de profilaxis, necesitamos otro estudio para comparar la retirada del antibiótico inmediatamente después de finalizar el tratamiento.
Según el análisis multivariado, el reflujo de grado III constituye el único factor de riesgo de recurrencia de la IVU febril. La ausencia de profilaxis no es un factor de riesgo. Como era de esperar, el aumento de la edad protege de las recurrencias (tabla 3). Es interesante que un estudio reciente19 demostró, en los modelos multivariable de Cox del intervalo hasta el episodio, que los factores asociados con el aumento del riesgo de IVU recurrente incluyeron a pacientes de 3 a 55 años de edad y mayores grados de RVU (IV-V). La profilaxis no se asoció con una disminución del riesgo de IVU recurrente, pero fue un factor de riesgo de resistencia antimicrobiana.
Nuestra población de estudio constó de niños sin distinción de sexo, < 7 años de edad, principalmente (309 de 366) con una localización parenquimatosa renal de la infección documentada. Ciento veintiocho (28%) de 336 tuvo un RVU primario de grados I a III. Los criterios de exclusión fueron trastornos de las vías urinarias como consecuencia de malformaciones urológicas complejas, gammagrafía con DMSA que muestra una función relativa de un riñón < 30%, y RVU de grados IV y V. Estos criterios se evaluaron rutinariamente en la práctica clínica al considerar la profilaxis, lo que significa que los resultados de este estudio son fácilmente aplicables.
Excluimos a los niños con reflujo de grado IV a V, hipodisplasia renal mono o bilateral, o ambas alteraciones, porque consideramos a estos niños en particular riesgo de infecciones repetidas y de daño renal. Nuestras conclusiones no se aplican a los niños con mayores grados de reflujo. Sin embargo, esto abre el debate sobre la necesidad de la CUMS rutinaria en primer lugar para los niños con una ecografía renal normal y una primera IVU febril, que tienen una probabilidad muy escasa de padecer un reflujo de gran grado.
CONCLUSIONESNuestro estudio demuestra que la profilaxis no disminuye la tasa de recurrencia de la IVU febril durante 12 meses tras el primer episodio de IVU febril en los niños con o sin un reflujo primario no intenso. Los pacientes con RVU de grado III parecen tener unos resultados significativamente distintos de los que tienen menores grados o ausencia de reflujo.
AGRADECIMIENTOSEste estudio fue financiado por la Región de Véneto (proyecto de investigación 40/01) y la asociación Il Sogno di Stefano (El sueño de Esteban).
Damos las gracias a todos los miembros del Italian Renal Infection Study Group en los niños (IRIS), que posibilitaron la realización de este estudio. Damos especialmente las gracias a Daniela Gobber (epidemióloga), que falleció hace 2 años. También agradecemos el análisis estadístico de Andrea Ponzoni y la revisión del manuscrito de Manola Bettio y Pia-Sop-hia Wool.
Comité de control de datos y seguridad: Roberto Buzzetti (epidemiólogo), Módena; Giovanni Capasso (nefrólogo pediátrico), Nápoles, y Roberto D’Amico (estadístico), Módena. Participantes en el estudio IRIS2: I. Marella, A. Budini (Adria); L. Marcazzò, S. Bellato (Arzignano); G. Audino, G. Picco (Bassano); P. Colleselli, D. Scorrano (Belluno); L. Pavanello (Castelfranco); C. Crivellaro (Chioggia); G. Cattarozzi, M. Pitter, A. Ballan (Dolo/Mirano); F. Rossetti, V. Cannella (Este/Monselice); G. Svaluto-Moreolo, Caddia (Feltre), G. Pozzan, F. Maschio (Mestre); P. Brisotto, N. Crema, S. Breseghella (Montebelluna); P. Luxardo, A. Toffolo (Odezo); G. Zacchello, G. Montini, L. Murer, C. Carasi, B. Andreetta, S. Comacchio, L. Rigon, S. Sartori, L. Tomasi, R. Pertile, D. Gobber (epidemiólogo), A. Ponzoni (estadístico) (Padua); A. Truini (Piove di Sacco); P.G. Flora, M. Ranieri (San Donà); R. Dall’Amico, L. Donello (Thiene); G. Marcer, S. Zanchetta (Soave); M. del Majno, M. Gheno (Venecia); P. Biban, P. Fortunati (Verona-Borgo Trento); M.G. Santangelo, O. Gianesini (Vicenza); A. Corsini (Bentivoglio); P.P. Molinari (Bolonia); A. Zucchini (Faenza/Lugo); Venturolli (Forlì); L. Serra (Imo-la); L. Casadio (Rávena); M. Principio (Macerata); M. Pitschiller, W. Cassar (Bolzano); M. de Marini, G. Crescenzi (Cuneo). El Dr. Montini tuvo libre acceso a todos los datos del estudio y asume la responsabilidad de la integridad de los datos y la exactitud del análisis de los datos.
Este ensayo se registró en www.clinicaltrials.gov (identificador NCT00156546).
Correspondencia: Giovanni Montini, MD, Nephrology, Dialysis and Transplant Unit, Pediatric Department, Azienda Ospe-daliera-University of Padova, Via Giustiniani, 3, 35128 Padua, Italia.
Correo electrónico: montini@pediatria.unipd.it