La migraña es común en los adolescentes, con una tasa de prevalencia del 15% en las edades de 12-15 años1. En este grupo, la migraña se caracteriza generalmente por ataques recurrentes de intensa cefalea que tienden a ser de más breve duración que la migraña del adulto2. Junto con los síntomas neurovegetativos, como náuseas, vómitos, y/o fotofobia, la migraña contribuye a una disminución de la capacidad funcional y a una pérdida significativa en la calidad de vida de los adolescentes3. Sin embargo, los ataques de migraña en los adolescentes pasan a menudo desapercibidos a los proveedores de asistencia sanitaria o se atribuyen erróneamente a otras causas, como afecciones sinusales o trastornos emocionales.
El tratamiento de la migraña del adolescente requiere un enfoque individualizado y equilibrado con medidas bioconductuales y agentes para el tratamiento agudo; además, si la frecuencia de los ataques o la discapacidad que los acompaña así lo aconseja, con medicamentos diarios preventivos. Sin embargo, en la población adolescente ha sido extremadamente difícil demostrar con carácter significativo la eficacia de los agentes específicos para la migraña, como los triptanes4-6. Ello se ha atribuido a la elevada tasa de respuestas al placebo en los ensayos clínicos de tratamiento agudo de la migraña del adolescente. En el adulto se han observado unas tasas de respuesta al placebo cercanas al 35% a las 2 horas, mientras que la tasa correspondiente en los estudios sobre migraña del adolescente ha sido del 50% o más7. Estos problemas nos indujeron a experimentar nuevos diseños de estudio para determinar la eficacia de los tratamientos específicos de la migraña, en comparación con un placebo, en esta población.
Se ha demostrado que el spray nasal (SN) de zolmitriptano es de acción rápida, eficaz y bien tolerado en el tratamiento agudo de los ataques de migraña en pacientes adultos8,9, con un perfil farmacocinético comparable en adolescentes y adultos10. El objetivo del presente estudio, por consiguiente, fue el de valorar la eficacia y la tolerancia del SN de zolmitriptano frente a un placebo en el tratamiento agudo de la migraña del adolescente. Un grupo de expertos neurólogos pediátricos, de los centros que realizaron el estudio, recomendó la adopción de un nuevo diseño del estudio para afrontar la alta respuesta al placebo que se preveía en los pacientes adolescentes.
MÉTODOSConsideraciones éticasEl presente estudio (código D1221C00005; “Double-Dia-mond”) se realizó entre septiembre de 2003 y marzo de 2004 en 17 centros de neurología pediátrica de Estados Unidos, con cumplimiento de los principios establecidos en la Declaration of Helsinki and Good Clinical Practice. Antes de iniciar el estudio se obtuvo el consentimiento informado de los progenitores o custodios legales, junto con el asentimiento del paciente. El protocolo fue aprobado por el comité de ética local o la junta de revisión institucional en cada centro del estudio.
PacientesFueron elegibles para participar los adolescentes (12 a 17 años durante el estudio) con un diagnóstico establecido de migraña, con o sin aura, durante al menos 1 año, según los criterios de la International Headache Society11,12 (IHS) o IHS-r13. Se requirió que la frecuencia basal de la migraña fuera ≥ 2 ataques al mes durante al año escolar, y < 14 días de cefalea no migrañosa al mes durante los 3 meses anteriores al cribado. La duración habitual de la cefalea no tratada fue > 2 horas en los 3 meses anteriores al cribado. El protocolo permitió incluir a los pacientes que tomaban medicamentos para la profilaxis de la migraña, siempre que se hallara estabilizada en el plazo de 2 meses, antes de la distribución aleatoria. Se aplicaron los criterios estándar de exclusión para los ensayos con triptanos: historia de migraña basilar, oftalmopléjica o hemipléjica; evidencia o factores de riesgo significativos de cardiopatía isquémica, arritmia o anomalías del sistema de conducción cardíaco, y fenómenos adversos previos inaceptables con cualquier agente triptano.
Diseño del estudioFue un estudio multicéntrico, de distribución aleatoria, doble ciego, controlado con placebo, bidireccional, cruzado en dos ataques de migraña, con una “placebo de prueba” simple ciego en cada ataque de migraña. Cada ataque se trató inicialmente con SN de placebo en el plazo de 30 minutos cuando la cefalea era moderada o intensa (simple ciego). Si se lograba respuesta a los 15 minutos (disminución de la cefalea a leve o ausente), no se tomaba ninguna otra medicación. Si persistía la migraña moderada o intensa, los pacientes trataban el ataque con SN de zolmitriptano (5 mg) o SN de placebo, según el esquema de distribución aleatoria doble ciego (preparado por el patrocinador del estudio). La distribución aleatoria de los pacientes se efectuó de un modo estrictamente secuencial. Si al cabo de 2 horas persistía una cefalea moderada o intensa, se permitió dar una segunda dosis de tratamiento aleatorio o una medicación de restablecimiento aprobada (FAINE, antieméticos, analgésicos, sedantes). El segundo ataque de migraña se trató con la medicación cruzada en el período de estudio de 12 semanas.
Variables de la eficaciaLa variable primaria de la eficacia fue la respuesta de la cefalea (definida como una reducción de 2 puntos en la intensidad de la cefalea en una escala de 4 puntos, desde 1 [ausencia de cefalea] hasta 4 [cefalea intensa]), 1 hora después del tratamiento aleatorio. Las variables secundarias de la eficacia fueron: respuesta de la cefalea a los 15, 30 y 45 min y a las 1,5 y 2 horas, después del tratamiento aleatorio; respuesta continuada de la cefalea a las 2 horas (pacientes que respondían al cabo de 1 hora de la dosis, seguían respondiendo a las 2 horas y no utilizaban medicación de restablecimiento); tasas de ausencia de dolor, caída de 1 punto en la intensidad del dolor (valorado en una escala de 4 puntos: ausente, ligero, moderado o intenso), y resolución de los síntomas migrañosos acompañantes en todos los momentos desde 15 min hasta 2 horas después de la dosis; tiempo transcurrido hasta la reanudación de las actividades normales, y uso de medicación de restablecimiento. Los pacientes registraron la intensidad del dolor, los síntomas y otras respuestas mediante un dispositivo electrónico manual (LogPad® system; PHT Corporation, Charlestown, Massachusetts, Estados Unidos).
A requerimiento de la FDA, que temía que hubiera pacientes excluidos del análisis de intención de tratar (IT) después de la distribución aleatoria, los datos de respuesta de la cefalea se atribuyeron a los que respondieron al placebo. En este análisis del “peor escenario posible”, todos los que respondieron al placebo de prueba y que habrían recibido luego también placebo aleatoriamente se consideraron como sujetos que respondieron al placebo; en cambio, quienes recibieron luego aleatoriamente SN de zolmitriptano se consideraron como sujetos que no respondieron al SN de zolmitriptano.
Análisis estadísticoLa población con IT se definió como aquellos pacientes que no respondieron al placebo de prueba en los primeros 15 minutos y luego se trataron con la medicación aleatoria (SN de zolmitriptano o placebo para ese ataque). La variable primaria de la eficacia, es decir, la respuesta a la cefalea al cabo de 1 hora, se analizó con el método de las ecuaciones estimativas generalizadas (EEG) utilizando la regresión logística alternativa14, que modeló simultáneamente la dependencia de la respuesta sobre las variables explicativas y la asociación entre las respuestas de los mismos pacientes. Se utilizó el mismo modelo para el análisis de la respuesta de la cefalea en otros momentos (incluida la respuesta continuada de la cefalea a las 2 horas), las tasas de ausencia de dolor, la caída de 1 punto en la intensidad del dolor, el retorno a las actividades normales, la resolución de los síntomas asociados y la incidencia del uso de medicación de restablecimiento. Los resultados del análisis se presentan en términos de probabilidad relativa (OR) e intervalo de confianza (IC) del 95% para el efecto del tratamiento. Las comparaciones se consideraron significativas cuando p < 0,05.
Para calcular el tamaño de la muestra se utilizó la prueba de McNemar (χ2) de igualdad de las proporciones aparejadas. Se asumió que, con la exclusión de los que respondieron precoz-mente al placebo, se lograría una respuesta de la cefalea al cabo de 1 hora en el 50% de los receptores de SN de zolmitriptano, frente al 35% de los receptores de placebo, y que la proporción de parejas discordantes sería del 45%. Mediante el uso de un error bilateral de tipo I de 0,05 y una potencia del 90%, sería necesaria una muestra de 203 pacientes que aportaran datos de ambos ataques. Sin embargo, con las estimaciones de que el 25% de los pacientes distribuidos aleatoriamente no aportarían datos sobre eficacia en ambos ataques, el tamaño total calculado de la muestra sería de 272 pacientes (136 por secuencia).
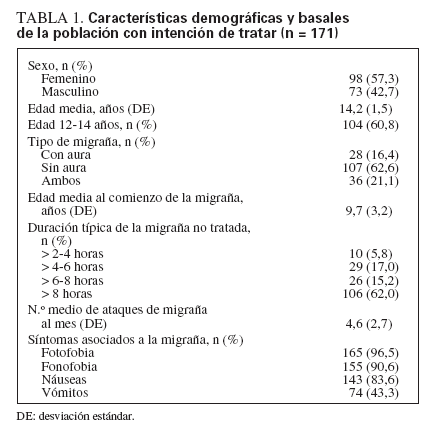
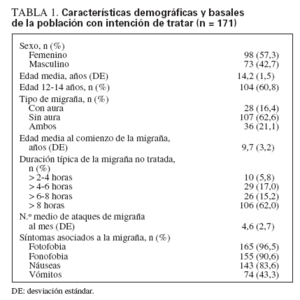
RESULTADOSGrupos de estudioSe incorporaron al estudio 248 pacientes adolescentes que se distribuyeron aleatoriamente a la secuencia A (placebo → zolmitriptano, n = 120) o B (zolmitriptano → placebo, n = 128) (fig. 1). Unos 171 pacientes trataron al menos 1 ataque con la medicación del estudio (población con IT). La edad media fue de 14,2 años, y 98 de 171 (57,3%) eran niñas; en la tabla 1 se muestran las características demográficas basales y de la migraña. En total se trataron 275 ataques de migraña durante el estudio (148 con SN de zolmitriptano y 127 con placebo).
Fig. 1. Diseño del estudio “Double Diamond” y resumen del flujo de pacientes. PL: placebo; Z: zolmitriptano.
TABLA 1. Características demográficas y basales de la población con intención de tratar (n = 171)
En conjunto, las características demográficas eran similares en los pacientes que respondieron al placebo de prueba y en quienes no respondieron (datos no mostrados).
Las tasas de finalización del estudio para las secuencias de tratamiento A y B fueron de 80% (96 de 120 pacientes) y 80,5% (103 de 128), respectivamente. Los motivos más comunes para el abandono fueron la falta de cumplimiento del protocolo (13 y 11 pacientes, respectivamente) y la pérdida para el seguimiento (9 y 10 pacientes, respectivamente).
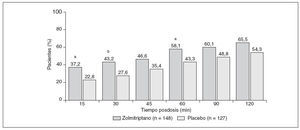
EficaciaAl cabo de 1 hora, el SN de zolmitriptano produjo una tasa de respuestas de la cefalea (58,1% [86/148]) mayor que el placebo (43,3% [55/127]) (OR = 1,827 [IC del 95%, 1,137-2,936, p < 0,05]). El comienzo de la acción ocurrió incluso a los 15 minutos de la dosis (37,3% [55/148] frente a 22,8% [29/127] con el placebo) (OR = 2,020 [IC del 95%, 1,162-3,510, p < 0,05]). El SN de zolmitriptano produjo también una respuesta a la cefalea mayor que el placebo al cabo de 1,5 y 2 horas posdosis, aunque la diferencia ya no fue estadísticamente significativa (fig. 2).
Fig. 2. Tasas de respuesta de la cefalea al spray nasal de zolmitriptano 5 mg y al placebo (población con intención de tratar). ap< 0,05; bp < 0,01 frente al placebo.
En la respuesta continuada de la cefalea a las 2 horas, el SN de zolmitriptano fue superior al placebo (51,4% [76/148] frente a 33,1% [42/127] [OR = 2,243 (IC del 95%, 1,325-3,796, p < 0,01)]).
Las tasas de ausencia de dolor fueron más elevadas con SN de zolmitriptano que con placebo en todos los momentos valorados, y estas diferencias entre los grupos de tratamiento fueron significativas al cabo de 1 hora (27,7 [41/148] frente al 10,2% [13/127]), 1,5 hora (32,4 [48/148] frente al 15,7% [20/127] y 2 horas posdosis (39,2 [58/148] frente al 18,9% [24/127]) (todos p < 0,01).
En los primeros momentos cronológicos, las diferencias entre los grupos de tratamiento fueron de una magnitud similar; sin embargo, no pudo realizarse un análisis estadístico válido a causa del pequeño número de sujetos que respondieron (fig. 3).
Fig. 3. Tasas de ausencia de dolor con spray nasal de zolmitriptano 5 mg y placebo (población con intención de tratar). ap < 0,001; bp < 0,01 frente al placebo.
El comienzo temprano de la acción del SN de zolmitriptano fue también evidente en las valoraciones de la caída de 1 punto en la intensidad del dolor, pues una mayor proporción de pacientes manifestó una reducción en la intensidad del dolor a los 15 y 30 minutos posdosis, en comparación con el placebo (50,0 [74/148] frente al 35,4% [45/127], y 54,1 [80/148] frente al 40,2% [51/127], respectivamente; p < 0,05 en ambos casos).
La mejoría de la cefalea con SN de zolmitriptano se acompañó de una mayor resolución de los síntomas asociados con la migraña, en comparación con el placebo. A los 30 minutos posdosis, la fotofobia y la fono-fobia se resolvieron en un mayor número de pacientes tratados con SN de zolmitriptano que en quienes recibieron placebo (32,5 [37/114] frente al 19,6% [19/97] y 36,0 [32/89] frente al 21,4% [18/84], respectivamente; p < 0,05 en ambos casos). El retorno a las actividades normales (en los pacientes en quienes se alteraron antes del tratamiento) fue también uniformemente más rápido con SN de zolmitriptano que con placebo en todos los momentos cronológicos, y tuvo carácter significativo a los 45 y 60 minutos posdosis (48,0 [61/127] frente al 33,9% [37/109] y 55,1 [70/127] frente al 41,3% [45/109], respectivamente; p < 0,05 en ambos casos).
El uso de cualquier medicación de restablecimiento fue también inferior con SN de zolmitriptano que con placebo (38,3 [62/162] frente al 50,0% [74/148], p < 0,05).
En comparación con el placebo, no se observó un beneficio significativo con el SN de zolmitriptano en la tasa de respuestas de la cefalea al cabo de 1 hora según el análisis del “peor escenario posible” (datos no mostrados). Se observaron hallazgos similares en el análisis del peor escenario posible en la respuesta continuada de la cefalea a las 2 horas; no se realizaron análisis para las variables secundarias bajo estos criterios.
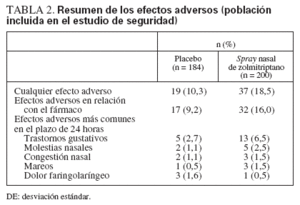
Tolerancia e inocuidadEl SN de zolmitriptano fue bien tolerado en esta población adolescente. Ningún paciente abandonó el estudio a causa de efectos secundarios y no se manifestaron efectos adversos importantes. Los efectos más frecuentes fueron: alteraciones gustativas, molestias nasales y congestión nasal (tabla 2).
TABLA 2.Resumen de los efectos adversos (población incluida en el estudio de seguridad)
DISCUSIÓNEl presente estudio, de diseño peculiar, donde se empleó una nueva estrategia para afrontar el problema de quienes responden precozmente al placebo, demostró que el SN de zolmitriptano (5 mg) es eficaz y bien tolerado para el tratamiento agudo de la migraña en el adolescente. El comienzo de la acción fue rápido, y se observaron diferencias significativas tempranas entre el zolmitriptano y el placebo a los 15 minutos de la administración intranasal, que persistieron durante períodos de hasta 2 horas.
El objetivo del tratamiento de un ataque de migraña es el alivio completo de la cefalea y los síntomas acompañantes, con un riesgo mínimo de efectos adversos. En comparación con el placebo, el SN de zolmitriptano produjo unas tasas más elevadas de alivio de los síntomas en todos los momentos valorados, y se alcanzó significación estadística para la respuesta de la cefalea a los 15 y 30 minutos y 1 hora posdosis. Además, mejoró la capacidad funcional, con un retorno más rápido a las actividades habituales y una menor necesidad de medicación de restablecimiento. Así mismo, el SN de zolmitriptano se toleró bien por parte de los adolescentes migrañosos, con un patrón de efectos adversos y una baja incidencia de los mismos similares a los hallados en los adultos. En conjunto, estos datos indican la utilidad del SN de zolmitriptano para el alivio de la migraña en la población adolescente.
En diversas revisiones recientes se ha valorado el tratamiento farmacológico actual de la migraña en el adoles-cente4-6. El consenso es que la evidencia apoya el uso del ibuprofeno, el paracetamol y el SN de sumatriptano para el tratamiento agudo de la migraña en estos pacientes (aunque el sumatriptano no ha recibido la aprobación de la FDA para esta indicación). De hecho, el SN de sumatriptano es el triptano que se ha estudiado más extensamente en la migraña del adolescente, y los resultados con este agente en ensayos clínicos controlados ilustran sobre la dificultad de demostrar la eficacia de los triptanos en presencia de una alta respuesta al placebo. En dos de los estudios a mayor escala controlados con placebo (en ambos participaros varios centenares de pacientes), el SN de sumatriptano (20 mg) no alcanzó significación estadística en los objetivos primarios de la respuesta de la cefalea a las 2 horas15 y la respuesta al cabo de 1 hora16. Sin embargo, en el presente estudio, el uso de un nuevo diseño sirvió para eliminar las respuestas precoces al placebo. De este modo, la tasa observada de respuestas al placebo fue cercana al 43%, y en el objetivo primario se alcanzó una diferencia significativa entre el SN de zolmitriptano y el placebo.
Con respecto a la prueba con placebo, se adoptó un tiempo de respuesta de 15 minutos para proporcionar a los pacientes un alivio rápido de la migraña. En cambio, si se hubiera utilizado un tiempo de respuesta de 30 minutos, los pacientes hubieran debido de esperar más antes de recibir el tratamiento que podía aliviar su cefalea, lo que es una importante consideración, dada la breve duración de los ataques de migraña en los adolescentes. La elección de un tiempo de respuesta de 15 minutos para la prueba con placebo fue un compromiso que tuvo en cuenta el diseño del estudio y la población estudiada.
La selección de los objetivos más relevantes desde el punto de vista clínico es problemática en la población de adolescentes con migraña, como se ha demostrado en los estudios anteriores con sumatriptano. En la mayoría de los estudios clínicos se ha empleado la respuesta de la cefalea a las 2 horas como objetivo primario; sin embargo, dado que la migraña del adolescente tiene generalmente una duración más breve que en el adulto, puede ser más relevante examinar la respuesta en momentos más precoces. El estudio sugiere que la respuesta de la cefalea al cabo de 1 hora, unida a la respuesta continuada a las 2 horas, es un objetivo valioso. El éxito en este objetivo se asoció con otros resultados muy deseables, como la reducción de los síntomas acompañantes, el retorno a las actividades normales, el menor uso de la medicación de restablecimiento y la ausencia de dolor.
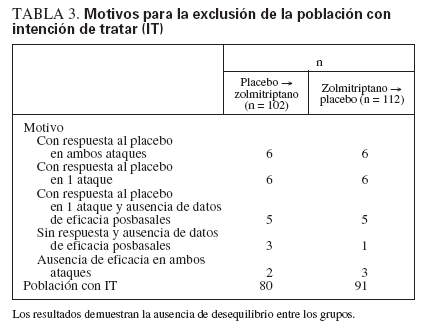
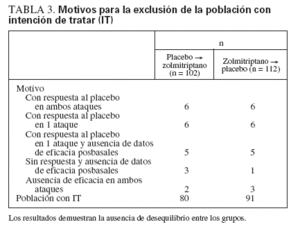
TABLA 3. Motivos para la exclusión de la población con intención de tratar (IT)
En concordancia con las instrucciones de la FDA, en el presente estudio se analizó también la eficacia del SN de zolmitriptano en “el peor escenario posible”, donde todos los que respondieron en la prueba con placebo se calificaron de “sujetos que responden” en el grupo del placebo y como “sujetos que no responden” en el grupo del zolmitriptano. Sin embargo, la atribución del peor caso posible devalúa injustamente el fármaco activo a expensas del placebo y niega el objetivo de la prueba con placebo. Además, los temores de la FDA, anteriores al estudio, sobre el desequilibrio por el diseño cruzado, no se confirmaron (tabla 3). No debe sorprendernos que en este análisis no se demostrara un beneficio significativo del SN de zolmitriptano. Otra posible cuestión con el procedimiento del peor caso es que los “sujetos que responden” al placebo, es decir, los pacientes con resolución precoz del ataque, no constituyen la población de interés. En cambio, el análisis empleado en el presente estudio proporcionaría una valoración más apropiada del efecto del SN de zolmitriptano en este contexto problemático.
El SN de zolmitriptano fue bien tolerado en la población de adolescentes con migraña y el perfil de efectos adversos fue similar al observado en los pacientes adul-tos8,9. Los fenómenos adversos más frecuentes, es decir, los trastornos gustativos, aparecieron en el 6,5% de los pacientes que recibieron SN de zolmitriptano. Esta incidencia es mucho más baja que la previamente descrita para el SN de sumatriptano (20 mg), que se asocia con trastornos gustativos en cerca del 25% de los adolescentes con migraña17.
En conclusión, el presente estudio controlado con placebo y diseñado de un modo peculiar demuestra que el mas de migraña en los pacientes adolescentes.
AGRADECIMIENTOSEste estudio fue financiado por AstraZeneca.
Damos las gracias a Andree Rose, Steve Winter y Vicki Oldfield, de Wolters Kluwer Health, que proporcionaron ayuda médica editorial y otras ayudas de redacción, subvencionados por AstraZeneca.
D. Hershey ha recibido ayuda para la investigación de AstraZe-neca, USB Pharma, Tishcon, Inc., y Ortho-McNeil. Warren W. Wasiewski trabajaba para AstraZeneca cuando se realizó el estudio.
Correspondencia: Donald W. Lewis, MD, FAAP, FAAN, Division of Pediatric Neurology, Children’s Hospital of the King’s Daughters, Eastern Virginia Medical School, Norfolk, VA 23510, Estados Unidos.
Correo electrónico: dlewis@chkd.org