Objetivo: Desarrollar un nomograma de predicción, basado en las mediciones transcutáneas de la bilirrubina (BTc), para la evaluación del riesgo de hiperbilirrubinemia importante en los neonatos sanos a término y pretérminos tardíos.
Métodos: Se realizaron 10.382 mediciones de la BTc sobre 2.039 neonatos sanos (edad gestacional ≥35 semanas y peso al nacimiento ≥2.000 g), con un bilirrubinómetro BiliCheck (SpectRx, Norcross, GA), en momentos predeterminados entre las 12 y 120 h de vida. Según su importancia, estas mediciones fueron controladas selectivamente en un aparato espectrofotométrico directo, y se definió la hiperbilirrubinemia importante según los valores umbral de fototerapia, específicos de las horas de vida, propuestos por la American Academy of Pediatrics. Mediante el empleo de la relación de verosimilitud (LR) se calcularon los delimitadores de alto y bajo riesgo para cada momento, que se presentan en un nomograma específico de hora.
Resultados: Se documentó una hiperbilirrubinemia importante en 122 neonatos (6%). A las 24 h de vida, la zona de alto riesgo del nomograma tuvo una sensibilidad del 73,9% y una LR positiva de 12,1 para predecir una hiperbilirrubinemia importante, mientras que la zona de bajo riesgo tuvo una sensibilidad del 97,7% y una LR negativa de 0,04. A las 48 h, la zona de alto riesgo tuvo una sensibilidad del 90% y una LR positiva de 12,1, mientras que la zona de bajo riesgo tuvo una sensibilidad del 98,8% y una LR negativa de 0,02. En nuestra población de estudio, la probabilidad de hiperbilirrubinemia importante sería > 35% para los valores de la zona de alto riesgo y < 0,5% para los valores en la zona de bajo riesgo del nomograma.
Conclusiones: Ofrecemos una herramienta de predicción de la BTc que podría permitir un abordaje incruento, basado en el riesgo, de la hiperbilirrubinemia neonatal.
La hiperbilirrubinemia se ha reconocido como la causa más habitual de reingreso tras el alta neonatal temprana de los neonatos sanos1-4. Por lo tanto, la identificación de los neonatos en riesgo de desarrollar una hiperbilirrubinemia importante constituye un especial desafío. La predicción de la hiperbilirrubinemia importante se basa en las mediciones prealta de la bilirrubina sérica total (BST), utilizando el nomograma desarrollado por Bhutani et al5-9. No obstante, la determinación de los valores de la BST sigue siendo un procedimiento cruento, estresante y que consume tiempo. Por el contrario, los actuales aparatos para la determinación de la bilirrubina transcutánea (BTc) han demostrado su exactitud y ahorro de tiempo en la estimación de las concentraciones de bilirrubina en los neonatos10-17. Pese a los limitados datos sobre su rendimiento de predicción, las mediciones de la BTc se están utilizando con frecuencia creciente en la detección sistemática de la hiperbilirrubinemia importante en los neonatos2,6,8,9,17-21.
El objetivo del presente estudio fue evaluar la utilidad de las mediciones de la BTc en determinados momentos entre las 12 y 72 h de vida, para predecir una hiperbilirrubinemia importante en los neonatos sanos a término y pretérminos tardíos. Además, estos valores de la BTc específicos por las horas de vida fueron utilizados, según su razón de verosimilitud (LR) positiva y negativa, para desarrollar un nomograma de predicción. Presentamos una herramienta de predicción basada en la medición de la BTc que puede guiar a los médicos para dirigir las evaluaciones y planificar las oportunas estrategias de seguimiento de los neonatos con ictericia.
MÉTODOS SujetosÉste fue un estudio prospectivo realizado en la unidad de neonatos sanos del University Hospital de Patras (Patras, Grecia) entre septiembre de 2005 y diciembre de 2007. Se incluyó a neonatos sanos a término o pretérminos tardíos, nacidos con una edad gestacional ≥35 semanas (basada en la fecha de la última regla o en los hallazgos ecográficos del primer trimestre) y un peso al nacimiento ≥2.000 g. Los criterios de exclusión fueron el ingreso en la ICU, una prueba directa de Coombs positiva, la ictericia que necesitó intervención durante las primeras 24 h y la deficiencia de glucosa-6-fosfato deshidrogenasa.
Se determinó el grupo sanguíneo y el resultado de la prueba directa de Coombs a todos los neonatos hijos de madre Rh negativa o con una prueba indirecta de Coombs positiva6. También se determinó el grupo sanguíneo, los resultados de la prueba directa de Coombs y la deficiencia de glucosa-6-fosfato deshidrogenasa a los neonatos que necesitaron fototerapia.
Protocolo Mediciones de la BTcLas determinaciones de la BTc se realizaron con un Bili-Check (SpectRx, Norcross, GA), un bilirrubinómetro manual que determina todos los valores de BTc mediante el análisis de la reflexión espectral con longitud de onda múltiple. Todas las mediciones se realizaron con el mismo aparato y por médicos adecuadamente entrenados, según las instrucciones del fabricante y la técnica estándar descrita11,12,17, bajo luz diurna ambiente o la luz blanca del fluorescente de la unidad neonatal.
Mediciones de la BSTLas muestras sanguíneas (50 μl) para la determinación de la BST se tomaron mediante una técnica de punción del talón, y las mediciones se realizaron en un bilirrubinómetro Unistat (Rochert, Depew, NY), un aparato de espectrofotometría directa con una exactitud (sesgo) de ± 5%. Todas las mediciones fueron realizadas por médicos expertos, según las instrucciones del fabricante respecto a la calibración y los controles de calidad. Se tuvo especial cuidado en no exponer a la luz las muestras tomadas.
Además, en los niños que necesitaron fototerapia, los valores de BST se determinaron en el laboratorio (muestra de 1 ml de sangre venosa) con el método diazo en un analizador Olympus AU640 (Olympus, Center Valley, PA), como parte de la evaluación rutinaria de la hiperbilirrubinemia importante. Estos valores de BST se utilizaron para estimar la exactitud de las mediciones de la BST realizadas con el método espectrofotométrico.
Control de seguimiento del paciente ingresadoEl estudio siguió estrictamente el protocolo de tratamiento de la ictericia neonatal de nuestra institución. Las determinaciones de BTc se tomaron a las 12 ± 2, 18 ± 2 y 24 ± 2 h durante el primer día tras el nacimiento, y luego a intervalos de 12 h (36 ± 2, 48 ± 2, 60 ± 2 y 72 ± 2 h). Se realizó una medición final de la BTc entre las 96 y 120 h. En cada neonato se tomaron al menos 5 mediciones. Los valores de la BTc se evaluaron utilizando los nomogramas de bilirrubina específicos por horas de vida propuestos por la American Academy of Pediatrics6 (AAP).
Las mediciones de la BTc se siguieron inmediatamente de determinaciones de la BST si el valor de BTc era > 15 mg/dl o, siendo inferior, superaba o quedaba a menos de 2 mg/dl del valor umbral para la fototerapia. Además, todos los neonatos se sometieron a mediciones de la BTc y la BST antes del alta, al tomar sangre para la detección sistemática metabólica universal obligatoria. Los valores de BTc y BST se registraron en un organigrama adjunto a la historia clínica de cada neonato.
Hiperbilirrubinemia importanteLa definición de hiperbilirrubinemia importante correspondió a cualquier valor de BST que superase el valor umbral para fototerapia específico para las horas de vida, según las pautas presentadas por la AAP6.
Evaluaciones del seguimiento ambulatorioNuestra institución ha adoptado una política de alta a las ≥72 h para los neonatos nacidos por vía vaginal y de ≥96 h para los nacidos por cesárea. Se ofrece una evaluación de seguimiento al cabo de 24 a 48 h del alta a todos los neonatos. Por lo tanto, se aconsejó a los padres de los niños nacidos por vía vaginal a regresar a la unidad neonatal para realizar una evaluación de seguimiento a una edad posnatal entre 96 y 120 h. Pasadas las 120 h, las evaluaciones adicionales de seguimiento de los neonatos consistieron en una inspección visual o una repetición de la medida de la BTc (y, si es necesario, de la BST) a discreción del médico. Este último control se realizó en el departamento de consultas externas del hospital. La resolución de la hiperbilirrubinemia se confirmó a los 12 a 14 días de edad, en cooperación con el pediatra de atención primaria.
Análisis estadísticos y diseño del nomograma de predicciónLos datos demográficos se analizaron con SPSS 15.0 para Windows (SPSS, Chicago, IL). El análisis de la curva de eficacia diagnóstica (ROC), realizado con MedCalc 8.1 (MedCalc, Mariakerke, Bélgica), se utilizó para evaluar la capacidad de predicción y para obtener las LR positiva y negativa de los valores de la BTc. La precisión del método espectrofotométrico se evaluó según el método de Bland y Altman (MedCalc 8.1), utilizando un diagrama de diferencias porcentuales y adoptando unos límites de aceptación del 3% para los EE y del 10% para los errores totales22.
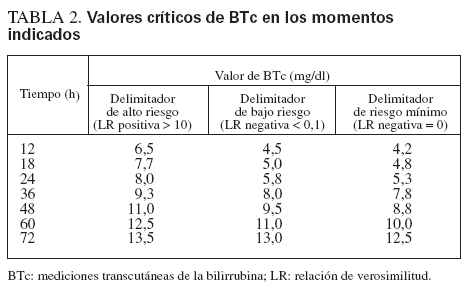
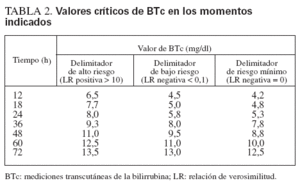
Los valores cruciales de BTc de cada momento prefijado se calcularon según las LR positiva y negativa. Las mediciones realizadas tras el inicio de la fototerapia no fueron utilizadas en el análisis. Como una LR positiva > 10 o negativa < 0,1 denota, respectivamente, un aumento o una disminución concluyente de la probabilidad de la enfermedad23,24, los menores valores de BTc con LR positiva > 10 y los mayores valores de BTc con LR negativa < 0,1 se consideraron como delimitadores del alto y el bajo riesgo, respectivamente, de desarrollar una hiperbilirrubinemia importante. También calculamos los mayores valores de BTc con LR negativa de 0, que se consideraron los delimitadores de mínimo riesgo. Estos valores de BTc fueron utilizados para diseñar un nomograma específico por horas de vida mediante Microsoft Excel (Microsoft, Redmond, WA). Los intervalos por encima, entre y por debajo de las trayectorias de los delimitadores del riesgo fueron definidos como zonas, es decir, zona de alto riesgo (por encima de la trayectoria del delimitador de alto riesgo), de bajo riesgo (por debajo de la trayectoria del delimitador de bajo riesgo) y de riesgo intermedio.
Para calcular la probabilidad de hiperbilirrubinemia importante tras la prueba, aplicamos el teorema de Bayes utilizando un nomograma específico25. Además, comparamos las características de predicción del nomograma desarrollado con el rendimiento de predicción del nomograma de BST desarrollado por Bhutani et al5, aplicado en nuestra población de estudio.
Consideraciones éticasEl comité de Ética del University Hospital de Patras aprobó y controló el estudio. La asignación de cualquier intervención médica (mediciones de la TBC, toma de muestras de sangre para la determinación de la BST o fototerapia) fue conforme al protocolo de nuestra institución para el tratamiento de la ictericia neonatal y no quedó a discreción de los investigadores. No se registraron datos personales, y se obtuvo el consentimiento informado de uno de los progenitores.
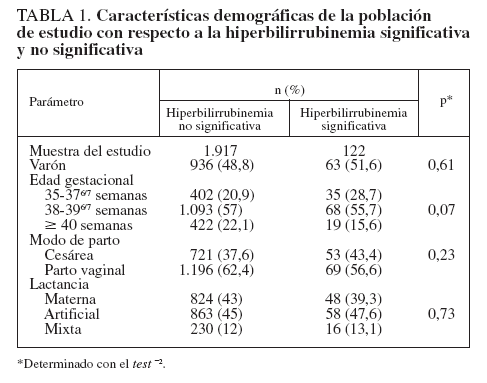
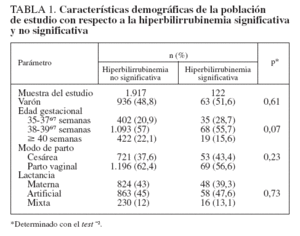
RESULTADOSDurante el período de estudio hubo 2.745 nacidos vivos en el University Hospital de Patras. Trescientos once neonatos no cumplieron los criterios de inclusión, y otros 395 no completaron el proceso de seguimiento. Los 2.039 neonatos restantes constituyeron nuestra población de estudio, de la que se tomaron 10.382 mediciones de BTc. La media del peso al nacimiento fue de 3.202 ± 439 g, y la media de la edad gestacional de 271 ± 10 días (385/7 ± 13/7 semanas). La tabla 1 presenta los datos demográficos. El número de mediciones de la BTc en cada momento prefijado fue el siguiente: 1.130 a las 12 h, 1.215 a las 18 h, 1.410 a las 24 h, 1.112 a las 36 h, 1.319 a las 48 h, 1.265 a las 60 h y 1.307 a las 72 h de edad posnatal. Una serie de 1.624 neonatos (el 79,6% de la población estudiada) tuvo una medición final de la BTc entre las 96 y las 120 h posnatales. Esta muestra incluyó a los 774 neonatos nacidos por cesárea (dados de alta después de las 96 h) y a 850 neonatos nacidos por vía vaginal y que regresaron a evaluaciones de seguimiento. En 534 neonatos se practicaron evaluaciones adicionales del seguimiento (inspección visual, determinaciones repetidas de la bilirrubina, o ambas) hasta la resolución de la hiperbilirrubinemia. Se efectuaron 3.249 mediciones de la BST, y se documentó una hiperbilirrubinemia importante en 122 neonatos (6%). Ninguno de los neonatos desarrolló una hiperbilirrubinemia importante tras la finalización del proceso de seguimiento.
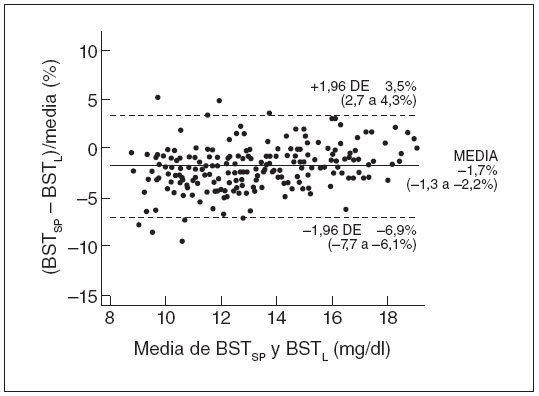
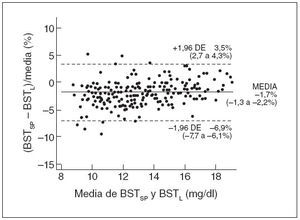
La precisión del método espectrofotométrico se evaluó comparando 223 mediciones apareadas de la BST, espectrofotométricas y de laboratorio. Como muestra la figura 1, el método de Bland y Altman, utilizando un diagrama de diferencia porcentual, demostró una buena concordancia entre los 2 métodos; la diferencia media entre las mediciones apareadas, espectrofotométricas y de laboratorio, de la BST fue de –1,7% (intervalo de confianza del 95%: –6,9% a 3,5%).
Fig. 1. Distribución de error de los valores apareados de BST espectrométrica (BSTSP) y BST de laboratorio (BSTL) (n = 223). Se muestra la media de los errores y los intervalos de confianza del 95% (límites superior e inferior de concordancia). DE: desviación estándar.
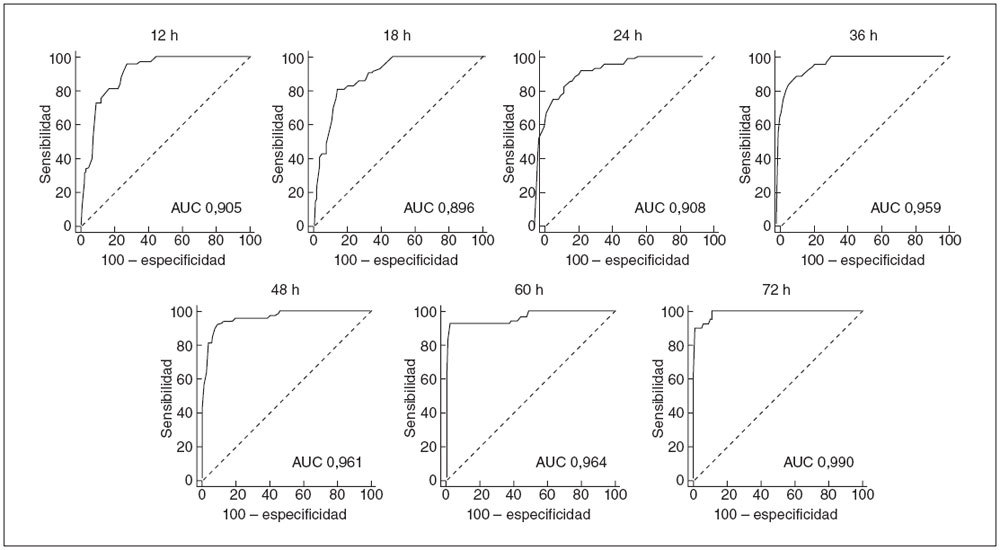
La figura 2 muestra las curvas ROC de los momentos predeterminados, e indica la capacidad de las mediciones de BTc para predecir una hiperbilirrubinemia importante.
Fig. 2. Curvas ROC del rendimiento de las mediciones de BTc en determinados momentos del estudio en la predicción de una hiperbilirrubinemia significativa posterior. AUC: área bajo la curva.
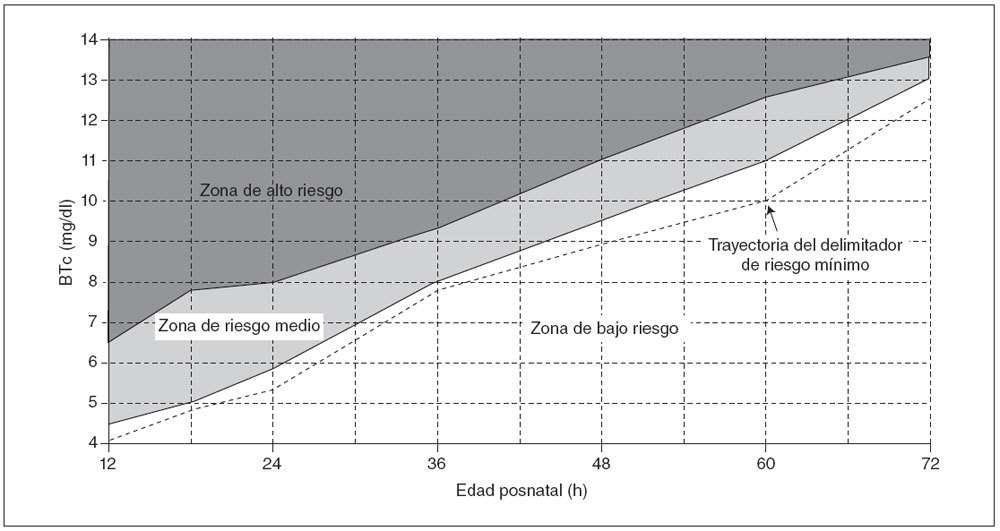
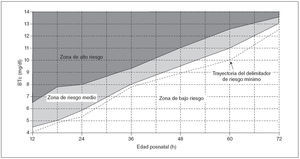
Los valores de BTc delimitadores del alto y bajo riesgo se calcularon según la LR positiva y negativa (tabla 2), y estos valores se utilizaron luego para el desarrollo del nomograma de predicción ilustrado en la figura 3.
Fig. 3. Nomograma de BTc para la evaluación del riesgo de hiperbilirrubinemia significativa posterior en neonatos sanos a término y pretérminos tardíos. La zona de alto riesgo está definida por la trayectoria de los valores de BTc con una LR positiva > 10 y la zona de bajo riesgo por la trayectoria de los valores de BTc con una LR negativa < 0,1. También se muestra la trayectoria del delimitador de mínimo riesgo (LR negativa = 0) (línea discontinua). El nomograma fue desarrollado con 10.382 mediciones de BTc de 2.039 neonatos de edad gestacional ≥ 35 semanas y peso al nacimiento ≥ 2.000 g. BTc: mediciones transcutáneas de la bilirrubina.
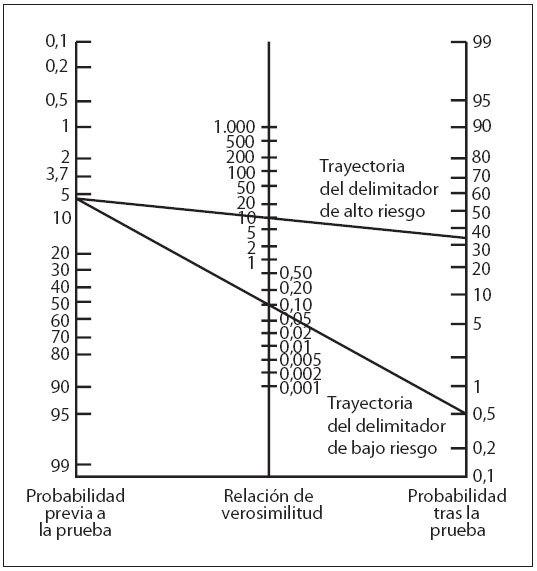
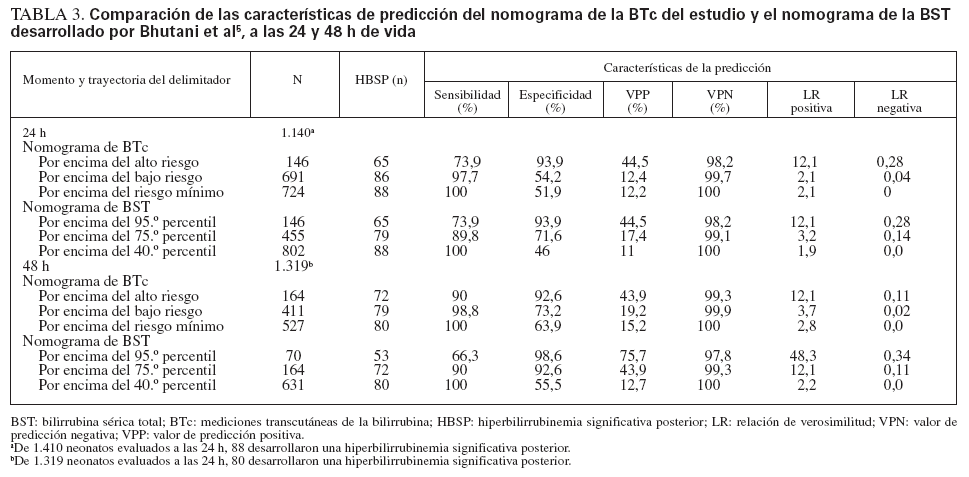
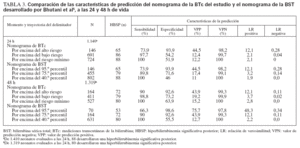
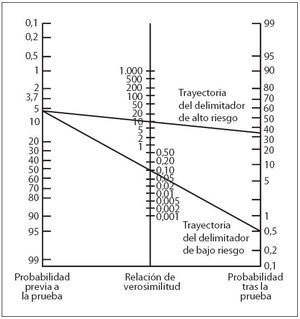
Se calcularon las características de predicción del nomograma de la BTc a las 24 y 48 h de vida, comparándolas con el rendimiento de predicción del nomograma de la BST5 aplicado a nuestra población de estudio (tabla 3). La aplicación del teorema de Bayes a nuestra población de estudio (probabilidad de hiperbilirrubinemia importante previa al test: 6%) utilizando el nomograma específico rindió unas probabilidades tras el test > 35% para los valores de la zona de alto riesgo (LR positiva > 10) y < 0,5% para los valores inferiores al delimitador de bajo riesgo (LR negativa < 0,1) (fig. 4).
Fig. 4. Nomograma para convertir las probabilidades antes de la prueba en probabilidades tras la prueba utilizando la LR. El trazado de una línea recta desde la probabilidad previa a la prueba (eje vertical izquierdo) a la LR de una prueba diagnóstica (eje vertical central) determina la probabilidad tras la prueba (eje vertical derecho) de la enfermedad. Presentamos las probabilidades tras la prueba de las trayectorias del delimitador de alto y bajo riesgo (nomograma de BTc) de nuestra población de estudio (probabilidad de hiperbilirrubinemia significativa antes de la prueba: 6%).
ANÁLISISEl alta posnatal temprana de neonatos sanos se ha convertido en una tendencia universal. Sin embargo, como los valores de bilirrubina alcanzan el máximo entre el tercer y el quinto día de vida, esta práctica se ha asociado con el mayor riesgo de hiperbilirrubinemia intensa no detectada1-4. Los intentos de identificar a los neonatos en riesgo se basan en la actualidad en evaluaciones del riesgo previas al alta, mediante mediciones de BST específicas para la edad y el nomograma de predicción desarrollado por Bhutani et al5. Las últimas pautas de la AAP sobre la hiperbilirrubinemia6 incluyen este abordaje, y han sido validadas y ampliamente aceptadas6-9. No obstante, la determinación de los valores de BST sigue siendo un procedimiento cruento, lento, que implica dolor, estrés neonatal y riesgo de infección. En estas circunstancias, la determinación incruenta de la concentración de bilirrubina parece tener ventajas, porque disminuye al mínimo la toma de sangre y permite la detección sistemática neonatal universal. Como los incruentos aparatos de medición de la BTc de nueva generación se han mostrado fiables para estimar las concentraciones de bilirrubina10-17, las mediciones de la BTc se están utilizando en todo el mundo para las estimaciones del riesgo de hiperbilirrubinemia importante2,6,8,9,17-21. Pese a este empleo, los datos disponibles sobre su rendimiento de predicción son limitados17-21 y todavía no se ha desarrollado una herramienta de predicción basada en la BTc, similar al nomograma de la BST desarrollado por Bhutani et al5.
En este estudio ofrecemos datos sobre la capacidad de predicción de las mediciones de BTc obtenidas con el aparato BiliCheck entre las 12 y 72 h de vida, sobre una población blanca griega de neonatos a término y pretérminos tardíos. Como demuestra el análisis de la curva ROC, el rendimiento de predicción de las mediciones de la BTc fue aceptable durante las primeras 24 h de vida y mejoró después (fig. 1). Además, se calcularon los valores de BTc delimitadores del riesgo de desarrollo de una hiperbilirrubinemia importante, utilizándolos para el desarrollo de un nomograma de predicción específico por las horas de vida.
Existen importantes diferencias entre nuestro estudio e informes similares publicados. Bhutani et al5 desarrollaron un nomograma basado en valores de BST específicos por horas de vida, que definió los valores ≥95.º percentil como indicadores de una hiperbilirrubinemia importante. En un estudio posterior, los autores trataron de evaluar la capacidad de predicción de las mediciones de la BTc utilizando el nomograma de predicción de la BST e indicaron que los neonatos con valores de BTc superiores al 75.º percentil del nomograma debieran ser considerados en alto riesgo de desarrollar una hiperbilirrubinemia excesiva17. Maisels y Kring20 también presentaron un nomograma basado en mediciones de la BTc obtenidas con el bilirrubinómetro JM-103 (Draeger Medical, Telford, PA). Este nomograma, que también se basó en los percentiles, representa en realidad la historia natural de las mediciones de BTc en su población de estudio.
En este estudio evaluamos el rendimiento de predicción de las mediciones de BTc obtenidas con el aparato BiliCheck y, según su importancia, controlamos selectivamente estas mediciones con un método espectrofotométrico directo. Definimos la hiperbilirrubinemia importante por los valores de la BST, según las pautas de la AAP6. Aunque este abordaje puede ser motivo de discusión26, es seguro y más próximo a la práctica clínica diaria. Además, los delimitadores del riesgo propuestos se calcularon mediante las LR positiva y negativa, en lugar de los percentiles de BTc. Las LR no se alteran por la prevalencia de la enfermedad, y ofrecen estimaciones más fiables de la probabilidad de enfermedad, incluso en poblaciones heterogéneas23,24. Además, las LR tienen la ventaja de su utilidad clínica cuantitativa inmediata, mediante la aplicación directa del teorema de Bayes23. Como muestra nuestra población de estudio, la probabilidad de una hiperbilirrubinemia importante sería > 35% para los valores de la zona de alto riesgo y < 0,5% para los de la zona de bajo riesgo (fig. 4).
A las 24 h de vida, el delimitador de alto riesgo de nuestro nomograma coincidió con el 95.º percentil del nomograma de BST desarrollado por Bhutani et al5; aunque a las 48 h, se acercó al 75.º percentil del nomograma de la BST (tabla 3). Esta discrepancia pudo atribuirse en parte a las diferencias de método entre los 2 estudios. Como se observó anteriormente7,20, el nomograma de BST se desarrolló mediante mediciones de BST tras el alta, que fueron obtenidas de un número bastante escaso de neonatos; por lo tanto, estos valores probablemente representen una muestra sesgada, que condujo a estimaciones con una falsa gran sensibilidad. Al aplicar el nomograma de BST a nuestra población, una cifra desproporcionadamente elevada de mediciones fue clasificada en la zona de riesgo medio y elevado (tabla 3). A las 24 h de vida, 691 mediciones (49%) fueron clasificadas en las zonas de riesgo elevado e intermedio del nomograma de la BTc, frente a 802 (56,9%) calificadas de riesgo elevado/medio con el nomograma de la BST. De forma similar, a las 48 h de vida, 411 mediciones de la BTc (31,3%) fueron calificadas de riesgo elevado/medio mediante el nomograma de BTc, comparado con 631 (47,9%) desarrollado por Bhutani et al5. Otra observación notable es que el 95.º percentil del nomograma de BTc desarrollado por Maisels y Kring20 está situado entre las trayectorias de los delimitadores de alto y bajo riesgo de nuestro nomograma pasadas las 18 h de vida. Sin embargo, estos autores reconocieron que el 95.º percentil de su nomograma era inexplicablemente menor que el informado en otros estudios20.
Aunque se calcularon los delimitadores del riesgo mínimo, definimos la zona de bajo riesgo del nomograma según los delimitadores de bajo riesgo. El neonato con un valor de BTc inferior a la trayectoria del delimitador de bajo riesgo (LR negativa < 0,1) debe considerarse con una probabilidad muy escasa de desarrollar una hiperbilirrubinemia importante. Si conocemos la prevalencia de una hiperbilirrubinemia importante en la población, esta probabilidad puede calcularse mediante el nomograma que muestra la figura 4, y planificar una estrategia racional de seguimiento. Por el contrario, el valor de BTc inferior a la trayectoria del mínimo riesgo (LR negativa de 0) indicaría que el riesgo esperado sería 0 con independencia de la prevalencia de hiperbilirrubinemia. Creemos que esto no constituiría un abordaje seguro de una tan frecuente y posiblemente peligrosa alteración como la ictericia neonatal.
Nuestro estudio tiene algunas posibles limitaciones. Informamos de los datos obtenidos en una población griega de recién nacidos de etnia blanca y de un solo centro. Sin embargo, las nuevas versiones de los bilirrubinómetros transcutáneos, como el BiliCheck, han demostrado que no se ven afectadas por la pigmentación cutánea11,12,14,15. Además, como el nomograma desarrollado se basa en las LR, debería ser aplicable incluso en poblaciones heterogéneas. Sin embargo, es necesario un estudio multicéntrico para la confirmación de esta presunción y para la evaluación de la aplicabilidad clínica de nuestro nomograma en distintos grupos raciales. Además, se debe mencionar que una gran proporción (38%) de los neonatos estudiados nacieron por cesárea y que hasta el 45,2% de los neonatos recibía lactancia artificial exclusiva. Sin embargo, como se muestra en la tabla 1, estos factores no ejercieron efecto sobre la prevalencia de una hiperbilirrubinemia importante.
La zona de riesgo medio no debería ser considerada como una desventaja del presente nomograma. La idea de un vector límite que pudiera clasificar de manera fiable una medición de la BTc en alto o bajo riesgo parece inalcanzable. El 75.º percentil del nomograma de BST, que se ha propuesto como tal delimitador17, tiene un mal rendimiento de predicción en nuestra población a las 24 h (LR positiva: 3,2; LR negativa: 0,14) y no pudo descartar una hiperbilirrubinemia importante a las 48 h de vida (LR negativa: 0,11). También vale la pena observar que la zona de riesgo medio de nuestro nomograma es muy amplia antes de las primeras 24 h, pero luego se estrecha de forma gradual (fig. 3). Es muy probable que este patrón refleje la mejoría gradual de la capacidad de predicción de los valores de BTc en el segundo y el tercer día de vida (fig. 2).
CONCLUSIONESLa detección sistemática neonatal universal prealta con medida de la BTc se ha convertido en práctica común en todo el mundo. En este estudio demostramos la capacidad de las mediciones de la BTc tomadas entre las 12 y las 72 h de vida para predecir una hiperbilirrubinemia importante. También ofrecemos un nomograma de predicción basado en la BTc para la evaluación de riesgo de hiperbilirrubinemia importante en los neonatos sanos a término o pretérminos tardíos. La aplicación de esta herramienta de predicción podría permitir un abordaje incruento, basado en el riesgo, de la hiperbilirrubinemia neonatal y podría guiar a los médicos a dirigir las evaluaciones y planificar las adecuadas estrategias de seguimiento de los neonatos con ictericia.
Correspondencia: Sotirios Fouzas, MD, Department of Pediatrics, University Hospital of Patras, Rio, Patras, 265 04, Grecia.
Correo electrónico: sfouzas@gmail.com