Las piscinas públicas deben ser desinfectadas, lo que se realiza habitualmente mediante la cloración del agua con hipoclorito sódico o cálcico, gas cloro o cloroisocianuratos. Estos desinfectantes clorados, denominados como “cloro”, se añaden al agua para liberar ácido hipocloroso, un potente oxidante que es el biocida activo. Al reaccionar con los compuestos nitrogenados originados por el sudor, la saliva o la orina de los nadadores, el ácido hipocloroso genera una compleja mezcla de subproductos nocivos, de los que los más irritantes son las cloraminas. Las mono y dicloraminas (NH2Cl y NHCl2, respectivamente) son hidrosolubles, y la suma de sus concentraciones en el agua se denomina cloro combinado. Por el contrario, la tricloroamina, también denominada tricloruro de nitrógeno (NCl3), es un gas insoluble en agua que, tras su formación, se libera inmediatamente al aire, confiriendo a las piscinas cubiertas su peculiar olor “a cloro”. Según la higiene del nadador y la ventilación de la piscina, los valores medios de tricloroamina en las piscinas cubiertas comunitarias europeas son del orden de 300 a 800 µg/m3, lo que convierte a este gas en uno de los contaminantes del aire más concentrados a los que se exponen regularmente los niños de los países desarrollados1-3. El aire de la piscina, especialmente el que está justo por encima de la superficie del agua, también está contaminado por vahos o aerosoles cargados de ácido hipocloroso, cloro combinado y otros subproductos hidrosolubles de la cloración, lo que aumenta la carga de los oxidantes inhalados activamente por los nadadores.
La toxicidad aguda de los desinfectantes basados en el cloro se conoce de antiguo. Aparecen con regularidad casos clínicos que describen lesiones pulmonares tras accidentes comunitarios en piscinas cubiertas4-7. La inhalación de gas cloro suele ser responsable de la lesión pulmonar aguda que, por fortuna, habitualmente es transitoria, recuperándose la función pulmonar al cabo de unas semanas. Sin embargo, hace poco que se ha reconocido la posibilidad de que los productos gaseosos y aerosolizados de la cloración del aire de la piscina puedan causar efectos respiratorios crónicos en los nadadores. Nuestras investigaciones en los niños que acuden a piscinas cubiertas cloradas han demostrado que la tricloroamina, probablemente junto con el ácido hipocloroso aerosolizado y las cloraminas, puede lesionar el epitelio pulmonar8 y promover el desarrollo del asma, especialmente en los niños atópicos9-11. Estos efectos pueden corresponder a las potentes asociaciones ecológicas entre la prevalencia del asma infantil y la disponibilidad de una piscina cubierta clorada que hemos puesto de manifiesto recientemente en Europa12. Los estudios de otros investigadores han confirmado los efectos nocivos de estas sustancias químicas sobre las vías respiratorias de nadadores de recreo13, incluyendo los asmáticos14, y ofrece más pruebas de que la asistencia a una piscina durante la lactancia podría contribuir al desarrollo de enfermedades alérgicas15.
Uno de los factores más críticos para determinar los riesgos de los productos de cloración para los niños parece ser la cronología de la exposición. El riesgo de desarrollar asma o de inflamación pulmonar, evaluado según el óxido nítrico espirado, parece ser máximo cuando los niños acuden regularmente a piscinas cubiertas antes de los 6-7 años de edad9,11. Una posible explicación de esta mayor sensibilidad de los niños pequeños es que no pueden nadar realmente antes de los 6 o 7 años de edad, por lo que deben acudir a la piscina de chapoteo, intensamente contaminada. Al jugar o aprender a nadar, los niños pequeños probablemente también inhalan y degluten más aerosoles y gotitas de agua que contienen ácido hipocloroso y cloraminas solubles. Otra posible exploración es que el pulmón de los niños muy pequeños todavía está en desarrollo, por lo que presumiblemente es más vulnerable a los efectos irritantes del cloro y sus derivados16.
Estos hallazgos plantean inevitablemente la cuestión de la seguridad de la práctica de la natación infantil, especialmente porque la mayor temperatura del agua y la mayor contaminación orgánica de las piscinas a las que acuden los niños pequeños son condiciones que favorecen la formación de los subproductos de la cloración. Se estima que, en Estados Unidos, de 5 a 10 millones de lactantes y niños preescolares participan en programas formales de aprendizaje de la natación, de los que probablemente varios millones han aprendido a nadar siendo lactantes17. La mayoría de los países industrializados ha popularizado sorprendentemente esta práctica en ausencia de datos fiables relativos a las posibles consecuencias de la exposición de los niños a los gases y aerosoles tóxicos del aire de las piscinas cubiertas. El único estudio que abordó este tema es el de Nystad et al18, quienes encontraron que la práctica de la natación infantil se asoció con un mayor riesgo de infecciones recurrentes de las vías respiratorias y de otitis media en el primer año de la vida. Sin embargo, este estudio no presentó datos sobre los valores de cloro en las piscinas a que acudían los lactantes, ni evaluó los efectos de la natación infantil sobre el desarrollo del asma y la alergia durante la infancia.
En este estudio transversal comparamos la salud respiratoria, el estado alérgico y la integridad del epitelio pulmonar de los niños en edad escolar que participaron en un programa de natación infantil con la de sus compañeros que no participaron en él. Siempre que fue posible se utilizaron medidas objetivas del resultado, además de los indicadores tradicionales de enfermedades alérgicas y respiratorias evaluadas mediante el cuestionario.
MATERIALES Y MÉTODOSUna revisión de 341 escolares de 10-13 años de edad identificó a 43 niños que habían participado en un programa de natación infantil. Los escolares fueron reclutados en 10 escuelas primarias del sudoeste de Bruselas. Los valores de cloro activo y combinado de la piscina pública a la que acudían los lactantes nadadores estaban en los límites recomendados en aquel momento (menos de 1,5 y 2 mg/l, respectivamente). Las concentraciones de tricloramina en el aire de la piscina, disponibles desde el inicio de la revisión sistemática de este gas en Bruselas, el año 2001, oscilaron entre 170 y 540 µg/m3 (media, 325 µg/m3, n = 7). Los valores de tricloramina probablemente fueran del mismo orden unos 10 años antes, ya que las condiciones de funcionamiento y los límites recomendados de cloro no habían variado desde los años ochenta. Se exploró a todos los niños en su escuela entre el 28 de marzo y el 29 de mayo de 2002, fuera de los principales períodos de polinización en Bélgica. El protocolo para la exploración de los niños ha sido descrito detalladamente en otro lugar12. En pocas palabras, tras el otorgamiento por escrito del consentimiento informado de los padres, los niños se sometieron a una exploración médica que incluyó la determinación del peso y la talla, la toma de una muestra de sangre (7 ml) tras la aplicación de una crema anestésica (Emla, Astra-Zeneca, Suecia). El asma se estudió mediante la prueba de broncoconstricción inducida por el esfuerzo19 (BIE, prueba basada en una disminución del 15% del VEF1 tras una marcha durante seis minutos a esfuerzo submáximo en una sala cerrada), prueba incruenta que ha demostrado su capacidad de predecir el asma clínica o los síntomas asmáticos en varios estu-20-22. La exploración incluyó también la medición del óxido nítrico espirado23 (NO) y de la proteína sérica de célula Clara24,25 (CC16) y la proteína D del surfactante (SP-D) (equipo SPD ELISA, Yamasa Corporation, Tokio, Japón), dos marcadores de la integridad del epitelio pulmonar profundo26,27. También se determinó en el suero la IgE total y la IgE frente a los 12 neumoalérgenos más habituales (Immulite® Total y AlatTOP®, DPC, LA). La información acerca de la salud respiratoria de los niños (síntomas respiratorios durante los últimos doce meses, asma diagnosticada por el médico y bronquitis recurrente) y su exposición a factores de riesgo de asma y alergia se tomó delcuestionario cumplimentado por los padres. El Comité de Ética de la Catholic University of Louvain aprobó el protocolo del estudio. La comparación estadística se basó en el test de µ2, el test t bilateral no apareada o el test U de Mann-Whitney. En las comparaciones múltiples se aplicó la corrección de Bonferroni. Para evaluar las asociaciones entre la práctica de la natación infantil y los resultados se utilizaron los análisis de regresión logística y retrógrada múltiple. Estudiamos 23 posibles factores de predicción, entre otros, el sexo, la IgE total y específica de aeroalérgeno, el antecedente familiar de enfermedades alérgicas, el tabaquismo materno durante el embarazo, el tabaquismo de los padres en el domicilio, los hermanos, la densidad del alojamiento, la exposición a animales domésticos, la asistencia acumulada a una piscina cubierta clorada y la accesibilidad a una piscina clorada. En los análisis de regresión múltiple, la asistencia acumulada a la piscina y la proporción CC16/SP-D que no tuvieron distribución normal se normalizaron mediante transformación logarítmica. Para permitir la transformación logarítmica, fijamos el mínimo de la asistencia acumulada en 2,5 horas en vez de cero (2,5 horas fue la mínima asistencia acumulada a la piscina notificada). Las variables independientes en los análisis de regresión múltiple se introdujeron a un valor de p de 0,25 y se mantuvieron en el modelo a un valor < 0,05. En los análisis de regresión logística se ajustó respecto a las variables restantes con un valor de p < 0,1. Estos análisis de regresión logística se repitieron en los niños que habían estado expuestos al humo de tabaco durante el embarazo o en su domicilio para detectar las posibles interacciones de estos dos factores con la práctica de la natación infantil. A menos que se indique lo contrario, sólo se informa de la odds ratio (OR) ajustada según las covariantes. Además, utilizamos el ANOVA bilateral para evaluar los cambios de las neumoproteínas séricas asociadas con la práctica de la natación infantil, el acceso a la piscina privada o la exposición al humo de tabaco durante el embarazo o en el domicilio y las posibles interacciones entre estos factores. Los análisis estadísticos se realizaron con SAS versión 9.1.3 (SAS International, Cary, NC).
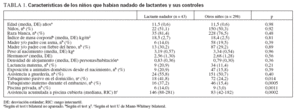
RESULTADOSComo muestra la tabla 1, los niños que empezaron a nadar de lactantes no difirieron de sus compañeros respecto a la edad, el sexo, la etnia, el índice de masa corporal ni el antecedente familiar de asma o fiebre del heno. Los niños del grupo de natación infantil tampoco difirieron significativamente de sus compañeros respecto al peso al nacimiento, el número de hermanos, la densidad del alojamiento o la proporción de niños con lactancia materna, que habían acudido a una guardería o que vivían con animales domésticos desde el nacimiento. Sin embargo, la proporción de niños expuestos al humo de tabaco en el domicilio o que lo habían estado durante el embarazo, así como la de niños con acceso a piscina clorada privada, fue notablemente mayor en los niños que nadaron desde lactantes. Estos niños también tuvieron una asistencia acumulada a piscinas cubiertas cloradas significativamente mayor.
TABLA 1. Características de los niños que habían nadado de lactantes y sus controles
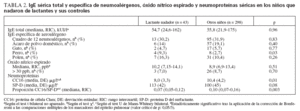
La tabla 2 compara el estado alérgico y los marcadores de la inflamación pulmonar y la integridad epitelial de los niños que nadaron de lactantes y de los controles. Los valores medios de la IgE sérica total y las prevalencias de IgE específica de los principales neumoalérgenos fueron similares entre los dos grupos. La tasa de sensibilización a la IgE específica de perro fue mayor en el grupo de natación infantil, diferencia que, sin embargo, perdió su significación estadística tras la aplicación del test de Bonferroni. Tampoco hubo diferencias entre los dos grupos respecto a los valores medios y la prevalencia de los valores elevados de NO espirado. La mayoría de los niños positivos en la prueba de eNO (n = 29) estaba sensibilizada frente al alérgeno ácaro del polvo doméstico (n = 21, 72,9%) y la IgE específica de aeroalérgeno (n = 26, 89,7%). Por el contrario, los niños del grupo de natación infantil mostraron una significativa disminución de la CC16 sérica y una disminución aún más significativa de la proporción CC16/SP-D, un índice que integra la lesión de las células Clara y las alteraciones de la permeabilidad de la barrera epitelial pulmonar. En el análisis multivariado, la natación infantil fue el único factor de predicción estadísticamente significativo de la CC16 sérica (r parcial = –0,14, p = 0,01), y esta práctica fue el determinante más importante de la proporción CC16/SP-D (valores transformados logarítmicamente, r parcial = –0,15, p = 0,006), proporción también influida por la asistencia a guardería (r parcial = –0,086, p = 0,007), la edad (r parcial = –0,058, p = 0,009), la lactancia materna (r parcial = –0,080, p = 0,022) y la etnia (r parcial = 0,087, p = 0,024). Así pues, la exposición pasiva al humo de tabaco durante el embarazo o en el domicilio, así como el acceso a una piscina privada no tuvieron influencia sobre las concentraciones séricas de CC16 o la proporción sérica CC16/SPD. El análisis de los efectos de la natación infantil y del tabaquismo pasivo sobre las neuropatías mediante el ANOVA bilateral confirmó la disminución de la CC16 sérica y de la proporción CC16/SP-D en los niños que nadaron de lactantes y no encontró interacción entre la natación infantil y el tabaquismo pasivo (todas las p µ 0,15).
TABLA 2. IgE sérica total y específica de neumoalérgenos, óxido nítrico espirado y neumoproteínas séricas en los niños que nadaron de lactantes y sus controles
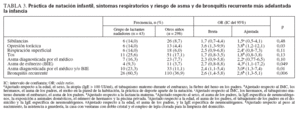
Como muestra la tabla 3, los cambios observados en las neumoproteínas séricas se asociaron con una peor salud respiratoria. Los niños que habían nadado de lactantes mostraron un mayor riesgo de opresión torácica. No hubo diferencias estadísticamente significativas en los demás síntomas respiratorios, que sin embargo tendieron a mostrar mayor prevalencia en el grupo de natación infantil. Estos niños también tuvieron una probabilidad casi tres veces mayor de ser positivos en la prueba de BIE, padecer asma diagnosticada por el médico y/o detectada por la prueba de BIE y de mostrar bronquitis recurrente. Vale la pena destacar que la falta de significación estadística del aumento del riesgo de asma diagnosticada por el médico con la natación infantil se debe a la influencia de la piscina privada (OR 4,27, IC del 95% 1,05 a 17,4). Además, la eliminación del factor piscina privada de la lista de factores de predicción aumentó la OR de asma diagnosticada por el médico asociada con la natación infantil hasta un valor significativamente superior a uno (OR 2,96, IC del 95% 1,08 a 8,11). No hubo asociación significativa entre cualquiera de estos resultados y la exposición pasiva al humo de tabaco, en el domicilio o durante el embarazo, excepto por el riesgo de sibilancias, que aumentó con el tabaquismo materno durante el embarazo (OR 2,75, IC del 95% 1,04 a 6,61). Sin embargo, la exposición pasiva al humo de tabaco y la natación infantil parecieron potenciar los efectos nocivos de la práctica de la natación infantil. Además, la OR de asma (diagnosticada por el médico y/o detectada con la prueba de BIE) asociada con la natación infantil fue superior a dos cuando los niños también estuvieron expuestos al tabaquismo de los padres (OR 6,54, IC del 95% 1,18 a 36,4 frente a OR 2,52, IC del 95% 0,86 a 7,39) mientras que las probabilidades de bronquitis recurrente asociadas con la natación infantil fue más de cuatro veces mayor entre los niños que habían estado expuestos al tabaquismo materno durante el embarazo (OR 6,99, IC del 95% 1,60 a 30,5 frente a OR 1,61, IC del 95% 0,71 a 3,65).
TABLA 3. Práctica de natación infantil, síntomas respiratorios y riesgo de asma y de bronquitis recurrente más adelantada la infancia
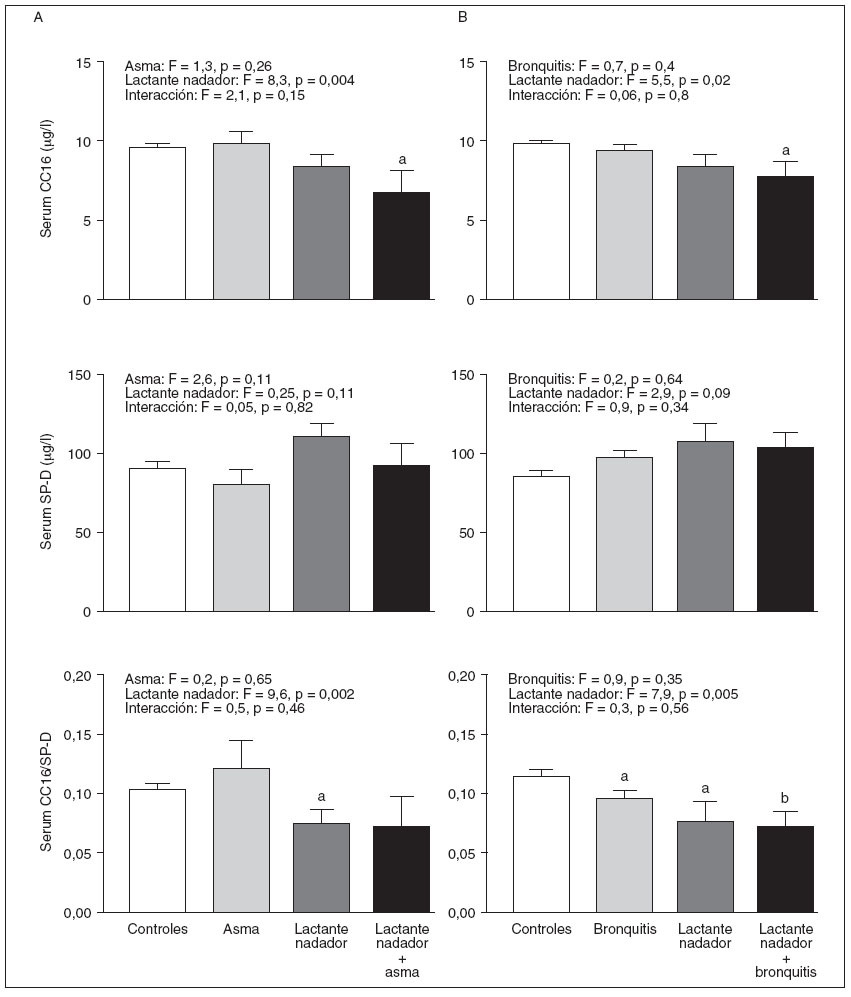
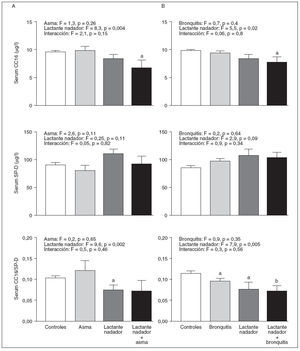
Para determinar si los cambios de las neumoproteínas séricas se debieron principalmente a la práctica de la natación infantil y no a meras consecuencias del asma o la bronquitis recurrente que fueron más frecuentes en el grupo de natación infantil, evaluamos mediante un ANOVA bilateral los efectos de la práctica de la natación infantil, el asma total o la bronquitis recurrente sobre las neumoproteínas séricas y las posibles interacciones entre estos factores. Como muestra la figura 1, el asma y la bronquitis recurrente carecen, por sí solas, de influencia sobre las concentraciones séricas de neumoproteínas, lo que contrasta vivamente con la muy significativa disminución de la CC16 sérica y la razón CC16/SP-D asociadas con la actividad de natación infantil (p < 0,001). Este análisis demuestra claramente que los valores de la CC16 sérica fueron, por término medio, los mínimos entre los niños nadadores desde lactantes que fueron asmáticos o habían padecido bronquitis de forma recurrente.
Fig. 1. Efectos del asma total (A), la bronquitis recurrente (B) y la práctica de la natación infantil (A y B) y de sus posibles interacciones sobre las concentraciones séricas de la proteína de célula Clara (CC16) y la proteína D asociada con el surfactante (SP-D) y sobre la proporción CC16 sérica/SP-D. Los resultados se evaluaron mediante ANOVA bilateral seguido del test de comparaciones múltiples de Dunett. ap < 0,05; bp < 0,01 indica los valores medios significativamente distintos a los de los controles. Media con EE.
DISCUSIÓNNuestros hallazgos demuestran que la práctica de la natación infantil se asocia con alteraciones del epitelio pulmonar que parece predisponer a los niños al desarrollo de asma y de bronquitis recurrente. Estos efectos no pueden ser explicados por las diferencias hereditarias de tación infantil, por término medio, hubiera estado más expuesto al tabaquismo de los padres o al cloro de las piscinas privadas. Nuestro estudio no mostró pruebas de que la natación infantil aumentase los riesgos de la alergia respiratoria. Tampoco hubo aumento del riesgo de inflamación de las vías respiratorias, a juzgar por la prueba del eNO, hallazgo que no sorprende dada la muy estrecha relación entre el eNO y la sensibilización alérgica observada por nosotros y también notificada en estudios recientes28,29.
Como cualquier estudio epidemiológico que utilice datos de cuestionarios autocumplimentados, el nuestro puede ser propenso a un sesgo de recuerdo. Sin embargo, creemos que es poco probable que nuestras observaciones hayan sido generadas o distorsionadas por un sesgo sistemático de las respuestas de los padres a las preguntas sobre la salud o la práctica de la natación de su hijo. El argumento más potente en contra de esta posibilidad es que las observaciones de mayor significación estadística fueron realizadas con mediciones objetivas del resultado (neumoproteínas séricas y prueba BIE) que los padres desconocían al rellenar el cuestionario. Los padres tampoco conocían la hipótesis estudiada, porque el estudio no se diseñó inicialmente para determinar de forma específica los efectos de la práctica de la natación infantil. Además, la hipótesis estudiada de la asociación de los efectos respiratorios adversos con la natación infantil dista mucho de ser habitual en la comunidad. En realidad, esta hipótesis es justo la contraria a la sensación que probablemente tenían los padres cuando se decidieron a llevar a su lactante a la piscina. Así pues, la posibilidad de que hubieran sesgado sus respuestas a favor de los efectos adversos no parece muy grande.
Nuestros datos indican que la peor salud respiratoria de los niños que nadaron de lactantes podría estar ligada con la lesión de las vías respiratorias distales detectada por la determinación de las neumoproteínas séricas. La concentración sérica de CC16 es un marcador validado de la integridad de la barrera epitelial pulmonar, que refleja tanto el número de células Clara que recubren las vías respiratorias terminales como la permeabilidad de la barrera alvéolo-capilar26,27. Tras ajustarla al valor de la proteína asociada con el surfactante como la SP-D, la concentración de CC16 demuestra ser un marcador aún más sensible, muy probablemente porque esta proporción integra tanto la lesión de las células Clara como el mayor goteo de la barrera alvéolo-sanguínea30. En las personas y los roedores expuestos de forma aguda o crónica a una serie de tóxicos pulmonares se ha demostrado una disminución de la CC16 sérica que refleja una pérdida paralela de células Clara31. Por ejemplo, el tabaquismo activo conduce a una disminución del 20 al 30% de CC16 sérica, lo que mimetiza una disminución paralela del número de células Clara30-34. Se ha observado una disminución similar de CC16 sérica tras la exposición laboral a sílice cristalino35 o a humo de chimenea36. La disminución de la CC16 sérica en los niños que nadaron de lactantes promedió un 20%. Así pues, es casi de la misma magnitud que la provocada por el humo de tabaco o las sustancias químicas industriales en los adultos. Si nos fijamos en las consecuencias clínicas del tabaquismo activo o de las exposiciones laborales a la sílice cristalina y a otros irritantes pulmonares, realmente no sería sorprendente que alteraciones similares del epitelio respiratorio de los niños pequeños les hiciera más propensos a desarrollar algunas enfermedades respiratorias. Esta interpretación también es compatible con las propiedades antiinflamatorias de CC1637,38 y con el hallazgo de la asociación del asma39 y otras enfermedades respiratorias40 con el conjunto intrapulmonar inferior de CC16 debido a la lesión de la célula Clara o a la extravasación intravascular de la proteína.
Dada la falta de datos de la toxicidad de las sustancias químicas de las piscinas respecto a las vías respiratorias de los lactantes y los niños pequeños, es difícil identificar el factor responsable de estas alteraciones de las vías respiratorias. Sin embargo, sospechamos mucho que el epitelio de las vías respiratorias se ve reiteradamente agredido por los productos de cloración que los lactantes inhalan como gases, aerosoles o incluso como agua. Uno de los culpables podría ser la tricloramina, el gas muy volátil y reactivo formado al reaccionar el cloro con la materia orgánica aportada por los nadadores. También se ha observado que este gas, que otorga a las piscinas cubiertas su característico olor a cloro, causa asma y lesiona el epitelio pulmonar de los socorristas y los nadadores de recreo8-11. Como sus pulmones todavía están en desarrollo, los lactantes pueden ser especialmente sensibles a este irritante y verse afectados pese al tiempo, bastante limitado, que pasan en las piscinas (habitualmente 20-30 minutos por sesión). Los valores de tricloramina en el conjunto estudiado fueron, por término medio, inferiores a la pauta provisional de calidad del aire durante 2 horas de 500 µg/m3, recientemente recomendada por la Organización Mundial de la Salud41 (OMS). Si la tricloramina fuera responsable de los efectos respiratorios observados en nuestro estudio, significaría que la pauta de la OMS es demasiado permisiva y debería disminuir sus límites para estar en concordancia con los estudios8,9 que demuestran que la tricloramina puede degradar la barrera epitelial pulmonar de los nadadores a unas concentraciones de 355 a 490 µg/m3. Otra vía de exposición importante, que podría causar un daño significativo a los pulmones del niño, es la inhalación de los aerosoles o de pequeños volúmenes de agua clorada cuando los niños juegan activamente o tienen la cabeza por debajo del agua. La lesión de las vías respiratorias causada por la inhalación de agua intensamente clorada parece especialmente verosímil porque los valores máximos recomendados de cloro en la piscina de Bruselas a que acudían nuestros niños cuando eran lactantes eran relativamente altos. Por ejemplo, el límite recomendado de cloro combinado era de 2 ppm, concentración dos veces mayor que la norma actual (0,8 ppm) y diez veces mayor que la norma aplicada en Alemania15 (0,2 ppm). Como los lactantes no pueden controlar su respiración con tanta facilidad como cuando crecen, la práctica de la natación infantil se considera segura por el reflejo laríngeo o de la mordaza desencadenados cuando el agua penetra en la boca del lactante. Al cerrar la laringe con la epiglotis, se supone que este reflejo impide que el agua de la piscina entre en los pulmones42. Sin embargo, el reflejo de la mordaza, aun siendo muy eficaz, no puede impedir que pequeñas cantidades de agua clorada depositadas o atrapadas en las vías respiratorias altas sean transportadas a mayor profundidad de los pulmones cuando el niño sube a la superficie para respirar.
Los casos de hiponatremia descritos tras la inmersión de lactantes en las piscinas43,44 atestiguan la cantidad de agua que puede ingerir, y posiblemente inhalar, un niño cuando está bajo el agua. Finalmente, no podemos excluir la posibilidad de que la inhalación de agua hipotónica también provoque algunas alteraciones epiteliales que agraven los efectos de los productos de cloración.
Aunque no entrevistamos específicamente a los padres sobre este tema, nuestro estudio ofrece algunos puntos de vista interesantes de las razones por las que los padres llevan a sus hijos a los programas de natación del lactante. Como podríamos esperar, la prevención del ahogamiento parece ser una razón importante porque los niños con acceso a una piscina privada fueron cinco veces más numerosos en el grupo de natación infantil comparados con los demás. Aunque el ahogamiento es la primera causa de lesión accidental y muerte en los niños, y afecta principalmente a las piscinas privadas, debemos señalar que la protección conseguida mediante los programas de natación infantil es muy discutida. Según la American Academy of Pediatrics, no existe una clara evidencia científica de que la participación en estos programas disminuya la probabilidad de ahogamiento17. La American Academy of Pediatrics argumenta que, hasta los 4 años de edad, los niños no están preparados por su desarrollo para recibir lecciones formales de natación y que la participación entre programas podría dar a los padres una falsa sensación de seguridad acerca de la habilidad de su hijo en el agua. La American Academy of Pediatrics no tuvo en cuenta los peligros de las sustancias químicas pero si, como sugieren nuestros hallazgos, el cloro utilizado para desinfectar las piscinas impusiera alguna amenaza a la salud del niño, seguramente estaría justificado realizar una valoración crítica de los programas de natación infantil. No obstante, podría existir una razón, todavía más discutible, que alentase a los padres a participar en los programas de natación infantil. De forma intrigante, el grupo de natación infantil incluyó a una proporción mucho mayor de niños que habían estado expuestos in utero o a domicilio al humo de tabaco. El origen de esta diferencia es oscuro, pero creemos que podría relejar el deseo de los padres de mitigar los efectos adversos del tabaquismo pasivo ofreciendo a su hijo la posibilidad de practicar una actividad saludable. La desagradable ironía es que el resultado puede ser justo el contrario, porque nuestro estudio indica que la actividad de natación infantil interactúa con el tabaquismo pasivo para aumentar en gran medida los riesgos del asma o la bronquitis recurrente.
La principal limitación de nuestro estudio reside ciertamente en el relativamente pequeño tamaño de la muestra del grupo de natación infantil. Dado que menos del 15% de los escolares de Bruselas participa en estos programas, éste fue el máximo tamaño de la muestra que pudimos conseguir en un estudio poblacional sobre 341 niños. La alternativa sería reclutar a los niños mediante las organizaciones de natación infantil. Sin embargo, suponiendo que estas organizaciones estuvieran dispuestas a colaborar con una investigación que explora los riesgos relacionados con las piscinas cloradas, el estudio se enfrentaría a la dificultad de evitar el sesgo de respuesta o el de selección y, sobre todo, con la dificultad de reclutar una población de control bien igualada. Por fortuna, la limitada potencia estadística de nuestro estudio estuvo equilibrada con el empleo de mediciones sensibles del resultado, lo que condujo a asociaciones particularmente potentes con pocas probabilidades de ser explicadas únicamente por el azar. Sin embargo, el pequeño tamaño de nuestro estudio no nos permitió extraer conclusiones definitivas acerca del impacto del cloro de la piscina privada al que los niños del grupo de natación infantil estuvieron expuestos con mayor frecuencia. Por supuesto, tener acceso a una piscina clorada privada fue un significativo factor de predicción de asma diagnosticada por el médico, que debilitó ligeramente la asociación con la natación infantil. Evidentemente, ésta es otra área no explorada que merece más investigación, especialmente porque las piscinas residenciales suelen tener mayores valores de cloro que las públicas y ofrecen a los niños unas posibilidades casi ilimitadas de nadar durante la estación calurosa.
CONCLUSIONESEn conclusión, nuestro estudio demuestra que la práctica de la natación infantil en piscinas cubiertas cloradas puede asociarse con alteraciones de las vías respiratorias que predispongan a los niños al asma y la bronquitis recurrente más adelantada la infancia. Dada la creciente popularidad de las piscinas, es clara la necesidad de evaluar los efectos de los productos de cloración sobre las vías respiratorias de los niños muy pequeños. Mientras tanto, como en la mayoría de los países estos productos no están tan estrictamente regulados y controlados como los indicadores de los riesgos microbianos, sólo podemos recomendar precaución antes de llevar regularmente a los lactantes a piscinas con mal mantenimiento y excesivos valores de cloro en el agua y en el aire.
AGRADECIMIENTOSEste estudio fue financiado por la Brussels Capital Region.
Alfred Bernard es Research Director del National Fund for Scientific Research en Bélgica.
Correspondencia: Alfred Bernard, PhD, Unit of Toxicology, Faculty of Medicine, Catholic University of Louvain, Avenue E Mounier 53, Box 53.02, B-1200 Bruselas, Bélgica.
Correo electrónico: alfred.bernard@uclouvain.be