La infección interpandémica estacional de la gripe tiene un importante impacto mundial, y la vacunación es una importante intervención de salud pública1-5. La vacunación también es una intervención clave para contener la gripe pandémica6,7. Incluso con una producción vacunal bien establecida para la gripe interpandémica, a veces se produce una escasez de abastecimiento. Por lo tanto, está justificada la preocupación de que, cuando es necesario vacunar a grandes poblaciones en un pequeño período de tiempo, la demanda puede superar a la capacidad de producción.
La vacunación intradérmica explota la abundancia de células que presentan antígenos (macrófagos y células dendríticas), que permite provocar una sólida respuesta inmunitaria mediante la administración de una pequeña dosis de antígeno directamente a la piel, que puede ser una solución a la escasez de vacuna. La vacunación intradérmica no es nueva. La vacunación con el bacilo de Calmette-Guerin (BCG), ampliamente extendida en muchas partes del mundo, se realiza de forma rutinaria por vía intradérmica. Desde los años cuarenta se han realizado estudios que exploran la administración intradérmica de las vacunas de la hepatitis B, la rabia y la gri-10-16. Sin embargo, estos primeros estudios carecían de grupo de control o tenían grupos de control con administración subcutánea, fueron realizados con vacunas mono o bivalentes con dosis de antígeno no comparables directamente con las actualmente disponibles, carecían de una clara definición de la respuesta en al menos un estudio o utilizaron determinaciones rudimentarias en comparación con las actualmente disponibles. Dos artículos recientes informan de la eficacia de la vacunación intradérmica contra la gripe a dosis reducida en los adultos17,18. Es importante investigar la posibilidad de la vacunación contra la gripe por vía intradérmica en los niños.
MÉTODOSDiseño del estudioEstudio abierto, aleatorizado, para comparar la seguridad y las respuestas inmunitarias de la administración intramuscular de una vacuna de la gripe inactivada con las de la administración intradérmica de la misma vacuna a un quinto de la dosis a niños sanos de 3 a 18 años de edad. La hipótesis fue que la vacunación intradérmica con la quinta parte de la dosis habitual de la vacuna de la gripe produjo una inmunogenicidad comparable a la vacunación intramuscular a dosis completa dela misma vacuna. El Comité de Ética conjunto de la University of Hong Kong y el Queen Mary Hospital aprobó el protocolo de estudio, que se atuvo a la Declaración de Helsinki de 1975, revisada en 1983. Los sujetos fueron pacientes ingresados en el hospital por una enfermedad aguda, o seguidos en nuestra consulta externa. Antes de la inclusión se obtuvo el consentimiento informado por escrito de los padres y los niños mayores. Los sujetos fueron considerados inelegibles si tenían una alteración subyacente que les ponía en riesgo de complicaciones de la gripe o necesitaban una medicación habitual. Para los niños entre 3 y < 9 años de edad, sólo se incluyeron a los que habían sido vacunados anteriormente de la gripe para evitar la necesidad de una segunda dosis de vacunación. Los sujetos se igualaron por la edad y se utilizó una lista de aleatorización, con tamaño de bloque de cuatro, generada por ordenador, para asignar a los sujetos del estudio para recibir una dosis intramuscular de 0,5 ml de vacuna inactivada trivalente de la gripe, o una dosis intradérmica de 0,1 ml de la misma vacuna. La aleatorización fue realizada por personal del estudio inmediatamente antes de la vacunación. Los investigadores de laboratorio desconocían la asignación de la aleatorización. Se determinó la talla y el peso y se tomó la historia de vacunación contra la gripe en el año anterior de todos los sujetos. Los niños fueron vacunados en octubre y noviembre de 2005, antes de la estación de la gripe en Hong Kong, que suele alcanzar el máximo en enero o febrero.
VacunaciónLa vacuna de la gripe (Fluarix, GlaxoSmithKline) utilizó el antígeno superficial purificado equivalente a los tipos y subtipos de la gripe recomendados por la Organización Mundial de la Salud para la estación 2005-8: cepa A/New Caledonia/20/99 (H1N1) like; cepa A/California/7/2004 (H3N2) like y cepa B/Shanghai/361/2002 like. Cada dosis de 0,5 ml contiene al menos 15 g de antígeno hemaglutinina por cepa recomendada.
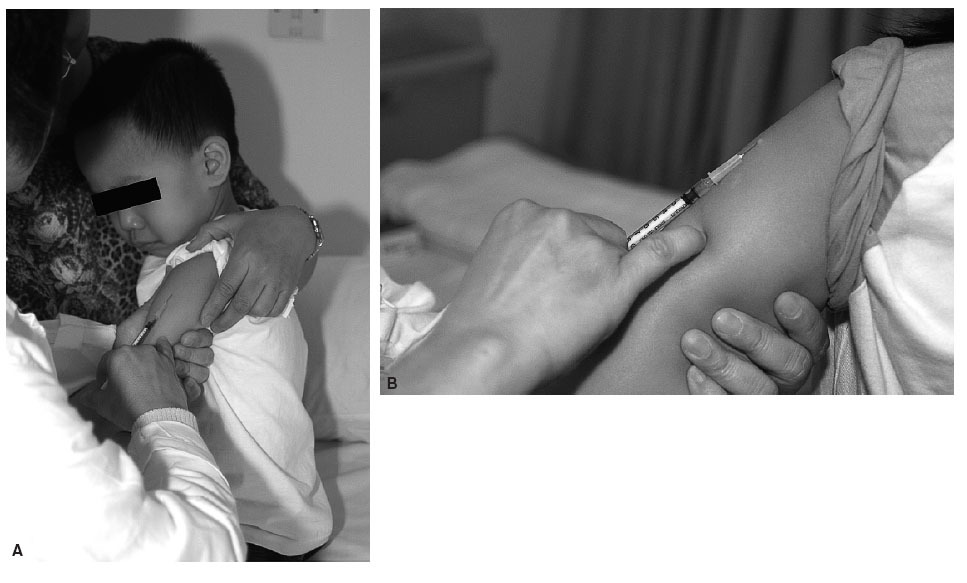
La inyección intramuscular se realizó en el área deltoidea según el procedimiento habitual. La inyección intramuscular se realizó mediante una jeringa de 1 ml calibrada en centésimos (Becton Dickenson). Una enfermera de investigación administró todas las inyecciones en el área deltoidea de los sujetos (figs. 1A y B). La aguja se insertó en un ángulo de 15 grados con la piel, según las técnicas estándar de inyección intradérmica18. La enfermera de investigación calificó al habón resultante como 0 (ausencia de habón), 1 (diámetro del habón de 1-2 mm), 2 (diámetro de 3-5 mm) o 3 (diámetro > 5 mm).
Fig. 1. (A) Vacunación intradérmica utilizando la técnica de una sola mano con ayuda de un cuidador en un niño de 3 años de edad durante el estudio. (B) Vacunación intradérmica utilizando la técnica de una sola mano.
SeguridadTras la vacunación, los sujetos se sometieron a observación por reacciones agudas durante 15 o 30 minutos. Se entregó a los cuidadores un diario para anotar las reacciones durante 3 días. Las reacciones a vigilar fueron: fiebre, malestar, escalofríos, eritema, induración y hematoma del punto de inyección con un diámetro superior a 5 mm. Los efectos secundarios se clasificaron según su gravedad. Un episodio adverso leve fue el que tuvo unos síntomas bien tolerados, una reacción moderada produjo interferencia con las actividades habituales y el grave desembocó en la imposibilidad de realizar las actividades habituales. El personal de investigación obtuvo telefónicamente la información de los episodios adversos a los 4 días. Se pidió a los padres que devolvieran el diario para su control cuando los sujetos volvieron a la extracción de sangre tras la vacunación.
Estudios serológicos y mediciones del resultadoSe tomaron muestras séricas de cada sujeto el día 0 (antes de la vacunación) y el día 21. Las muestras apareadas fueron estudiadas conjuntamente respecto a la inhibición de la hemaglutinación (IHA) utilizando los antígenos de referencia del equipo de la OMS suministrado por el WHO Influenza Collaborating Centre, Centres for Disease Control and Prevention, Atlanta, Ga. Los sueros fueron tratados con enzima destructora del receptor (EDR) (1:3) a 37 °C durante una noche para eliminar los inhibidores inespecíficos, y la EDR residual fue destruida mediante inactivación por calor a 56 °C durante 30 minutos. Las diluciones seriadas al doble del suero tratado con EDR (1 en 10) fueron tituladas en una placa de microtitulación de 96 pocillos frente a 4 unidades HA de los antígenos de referencia (A/New Caledonia/20/99 [H1N1], A/Wyoming/3/2003 [H3N1] y B/Shanghai/361/2002 like) utilizando hematíes de pavo al 0,25%19.
Sobre los títulos de anticuerpos a cada antígeno obtenido en los dos grupos de pacientes se realizaron los siguientes análisis: la media geométrica de los títulos (MGT) antes y 21 días después de la vacunación; los múltiples de aumento de la MGT (calculado como la media del cociente del título antes y 21 días después de la vacunación); la tasa de seroprotección20 (calculada como el porcentaje de sujetos con un título de anticuerpos prevacunación 40 que desarrollaron un aumento al cuádruplo O un título 40 tras la vacunación). Los que mostraron un aumento al cuádruplo del título de anticuerpos se determinaron globalmente en los grupos intramuscular e intradérmico, y se realizó un análisis de subgrupo para los que tenían un título de anticuerpos previo a la vacunación 40 y los que tenían un título 40.
Análisis estadísticoLos dos métodos de administración vacunal se consideran equivalentes si el intervalo de confianza (IC) del 95 por ciento de la razón de la media geométrica de los títulos (en forma de porcentaje) es suficientemente estrecho y cae en un rango del 80 al 120 por ciento. Un tamaño de muestra de 50 sujetos por grupo tendría un poder estadístico del 80 por ciento para identificar una diferencia entre los dos métodos, utilizando una prueba bilateral y una tasa de error tipo 1 del 5 por ciento, siendo una diferencia significativa una diferencia mínima de una razón de 2,05 en la media geométrica del título y una razón de 2,33 en los múltiplos de aumento entre los dos grupos. Para compensar una tasa de atrición del 12% se incluyó a 56 sujetos por cada grupo. En el análisis por intención de tratar, los valores omitidos en la serología convaleciente recibirían el valor medio del grupo. Se utilizó la correlación de Pearson para detectar la correlación entre los títulos individuales del grupo intradérmico con la edad, el tamaño de la induración y el índice de masa corporal. La comparación de los episodios adversos de los dos grupos se realizó mediante la prueba de 2.
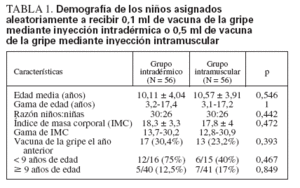
RESULTADOSCincuenta y seis sujetos fueron asignados aleatoriamente a recibir la vacunación en cada uno de los grupos, intramuscular o intradérmico. Dos niños del grupo intramuscular no regresaron a la toma de sangre convaleciente. La tabla 1 muestra la demografía de los sujetos. Fueron comparables respecto a la edad, la razón niño a niña, el índice de masa corporal (IMC) y la historia de la vacuna de la gripe en el año anterior. Cuando se utiliza la técnica de inyección con una mano, la vacunación intradérmica no provocó problemas significativos, ni siquiera en los niños jóvenes. La mediana de la puntuación de las lesiones intradérmicas fue 2 (habón de 3-5 mm), con un rango de 1 a 3.
TABLA 1. Demografía de los niños asignados aleatoriamente a recibir 0,1 ml de vacuna de la gripe mediante inyección intradérmica o 0,5 ml de vacuna de la gripe mediante inyección intramuscular
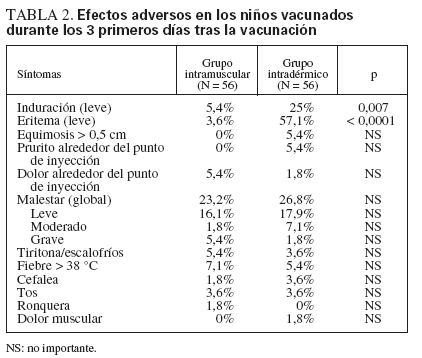
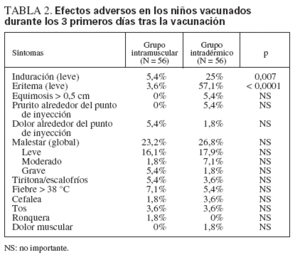
Capacidad de reacciónSe dispuso de los datos completos de la capacidad de reacción de todos los sujetos. Ambos métodos de vacunación de la gripe fueron bien tolerados (tabla 2). No es sorprendente que la induración se notificase con mayor frecuencia en el grupo intradérmico, pero en su mayoría desapareció al día siguiente. Se informó de eritema leve en el 57,1% del grupo intradérmico, frecuencia significativamente mayor que la del grupo intramuscular (3,6%). No hubo otra diferencia significativa de efectos adversos locales o sistémicos en ambos grupos.
TABLA 2. Efectos adversos en los niños vacunados durante los 3 primeros días tras la vacunación
InmunogenicidadDe los 112 sujetos incluidos y vacunados, 110 regresaron a la toma de sangre convaleciente. Dos sujetos del grupo intramuscular, de 9,4 y 10,1 años de edad, no regresaron para determinar la serología convaleciente, y se les asignó la media del título de serología del grupo. La sangre convaleciente se tomó a una media de 23,7 ± 3,1 días y de 24,4 ± 5,9 días después de la vacunación en los grupos intradérmico e intramuscular, respectivamente (p = ns). Todas las muestras sanguíneas se tomaron antes del inicio de la estación de la gripe en enero de 2006.
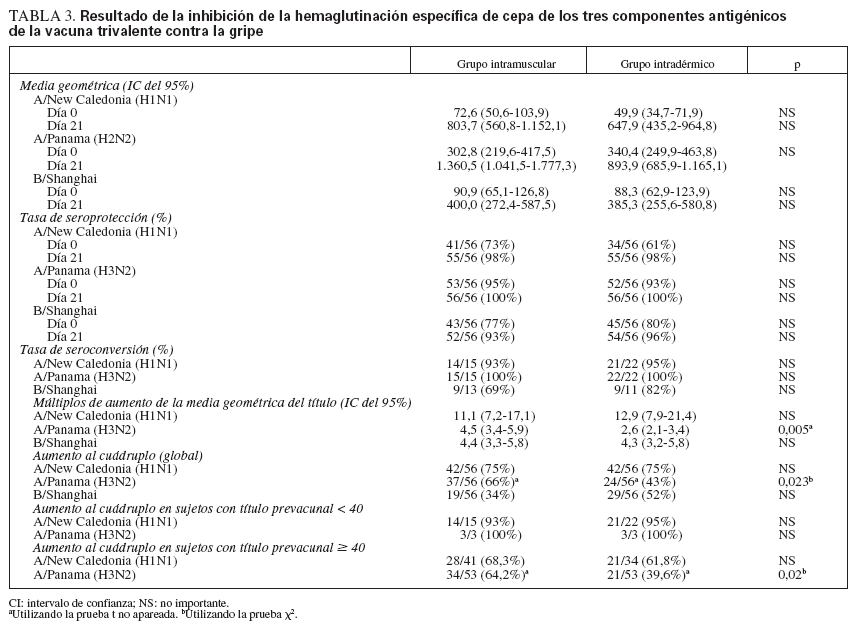
No hubo diferencia estadísticamente significativa en la tasa de seroconversión y en la de seroprotección tras la vacunación entre los sujetos de los grupos frente a cualquiera de los tres antígenos (tabla 3). Ambos grupos mostraron grandes MGT tras la vacunación frente a los tres antígenos, especialmente a los dos antígenos influenza A. No hubo correlación entre los títulos individuales de anticuerpos con la edad, el IMC o el antecedente de vacuna de la gripe en el año anterior. Tampoco hubo correlación entre los títulos de anticuerpos y el tamaño de la induración en el grupo intradérmico (datos no ofrecidos). No hubo diferencia significativa entre los grupos intramuscular e intradérmico en los múltiplos de aumento de la MGT de anticuerpos a influenza A/Caledonia (H1N1), de 11,1 y 12,9, respectivamente, o B/Shandong, 4,4 y 4,3, respectivamente. Sin embargo, hubo una diferencia significativa de los múltiplos de aumento de la MGT frente a influenza A/Panama (H3N2), con un aumento de 4,5 veces en el grupo intramuscular, comparado con el 2,6 del grupo intradérmico (p = 0,005). Pese a esta diferencia, ambos abordajes provocaron una MGT muy alta: 1.360,5 y 893,9 en los grupos intramuscular e intradérmico, respectivamente. En los que tuvieron un título de anticuerpos previo a la vacunación < 40 a cualquiera de los tres antígenos (n = 68), no hubo diferencia en los múltiplos de aumento de la MGT frente a influenza A/Panama (H3N2) entre el grupo intramuscular (66%) y el grupo intradérmico (43%). Los que tuvieron un menor título previo a la vacunación tuvieron más probabilidades de responder con un aumento del título al menos del cuádruplo. El porcentaje de sujetos de cualquier grupo con títulos previos a la vacunación de < 40 frente a cualquiera de los tres antígenos con un aumento al menos del cuádruplo de la MGT fue mayor que el de los que tenían títulos previos a la vacunación de > 40 (tabla 3). Los sujetos con grandes títulos previos a la vacunación y un aumento modesto o nulo del título tras la vacunación fueron más numerosos en el grupo intradérmico. Veintisiete sujetos (55%) del grupo intradérmico con títulos previos a la vacunación frente a influenza A/Pana-ma (H3N2) 1:160 mostraron un aumento del título menor que el cuádruplo, comparados con 16 sujetos (33,3%) del grupo intramuscular (p = 0,04).
TABLA 3. Resultado de la inhibición de la hemaglutinación específica de cepa de los tres componentes antigénicos de la vacuna trivalente contra la gripe
Para validar el cálculo de potencia de nuestro tamaño de muestra, calculamos, con el múltiplo de aumento relativo al día 0, que las desviaciones estándar de la MGT y la razón media del log10 de la MGT eran 0,66 y 0,764, respectivamente, con pequeñas variaciones según la cepa. Así pues, el tamaño de la muestra, 56 en cada grupo, tuvo un poder estadístico del 80 por ciento para identificar una diferencia entre los dos métodos, con una prueba bilateral y una tasa de error tipo 1 del 5 por ciento, de una razón de 2,07 en la MGT y una razón de 2,52 en el múltiplo de aumento.
DISCUSIÓNLa administración intradérmica de la vacuna de la gripe en los niños fue segura e inmunogénica. La reacción local fue más habitual en los sujetos que recibieron la inyección intradérmica. Este hallazgo es similar al notificado en un estudio de vacuna intradérmica de la rabia en los niños15. No encontramos diferencias en las reacciones sistémicas entre los dos grupos.
La aplicación intradérmica de la quinta parte de la dosis habitual produjo unas MGT de IHA muy altas frente a los tres antígenos de la vacuna contra la gripe. Estos títulos fueron mucho mayores que los notificados en estudios similares sobre adultos17,18. Sin comparación directa, se desconoce si la vacunación intradérmica contra la gripe es, en realidad, más inmunogénica que en los adultos. Sin embargo, los datos disponibles demuestran que la piel joven tiene más células de Langerhans en reposo y muestra mayor respuesta de migración tras la inyección intradérmica que la piel anciana21. Como H3N2 está circulando por todo el mundo desde 1968 y H1N1 desde 1977, y el diseño incluyó a los niños pequeños con vacuna previa contra la gripe, no es sorprendente que la mayoría de los niños con una edad media de 10 años en este estudio tuvieran ya títulos de IHA 1:40 frente a ambos antígenos. La elevada y protectora MGT previa a la vacunación apoya la idea de que los niños de Hong Kong están sometidos a una intensa experiencia con la gripe. Se ha sugerido que en una población parcialmente seropositiva como la del estudio actual, los múltiplos de aumento de los títulos tienden a infravalorar la inmunogenicidad de la vacuna22. Esto, y no la vía de la administración, puede explicar parcialmente la significativa diferencia estadística del múltiplo de aumento de la MGT contra influenza A/Panama (H3N2). Esta hipótesis se ve apoyada por: 1) el comparable múltiplo de aumento frente a influenza A/Caledonia (H1N1) e influenza B/Shandong, frente al que sujetos de ambos grupos tuvieron una menor MGT previa a la vacunación y tuvieron menos probabilidades de presentar un valor de anticuerpos 1:40, 2) un mayor porcentaje de aumento al menos al cuádruplo del título en ambos grupos entre los que tuvieron títulos seronegativos previos a la vacunación y 3) un robusto y equivalente múltiplo de aumento de los títulos seronegativos previos a la vacunación contra los tres antígenos en ambos grupos. En la vacunación contra la rabia de los niños preocupó que los anticuerpos provocados por la vacunación intradérmica tuvieran títulos bajos, y posiblemente no duraderos15. Dada la muy elevada MGT tras la vacunación, no es probable que la diferencia de la MGT tras la vacunación contra influenza A/Panama (H3N2) entre los dos grupos tuviera significado clínico. Además, al administrar anualmente la vacuna contra la gripe, la duración a largo plazo de los anticuerpos tiene menos relevancia.
La piel ha sido objetivo de la vacunación durante muchos años y recientemente se ha renovado el interés por explotar este órgano inmunitario. Los estudios realizados en los animales y las personas han ofrecido resultados prometedores23-25. La vacunación epidérmica que incluye la inmunización transcutánea o los inyectores a chorro sin aguja busca la epidermis abundante en células de Langerhans, y la vacunación epidérmica y dérmica que utiliza la pistola génica o la tecnología de electroporación busca tanto las capas de piel que contienen células de Langerhans como las que contienen células dendríticas26. Estos métodos de vacunación necesitan preparaciones y dispositivos especiales. La vacunación intradérmica busca la dermis rica en células dendríticas y puede realizarse mediante una simple jeringa y aguja utilizando una preparación de vacuna ya existente. Sin embargo, la inyección intradérmica necesita, por lo general, más habilidad que la intramuscular. Realizar la vacunación intradérmica en niños pequeños, que forcejean, es más difícil que en lactantes pequeños inmóviles. El estudio actual ha demostrado que la inyección intradérmica se puede realizar con seguridad y eficacia incluso en niños de sólo 3 años de edad mediante la técnica de inyección con una sola mano, que se puede dominar fácilmente con jeringas de tuberculina, y que también se puede realizar eficazmente en los niños con exceso de peso con mayor cantidad de grasa subcutánea. Esto tiene importantes consecuencias para su empleo en países pobres en recursos, ya que los aparatos sofisticados probablemente signifiquen aumento de los costes.
Nuestro estudio tiene limitaciones. Nuestros sujetos tenían una intensa experiencia con la gripe. Aunque esta situación refleja la realidad de que una parte de la población probablemente sea seropositiva a las cepas de la vacuna, esto no es cierto acerca de la cepa pandémica. Una persona experta administrará todas las inyecciones intradérmicas. Se podría esperar una mayor variación de los resultados cuando son muchas las personas que administran esta vacuna. Nuestro diseño recogió muestras de sangre convaleciente a los 21 días de la vacunación. En condiciones ideales, otra toma de muestra a los 42 días de la vacunación hubiera ofrecido información adicional sobre la cinética de los anticuerpos. Sin embargo, la reiterada toma de muestras de sangre no suele ser bien recibida por los padres de niños pequeños sanos. Los futuros estudios deben incluir a niños menores de 3 años de edad, niños seronegativos a las cepas vacunales, niños con diversos grados de inmunodepresión, comparar una dosis intradérmica con el régimen de 2 dosis intramusculares en los niños pequeños, administradores múltiples de vacunas, seguimiento más prolongado y estudios que incluyan la eficacia para determinar si los anticuerpos provocados por las distintas vías de administración son funcionalmente comparables.
Este estudio ha ofrecido datos alentadores de que la inyección intradérmica puede provocar una respuesta inmunitaria contra la gripe comparable a una dosis mucho menor en los niños sanos de tan sólo 3 años de edad, y que es una estrategia útil ante la escasez de vacunas. Se sabe que las vacunas pandémicas con hemaglutininas aviares, especialmente la vacuna H5N1 no ayudada, son malos inmunógenos27,28. No se sabe si la vacunación por vía intradérmica ofrecerá alguna ventaja. Un informe reciente de la administración intradérmica de una vacuna H5N1 subvirión indica que no fue inmunogénica hasta 3 dosis en los adultos sanos29. En la actualidad estamos investigando la respuesta celular de nuestros sujetos para definir mejor el papel de la vacunación intradérmica contra la gripe.
AGRADECIMIENTOSEste trabajo fue financiado por becas de investigación del Council of Hong Kong (HKU 7396/03M), Ellison Medical Foundation (beca 1D-1A-0036-02) y Vice Chancellors Development Fund, University of Hong Kong.
Damos las gracias a los niños y los padres que participaron en el estudio, a nuestro estupendo equipo de personal de investigación y a Winnie Lau, que realizó todas las inyecciones intradérmicas con una sola mano.
Presentación de datos financieros: Dr. Lau ha realizado ensayos clínicos para Wyeth, GlaxoSmithKline, Medimmune y Merck Sharp & Dome (Asia) Limited, y forma parte del Steering Committee for Prevention and Control of Infectious Diseases in Asia en representación de GlaxoSmithKline. El resto de los autores han indicado que no tienen relaciones financieras relevantes comprometidas con este artículo.
Correspondencia: Susan S. Chiu, MD, FAAP, Department of Pediatrics and Adolescent Medicine, Queen Mary Hospital, Pokfulam, Hong Kong Special Administrative Region, China.
Correo electrónico: ssschiu@hkucc.hku.hk