Hasta hace poco, las infecciones por Staphylococcus aureus resistente a meticilina (SARM) afectaban con más frecuencia a individuos en contacto con instituciones sanitarias. No obstante, desde finales de la década de los noventa, las infecciones por SARM adquiridas en la comunidad (SARM-AC) han llegado a ser habituales. En general, estas infecciones afectan a huéspedes inmunocompetentes y su gravedad varía desde las cutáneas superficiales y los abscesos de tejidos blandos hasta la enfermedad invasiva, incluida neumonía necrosante, piomiositis, osteomielitis, sepsis grave y la muerte1-9.
Las cepas de SARM asociadas a infecciones adquiridas en la comunidad (a partir de este momento citadas como SARM-AC) tienen características diferenciadas en comparación con las relacionadas con infecciones asociadas a la asistencia sanitaria (SARM-AAS). La resistencia a meticilina se debe al gen mecA localizado en una estructura de cassette en el cromosoma estafilocócico denominada Staphylococcal cassette chromosome mec (SCCmec). El SCCmec es un elemento diferente en las cepas de SARM adquiridas en el hospital y comunitarias. Típicamente, las cepas de SARM-AAS contienen los elementos de tipo I, II o III más grandes, mientras que las cepas SARM-AC contienen los elementos de tipo IV o V más pequeños7,10-14. Los aislamientos de SARM-AC suelen ser resistentes a un menor número de clases de antibióticos no betalactámicos y, en general, son portadores de los genes que codifican la leucocidina de Panton-Valentine (PVL), una exotoxina que destruye los leucocitos asociada con la patogenia de las infecciones graves de la piel y de los tejidos blandos y la neumonía necrosante5,8,14-19.
Un método para evaluar el grado de dispersión de un microorganismo como S. aureus en una comunidad es determinar la tasa de colonización. El lugar más constante de colonización para S. aureus son las narinas anteriores20. En algunas poblaciones, la colonización nasal por este microorganismo se ha asociado con un aumento de las tasas de infecciones por la bacteria20-22. Sin embargo, esta relación no se ha establecido en un ámbito pediátrico comunitario. Hasta la fecha, se han publicado pocos estudios comunitarios a gran escala sobre colonización por SARM. Los efectuados en la población pediátrica ambulatoria entre 1999 y 2001 revelaron prevalencias de colonización nasal por SARM-AC del 0,4 al 0,8%, mientras que, en un estudio más reciente, efectuado en 2004, se documentó una tasa del 9,2%23-25. Entre estos estudios, los factores de riesgo de colonización por SARM-AC han variado y han incluido la profesión sanitaria de un miembro de la familia así como el uso de antibióticos en los 6 últimos meses24-26.
En el presente artículo describimos el estudio pediátrico comunitario de mayor tamaño publicado hasta la fecha sobre prevalencia de colonización nasal por SARM, efectuado en colaboración con consultas de pediatría afiliadas al Washington University Pediatric and Adolescent Ambulatory Research Consortium (WU PAARC), una red de investigación basada en consultorios. Los objetivos del presente estudio fueron definir la prevalencia del estado de portador nasal de SARM entre niños de la comunidad de St Louis, caracterizar los aislamientos de la colonización e identificar los factores de riesgo epidemiológico asociados a la colonización por esta bacteria.
PACIENTES Y MÉTODOSReclutamiento de los participantesEl presente estudio fue aprobado por el Washington University Pediatric and Adolescent Ambulatory Research Consortium (WU PAARC). El WU PAARC consiste en 65 clínicas que representan a 28 consultorios comunitarios diversos desde un punto de vista geográfico y demográfico del área metropolitana de St Louis. Se invitó a participar a cada uno de los consultorios afiliados al WU PAARC. Las 11 consultas que estuvieron de acuerdo en participar estaban dispersadas por toda el área de St Louis y representaban la diversidad socioeconómica de su población. Durante un período de 8 meses (octubre de 2005 a junio de 2006), efectuamos un estudio transversal, reclutando a niños desde el nacimiento a los 18 años de edad cuyos padres hablaban inglés y que se presentaron al pediatra para una visita de revisión de la salud o de una enfermedad. Se obtuvo el consentimiento informado por escrito de los progenitores y la conformidad de los pacientes. Sólo se reclutó a un niño por familia. De ambas narinas se obtuvo una muestra de frotis nasal anterior (BBL, CultureSwab, Becton Dickinson, Sparks, MD). Se administró un cuestionario al participante o progenitor para obtener los datos demográficos e identificar los posibles factores de riesgo epidemiológico de colonización nasal por S. aureus.
Métodos de laboratorioLas muestras se transportaron al laboratorio de bacteriología del St Louis Children’s Hospital y se sembraron en un plazo de 8-18 h de su obtención. Los frotis nasales se sembraron en agar tripticasa soja más un 5% de sangre de carnero (BBL, Becton Dickinson), se incubaron a 35 °C en un 5% de CO2 durante 2448 h sometiéndose a un cribado para la presencia de aislamientos de S. aureus partiendo del aspecto (morfología de las colonias, beta-hemólisis, tinción de Gram), actividad de la catalasa, y actividad de la coagulasa (Staphaurex, Remel, Lenexa, KS). De acuerdo con los procedimientos recomendados por el Clinical and Laboratory Standards Institute27, mediante el método de la difusión en disco con agar de Mueller-Hinton (BBL, Becton, Dickinson), se efectuaron los perfiles de sensibilidad antibiótica para 10 antibióticos. Si demostraron resistencia a cefoxitina, los aislamientos se clasificaron como SARM27. También se efectuó la prueba de la zona D para resistencia inducible a clindamicina27-29. En todos los aislamientos de SARM, utilizando un análisis establecido se efectuó una reacción en cadena de la polimerasa múltiplex para tipificación de SCCmec y para la presencia del gen LukF-PV30,31 (que codifica parte de la toxina PVL). En aislamientos seleccionados, en los Centers for Disease Control and Prevention, de acuerdo con los métodos de Mc-Dougal et al se efectuó tipificación mediante electroforesis en gel de campo pulsátil32 (PFGE).
Métodos estadísticosLos análisis estadísticos se efectuaron utilizando el programa SAS PC, versión 9.1 (SAS, Inc., Cary, NC) a menos que se especifique lo contrario. Todas las pruebas en busca de significación fueron de dos colas. Se consideró significativo un valor de p µ 0,05.
En el análisis univariado, se usó el procedimiento estadístico PROC GLIMMIX del programa SAS para ajustar los modelos mixtos con el estado de la colonización como variable categórica y la consulta pediátrica como efecto aleatorio. Mediante este procedimiento se calcularon las odds ratios (OR) y los intervalos de confianza (IC) utilizando el enlace = opción logit.
Para el análisis multivariado, se usó el procedimiento de ecuaciones de estimación generalizada para estimar los parámetros del modelo de regresión con el objetivo de comparar a los individuos por el estado de colonización teniendo en cuenta los datos correlacionados como consecuencia de la asistencia de los individuos a la misma consulta pediátrica33. El análisis multivariado se efectuó utilizando factores que a priori se consideraron asociados a colonización por SARM o SASM y con factores seleccionados que fueron significativos en el análisis univariado.
La comparación de los factores de riesgo potencial entre participantes colonizados por cepas SARM-AAS y SARM-AC se efectuó mediante la prueba exacta de Fisher para variables categóricas y la prueba de la U de Mann-Whitney para variables continuas utilizando el programa SPSS para Windows, versión 14.0 (SPSS, Chicago, IL).
El análisis de la tendencia lineal mediante chi2 se efectuó utilizando el programa EpiInfo, versión 3.3.2 (CDC, Atlanta, GA).
Localización en el mapa mediante el Geographic Information SystemLas direcciones de los participantes se localizaron en un mapa utilizando el programa Geographic Information System (ESRI ArcView 3.2 y ESRI ArcGis 9.1 StreetMap). Para los dos principales condados del área metropolitana de St Louis, la información demográfica del censo (St Louis County y St Louis City) se obtuvo a partir del Office of Social and Economic Date Analysis estatal (www.oseda.missouri.edu).
Para estos dos condados las tasas estimadas de colonización por SARM y SASM se calcularon como el número de niños colonizados en la población del presente estudio ponderado por la edad y raza dentro de cada condado, dividido por el número de niños en la categoría respectiva de la población de cada condado según lo determinado por el 2000 US Census.
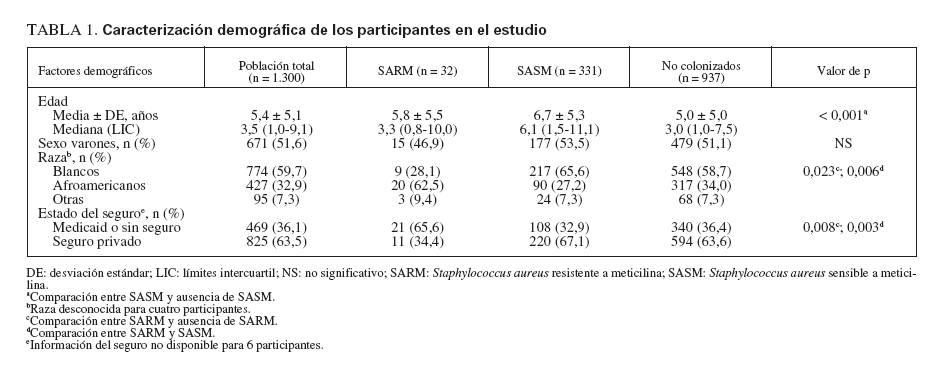
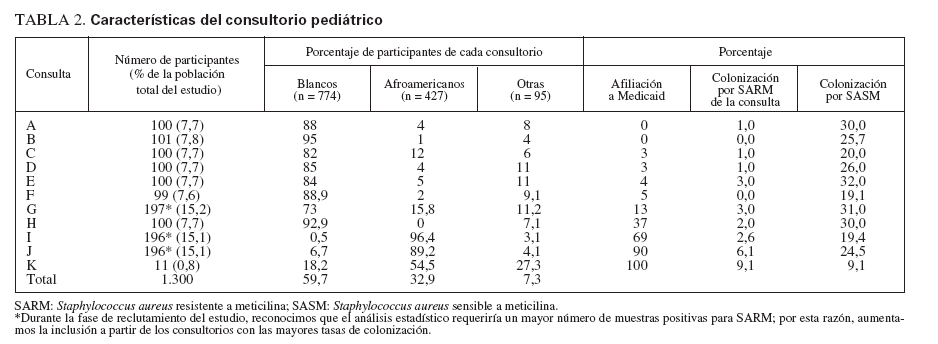
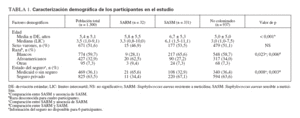
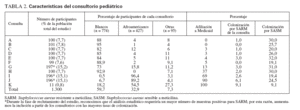
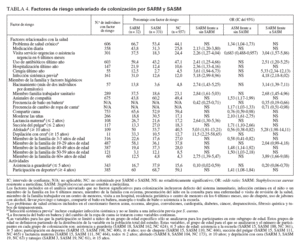
RESULTADOSPoblación del estudioReclutamos a 1.300 niños de 11 consultorios de pediatría general. En la tabla 1 se describen sus características. Con más frecuencia que los niños blancos, los afroamericanos estaban afiliados a Medicaid o carecían de seguro sanitario y vivían hacinados en una vivienda (definiéndose como más de dos individuos por dormitorio) (p < 0,001 para ambas variables). El número de niños reclutados a partir de cada consulta varió de 100 a 197, excepto para una, de la que sólo se reclutaron 11 niños. En la tabla 2 se muestran las características del consultorio.
TABLA 1. Caracterización demográfica de los participantes en el estudio
TABLA 2. Características del consultorio pediátrico
Resultados del cultivo y factores de riesgo de colonizaciónSARM
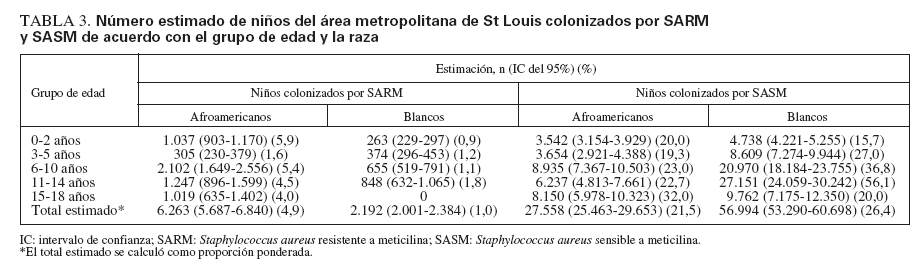
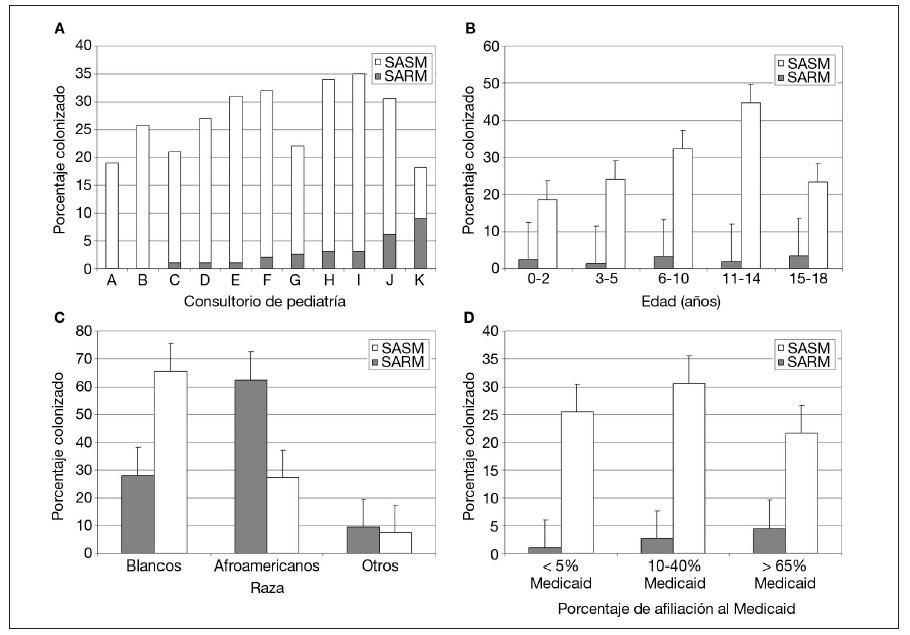
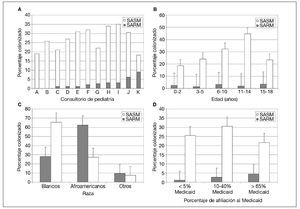
En conjunto, 32 niños estaban colonizados por SARM. La proporción de estos niños dentro de cada consulta varió del 0 al 9% (media 2,6%) (fig. 1A). Partiendo de la tasa de colonización en los grupos definidos por edad y raza, estimamos que en los dos principales condados del área metropolitana de St Louis (St Louis City y St Louis Country) el número total de estos niños era de 8.455 (IC del 95% 8.279-8.631), correspondientes al 2,4% de la población menor de 18 años de edad en el momento del estudio (tabla 3).
Fig. 1. Colonización por SARM y SASM por edad (A), raza (B), consultorio (C) y porcentaje de afiliación a Medicaid de la consulta (D). SARM: Staphylococcus aureus resistente a meticilina; SASM: Staphylococcus aureus sensible a meticilina.
TABLA 3. Número estimado de niños del área metropolitana de St Louis colonizados por SARM y SASM de acuerdo con el grupo de edad y la raza
Las tasas de colonización por SARM fueron similares en todos los grupos de edad (fig. 1B). La tasa entre afroamericanos fue del 4,7% y entre los blancos fue del 1,2% (p = 0,023) (tabla 1 y fig. 1C). Los niños afiliados a Medicaid o sin seguro tuvieron más probabilidades de estar colonizados por SARM que aquellos con un seguro sanitario privado (p = 0,008) (tabla 1). En las consultas con una mayor afiliación porcentual a Medicaid se observaron mayores tasas de colonización (p < 0,001) (fig. 1D).
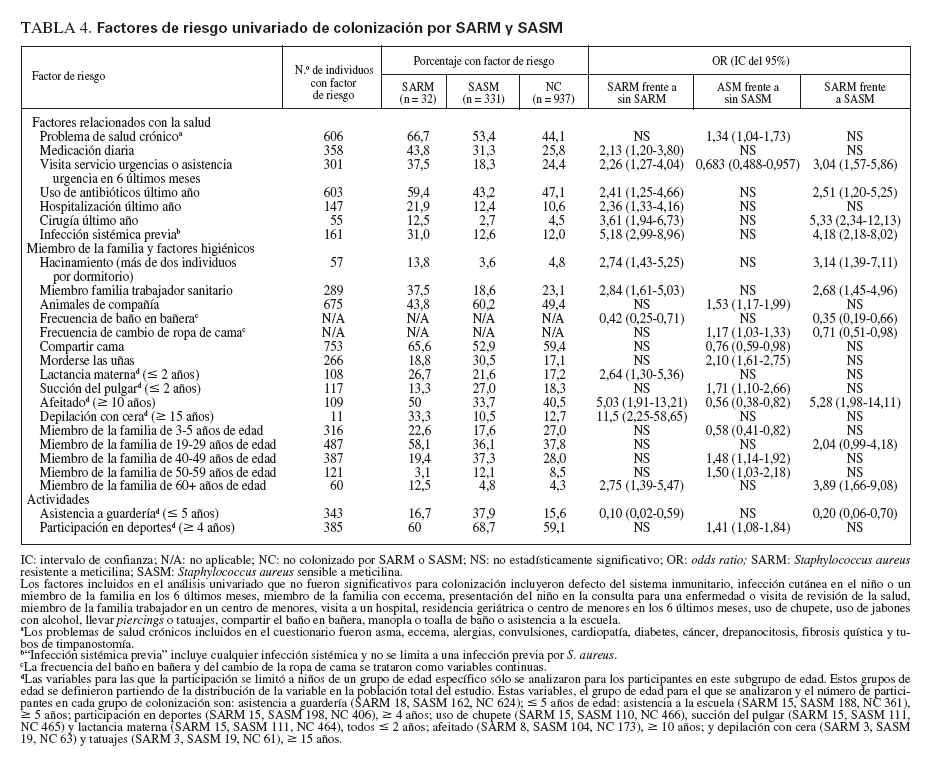
En la tabla 4 se citan los factores de riesgo epidemiológico significativos asociados a colonización por SARM. Los factores incluidos en el cuestionario pero no asociados significativamente con ella se citan en las notas al pie. Inesperadamente, la asistencia a guarderías (para niños µ 5 años de edad) fue un factor significativamente protector (OR 0,10, IC del 95% 0,02-0,59) y los niños que se bañaban con mayor frecuencia tuvieron mayores probabilidades de estar colonizados por el microorganismo (OR 0,42, IC del 95% 0,25-0,71). En la población del presente estudio, asistían a guarderías un mayor número de niños con seguro sanitario privado que afiliados a Medicaid o sin seguro sanitario (p = 0,028). El estado de colonización no difirió entre niños que se presentaron al pediatra para una visita por enfermedad o de revisión de la salud. En el análisis multivariado, los factores de colonización nasal por SARM que siguieron siendo significativos fueron la raza afroamericana (p = 0,007) y los antecedentes de infección sistémica (p = 0,023).
TABLA 4. Factores de riesgo univariado de colonización por SARM y SASM
SASM
Se detectó colonización por SASM en 331 participantes. Esto varió entre consultas, del 9 al 32% (media 24,2%) (fig. 1A). En los dos principales condados metropolitanos de St Louis el número total estimado de niños con colonización por SASM fue de 84.552 (IC del 95% 84.122-84.982), correspondiente a una prevalencia del 24,6% (tabla 3). Las tasas de colonización por SASM fueron más altas en los niños más mayores (p < 0,001) (fig. 1B). La tasa fue del 21,1% en niños afroamericanos comparado con el 28,0% en blancos (p = 0,065) (fig. 1C). Su proporción fue mayor en participantes atendidos en consultorios con una proporción intermedia de receptores de Medicaid comparado con la tasa en consultorios con proporciones más bajas o más altas de ellos (p = 0,025) (fig. 1D). El estado del seguro sanitario de los participantes en el estudio no se relacionó significativamente con el riesgo de esta colonización (tabla 1).
En la tabla 4 se citan los factores de riesgo epidemiológico asociados significativamente con colonización por SASM en el análisis univariado. El modelo multivariado reveló que morderse las uñas (p < 0,001) y la participación en deportes (p = 0,057) eran factores de riesgo de esta colonización.
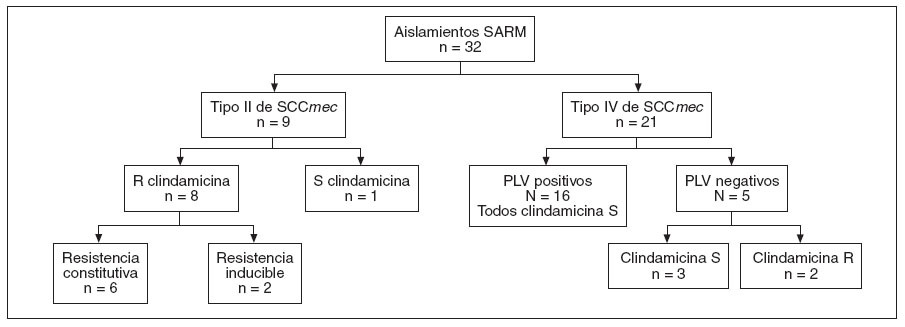
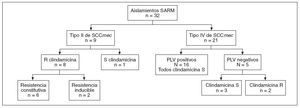
Hallazgos microbiológicosEl análisis molecular identificó una población heterogénea de aislamientos SARM (fig. 2). De los aislamientos nueve (28%) contenían el elemento cassette de tipo II de SCCmec (SARM-AAS), 21 (66%) contenían el elemento cassette de tipo IV (SARM-AC) y dos contenían el gen mecA pero no pudo determinarse el tipo de SCCmec. De los nueve aislamientos portadores del elemento cassette de tipo II, cuatro se caracterizaron mediante PFGE y todos eran clonas USA100. De los 21 aislamientos que contenían el tipo IV de SCCmec, 13 también se caracterizaron mediante PFGE. De éstos, siete eran clonas USA300 (todas positivas para el gen PVL), tres eran clonas USA800 (ninguna era portadora del gen PVL) y tres eran clonas USA1000 (ninguna era portadora del gen PVL). El gen PVL estuvo presente en 16 (76%) de los aislamientos SARM-AC pero en ninguno de los SARM-AAS (p < 0,001). La resistencia a clindamicina estuvo presente en ocho de nueve (89%) aislamientos SARM-AAS (6 resistencias constitutivas y dos inducibles) y dos (9,5%) de los 21 aislamientos SARMAC (ambos resistencia inducible a clindamicina). De los 331 aislamientos SASM, en 62 (18,7%) estaba presente resistencia a clindamicina (7 resistencias constitutivas y 55 inducibles). Todos los aislamientos de S. aureus eran sensibles a trimetoprim-sulfametoxazol, rifampicina y vancomicina.
Fig. 2. Caracterización de los aislamientos de SARM. La resistencia clindamicina se clasificó como constitutiva o inducible (prueba D positiva). PVL: leucocidina de Panton-Valentine; R: resistente; S: sensible; SARM: Staphylococcus aureus resistente a meticilina; SSCmec: Staphylococcal cassette chromosome mec. *Dos aislamientos SARM no correspondieron al tipo II o al tipo IV de SCCmec.
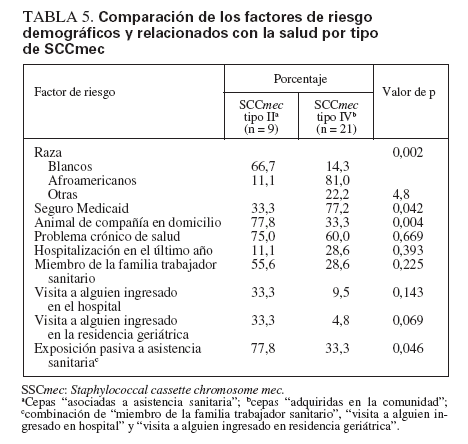
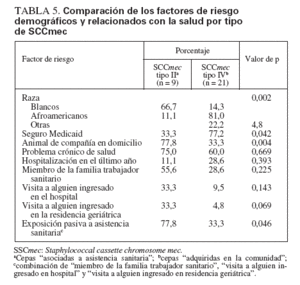
Comparación de SARM-AAS y SARM-ACLos aislamientos de SARM que contenían el elemento cassette de tipo II de SCCmec (SARM-AAS) se compararon con los SARM que contenían el elemento de tipo IV (SARM-AC) (tabla 5). Los niños colonizados por SARM-AAS tuvieron más probabilidades de ser blancos (p = 0,002), de tener un seguro sanitario privado (p = 0,042) y de convivir con un animal de compañía (p = 0,046). Aunque no fue estadísticamente significativo, la edad de colonizados por cepas SARM-AC fue menor que la de colonizados por cepas AAS (edad mediana 2,65 y 9,43 años, respectivamente).
TABLA 5. Comparación de los factores de riesgo demográficos y relacionados con la salud por tipo de SCCmec
Aunque no se detectaron diferencias significativas en los factores individuales relacionados con la salud (p. ej., hospitalización o visitas al servicio de urgencias) entre grupos colonizados por SARM-AAS y SARM-AC, para el 77,8% de niños del primer grupo un miembro de la familia era profesional sanitario o había visitado a alguien en el hospital o en una residencia geriátrica (exposición “indirecta” a la asistencia sanitaria) comparado con el 33% de niños del segundo grupo (p = 0,046).
DISCUSIÓNEl aumento espectacular del número de niños de nuestra comunidad que presentan infecciones por SARM-AC propició que iniciáramos una investigación para definir la prevalencia de colonización nasal por esta bacteria en la población pediátrica metropolitana de St Louis e identificáramos los factores de riesgo de dicha colonización con el objetivo de desarrollar estrategias de control. Los resultados del sondeo revelaron pruebas de diseminación de la bacteria en la comunidad, detectándose colonización en 32 niños de nueve consultorios diferentes, junto con 331 colonizados por SASM. La tasa de colonización por Staphylococcus aureus en cada consulta individual varió del 0 al 9% para el resistente a meticilina y del 9 al 32% para el sensible. Partiendo del sondeo estimamos que la colonización por SARM afectaba al 2,4% de niños del área metropolitana, correspondiente a más de 8.000 niños.
La tipificación molecular reveló una heterogeneidad entre los aislamientos, clasificándose la mayoría como cepas asociadas a la comunidad y una menor proporción de cepas, como las típicamente asociadas a infecciones adquiridas en asistencia sanitaria. Entre niños incluidos en otros estudios recientes, la prevalencia de colonización varió desde el 0,6% en el National Health and Nutrition Examination Survey, efectuado desde 2001 a 2002, hasta el 9,2% en un estudio efectuado en 2004 por Creech et al, que obtuvieron una muestra de niños de dos consultorios en Nashville, TN26,34. En pocos estudios sobre prevalencia de colonización por este microorganismo se ha documentado la tipificación de SCCmec de sus aislamientos. Sin embargo, estos dos estudios hallaron cepas tanto asociadas a la asistencia sanitaria
SSCmec: Staphylococcal cassette chromosome mec. como adquiridas en la comunidad en sus poblaciones aCepas “asociadas a asistencia sanitaria”; bcepas “adquiridas en la comunidad”; con proporciones similares a las del presente estudio35 ccombinación de “miembro de la familia trabajador sanitario”, “visita a alguien ingresado en hospital” y “visita a alguien ingresado en residencia geriátrica”. (B. Creech, comunicación personal).
Es posible que la prevalencia real en nuestra comunidad sea incluso mayor que lo demostrado por el sondeo del presente estudio, dado que en los participantes sólo se obtuvo una muestra en una ocasión y a partir de una sola región corporal. El reclutamiento de un niño por familia también habría subestimado la prevalencia de SARM en la comunidad, aunque consideramos que, si hubiera estado presente, este efecto habría sido insignificante. Además, las muestras del frotis nasal se cultivaron directamente en placas de agar sangre nutritivas, mientras que las muestras obtenidas por Creech et al se incubaron toda la noche en un caldo de enriquecimiento para SARM antes de cultivarlas en agar sal manitol, lo que deparó una mayor tasa de recuperación de la bacteria que el cultivo directo (B. Creech, comunicación personal). Es probable que la menor tasa de colonización en el estudio NHANES comparado con el presente estudio, al igual que el de Nashville, refleje la mayor propagación del microorganismo en la comunidad que ha tenido lugar durante el intervalo entre estudios aunque la variación geográfica también podría explicar parte de la diferencia.
El presente sondeo identificó diversos factores de riesgo nuevos e importantes de la colonización. Ésta es la primera investigación en la población pediátrica que demuestra que la colonización por SARM se asocia con una posición socioeconómica desfavorecida, representada por la afiliación a Medicaid y el hacinamiento en la vivienda. En comparación, en el estudio de Creech se encontró que el estado de colonización de los niños de diferentes niveles socioeconómicos no difirió significativamente26. Una posible explicación de esta discrepancia es la base más amplia de población del presente estudio. Además, este estudio encontró un número significativa-mente mayor de afroamericanos que de blancos colonizados por SARM. Aunque otros estudios han demostrado una mayor tasa de infecciones por SARM en afroamericanos que en blancos35,36, esta asociación no se ha demostrado previamente en otros estudios sobre colonización por este microorganismo26,37. Las posibles explicaciones de esta disparidad racial incluyen los factores medioambientales que dan lugar a una mayor exposición o predisposición genética a la colonización, como una diferencia en los receptores de SARM.
Aunque en todos los niños se obtuvieron muestras en un ámbito ambulatorio, evidenciamos que las exposiciones previas relacionadas con la asistencia sanitaria fueron factores de riesgo significativos de colonización. En comparación con múltiples estudios que no han demostrado una relación entre infecciones por SARM-AC y el contacto con el sistema sanitario, observamos que los niños colonizados tanto por SARM-AC como por SARM-AAS tuvieron más probabilidades de haber tenido contacto personal con el sistema de asistencia sanitaria que los no colonizados. Sin embargo, los niños colonizados por SARM-AAS tuvieron más probabilidades que los colonizados por SARM-AC de referir una exposición indirecta a la asistencia sanitaria. Esta relación puede sugerir una evolución de la epidemia con una distinción imprecisa entre SARM-AAS y SARMAC. Esto se ha reflejado en los estudios sobre brotes “nosocomiales” de SARM-AC que sugieren que las cepas se introducen y se propagan a través de centros sa-nitarios38,39.
Otros diversos factores de riesgo asociados previamente con infecciones por SARM no se asociaron con colonización en la población del presente estudio. Las sugerencias para limitar su transmisión entre miembros de la familia y miembros del equipo deportivo incluyen que no se compartan los artículos de higiene personal, como las toallas y manoplas40. Sin embargo, en este estudio, los niños que compartían toallas de baño o manoplas para la cara no corrieron un mayor riesgo de colonización por la bacteria. Aunque entre atletas41-44 y en prisiones45,46 se han descrito brotes de infecciones por SARM, en este estudio la participación en deportes y el contacto con un individuo hospitalizado o la profesión sanitaria de un miembro de la familia no fueron factores de riesgo significativos de colonización. Estos hallazgos destacan el concepto de que los factores asociados a la colonización pueden diferir de los asociados a la transmisión del microorganismo o a la infección clínica.
Al igual que otros estudios sobre colonización, los antecedentes de infección cutánea o de tejidos blandos no se relacionaron con un estado de portador nasal de SARM21,26. Entre los niños más mayores, encontramos que el afeitado y la depilación con cera del vello corporal se asociaron con colonización. Es posible que el microorganismo pueda transmitirse a través de la cera depilatoria o del material relacionado o que estas costumbres provoquen una lesión microscópica u otros cambios de la piel que favorezcan la colonización.
También investigamos los factores de riesgo de colonización de SASM. En comparación con los hallazgos para el microorganismo resistente a meticilina, la raza y la posición socioeconómica no se relacionaron significativamente con el riesgo. Es interesante destacar que los niños que solicitaron asistencia en un servicio de urgencias o clínica de urgencias en los 6 últimos meses tuvieron menos probabilidades de estar colonizados por el sensible a meticilina que aquellos sin visitas a un servicio de urgencias. Especulamos que esto podría guardar relación con el elevado número de recetas de antibióticos que se extienden en estos ámbitos, que posteriormente pueden eliminar el estado de portador nasal de SASM.
El presente estudio adolece de diversas limitaciones. El número relativamente reducido de casos colonizados por SARM podría haber limitado la capacidad para detectar todos los factores de riesgo. Además, el reducido número de casos limitó nuestra capacidad para efectuar un análisis multivariado, y es posible que algunos de los factores de riesgo que identificamos, como la raza, seguro Medicaid y hacinamiento, pudieran relacionarse entre sí. Puesto que no efectuamos un ajuste para las comparaciones múltiples en el análisis estadístico, algunas variables habrían alcanzado significación sólo por casualidad. Sin embargo, el extenso tamaño de la muestra y el reclutamiento a partir de 11 consultorios diferentes con poblaciones de pacientes que representaban orígenes socioeconómicos diversos en la región de St Louis son puntos fuertes del estudio.
El impacto sanitario y económico de las infecciones por SARM-AC se ha convertido en un problema significativo en muchas comunidades. El presente estudio proporciona nueva información sobre la dispersión del mecanismo causal y los factores de riesgo epidemiológico asociados de colonización. Además, proporciona pruebas de que SARM-AAS tradicional también está presente entre niños que se visitan en consultas pediátricas ambulatorias. Queda por dilucidar la relación entre la colonización nasal y la incidencia de infecciones adquiridas en la comunidad. Están en curso estudios longitudinales con un seguimiento de niños identificados con colonización por SARM y su progresión hasta una infección, al igual que comparaciones epidemiológicas de niños con infecciones y colonización.
AGRADECIMIENTOSLa presente investigación se financió con una beca de los National Institutes of Health a través de la Ruth L. Kirschstein National Research Service Award 5 T32 HD007507 del NICHD.
Deseamos expresar nuestro agradecimiento a los médicos y personal del WU PAARC que nos permitieron reclutar a pacientes de sus consultas: Blue Fish Pediatrics, Children’s Clinic, Crystal City Pediatrics, Esse Health–Creve Coeur, Esse Health–Webster Groves, Grace Hill–Soulard, Healthcare for Kids, Northwest Pediatrics, St Louis Pediatric Practitioners, Southwest Pediatrics, y Tots through Teens Pediatrics; al personal del laboratorio de bacteriología del St. Louis Children’s Hospital por su ayuda técnica; a Richard Buller, PhD y Monique Gaudreault por efectuar el análisis RCP de los aislamientos; a Mario Schootman, PhD y Jim Struthers de la Washington University Division of Health Behavior Research for Geographic Information System mapping; a Christina Banister, Rachel Orscheln, MD, y David Hunstad, MD, por su experiencia técnica; y a Roberta Carey, PhD, Gregory Fosheim, MPH, y Sigrid McAllister, MS, de los Center for Disease Control and Prevention, Division of Healthcare Quality Promotion, Clinical and Environmental Microbiology Branch, por la realización de la PFGE en los aislamientos.
Correspondencia: Stephanie A. Fritz, MD, Department of Pediatrics, Washington University School of Medicine, 660 S. Euclid Ave, Campus Box 8116, St Louis, MO 63110, Estados Unidos.
Correo electrónico: lutter_s@kids.wustl.edu