Los niños no vacunados previamente de 6 meses amenores de 9 años de edad deberían recibir 2 dosis de vacuna de la gripe antes del inicio de la temporada de la gripe.
Los datos disponibles indican que los niños meno-res de 9 años de edad que no reciben la segunda dosis de vacuna de la gripe el mismo año que se administró la vacuna inicial pueden no estar adecuadamente protegidos con 1 sola dosis en la siguiente temporada de gripe. En este grupo, los grados de protección pueden ser subóptimos, especialmente si la especificidad antigénica de las cepas predominantes ha cambiado respecto al año anterior. Así pues, la American Academy of Pediatrics recomienda administrar 2 dosis a estos niños en la siguiente temporada de gripe*. Esta recomendación sólo se aplica a la temporada de gripe que sigue al primer año en que un niño menor de 9 años de edad recibe la vacuna de la gripe.
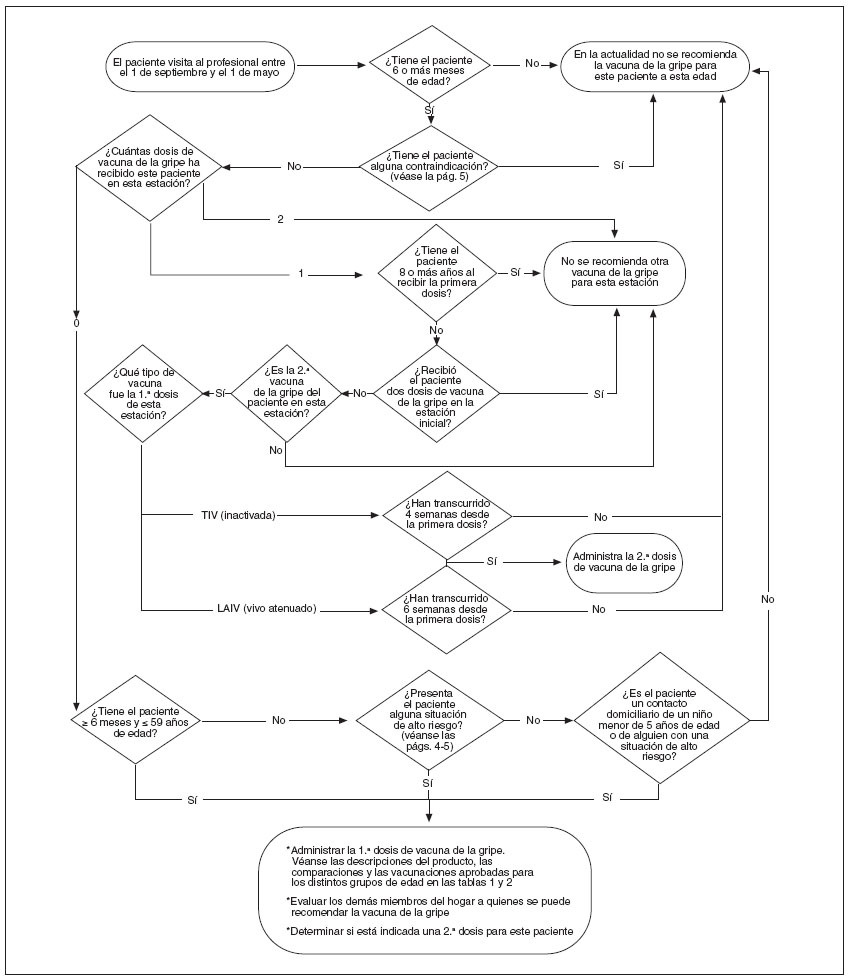
Fig. 1. Algoritmo de la gripe para 2006-2007. LAIV: vacuna de la gripe viva atenuada; TIV: vacuna trivalente inactivada de la gripe.
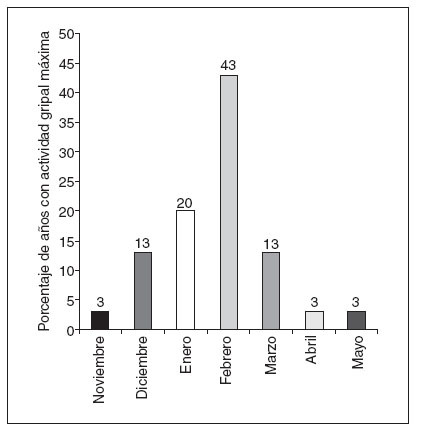
Fig. 2. Actividad máxima de la gripe por mes (%) entre 1976 y 2006.
VACUNAS DE LA GRIPELas tablas 1 y 2 resumen la información de los 2 tipos de vacuna de la gripe utilizados para vacunar tanto a los niños como a los adultos –vacuna trivalente inactivada de la gripe (TIV) y vacuna de la gripe viva atenuada (LAIV)– así como el grupo de edad asignado a cada preparación. Ambas vacunas contienen 3 cepas víricas: 2 de influenza A (subtipos H1N1 y H3N2) y 1 cepa de influenza B, que se seleccionan anualmente según las previsiones de los virus circulantes durante la siguiente estación de la gripe. Los niños con alergias graves al pollo o a las proteínas del huevo no deben recibir estas vacunas, porque tanto la TIV como la LAIV están desarrolladas con cultivos en huevo embrionado. La vacuna inactivada de la gripe se prefiere a los estrechos contactos de personas con muy grave inmunodepresión.
La TIV es una vacuna inactivada, administrada por vía intramuscular, que contiene virus muertos y, por lo tanto, no puede producir signos o síntomas de gripe causados por una infección vírica activa. Los síntomas más habituales asociados con la administración de TIV son dolor en el punto de inyección y fiebre. La fiebre, que suele aparecer de 6 a 24 horas después de la vacunación, afecta aproximadamente del 10% al 35% de los niños de menos de 2 años de edad. Los síntomas sistémicos leves, como las náuseas, la letargia, la cefalea, las algias musculares y los escalofríos, también pueden ocurrir con la inyección TIV.
La TIV se administra por vía intramuscular en la cara anterolateral del muslo de los lactantes y los niños pequeños y en el músculo deltoides de los niños mayores y los adultos (las recomendaciones del punto de inyección se describen en el Red Book: 2006 Report of the Committee on Infectious Diseases). Recientes preocupaciones por el timerosal han llevado a algunos padres a reconsiderar la vacunación de la gripe. Sin embargo, los beneficios de proteger a los niños con los riesgos conocidos de la gripe superan con mucho a los riesgos teóricos asociados con las pequeñas cantidades de timerosal en algunos tipos de vacuna contra la gripe actualmente disponibles. Además, ciertos tipos de TIV están libres de timerosal, como Fluzone en dosis única (Sanofi Pasteur, Swiftwater, PA) y Fluvirin (Novartis Vaccines, Emeryville, CA), pero la última no está autorizada para los niños menores de 4 años de edad.
LAIV es una vacuna viva atenuada que se administra por vía intranasal y está autorizada por la Food and Drug Administration para personas sanas de 5 a 49 años de edad. LAIV puede producir signos o síntomas leves relacionados con la infección por el virus de la gripe. La formulación adaptada al frío autorizada en Estados Unidos debe conservarse a –15 ºC o menos. LAIV puede conservarse en congeladores sin escarcha sin utilizar una caja congeladora. Cuando se calienta la vacuna a temperatura ambiente para su empleo, debe utilizarse antes de transcurridos 30 minutos. No se debe recongelar tras la descongelación por la disminución de la potencia de la vacuna.
TABLA 1. Vacunas de la gripe autorizadas para distintos grupos de edad. Estados Unidos, estación 2006-2007
TABLA 2. Vacuna de la LAIV comparada con la TIV
RECOMENDACIONES ACTUALESSe recomienda la vacunación con TIV para los siguientes grupos (fig. 1):
• Niños sanos de 6 a 59 meses de edad
• Niños en alto riesgo de 6 o más meses de edad y ado-lescentes con alteraciones médicas subyacentes, como:
- Asma u otras enfermedades pulmonares crónicas, como la fibrosis quística
- Cardiopatía hemodinámicamente significativa
- Trastornos o tratamiento inmunodepresor
- Infección por VIH
- Drepanocitosis y otras hemoglobinopatías
- Enfermedades que necesitan tratamiento con salicilatos a largo plazo, como la artritis reumatoide o la enfermedad de Kawasaki
- Disfunción renal crónica
- Enfermedad metabólica crónica, como la diabetes mellitus
- Toda alteración que pueda comprometer la función respiratoria o el manejo de las secreciones o pueda aumentar el riesgo de aspiración, como la disfunción cognitiva, las lesiones de la médula espinal, los trastornos convulsivos u otros trastornos neuromusculares
• Toda mujer que vaya a estar embarazada durante latemporada de la gripe
Para prevenir los casos adicionales de gripe y la transmisión de estos casos a las personas en riesgo, se recomienda la vacunación de la gripe con TIV o LAIV a las siguientes personas, a menos que esté contraindicada:- Contactos sanos en el domicilio y cuidadores fueradel domicilio de niños y adolescentes de alto riesgo o de niños menores de 5 años de edad; la vacunación de los contactos estrechos de los niños menores de 6 meses es especialmente importante, porque la vacuna de la gripe no está autorizada para su empleo en estos lactantes
- Contactos sanos y cuidadores de otros niños o adul-tos en alto riesgo de complicaciones por la vacuna de la gripe
- Contactos estrechos de personas inmunodeprimidas
- Profesionales de la asistencia sanitaria o voluntariosde hospitales o consultas médicas
- Tuvieron una grave reacción alérgica a una dosisprevia o a un componente vacunal, como los huevos
- Tienen menos de 6 meses de edad
- Tienen una enfermedad febril moderada a grave; lasenfermedades menores, con o sin fiebre, no contraindican el empleo de TIV, especialmente entre los niños con síntomas leves de las vías respiratorias altas o rinitis alérgica
- Tuvieron síndrome de Guillain-Barré en las 6 sema-nas posteriores a una dosis anterior de vacuna de la gripe
- Tienen menos de 5 años de edad
- Tienen una enfermedad febril moderada o grave
- Han recibido otra(s) vacuna(s) con antígeno vivo enlas últimas 4 semanas
- Tuvieron una reacción alérgica grave a una dosisprevia o componente de la vacuna, como los huevos
- Han recibido salicilatos
- Padecen, o se sospecha, una inmunodeficiencia
- Tienen antecedente de síndrome de Guillain-Barré
- Tienen asma o enfermedad reactiva de las vías res-piratorias
- Tienen otras alteraciones tradicionalmente conside-radas que les colocan en alto riesgo de influenza grave (trastornos pulmonares o cardíacos crónicos, embarazo, enfermedad metabólica crónica, disfunción renal, hemoglobinopatías o tratamiento inmunodepresor)
Las consideraciones de los posibles riesgos y beneficios de la administración de la vacuna de la gripe a todo niño con, o sin sospecha de, inmunodeficiencia se estudian en el Red Book: 2006 Report of the Committee on Infectious Diseases.
También se debe tener cuidado al considerar la administración de LAIV a personas con una enfermedad menor aguda, como una infección leve de las vías respiratorias altas, con o sin fiebre. Aunque muy probablemente se puede administrar la vacuna en este caso, LAIV se debe retrasar temporalmente si la congestión nasal impide la administración de la vacuna en la mucosa nasofaríngea, hasta que se resuelva la enfermedad congestiva.
LAIV o TIV pueden ser utilizadas para prevenir la gripe en quienes estén en estrecho contacto con la mayoría de las personas inmunodeprimidas. Las personas en contacto con individuos gravemente inmunodeprimidos, como los cuidados en un ambiente protector tras el trasplante de células madre hematopoyéticas, no deben recibir LAIV. En estos individuos se recomienda la TIV.
COMMITTEE ON INFECTIOUS DISEASES, 2006-2007Joseph A. Bocchini Jr., MD, Presidente Robert S. Baltimore, MD Henry H. Bernstein, DO John S. Bradley, MD Michael T. Brady, MD Penelope H. Dennehy, MD Margaret C. Fisher, MD Robert W. Frenck, Jr., MD David W. Kimberlin, MD Sarh S. Long, MD Julia A. McMillan, MD Lorry G. Rubin, MD
COORDINADORESRichard D. Clover, MD, American Academy of Family Physicians Marc A. Fisher, MD, Centers for Disease Control and Prevention Richard L. Gorman, MD, National Institutes of Health Douglas R. Pratt, MD, Food and Drug Administration Anne Schuchat, MD, Centers for Disease Control and Prevention Benjamin Schwartz, MD, National Vaccine Program Office Jeffrey R. Starke. MD, American Thoracic Society Jack Swanson, MD, Practice Action Group
DE OFICIOLarry K. Pickering, MD, Director de Red Book
CONSULTOREdgar O. Ledbetter, MD
COLABORADORJ. Dennis O’Dell, MD, Medical Home ExpertStuart T. Weinberg, MD, Partnership for Policy Implementation (PPI)
PERSONALAlison Siwek, MPH
RECURSOS IMPORTANTESVéanse otros detalles de la gripe en el Red Book: 2006 Report of the Committee on Infectious Diseases de la American Academy of Pediatrics y el MMWR de los Centers for Disease Control and Prevention:
American Academy of Pediatrics. Influenza. En: Pickering LK, Baker CJ, Long SS, McMillan JA, directores. Red Book: 2006 Re-port of the Committee on Infectious Diseases. 27.ª ed. Elk Grove Village, IL: American Academy of Pediatrics; 2006. p. 401-11.
Centers for Disease Control and Prevention. Prevention and control of influenza: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2006;55(RR-10):1-42.
Todas las declaraciones apoyadas por la American Academy of Pediatrics expiran automáticamente 5 años después de su publicación a menos que sean confirmadas, revisadas o retiradas antes o en este momento.
*Esta recomendación difiere de la del Advisory Committee on Immunization Practices de los Centers for Disease Control and Prevention. Por la discordancia de las recomendaciones, el American Academy of Pediatrics Committee on Infectious Diseases revisó los datos disponibles en su reunión de octubre de 2006 y reafirmó su decisión de 2 dosis el segundo año por lo siguiente: 1) los datos serológicos sugieren que se protegería a más niños dando 2 dosis al año siguiente, especialmente porque la formulación de la vacuna del grupo cambia rutinariamente para equipararse a las cepas circulantes del virus; 2) sería más fácil para el profesional poner en marcha esta estrategia si las recomendaciones fueran administrar 2 dosis el segundo año cuando sólo se haya administrado 1 el primer año, en vez de realizar anualmente una recomendación distinta según si la formulación de la vacuna había cambiado respecto a la del año anterior; 3) el suministro de vacuna durante la temporada de gripe 2006-2007 es adecuado para poner en marcha esta recomendación; aunque el suministro se haya retrasado, si no ha sucedido ya, todas las órdenes se cumplirán en poco tiempo; 4) es necesaria la revisión de los registros de vacunación en cada visita para vacunación, de forma que decidir la necesidad de una segunda dosis no sea difícil, y 5) adoptar la postura de que esta cohorte de niños no sea incluida para 2 dosis por la carga adicional que impone al pediatra ignora el objetivo principal de esta propuesta: disminuir la carga de gripe en los pacientes pediátricos mediante la mejoría de su estado de vacunación.