El 3 de febrero de 2006 la Food and Drug Administration de EE.UU. aprobó la vacuna frente a rotavirus pentavalente con rotavirus bovinos (RotaTeq, Merck and Co Inc., Whitehouse Station, NJ) para utilizar en lactantes de Estados Unidos. La American Academy of Pediatrics recomienda la inmunización sistemática de lactantes con tres dosis de la vacuna frente a rotavirus pentavalente, administrada por vía oral a los 2, 4 y 6 meses de edad. La primera dosis debe administrarse a las 6-12 semanas de edad; la vacunación no debe iniciarse en lactantes mayores de 12 semanas de edad. Las dosis ulteriores deben administrarse a intervalos de 4-10 semanas, y las tres dosis de la vacuna deben haberse administrado a las 32 semanas de edad. La vacuna pentavalente frente a rotavirus puede administrarse conjuntamente con otras vacunas administradas en la infancia. Esta vacuna está contraindicada en lactantes con una reacción alérgica grave a cualquier componente de la vacuna o a una dosis previa de la vacuna.
OBJETIVO DE LAS RECOMENDACIONES Y JUSTIFICACIÓNEl objetivo del presente informe es proporcionar las razones y recomendaciones para el uso de la vacuna frente a rotavirus pentavalente con rotavirus bovinos (RotaTeq) en lactantes de Estados Unidos. La razón de administrar la vacuna frente a rotavirus para la prevención o la modificación de la infección se basa en diversas consideraciones. En primer lugar, las tasas de enfermedad por rotavirus son similares entre los niños de países industrializados y menos desarrollados, lo que indica que el suministro de agua potable y la higiene apropiada apenas producen efectos sobre la transmisión del virus, de modo que es poco probable que las mejoras adicionales de estos factores prevengan la enferme-dad1-5. En segundo lugar, en Estados Unidos, se ha identificado un nivel elevado de morbilidad por rotavirus que persiste, a pesar de los tratamientos disponibles en la actualidad. Por ejemplo, desde 1979 a 1995, la tasa de hospitalizaciones por gastroenteritis en niños pequeños sólo disminuyó un 16%6,7, a pesar de las recomendaciones de los expertos, incluida la American Academy of Pediatrics (AAP) y los Centers for Disease Control and Prevention8,9 (CDC), de uso de soluciones de rehidratación oral en el tratamiento de la gastroenteritis con deshidratación. En tercer lugar, los estudios sobre infección natural por rotavirus indican que la infección inicial protege frente a la gastroenteritis grave posterior, aunque puede seguir apareciendo una infección asintomática y una enfermedad leve ulterior1,10,11. Por último, en Estados Unidos y otros 10 países, los ensayos sobre la vacuna pentavalente frente a rotavirus ponen de relieve tasas de eficacia del 98% para la prevención de la infección grave y del 74% para la prevención de los episodios de diarrea inducidos por rotavirus de cualquier gravedad12. Estos resultados son similares a la protección observada tras la infección natural por rotavirus. Por lo tanto, la vacunación en los primeros meses de vida, que mimetiza la primera infección natural del niño, no prevendrá todas las infecciones ulteriores pero sí la mayor parte de casos de infección grave por el virus, al igual que sus secuelas (p. ej., deshidratación, visitas al médico, hospitalizaciones y muertes).
El presente informe proporciona las recomendaciones relativas al uso de la vacuna pentavalente frente a rota-virus en lactantes de Estados Unidos.
EPIDEMIOLOGÍA DE LA ENFERMEDADEl rotavirus es la causa principal de gastroenteritis aguda en Estados Unidos, infectando a casi todos los niños en los 3-5 primeros años de vida, produciéndose gastroenteritis con deshidratación grave sobre todo entre los de 3-35 meses de edad. En Estados Unidos, en los 5 primeros años de vida 4/5 niños desarrollarán gastroenteritis por este virus1,4,13, 1/7 requerirá una visita clínica al departamento de urgencias, 1/70 será hospitalizado y 1/200.000 fallecerá de la infección14,15.
En Estados Unidos, se ha demostrado que los rotavirus sólo son responsables del 5-10% de todos los episodios de gastroenteritis entre niños menores de 5 años de edad. No obstante, la infección por este virus se traduce en una enfermedad más grave que la debida a otros patógenos causantes de gastroenteritis y, por lo tanto, representa una mayor proporción de episodios de gastroenteritis grave que requieren visitas ambulatorias u hospitalarias16,17. Por ejemplo, rotavirus es responsable del 30-50% de ingresos pediátricos en hospitales debido a gastroenteritis y el 20-25% de casos de gastroenteritis pediátrica en clínicas ambulatorias18-21. Durante la estación pico de rotavirus, el virus puede ser la causa de más del 70% de ingresos pediátricos por enfermedad gastrointestinal7. Este virus también es una importante causa de diarrea hospitalaria en niños22,23 y es una causa principal de gastroenteritis aguda en los que asisten a guarderías24-26.
En Estados Unidos, rotavirus causa epidemias anuales de enfermedad desde finales de otoño hasta principios de la primavera. El pico de la infección varía según la región. En el sudoeste, la estación pico del virus es no-viembre-diciembre. El pico de la epidemia viaja secuencialmente a través de Estados Unidos, de oeste a este, concluyendo en abril-mayo en el norte6,27,28.
Se encuentran en circulación múltiples serotipos de rotavirus. El serotipo se define por las dos proteínas de superficie: VP7, la glucoproteína (proteína G), y VP4, la proteína desdoblada por la proteasa (proteína P), que inducen anticuerpos neutralizantes. Para cada proteína se ha desarrollado un sistema de tipificación29. En seres humanos se han identificado 10 serotipos G y 11 serotipos
P. Las cuatro cepas de rotavirus (G1, G3, G4 combinadacon P1A[8], y G2 combinada con P1B[4]) constituyen el 96% de las identificadas en todo el mundo30. Recientemente, han emergido serotipos G previamente excepcionales, como el G9. Los serotipos predominantes varían de año en año y de una región a otra.
El rotavirus se transmite de persona a persona por vía fecal-oral. Los niños eliminan más de 100.000 millones de partículas víricas por gramo de heces durante la infección aguda31,32. La eliminación puede tener lugar antes del desarrollo de los síntomas y persiste durante hasta 10 días después del inicio de éstos en huéspedes inmunocompetentes33. Es frecuente la diseminación de las infecciones por rotavirus en familias. El 30-50% de contactos adultos de lactantes infectados contraen la infección, aunque la mayor parte permanecen asintomáticos34,35.
Manifestaciones clínicas de la enfermedadDespués de un período de incubación de 1-3 días, la gastroenteritis por rotavirus se inicia de forma aguda con fiebre y vómitos, seguido 24-48 horas más tarde de diarrea acuosa36. Característicamente, el paciente produce 10-20 deposiciones al día. En general, los síntomas persisten durante 3-8 días. La fiebre afecta hasta la mitad de todos los niños infectados y suele ser de bajo grado, aunque un tercio de pacientes puede tener fiebre de hasta 39 oC. Los vómitos no son biliosos y afectan al 80-90% de niños infectados. Los vómitos suelen ser de breve duración y persisten 24 horas o menos en la mayor parte de niños. Las principales secuelas de la infección son la deshidratación y las alteraciones electrolíticas que afectan con más frecuencia a niños pequeños37,38. La infección por rotavirus suele localizarse en el intestino, pero ocasionalmente se ha descrito la afectación de localizaciones extraintestinales, como las vías respiratorias, hígado, riñón, ganglios linfáticos y sistema nervioso central39-42.
En niños inmunocompetentes la infección tiene tendencia a ser más grave en los de 3-24 meses de edad, aunque el 25% de casos de infección grave afecta a los mayores de 2 años de edad7. Los pacientes con inmunodeficiencia, incluidos aquellos con infección por el virus de la inmunodeficiencia humana (VIH), trasplante de órganos sólidos o de médula ósea y déficit de células natural killer, pueden padecer una diarrea más grave o prolongada43-46.
La mayor parte de niños se infectan por el virus más de una vez. Las infecciones iniciales tienen más probabilidades de traducirse en una gastroenteritis grave que las siguientes. Después de la infección se desarrolla inmunidad protectora que es más potente frente a la enfermedad moderada o grave1. Las infecciones ulteriores suelen ser más leves o incluso pueden ser asintomáticas. Los adultos suelen presentar una infección asintomática o leve debido a la inmunidad a partir de exposiciones previas34,35.
A partir de infecciones previas la mayor parte de embarazadas presentan anticuerpos frente a rotavirus que se transmiten por vía transplacentaria protegiendo al recién nacido. Como consecuencia, la mayor parte de recién nacidos infectados presentará una infección asintomática o de carácter leve11. Una excepción es el lactante prematuro, que corre mayor riesgo de enfermedad grave que el lactante a término debido a la ausencia de dichos anticuerpos maternos47.
Puesto que las características clínicas y las de la diarrea causada por rotavirus son inespecíficas, en niños con diarrea, en algunos ámbitos clínicos y como medida de vigilancia, se requiere una confirmación del diagnóstico de la infección por rotavirus mediante pruebas de laboratorio. El método usado con más frecuencia es la detección del antígeno en las heces mediante enzimoinmunoanálisis (EIA) dirigido al antígeno de grupo común para todos los rotavirus de grupo A, incluidos los de la vacuna frente al virus. Las muestras de heces de menos del 10% de niños vacunados pueden ser positivas mediante EIA durante hasta dos semanas después de la primera dosis de la vacuna. Es poco probable que un resultado positivo de la prueba EIA en heces afecte a las dosis posteriores de la vacuna.
VacunaDescripción
La vacuna pentavalente aprobada frente a rotavirus es una vacuna oral que contiene 5 rotavirus vivos reagrupados. Las cepas originales de rotavirus de los agrupados se aislaron de huéspedes humanos y bovinos. Cuatro de los rotavirus reagrupados expresan una de las proteínas de la cápside externa (G1, G2, G3 o G4) de la cepa original de rotavirus humano y la proteína de unión (P7[5]) de la cepa original de rotavirus bovino. El quinto virus reagrupado expresa la proteína de unión (P1A[8]) de la cepa original de rotavirus humano y la proteína G6 de la cápside externa de la cepa original de rotavirus bovino. Los virus reagrupados se propagan en células Vero utilizando técnicas estándar de cultivo de tejido.
Los virus reagrupados se suspenden en una solución estabilizadora neutralizada. Cada dosis de vacuna contiene glucosa, citrato sódico, monohidrato monobásico de fosfato sódico, hidróxido sódico, polisorbato 80, medios de cultivo celular e indicios de suero bovino fetal. No contiene conservantes ni timerosal.
Inmunogenicidad
No se comprenden del todo las correlaciones inmunes de la protección frente a la infección y la enfermedad por rotavirus. En un ensayo clínico a gran escala de fase III, efectuado con la vacuna pentavalente frente a rotavirus, como uno de los parámetros de la inmunogenicidad de la vacuna se utilizó un aumento del título de anticuerpos séricos de inmunoglobulina A (IgA) específicos de grupo de rotavirus. Se obtuvieron muestras séricas a partir de un subgrupo de los participantes en el estudio antes de la vacunación y aproximadamente dos semanas después de la tercera dosis, y la seroconversión se definió como un aumento del triple o mayor en el título de anticuerpos desde el valor basal. Entre los 189 receptores de la vacuna las tasas de seroconversión de los anticuerpos IgA frente a rotavirus fueron del 95% comparado con el 14% en 161 receptores de placebo12.
Cuando se administran simultáneamente, la serie de 3 dosis de la vacuna pentavalente frente a rotavirus no disminuye la respuesta inmune a la vacuna conjugada frente a Haemophilus influenzae tipo b (Hib), vacuna inactivada de virus de la poliomielitis (IPV), vacuna frente a la hepatitis B, vacuna conjugada antineumocócica y los antígenos diftérico y tetánico de la vacuna de toxoides diftérico y tetánico y acelular de la tos ferina48 (DTaP). Puesto que todavía se encuentra en revisión la validación de los análisis de la tos ferina, no están disponibles datos suficientes sobre la inmunogenicidad para confirmar la ausencia de interferencia cuando la vacuna pentavalente frente a rotavirus se administra concomitantemente con las vacunas de la infancia para prevenir la tos ferina.
Eficacia
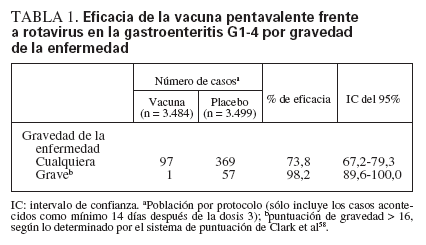
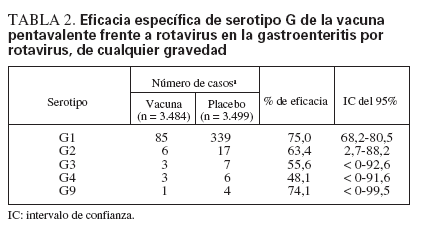
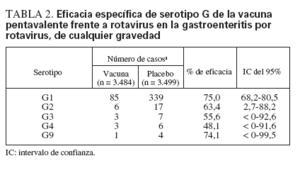
La eficacia de la vacuna pentavalente frente a rotavirus se ha evaluado en dos ensayos de fase III12,49. En estos ensayos, la eficacia de la vacuna tras completar la pauta de tres dosis frente a la gastroenteritis por rotavirus de cualquier gravedad fue del 74% y, de nuevo, frente a la gastroenteritis grave por el virus fue del 98% (tabla 1). Se observó eficacia frente a todos los serotipos G1-G4 y G9 (tabla 2), pero se documentó un número relativamente reducido de casos por rotavirus diferente de G1.
TABLA 1. Eficacia de la vacuna pentavalente frente a rotavirus en la gastroenteritis G1-4 por gravedad de la enfermedad
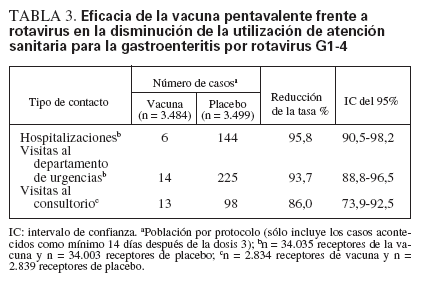
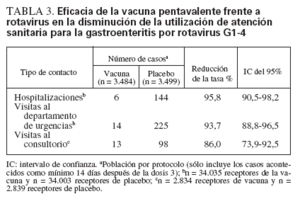
En un estudio efectuado a gran escala12, se evaluó la eficacia de la vacuna pentavalente frente a rotavirus en la reducción del número de visitas al consultorio para gastroenteritis por rotavirus entre 5.673 individuos y así mismo en la reducción del número de visitas al departamento de urgencias y de hospitalizaciones para gastroenteritis por rotavirus entre 68.038 individuos durante los 2 primeros años de vida. Esta vacuna redujo la incidencia de visitas al consultorio en un 86%, visitas al departamento de urgencias en un 94% y hospitalizaciones para gastroenteritis por rotavirus en un 96% (tabla 3).
TABLA 2. Eficacia específica de serotipo G de la vacuna pentavalente frente a rotavirus en la gastroenteritis por rotavirus, de cualquier gravedad
TABLA 3. Eficacia de la vacuna pentavalente frente a rotavirus en la disminución de la utilización de atención sanitaria para la gastroenteritis por rotavirus G1-4
La eficacia frente a todas las hospitalizaciones por gastroenteritis de cualquier etiología fue del 59%.
En la segunda estación del virus tras la vacunación la eficacia de la vacuna pentavalente frente a rotavirus fue del 63% frente a la gastroenteritis por rotavirus de cualquier gravedad y del 88% frente a la de carácter grave12.
Los datos sobre eficacia de un número inferior a 3 dosis de la vacuna son limitados. En un estudio efectuado a gran escala, se evaluó la eficacia de la vacuna en la reducción del número de visitas al departamento de urgencias y hospitalizaciones para gastroenteritis por rotavirus en niños que recibieron menos de 3 dosis de la vacuna50. Aunque el estudio incluyó a más de 68.000 niños, el número que recibió menos de 3 dosis de la vacuna o placebo fue inferior a 100. En este estudio la eficacia estimada de 1, 2 y 3 dosis de la vacuna fue del 29%, 80% y 95%, respectivamente.
La lactancia materna y la administración concurrente de otras vacunas infantiles no parecen disminuir la eficacia de la serie de tres dosis de la vacuna pentavalente frente a rotavirus (Merck, datos no publicados, 2005). Entre 204 lactantes prematuros vacunados (< 37 semanas de gestación), la estimación punto de la eficacia de la vacuna frente a la gastroenteritis por rotavirus G1-G4 de cualquier gravedad fue comparable a la observada entre lactantes que no eran prematuros (70%), pero los límites de confianza incluyeron el 0 debido al pequeño tamaño de la muestra (Merck, datos no publicados, 2005).
Seguridad
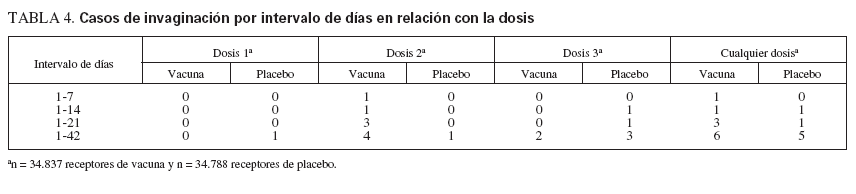
Invaginación intestinal. La seguridad con respecto a la invaginación intestinal se evaluó en 71.725 individuos reclutados en ensayos de fase III de eficacia. En un ensayo a gran escala sobre seguridad y eficacia, diseñado específicamente para evaluar el riesgo de invaginación12, se contactó por teléfono o a través de una visita domiciliaria con los padres o tutores legales aproximadamente el día 7, 14 y 42 después de cada vacunación y, a continuación, cada 6 semanas durante hasta un año después de la primera dosis. Se formularon preguntas a los padres acerca de todas las experiencias adversas graves, incluida la invaginación, entre los niños reclutados. Los casos potenciales de invaginación se adjudicaron de acuerdo con una definición preespecificada de caso que incluyó criterios radiológicos, quirúrgicos y de autopsia. Para el criterio de valoración preespecificado en el 42 día después de la vacunación, se observaron 6 casos de invaginación en el grupo al que se administró la vacuna pentavalente frente a rotavirus comparado con 5 casos en el grupo placebo (riesgo relativo ajustado a la multiplicidad: 1,6). Los datos no sugirieron un aumento del riesgo de invaginación en comparación con placebo. Entre los receptores de la vacuna, no se comprobaron casos de invaginación en el período de 42 días después de la primera dosis, que representaba el período de mayor riesgo de la vacuna tetravalente de rotavirus rhe-sus-humanos reagrupados (RRV-TV), aprobada previamente (tabla 4). Además, no se observaron pruebas de agrupación de casos de invaginación en una ventana de 7 o 14 días después de la vacunación para cualquier dosis. Durante el período de seguimiento de un año tras la administración de la primera dosis, se observaron 13 casos de invaginación en el grupo al que se administró la vacuna pentavalente comparado con 15 casos en el grupo placebo (riesgo relativo ajustado para la multiplicidad: 0,9).
TABLA 4. Casos de invaginación por intervalo de días en relación con la dosis
Otros efectos adversos. Los efectos adversos graves y las muertes se evaluaron en los 71.725 lactantes recluta-dos en ensayos de fase III (tabla 5). Entre los receptores de la vacuna pentavalente y los de placebo, la incidencia de acontecimientos adversos graves, incluidas muertes, fue similar. Los investigadores enmascarados no atribuyeron ninguna muerte a la vacunación. La causa más frecuente de la muerte (que representó 17 de 52 muertes) fue el síndrome de la muerte súbita del lactante (SMSL) y las muertes debidas a este síndrome se distribuyeron por igual entre receptores de la vacuna y los de placebo (n = 8 y n = 9, respectivamente).
Se estudió con detalle a un subgrupo de 11.722 individuos para evaluar otros acontecimientos adversos potenciales como la fiebre, diarrea, y vómitos. En el período de 42 días después de la vacunación, entre los vacunados se puso de relieve una tasa reducida pero significativamente (p < 0,05) mayor de síntomas comparado con los receptores de placebo, incluido un exceso de vómitos del 1% (15% comparado con 14%, respectivamente), un exceso de diarrea del 3% (24% comparado con 21%, respectivamente), un exceso de rinofaringitis del 1% (7% comparado con 6%, respectivamente), un exceso de otitis media del 2% (15% comparado con 13%, respectivamente) y un exceso de broncospasmos del 0,4% (1,1% comparado con 0,7%, respectivamente). Entre los receptores de la vacuna pentavalente frente a rotavirus y los de placebo, la incidencia de episodios documentados de fiebre (43% comparado con 43%, respectivamente) y hematoquecia (0,5% comparado con 0,3%, respectivamente) fue similar.
TABLA 5. Resumen de los acontecimientos adversos graves (AAG) al cabo de 42 días de cualquier dosis
En el período de 7 días después de la vacunación, entre los vacunados se halló una tasa pequeña pero significativamente (p < 0,05) mayor de diarrea, con un exceso del 1% después de la primera dosis (10% comparado con 9%, respectivamente), 3% después de la segunda dosis (9% comparado con 6%, respectivamente) y 3% después de cualquier dosis (18% comparado con 15%, respectivamente). De forma parecida, entre los vacunados hubo una tasa de vómitos pequeña pero significativamente (p < 0,05) mayor con un exceso del 2% después de la primera dosis (7% comparado con 5%, respectivamente) y del 2% después de cualquier dosis (12% comparado con 10%, respectivamente). Durante el período de 7 días después de cualquier dosis de vacuna la incidencia de fiebre e irritabilidad fue similar entre los receptores de la vacuna pentavalente y los de placebo.
Seguridad en lactantes prematuros. En los ensayos de fase III se administró la vacuna pentavalente frente a rotavirus o placebo a 2.070 lactantes prematuros (25 a 36 semanas de edad gestacional, mediana 34 semanas). Se monitorizó a todos los lactantes prematuros en busca de acontecimientos adversos graves y un subgrupo de 308 se monitorizó con más detalle para todos los acontecimientos adversos. Entre los lactantes prematuros no se documentaron casos de invaginación. Entre los lactantes prematuros que recibieron la vacuna pentavalente frente a rotavirus y placebo, la incidencia de acontecimientos adversos graves (5,5% comparado con 5,8%, respectivamente) fue similar. Entre lactantes prematuros que recibieron la vacuna pentavalente frente a rotavirus se documentaron dos muertes (una por SMSL y otra por accidente de tráfico) y entre los que recibieron placebo se documentaron otras dos (una por SMSL y otra de causa desconocida).
Eliminación y transmisión de las cepas vacunales. En un subgrupo de individuos reclutados en los ensayos de fase III se evaluó la eliminación fecal del virus vacunal mediante EIA obteniendo una muestra de heces durante los 4-6 días después de cada visita para la vacunación y entre todos los niños que en cualquier momento presentaron una muestra de heces positiva para el antígeno de rotavirus. Después de la primera dosis se detectó la eliminación del virus vacunal entre 32 de 360 (8,9%) individuos, después de la segunda no se detectó en ninguno de 249 (0%) y después de la tercera dosis se detectó en uno de 385 (0,3%). En los estudios de fase III se observó eliminación al cabo de un día y 15 días después de una dosis. A través de los estudios epidemiológicos no se evaluó el potencial de transmisión del virus vacunal.
Rentabilidad
En un análisis reciente que utilizó las estimaciones actuales de la carga de la infección por rotavirus, eficacia de la vacuna, tasas de cobertura de la vacuna y costes sanitarios, los investigadores estimaron que un programa nacional de inmunización frente a rotavirus en el que se administraran tres dosis de la vacuna pentavalente a los 2, 4, y 6 meses de edad daría lugar a 255.000 visitas menos a médicos, 137.000 visitas menos a departamentos de urgencias, 44.000 hospitalizaciones menos y 13 muertes menos al año en niños menores de 5 años de edad. Desde una perspectiva exclusiva de asistencia sanitaria, es probable que la vacunación ahorre costes con un coste total por niño (incluidos los costes de administración) de hasta 66 dólares por niño (alrededor de 12 dólares por dosis de vacuna). Una vacuna de mayor precio tendría probabilidades cada vez menores de ahorrar costes y con un coste de más de 268 dólares por niño (alrededor de 79 dólares por dosis), un programa de inmunización frente a rotavirus tendría más probabilidades de producir un coste neto a la sociedad (CDC, datos no publicados, 2006).
Administración y conservación de la vacuna
La vacuna pentavalente frente a rotavirus se suministra en un tubo dosificador de plástico extraíble con un tapón de media rosca destinado a permitir que la vacuna se administre directamente a lactantes por vía oral. Cada tubo contiene una sola dosis de 2 ml de vacuna como una solución única estabilizada, neutralizada, de color amarillo pálido pero que puede tener una coloración rosada. Esta formulación protege al virus vacunal frente al ácido gástrico y estabiliza la vacuna, lo que permite su conservación a temperaturas de frigorífico (2-8 oC) durante 24 meses. La vacuna pentavalente frente a rotavirus debe administrarse lo antes posible después de extraerla del frigorífico. Para información sobre estabilidad en condiciones diferentes de las recomendadas se ruega llamar a Merck al teléfono 1-800-637-2590.
Contraindicaciones y precaucionesContraindicaciones
Reacción alérgica grave a un componente de la vacuna o a una dosis previa. La vacuna pentavalente frente a rotavirus no debe administrarse a lactantes con hipersensibilidad grave a cualquier componente de la vacuna o que han experimentado una reacción alérgica grave a una dosis previa de la vacuna. (Recomendación; opinión del experto [v. apéndices 2 y 3].)
Precauciones
Alteraciones de la inmunocompetencia. Los médicos deben considerar los posibles riesgos y beneficios de administrar la vacuna a lactantes con una alteración conocida o sospechada de la inmunocompetencia (evidencia de grado III). En ocasiones los niños y adultos inmunocomprometidos debido a una inmunodeficiencia congénita, trasplante de médula ósea o de órganos sólidos experimentan gastroenteritis por rotavirus prolongada, grave e incluso mortal. Sin embargo, no se dispone de datos de seguridad o eficacia para la administración de la vacuna a lactantes potencialmente inmunocomprometidos, incluidos:
- Lactantes con discrasias sanguíneas, leucemia, lin-fomas de cualquier tipo u otras neoplasias malignas que afectan a la médula ósea o al sistema linfático.
- Lactantes tratados con inmunosupresores (incluidoscorticosteroides sistémicos en dosis altas).
- Lactantes con estados de inmunodeficiencia prima-ria y adquirida, incluida la infección por VIH o síndrome de la inmunodeficiencia adquirida (sida) u otras manifestaciones clínicas de la infección por VIH; inmunodeficiencias celulares y estados hipogammaglobulinémicos y disgammaglobulinémicos. Los datos de los ensayos clínicos son insuficientes para respaldar la administración de esta vacuna a lactantes con un estado indeterminado del VIH dados a luz por mujeres con infección por VIH o sida.
- Lactantes que han recibido una transfusión sanguí-nea o hemoderivados, incluidas inmunoglobulinas, en un plazo de 42 días. En general, si es posible, la vacuna frente a rotavirus debe diferirse durante 42 días después de recibir un preparado que contenga anticuerpos. No obstante, si esta demora de 42 días hace que la primera dosis de la vacuna deba administrarse a una edad µ 13 semanas, debe utilizarse un intervalo más breve para garantizar que la primera dosis se administra antes de dicha edad.
Gastroenteritis aguda moderada o grave. En las circunstancias habituales, la vacuna pentavalente no debe administrarse a lactantes con gastroenteritis aguda, moderada o grave hasta que su proceso mejore (evidencia de grado III). Sin embargo, los lactantes con gastroenteritis aguda leve pueden ser vacunados, en particular si el retraso de la vacunación puede ser sustancial haciendo que el niño no sea elegible para la vacuna (p. ej., mayor de 12 semanas de edad antes de iniciar la vacunación).
La vacuna pentavalente no se ha estudiado entre lactantes con gastroenteritis aguda concurrente, entre los que, en teoría, su inmunogenicidad y eficacia pueden comprometerse. Por ejemplo, en algunos casos en lactantes que, durante un episodio de gastroenteritis aguda, recibieron la vacuna oral de la poliomielitis (OPV) se detectó una disminución de anticuerpos frente al virus de la poliomielitis de la OPV.
Enfermedad febril moderada o grave. Los lactantes con enfermedad febril moderada o grave deben vacunar-se tan pronto como se hayan restablecido de la fase aguda de la enfermedad (evidencia de grado III). Esta precaución evita la superposición de efectos adversos de la vacuna en la enfermedad subyacente o la atribución por error de una manifestación de la enfermedad subyacente a la vacuna.
Enfermedad gastrointestinal crónica preexistente. Los médicos deben considerar los riesgos y beneficios potenciales de administrar la vacuna pentavalente frente a rota-virus a lactantes con una enfermedad gastrointestinal crónica preexistente (evidencia de grado III). Los lactantes con procesos gastrointestinales crónicos preexistentes y que no reciben tratamiento inmunosupresor deben beneficiarse de la vacunación frente a rotavirus y los beneficios son mayores que los riesgos teóricos. Sin embargo, la seguridad y eficacia de la vacuna pentavalente no se ha establecido para lactantes con estos procesos preexistentes (p. ej., síndromes de mala absorción congénita, enferme-dad de Hirschsprung, síndrome del intestino corto o vómitos persistentes de causa desconocida).
Antecedentes de invaginación. Después de la administración de la vacuna frente a rotavirus aprobada previamente (RRV-TV), se observó un aumento del riesgo de invaginación. Los datos disponibles previos a la aprobación a partir de un gran ensayo efectuado en 70.000 lactantes no demuestran pruebas de una asociación entre este proceso y la vacuna pentavalente. Sin embargo, se requieren datos adicionales de vigilancia postaprobación para confirmar que la vacuna no se asocia con invaginación a una tasa menor que la que se habría detectado en los ensayos previos a la aprobación. Además, algunos datos sugieren que los lactantes con antecedentes de este proceso pueden correr un mayor riesgo de un episodio repetido que los demás niños. Por esta razón, hasta que se disponga de datos postaprobación sobre la seguridad de la vacuna, cuando se vacune a lactantes con un episodio previo de invaginación es preciso considerar los riesgos y beneficios de la vacunación (evidencia de grado III).
RECOMENDACIONESVacunación sistemática con la vacuna pentavalente frente a rotavirusLos lactantes deben recibir 3 dosis de la vacuna pentavalente administrada por vía oral a los 2, 4 y 6 meses de edad. La primera dosis debe administrarse a las 612 semanas (es decir, en la semana 12 o antes, 0 días de edad). Las dosis ulteriores deben administrarse a intervalos de 4-10 semanas, y las 3 dosis de la vacuna deben haberse administrado a las 32 semanas de edad (es decir, a las 32 semanas o antes, 0 días) (evidencia de grado I).
No debe iniciarse la vacunación en lactantes mayores de 12 semanas porque no se dispone de datos suficientes sobre tolerabilidad de la primera dosis de la vacuna en lactantes más mayores (evidencia de grado III).
La vacuna no debe administrarse después de las 32 semanas de edad porque no se dispone de datos suficientes sobre la seguridad y eficacia de dicha vacuna en lactantes después de esta edad (evidencia de grado III). Los acontecimientos adversos, como la fiebre, fueron sustancialmente más altos en niños que iniciaron o completaron la serie de la vacuna RRV-TV después de los 6 meses de edad51-53.
Para lactantes en los que la primera dosis de la vacuna pentavalente se administró involuntariamente como uso no autorizado a las 13 semanas o a una edad mayor, debe completarse el resto de la vacunación como en la pauta definida previamente, porque el momento de la administración de la primera dosis no afecta a la seguridad y eficacia de la segunda y tercera dosis (evidencia de grado III).
En lactantes en los que se documenta que han experimentado gastroenteritis por rotavirus antes de recibir toda la tanda de vacunación frente a rotavirus se iniciará o completará la pauta de 3 dosis porque, con frecuencia, la infección inicial sólo confiere inmunidad parcial (evidencia de grado III).
Los lactantes que son alimentados al pecho pueden recibir la vacuna pentavalente. La eficacia de la vacuna es similar entre lactantes alimentados al pecho y los alimentados con lactancia artificial (evidencia de grado I).
Al igual que otras vacunas infantiles, la vacuna pentavalente puede administrarse a lactantes con enfermedades leves, transitorias, con o sin fiebre de bajo grado54 (evidencia de grado I).
Administración simultánea con otras vacunas infantilesLa vacuna pentavalente frente a rotavirus puede administrarse junto con las vacunas DTaP, Hib, IPV, hepatitis B y antineumocócica conjugada. Las pruebas disponibles sugieren que la vacuna no interfiere con las respuestas inmunes a dichas vacunas ni los antígenos diftérico y tetánico de la vacuna DTaP (evidencia de grado I). Puesto que todavía se encuentra en revisión la validación de los análisis de la tos ferina, no se dispone de datos suficientes sobre inmunogenicidad para confirmar la falta de interferencia de las respuestas inmunes cuando la vacuna pentavalente se administra concomitantemente con vacunas infantiles de la tos ferina (evidencia de grado III).
Situaciones especialesLactantes prematuros (nacidos < 37 semanas de embarazo)
Los médicos deben considerar los beneficios y riesgos potenciales de vacunar a lactantes prematuros frente a rotavirus. Los datos limitados sugieren que estos lactantes corren un mayor riesgo de hospitalización por gastroenteritis vírica durante el primer año de vida47. En los ensayos clínicos, la tolerabilidad y eficacia de la vacuna pentavalente parece ser similar para lactantes prematuros y a término, aunque se ha evaluado un número relativamente reducido de lactantes prematuros. En teoría, en lactantes prematuros de muy bajo peso al nacer la menor concentración de anticuerpos maternos frente a rotavirus podría aumentar el riesgo de reacciones adversas a la vacuna pentavalente. La AAP respalda la vacunación de estos lactantes en las condiciones siguientes: lactantes de como mínimo 6 semanas de edad, clínicamente estables y cuya primera dosis de vacuna se administra en el momento del alta o después de haber sido dados de alta del servicio de neonatología del hospital. Hasta que se disponga de datos adicionales, la AAP considera que los beneficios de la inmunización con la vacuna pentavalente para lactantes prematuros son mayores que los riesgos teóricos (evidencia de grado III).
Exposición de individuos inmunocomprometidos a lactantes vacunados
Es preciso vacunar a los lactantes que viven en familias con algún miembro portador o en el que se sospecha un trastorno de tipo inmunodeficiencia o deterioro del estado inmune (evidencia de grado III). La mayor parte de expertos consideran que el beneficio de la protección del miembro inmunocomprometido de la familia, conferida por la vacunación del niño, es mayor que el ligero riesgo de transmitir el virus vacunal al miembro inmunocomprometido y cualquier riesgo teórico posterior de enfermedad asociada al virus vacunal. Para reducir a un mínimo la transmisión potencial del virus, todos los miembros de la familia deben emplear medidas como el lavado de manos apropiado después del contacto con las heces del niño vacunado (p. ej., después del cambio de pañal) durante, como mínimo, una semana después de la primera dosis de la vacuna pentavalente.
Exposición de la mujer embarazada a lactantes vacunados
Los lactantes que viven en familias con una mujer embarazada deben ser vacunados (evidencia de grado III). La mayor parte de mujeres en edad fértil presentan una inmunidad preexistente a rotavirus, de modo que el riesgo de infección y enfermedad a partir de la exposición potencial a la cepa del virus vacunal atenuado es muy bajo. Además, la vacunación de niños pequeños reduce la exposición potencial de la mujer embarazada al virus natural si el lactante no vacunado contrae una gastroenteritis por rotavirus.
Regurgitación de la vacuna
El médico no debe readministrar una dosis de vacuna pentavalente a un lactante que regurgita o vomita durante o después de la administración de la vacuna (evidencia de grado III). El lactante puede recibir el resto de dosis recomendadas de la vacuna a los intervalos apropiados. Se dispone de datos limitados relativos a la inocuidad de administrar una dosis de vacuna pentavalente mayor que la recomendada y sobre la eficacia de administrar una dosis parcial. Se requieren más datos sobre seguridad y eficacia para evaluar los beneficios y riesgos de la readministración.
Hospitalización después de la vacunación
Si un niño vacunado recientemente es hospitalizado por cualquier razón, no deben tomarse más precauciones que las de referencia para prevenir la diseminación del virus vacunal en un ámbito hospitalario (evidencia de grado III).
Documentación de acontecimientos adversosEs preciso documentar cualquier acontecimiento adverso clínicamente significativo o inesperado que se produzca después de la administración de la vacuna al Vaccine Adverse Event Reporting System (VAERS). La National Childhood Vaccine Injury Act exige que los profesionales sanitarios documenten al VAERS 1) cualquier acontecimiento citado por el fabricante de la vacuna como una contraindicación de una dosis ulterior de la vacuna o 2) cualquier acontecimiento citado en la tabla de acontecimientos que deben notificarse después de la vacunación (v. http://vaers.hhs.gov/reportable.htm) que se produce dentro del período de tiempo especificado tras la vacunación. La vacuna pentavalente se aborda en la categoría general de vacunas frente a rotavirus en la tabla de acontecimientos que deben notificarse, y no se citan circunstancias específicas para la notificación. Pueden solicitarse las hojas de notificación del VAERS al igual que información durante 24 horas al día llamando al 800-822-7967 o accediendo a la página web del VAERS en http://vaers.hhs.gov/.
Aumento de la vigilancia de acontecimientos adversos después de la aprobación
En los ensayos clínicos efectuados previamente a la aprobación, la vacuna pentavalente no se ha asociado con acontecimientos adversos graves, incluida la invaginación. Sin embargo, es importante la monitorización continuada de los acontecimientos adversos tras la introducción de la vacuna pentavalente en los programas de vacunación sistemática, en particular a la luz de la experiencia previa con la vacuna RRV-TV. Además de los estudios de fase IV patrocinados por el fabricante, la monitorización después de la aprobación incluirá una revisión detenida de los acontecimientos adversos notificados al VAERS. También se usará el Vaccine Safety Datalink (VSD) para monitorizar el riesgo de invaginación asociado con la vacuna pentavalente y para evaluar cualquier otra posible asociación que pueda identificarse a través del VAERS o en los estudios de fase
IV. El proyecto VSD incluye información sobre indivi-duos reclutados en ocho grandes compañías de seguros médicos de oferta restringida con una cohorte de nacimiento anual de más de 90.000 lactantes. Se registran los datos sobre todas las vacunas administradas en la población del estudio y se vinculan con los diagnósticos a partir de las visitas médicas para determinar las tasas de posibles acontecimientos adversos como consecuencia de la vacunación. Recientemente, los métodos de análisis rápidos desarrollados han permitido que el VSD condujera una monitorización de los acontecimientos adversos relacionados con la vacuna casi en «tiempo real».
Dada la tasa basal de invaginación natural entre lactantes de Estados Unidos (25-38 casos por 100.000) y el elevado número de lactantes potencialmente elegibles para la vacunación, es predecible que algunos procesos acontezcan sólo por casualidad en el período de dos semanas después de la vacunación y no relacionados con la vacuna. En consecuencia, será necesaria una intensa vigilancia postaprobación para evaluar la tolerabilidad de la vacuna pentavalente frente a este acontecimiento poco frecuente.
Necesidades futurasVigilancia de la gastroenteritis por rotavirus
La gastroenteritis por rotavirus no es una enfermedad de declaración obligatoria en Estados Unidos, y, cuando un niño solicita asistencia médica por gastroenteritis aguda, no siempre se efectúan pruebas en busca de infección por rotavirus. Será necesario establecer sistemas de vigilancia de la infección por rotavirus que sean lo suficientemente sensibles y específicos para documentar la eficacia de los programas de vacunación. Los sistemas actuales de vigilancia nacional de las infecciones por rotavirus incluyen 1) revisión de las bases de datos nacionales de altas hospitalarias para diagnósticos específicos de rotavirus o compatibles; 2) informes del aislamiento de rotavirus a partir de un sistema centinela de laboratorios; y 3) vigilancia en 3 centros que participan en la New Vaccine Surveillance Network. A nivel estatal y local, serán necesarios esfuerzos adicionales de vigilancia, con una mayor vigilancia en los hospitales centinela o mediante la revisión de las bases de datos del alta hospitalaria para monitorizar la eficacia del programa de la vacuna. Se requerirán estudios especiales (p. ej., de casos-controles) para confirmar la eficacia de la vacuna pentavalente en su uso programático sistemático.
Detección de cepas infrecuentes de rotavirus
En los CDC se ha establecido un sistema de vigilancia nacional de las cepas de laboratorios centinelas para monitorizar la prevalencia de las cepas de rotavirus antes y después de la introducción de la vacuna. Este sistema está destinado a detectar cepas nuevas o insólitas que la vacunación no prevendría satisfactoriamente y que afectarían a la eficacia del programa de vacunación.
Investigación
La futura investigación debe incluir estudios que determinen la tolerabilidad y eficacia de la vacuna pentavalente administrada a lactantes prematuros, lactantes con inmunodeficiencias, aquellos que viven en familias con miembros inmunocomprometidos, y lactantes con enfermedad gastrointestinal crónica. También deben conducirse estudios postaprobación para determinar la eficacia relativa de menos de tres dosis de vacuna y abordar la rentabilidad de los programas de vacunación en diversos ámbitos.
Introducción de otras vacunas frente a rotavirusUna vacuna monovalente de rotavirus humanos atenuados (RotaRix, GSK Biologicals, Bélgica) ha demostrado una eficacia clínica apropiada y, en un ensayo efectuado en más de 60.000 lactantes, no se observó un aumento de la invaginación entre receptores de la vacuna comparado con los de placebo55. Hasta agosto de 2006, RotaRix estaba aprobada en la Unión Europea yen 33 países de Sudamérica, África y Asia pero en Estados Unidos todavía no se ha presentado la solicitud de autorización.
Factores que pueden influir en la aceptación de la vacuna
La eficacia de un programa de vacunación frente a rotavirus depende de la aceptación y el entusiasmo de los médicos y otros profesionales de asistencia sanitaria que atienden a niños y cuidadores de lactantes. A la luz de la experiencia con la retirada de la vacuna RRV-TV debido a su asociación con la invaginación, algunos profesionales sanitarios y padres pueden suscitar preocupaciones acerca de la vacunación con la vacuna pentavalente. Sin embargo, en un estudio efectuado por Iwamoto et al56, el 94% de pediatras encuestados mencionaron que usarían una nueva vacuna frente a rotavirus si se demostraba que era mejor tolerada que la vacuna RRV-TV y si la AAP y los CDC la recomendaban para uso sistemático entre lactantes. Los obstáculos para reintroducir una vacuna frente a rotavirus fueron el temor a las reacciones adversas entre el 95% de pediatras, seguido del coste elevado potencial de la vacuna (63%) y la cantidad de tiempo necesario para educar a los padres (57%).
El personal del programa de vacunación se beneficiará de la educación sobre la infección por rotavirus y la vacuna antirrotavirus. También será esencial la educación de los padres sobre gastroenteritis por rotavirus y sobre la vacuna para establecer y mantener la confianza del gran público en esta vacuna y evitar la confusión por casos de gastroenteritis en la primera infancia que son consecuencia de causas diferentes de rotavirus no prevenibles con esta vacuna.
APÉNDICE 1. Sistema de valoración de la calidad de la evidencia científica del US Preventive Services Task Force*
APÉNDICE 2. Definiciones de las directrices de las afirmaciones basadas en la evidencia
APÉNDICE 2. Definiciones de las directrices de las afirmaciones basadas en la evidencia (continuación)
APÉNDICE 3. Calidad de la evidencia para los grados de evidencia
AGRADECIMIENTOSEl presente informe de la AAP se preparó paralelamente a las recomendaciones e informes de los CDC, “Prevention of rotavirus gastroenteritis among infants and children: recommendations of the Advisory Committee on Immunization Practices”57 (Prevención de la gastroenteritis por rotavirus entre lactantes y niños: recomendaciones del Comité Asesor sobre Vacunación). Buena parte de la información básica presentada en este informe de la AAP se basa en una revisión de los estudios publicados, análisis de datos no publicados y deliberaciones del personal de los CDC en colaboración con el grupo de trabajo para la vacuna frente a rotavirus del Advisory Committee on Immunization Practices (ACIP) (con coordinación de la AAP). Los autores desean expresar su agradecimiento al grupo de trabajo de los CDC para la vacuna frente a rotavirus (Rotavirus Vaccine Work Group) y a los individuos siguientes que proporcionaron contribuciones técnicas y una revisión de los datos: Umesh D. Parashar, MBBS; y James P. Alexander, MD.
COMMITTEE ON INFECTIOUS DISEASES, 2006-2007Joseph A. Bocchini, Jr., MD Robert S. Baltimore, MD Henry H. Bernstein, DO John S. Bradley, MD Michael T. Brady, MD Penélope H. Dennehy, MD Margaret C. Fisher, MD Robert W. Frenck, Jr., MD David W. Kimberlin, MD Sarah S. Long, MD Julia A. McMillan, MD Lorry G. Rubin, MD
COORDINADORESRichard D. Clover, MD, American Academy of Family Physicians Joanne Embree, MD, Canadian Paediatric Society Marc A. Fischer, MD, Centers for Disease Control and Prevention Richard L. Gorman, MD, National Institutes of Health Douglas R. Pratt, MD, Food and Drug Administration Anne Schuchat, MD, Centers for Disease Control and Prevention Benjamin Schwartz, MD, National Vaccine Program Office Jeffrey R. Starke, MD, American Thoracic Society
EX OFFICIO
Larry K. Pickering, MD, editor del Reed Book
CONSULTOR
Edgar O. Ledbetter, MD
PERSONAL
Alison Siwek, MPH