Desde el período temprano posparto, las madres muestran una singular capacidad de reconocer distintas claves sensoriales de sus propios hijos, visuales1,2, auditivas3 y olfativas4. Estos estímulos, como el llanto por hambre o la cara sonriente, constituyen potentes motivaciones de la respuesta de la madre, mediante los cuidados, el contacto físico, el habla o el juego. La investigación sobre animales sugiere que el comportamiento materno en respuesta al recién nacido muestra una relación causal con el resultado a largo plazo del desarrollo del niño en una serie de territorios, como el desarrollo cognitivo5,6, la reacción al estrés7-9 y el comportamiento materno en la edad adulta7,10. Los factores que restringen la capacidad de la madre para responder a los estímulos de su hijo, como la depresión11, la drogadicción12 e incluso la prolongada separación madre-hijo13, pueden resultar en resultados adversos del desarrollo de los niños11,12,14,15. Además, se cree que la capacidad de relacionar estas claves sensoriales con las necesidades subyacentes de un lactante, y de responder específica-mente a estas necesidades, constituye la base del establecimiento de un vínculo maternofilial seguro15-17. Así, la respuesta cerebral y del comportamiento de la madre a los estímulos de su hijo puede constituir un importante factor de predicción del desarrollo infantil.
En los últimos años, varios grupos de investigación han tratado de comprender mejor cómo responde el cerebro de la madre a los estímulos auditivos o visuales de su hijo mediante la RM funcional18-23 (RMf). Un tema común que emerge de estos estudios ha sido el posible papel del sistema dopamina mesocorticolímbico en el proceso de las señales basadas en la recompensa y que motivan el cuidado maternal, como se observa en los
modelos animales (v. la revisión24). Varios estudios han demostrado que el estriado, una proyección clave de las neuronas dopamínicas del mesencéfalo, que incluyen el putamen y la cabeza del caudado, es activo en respuesta a las imágenes faciales del hijo en comparación con las de niños desconocidos (o conocidos pero no emparentados22,23, del mismo modo que el estímulo del llanto del niño18. Se han observado patrones similares de activación en respuesta a fotografías de parejas románticas22, caras hermosas25 y estímulos sexuales26, lo que sugiere una relación entre el vínculo y los circuitos de recompensa cerebral.
Sin embargo, algunos estudios de la respuesta materna no han demostrado la activación del estriado20,21, entre otras diferencias importantes. Por ejemplo, las amígdalas están claramente activadas en algunos estudios20,23, y desactivadas en otros22. Como las amígdalas desempeñan un papel importante en el proceso del estado expresado en la cara27, y su respuesta puede estar modulada por la dopamina28,29, las diferencias en la expresión de estados en la cara del niño pueden ser un factor de confusión. Aunque la mayoría de los estudios de la cara de los niños tratan de normalizar el estado expresado en la cara, ninguno de ellos controló específicamente la variación del estado ni examinó las diferencias de la respuesta relacionadas con el estado expresado en la cara. Además, la mayoría de los estudios anteriores tuvo un pequeño tamaño de la muestra (10 sujetos o menos) o utilizó un análisis subóptimo de efectos fijos24 que impide la generalización de los resultados a la población de la que se tomó la muestra30.
Este estudio incluye una muestra relativamente grande de madres primíparas y sus hijos, comparando específicamente las respuestas cerebrales de la madre a los estímulos de la cara del niño agrupados en estado de felicidad, neutro y tristeza. Supusimos que la cara del hijo comparada con la de un desconocido activaría las regiones cerebrales del proceso de recompensa asociado con dopamina, incluyendo la corteza ventral del estriado y la prefrontal, y que el contraste en estas regiones sería mayor en las caras de niños sonrientes que en las caras neutras o tristes. Según los resultados de estudios piloto31 y de estudios del llanto infantil18, también supusimos que las caras tristes del hijo, comparadas con las de un niño desconocido, activarían la corteza de la zona anterior del cíngulo, que interviene en el control de los conflictos32, y de la ínsula y la amígdala, regiones asociadas a menudo con el proceso de las emociones negativas27. En conjunto, estos patrones de respuesta nos ayudarían a definir mejor la base neurológica del vínculo maternofilial humano.
MÉTODOSSujetosEsta cohorte forma parte de un estudio longitudinal de mayor tamaño sobre el vínculo maternofilial, incluyendo a 43 mujeres incluidas durante el tercer trimestre del embarazo. Fueron incorporadas en consultas prenatales, los grupos de la iglesia local y en anuncios en carteles, revistas e internet. Cada mujer fue estudiada para su inclusión mediante una entrevista telefónica o un cuestionario en internet. Los criterios de inclusión fueron: primer embarazo, de feto único, ser diestra, no haber fumado durante el embarazo, no recibir actualmente medicamentos psicotrópicos y carecer de contraindicaciones para el estudio con RM (como implantes metálicos o claustrofobia intensa). En el momento de la RMf, cerca de un año después de la inclusión, se había perdido el seguimiento o habían declinado seguir participando 5 mujeres y no se pudo estudiar a 10 (9 por un segundo embarazo y 1 por el antecedente de convulsiones), por lo que fueron estudiadas 28 mujeres. Durante el segundo estudio sólo se dispuso de datos de 26 mujeres, en un caso por un movimiento inaceptable de la cabeza y en otro por un fallo del aparato.
El Comité de Ética del Baylor College of Medicine, Houston, Texas, aprobó el protocolo y todas las participantes ofrecieron su consentimiento por escrito.
Diseño experimentalSesión prenatal
Durante el tercer trimestre del embarazo, las mujeres incluidas ofrecieron información sociodemográfica, de la que se calculó el índice SES de Hollingshead. También se sometieron a una serie de pruebas psicométricas, como Adult Attachment Interview, Personality Disorder Questionnaire 4+ (PDQ4+), McLean Screening Instrument for Borderline Personality Disorder (MSI-BPD) y Beck Depression Inventory33 (BDI).
Sesión de grabación en vídeo
Unos 7 meses después del parto, cada niño fue grabado en vídeo en condiciones estándar en el Human Neuroimaging Laboratory, Baylor College of Medicine. Los experimentadores provocaron unas caras sonrientes mediante la interacción con los niños utilizando juguetes adecuados a su edad, y las de llanto se tomaron dejando al niño solo en la habitación (mientras se le observaba tras un falso espejo) con la cámara de vídeo grabando las expresiones faciales. Las madres no observaron la grabación en vídeo para garantizar que la imagen facial del niño era novedosa al presentarla en la siguiente sesión de estudio con neuroimagen. En esta visita, las madres también actualizaron su información demográfica y completaron otro BDI.
Luego se tomaron de la cinta de vídeo los fotogramas de la cara del niño que correspondían a distintos estados (felicidad, neutro y tristeza). Mediante un esquema de codificación del estado anímico expresado por la cara, basado en Cole et al34, un ayudante de investigación entrenado clasificó estas imágenes en uno de cinco grupos de estado de ánimo: muy feliz, feliz, neutro, triste o muy triste. Se demostró una excelente fiabilidad entre los observadores, basada en 466 imágenes con doble codificación (coeficiente de correlación de Pearson 0,925, bilateral, p < 0,001). Las imágenes de control de la cara del niño, desconocidas para cada madre, se tomaron de los hijos de otras madres incluidas o de las que participaron en el estudio piloto. Cada niño fue igualado a un solo control, con un mismo número de imágenes faciales en cada grupo de expresiones. Cuando fue posible, los dos niños también estuvieron igualados respecto a la edad y la raza. En los casos de mezcla racial, el igualamiento se basó en una combinación de la raza, la complexión y el color del cabello. El sexo fue el mismo cuando había rasgos de distinción evidentes, como pendientes o un cabello más largo. Todos los niños fueron grabados en vídeo vestidos con un mono blanco, neutro respecto al sexo. Todas las imágenes fueron normalizadas respecto al tamaño, la orientación y el fondo mediante Adobe PhotoShop.
Sesión de estudio por neuroimagen
Al menos 3 meses después de la sesión de grabación en vídeo, todas las madres acudieron a una sesión de estudio por neuroimagen en el Human Neuroimaging Laboratory. Inmediatamente antes del estudio, la madre participó en una entrevista semiestructurada de una hora de duración, Parent Development Interview35, que trató que la madre se reflejara en su relación con su hijo. Esto ofreció un marco común para cada madre antes de ver las imágenes de la cara del niño en el estudio por neuroimagen.
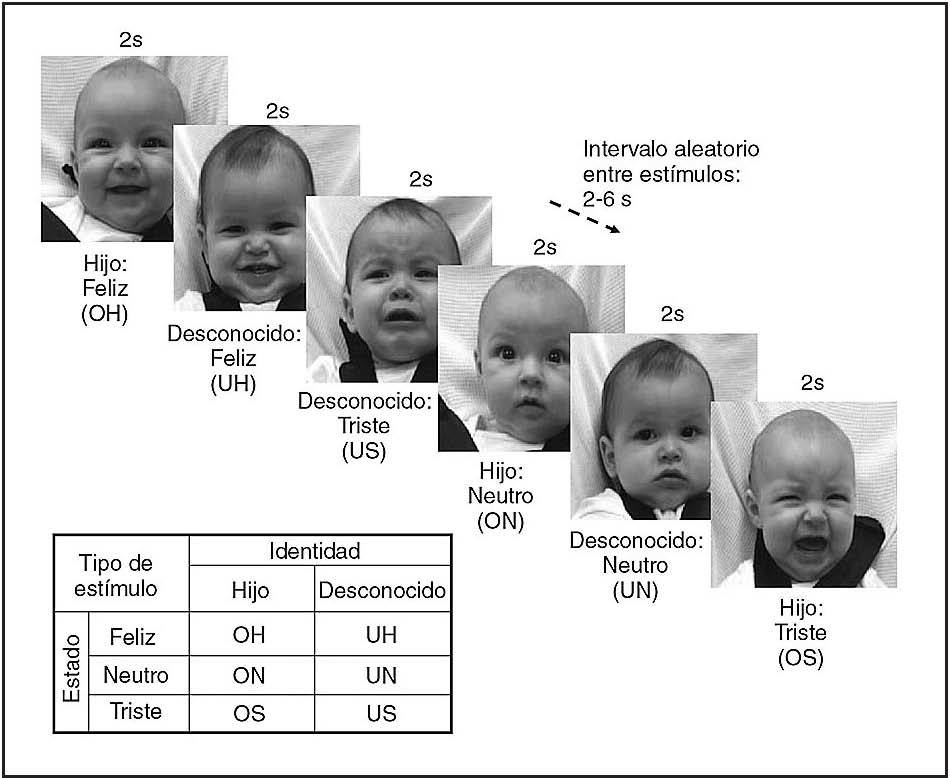
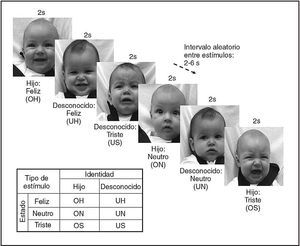
Luego, la madre participó en dos estudios por RM funcional, en cada una de las cuales vio pasivamente una serie de 60 imágenes singulares de la cara del niño, 30 de su hijo y 30 de la cara de un niño desconocido. Se informó a la madre que “se monitorizará la actividad cerebral mediante la RM funcional mientras se le muestran fotografías de su hijo y de niños desconocidos” (folleto de captación). Mediante un diseño de RMf relacionado con los episodios, se contemplaron durante 2 s imágenes presentadas aleatoriamente, con un intervalo aleatorio entre los estímulos de 2, 4 o 6 s (fig. 1). Las 60 imágenes se dividieron por igual en 3 grupos de estado (felicidad, neutro o tristeza, con una intensidad de la felicidad y de la tristeza equilibrada entre la cara del hijo y del desconocido). El orden de las imágenes de cada uno de los 6 grupos (OH, ON, OS, UH, UN, US) fue pseudoaleatorizado en y entre cada ciclo, pero no entre los sujetos. No hubo diferencias significativas en la cronología de las imágenes del hijo y del desconocido (log natural de la media del tiempo de presentación, test t de muestras apareadas, t = –0,73, gl = 2, p = 0,47) ni en las comparaciones OH > UH, ON > UN u OS > US (gl = 9, feliz: t = –1,52, p = 0,16; neutro: t = 0,72, p = 0,49, triste: t = –1,69, p = 0,13).
Fig. 1. Paradigma de presentación de caras de lactante en el experimento con RM funcional. Se presentaron imágenes estáticas de la cara de niños de la misma etnia durante 2 s, seguidos de un período variable de 2-6 s de una pantalla en blanco. Los 6 tipos de estímulos mostrados se presentaron en un orden aleatorio.
Todas las imágenes se realizaron con un aparato de RM sólo craneal Siemens Allegra de 3 Tesla. Las imágenes se generaron mediante un proyector de LCD de controlado informáticamente y se presentaron a la madre mediante un espejo situado sobre su cabeza. Las imágenes estructurales T1 de gran resolución (192 cortes, resolución en plano 256 x 256; campo de visión [FOV] 245 mm; grosor del corte 1 mm) se tomaron en primer lugar. La activación regional del cerebro fue evaluada midiendo los cambios de la señal de RM funcional dependientes del valor de oxígeno en la sangre (BOLD-RMf). Las madres se sometieron a ciclos funcionales cerebrales globales de unas 185 imágenes (imagen ecoplanar de gradiente recordado; 37 cortes; tiempo de repetición [TR] 2.000 ms; tiempo de eco [TE] 25 ms; ángulo de inclinación, 90º; matriz 64 x 64 [en resolución de plano]; FOV 220 mm; grosor de corte 3 mm; grosor del salto 1 mm). Los cortes se colocaron a 30º de la línea comisura anterior/comisura posterior (ACPC) en el plano axial, hacia debajo de detrás adelante, lo que (además de un menor TE y grosor del corte) ha demostrado optimizar la visualización de la corteza orbitofrontal36.
Tras la sesión de neuroimagen se pidió a la madre que calificase cada una de las imágenes de la cara del niño sobre lo que creen que sentía el niño, así como sus propias sensaciones de placer o de alerta, mediante una adaptación del Self-Assessment Manikin37. Cada una de las madres cumplimentó además el Wechsler Test of Adult Reading, un factor de predicción del CI38, y repitió el BDI. Hacia los 14 meses de edad, todos los niños menos uno fueron evaluados respecto al desarrollo global mediante el Screening Test de las Bayley Scales of Infant and Toddler Development39, 3.ª ed. También participaron en una valoración infantil del vínculo, mediante el Strange Situation Procedure40.
Proceso y análisis de los datosLos datos de la imagen de cada madre fueron procesados previamente en BrainVoyager QX, versión 1.7.941, y analizados en la versión 1.8.6 y 1.9.9, utilizando los siguientes pasos.
La corrección por el movimiento de la cabeza se realizó aplicando la interpolación trilineal/sinc mediante la alineación de todos los volúmenes cerebrales con el Reimer volumen mediante transformaciones corporales rígidas. Una mujer tuvo una traslación de más de 2 mm (2,3 mm) durante el ciclo 1, por lo que se repitieron los análisis tras su exclusión. Otra mujer también tuvo un movimiento cefálico inaceptable durante el ciclo 2 (traslación de 3,2 mm y rotación de 3,5 mm), por lo que fue excluida de los siguientes análisis.
La corrección del tiempo de captación del corte se realizó mediante interpolación sinc, basada en el tiempo de repetición (TR) y el orden de la captación del corte (intercalamiento ascendente) Tras la eliminación de la tendencia lineal, se retiraron los grupos no lineales de baja frecuencia de 3 ciclos o menos mediante un filtro de gran paso temporal. No se realizó el aplanamiento espacial.
El conjunto de datos anatómicos sometidos a escalado isovoxel hasta una resolución de 1 x 1 x 1 mm se transformaron en orientación sagital. Luego se transformaron en ACPC y espacio estándar de Talairach mediante interpolación sinc42. Los ciclos funcionales de cada mujer se corregistraron con el conjunto de datos anatómicos tridimensionales, sufrieron transformación isovoxel a una resolución 3 x 3 x 3 mm, y luego se transformaron en ACPC estándar y espacio coordinado de Talairach, lo que resultó en unos datos normalizados tetradimensionales en el curso volumen-tiempo. A efectos de presentación, el mapa de activación final se interpoló a una resolución de 1 x 1 x 1 mm.
Por cada ciclo funcional de datos relacionados con los acontecimientos se creó un archivo del protocolo BrainVoyager, que representa la cronología de cada acontecimiento de estímulo. Los tipos de estímulo de las seis caras de niños de la matriz del diseño fueron propio feliz (OH), propio neutro (ON), propio triste (OS), desconocido feliz (UH), desconocido neutro (UN) y desconocido triste (US) (fig. 1). Cada uno de los factores de predicción fue sometido a una función de respuesta hemodinámica de doble gamma43. Mediante el General Linear Model (GLM) se evaluaron los efectos de grupo con empleo de un análisis de efectos aleatorios, aplicando un % de transformación del curso temporal a cada ciclo de cada mujer por separado. En el análisis de efectos aleatorios se crearon mapas estadísticos de cada mujer antes de ser sometida a un segundo grado de análisis estadístico, lo que permite la generalización a la población de muestra de las madres primíparas. Los principales efectos y los posibles efectos de interacción de la “identidad” y el “humor” del lactante (fig. 1) se exploraron mediante ANOVA de medidas repetidas de 2 factores (test F, gl = 2,54). También se generaron mapas t de grupo (bilateral, gl = 27) tras especificar un contraste particular en el tipo de estímulo (p. ej., OH > UH) y se representaron en una imagen anatómica 3D promediada, que se creó a partir de las imágenes individuales de las madres.
Se utilizó el abordaje de la tasa de falsos descubrimientos44 (TFD) para corregir respecto a las comparaciones múltiples a un umbral de q < 0,05, que acepta el 5% de los voxels descubiertos (supraumbral) como falsos positivos. Se utilizó una agrupación umbral de 100 mm3 (o unos 4 voxels) excepto en el tronco cerebral, donde se usó un umbral de 30 mm3 (cerca de 1 voxel) para revelar la activación de los núcleos menores. Las regiones anatómicas se confirmaron mediante el “Talairach Daemon” automatizado (que busca la “sustancia gris más cercana”)45 y, manualmente, con un atlas del cerebro humano46. Las áreas de Brodmann (AB) se definieron con el BrainVoyager Brain Tutor47.
Las respuestas hemodinámicas a los tipos de acontecimientos (% de cambio de la señal BOLD) se promediaron y normalizaron entre las madres, y se trazaron frente al tiempo hasta crear un diagrama promedio relacionado con los acontecimientos de las regiones anatómicas de interés. Se realizó un análisis individual GLM de efectos aleatorios en cada volumen.
RESULTADOSDescripción de las madresLas 28 madres que participaron en este estudio tuvieron una edad media de 29 años, tenían distintas razas (representativo de la población de Houston48), y eran de clase media alta (según el Hollingshead Four-Factor Index of Social Status49), y el 75% había finalizado la formación superior. Sólo una madre tuvo una puntuación fuera de la gama normal de la puntuación del CI WAISIII prevista por WTAR (límites 81-120, mediana y moda = 112) (tabla 1). Otra de las madres fue calificada de síntomas de depresión “leve”, según el Beck Depression Inventory durante la sesión de grabación en vídeo, pero ninguna de las madres informó de síntomas significativos durante las visitas posteriores. No hubo autonotificaciones de problemas, actuales o antiguos, de abuso de alcohol o de drogas, o de inclusión en programas de tratamiento de la drogadicción. Sin embargo, el 61% de las madres dio resultado positivo en uno o más trastornos de la personalidad en el PDQ4+, incluyendo a 8 madres por trastorno obsesivo-compulsivo y 8 por trastorno de evitación de la personalidad (pero no de personalidad límite en MSI-BPD). Aunque el 93% de las madres informó de haber vuelto a trabajar en el momento del estudio de neuroimagen, el 54% seguía con lactancia materna, y el 43% informó que no estaban separadas de su hijo más de 20 h a la semana. Los niños habían nacido a término, excepto uno que nació a las 36 semanas de gestación. A los 14 meses de edad, sólo un niño estuvo en la zona “de riesgo” en una de las cinco subescalas de las Bayley Scales for Infant and Toddler Development, y esta puntuación estuvo en el límite superior de esta gama. En este niño, 3 de los otros 4 índices de desarrollo estuvieron en la gama de “competencia”. Todos los demás niños estuvieron en la gama de “competencia” o “emergente” en cada una de las subes-calas del desarrollo, incluyendo el desarrollo de la cognición, la comunicación expresiva y receptiva, la motilidad fina y la motilidad grosera (tabla 1).
TABLA 1. Información demográfica de la cohorte de estudio (en el momento del estudio por la imagen si no se indica lo contrario)
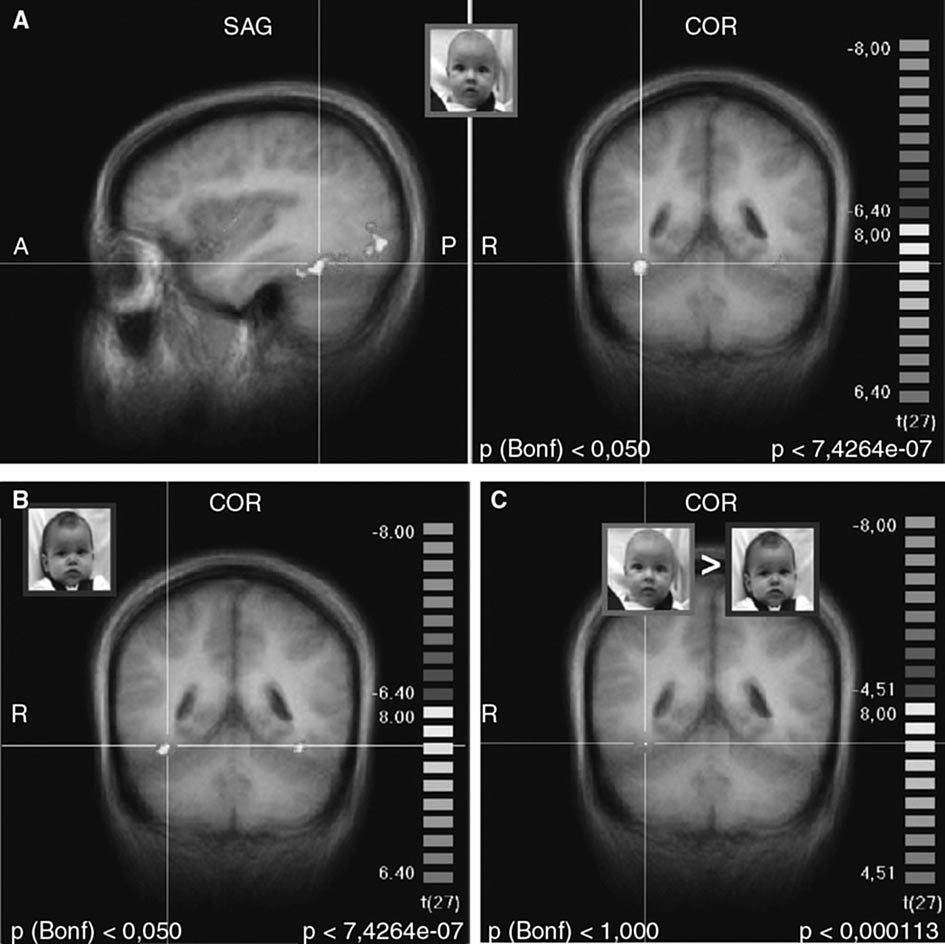
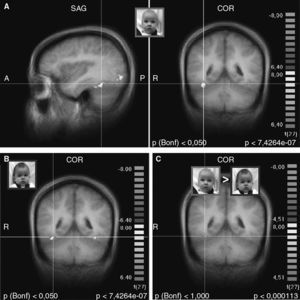
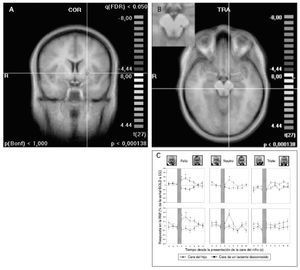
Respuestas cerebrales maternasAntes de abordar las hipótesis específicas de este estudio, examinamos las respuestas cerebrales maternas a las caras de niños con estado neutro, comparado con la ausencia inicial de caras. Como se esperaba, los estímulos de la cara activaron las regiones cerebrales a lo largo de la vía visual ventral entre la corteza visual primaria y el lóbulo temporal, incluyendo la circunvolución fusiforme y la denominada “área fusiforme de la cara” (figs. 2A y 2B)50. Sin embargo, al contrastar las caras del niño “propio” y “desconocido” (ON > UN) no persistió una activación significativa, ni siquiera a menores umbrales estadísticos (fig. 2C). Así pues, no hubo diferencias significativas en la respuesta de la vía visual posterior entre los estímulos faciales de la cara del hijo y la del niño desconocido.
Fig. 2. Activación de la vía visual ventral, incluyendo el área fusiforme facial (coordenadas de Talairach 36, –46, –17) por las caras de hijo/neutro y de lactante desconocido/neutro. A. Imágenes coronal y transversal de la activación por la cara del hijo/neutro (ON), comparado con la situación inicial sin cara. B. Imagen coronal de la activación por la cara de un lactantedesconocido/neutro (UN), comparado con la situación inicial sin cara. C. Contraste entre ON > UN, que no muestra activación residual de la vía visual o del área fusiforme facial. (A y B: p < 0,000001, corrección de Bonferroni p < 0,05, C: p < 0,0001, no corregido; umbral de agrupación 100 m3). A: anterior; COR: coronal; D: derecha; P: posterior; SAG: sagital.
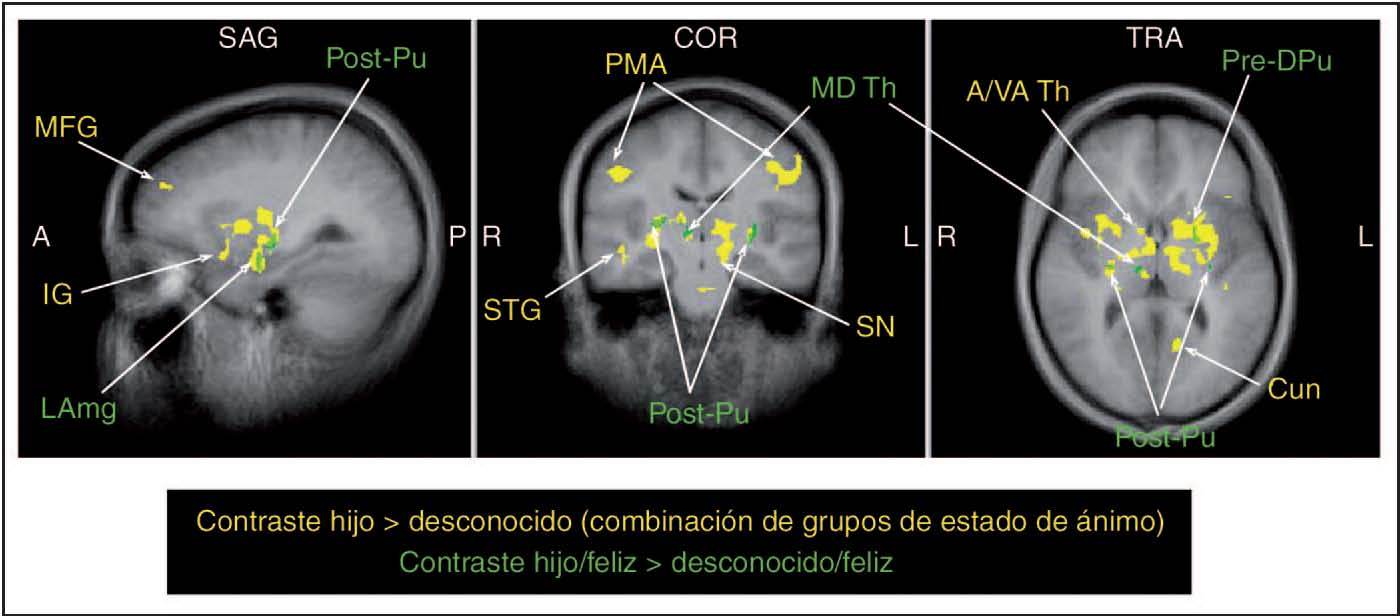
A continuación comprobamos nuestra hipótesis acerca del efecto principal de la “identidad” del recién nacido (O > U) sobre la respuesta cerebral materna. Desde la primera exploración, reveló la activación de las regiones del prosencéfalo que intervienen en: 1) el procesamiento de las emociones (corteza prefrontal medial, del cíngulo anterior y de la ínsula), 2) la cognición (corteza prefrontal dorsolateral) y 3) las respuestas motoras/con-ductuales (área motora primaria, BA 4) (F = 13,6 a 16, gl = 1,27, p < 0,001, TFD corregida q < 0,05). También se activaron las regiones del estriado y del mesencéfalo, incluyendo el estriado ventral, la cabeza del caudado, el putamen, el área tegmentaria ventral (VTA) y la sustancia negra. Otras áreas significativas incluyeron las regiones de las circunvoluciones temporales inferior, media y superior (incluyendo la fusiforme y el polo temporal), la amígdala lateral, los núcleos talámicos y el hipotálamo (tabla 2, fig. 3). Ninguna región cerebral estuvo significativamente afectada por el “ánimo” del lactante como efecto principal (F > 15,66, gl = 2,54, aplicando un modelo de efectos aleatorios, TFD corregida q < 0,05), ni se observó un efecto de interacción “ident idad x estado de ánimo”, con o sin corrección TFD. No se observó una activación significativa con contraste alguno durante la segunda exploración, en la que se repitieron los estímulos de la cara del niño de la exploración 1 y faltaron los datos de 2 madres.
TABLA 2. Áreas de activación significativa en el contraste de caras de lactante, del hijo frente a un desconocido (todos los grupos combinados)
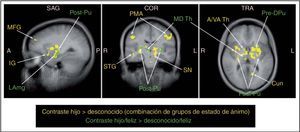
Fig. 3. Activación cerebral materna en respuesta a la cara feliz del hijo frente a la de un lactante desconocido (regiones y anotaciones en verde: test t, gl = 27, p < 0,0001, FDR corregido q < 0,05, umbral de agrupación 100 m3) y combinación de todos los estados de ánimo (regiones y anotaciones en amarillo: test F, gl = 1, 27, p < 0,001, FDR corregido q < 0,05). Coordenadas de Talairach –27, –16, 6. A: anterior; A/VA Th: tálamo anterior/ventral anterior; COR: coronal; Cun: cuña; IG: circunvolución de la ínsula; L: izquierda; LAmg: amígdala izquierda; MD Th: tálamo mediodorsal; MFG: circunvolución frontal media; P: posterior; PMA: área motora primaria; Post-Pu: putamen poscomisural; Pre-DPu: putamen dorsal precomisural; R: derecha; SAG: sagital; SN: sustancia negra; STG: circunvolución temporal superior; TRA: transversal.
Como se preveía, se observaron áreas significativas de activación cuando se mostró a las madres la cara feliz de su hijo en comparación a la de un niño desconocido (OH > UH) (p < 0,0005, TFD corregido q < 0,05). En el área límbica se observaron cinco regiones específicas de activación (con un umbral de agrupamiento de 100 mm3), y una en el mesencéfalo (umbral de agrupamiento 30 mm3), correspondientes al putamen de ambos hemisferios, la región izquierda de la sustancia negra, el tálamo derecho y la zona laterosuperior izquierda de la amígdala (tabla 3). En esencia, estas regiones solapan regiones de significación en el análisis de “identidad” de los efectos principales en O > U (fig. 3).
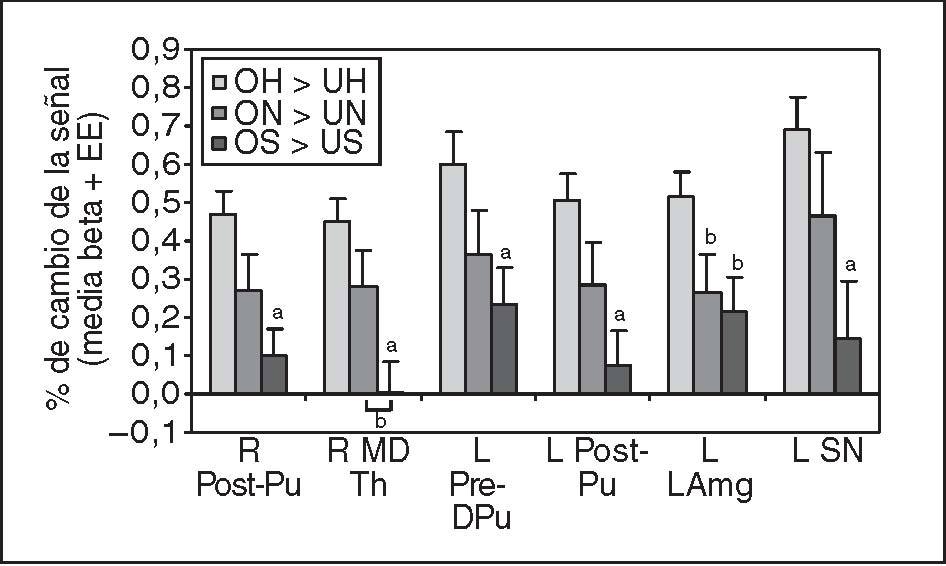
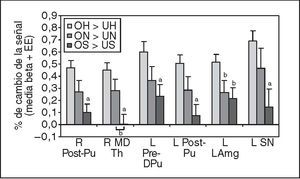
Luego se realizó el análisis de efectos aleatorios de la región de interés en cada una de las regiones OH > UH por separado (todas las p < 0,0001; tabla 3). Para explorar cómo variaron estos resultados con el estado de ánimo del lactante y garantizar que no se debían sólo a las diferencias de familiaridad con la cara del niño, los análisis se repitieron con las caras con estado de ánimo triste y neutro. Se observó una significativa activación en 4 de las 6 regiones al utilizar el contraste “hijo/neutro” frente a “desconocido/neutro” (ON > UN), aunque, como se predijo, a valores mucho menores de la significación estadística (p < 0,01). Ninguna región mostró una significativa activación al contrastar caras tristes del hijo frente a un desconocido. En las 6 regiones pareció existir una progresiva disminución del % de diferencias del cambio de señal, entre el estado de ánimo feliz, neutro y triste (fig. 4). La respuesta al estado de tristeza fue significativamente menor que al de felicidad en todas las regiones (tests t de muestras apareadas, bilateral, gl = 27, p < 0,005, excepto en la amígdala: p < 0,05). También se observó una diferencia significativa entre el estado feliz y el neutro en una región, y entre el neutro y el triste en otra (ambas p < 0,05).
Fig. 4. Disminución progresiva de la activación dependiente del estado de ánimo del lactante (feliz > neutro > triste) en determinadas regiones de interés. Tests t de muestras apareadas (bilateral, gl = 27) al comparar estado de ánimo feliz con neutro o triste, excepto lo indicado. L LAmg: amígdala lateral izquierda; L Post-Pu: putamen postcomisural izquierdo; L Pre-DPu: putamen dorsal izquierdo precomisural; L SN: sustancia negra izquierda; OH: propio feliz; ON: hijo neutro; OS: hijo triste; R MD Th: tálamo dorsomedial derecho; R Post-Pu: putamen derecho poscomisural; UH: desconocido feliz; UN: desconocido neutro; US: desconocido triste. ap < 0,005; bp < 0,05.
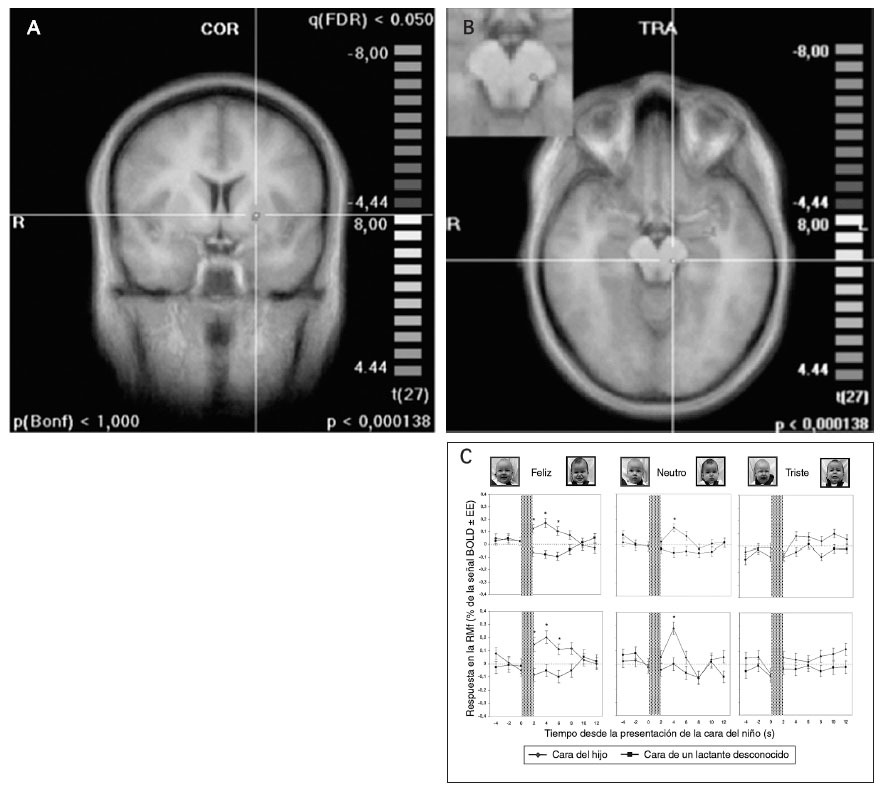
Al examinar el cambio de la señal BOLD con el tiempo en cada una de estas regiones, el cambio de la respuesta RMf inicial coincidió exactamente con el inicio de la presentación de los estímulos de la cara del niño, observándose significativas diferencias entre las respuestas a los estímulos OH y UH. Por ejemplo, en la figura 5, el putamen dorsal izquierdo y el área de la sustancia negra, dos regiones dopaminérgicas cerebrales clave interconectadas, mostraron una significativa respuesta BOLD en la RMf a la cara feliz del hijo, pero mucho menor a la neutra, y no hubo diferencia de respuesta en el contraste de caras tristes.
Fig. 5. Respuesta hemodinámica cerebral de las madres al ver la cara de su hijo, comparada con la respuesta a la cara de un lactante desconocido, en (A) el putamen dorsal izquierdo y (B) la sustancia negra izquierda (imagen agrandada en el recuadro) (p < 0,0001, FDR corregida q < 0,05). C: gráficos promediados relacionados con los acontecimientos de cada región, separados por grupo de estado de ánimo. COR: coronal; FDR: tasa corregida de falso descubrimiento; R: derecha; RMf: RM funcional; TRA: transversal.
Así, pese a no observar una significativa interacción “estado x identidad”, estos hallazgos sugieren que el estado de ánimo del lactante ejerce un efecto moderador en cada una de estas 6 regiones cerebrales asociadas con la dopamina, y que la familiaridad no explica por completo los resultados del análisis de contraste OH > UH.
Finalmente, examinamos las diferencias de la respuesta cerebral materna a las caras tristes de los niños. Comparado con la situación inicial, sin cara, tanto la cara triste del “hijo” como del “desconocido” produjeron una activación cerebral generalizada, incluyendo las regiones específicas de la hipótesis, la porción anterior del cíngulo, la ínsula y la amígdala (test t, gl = 27, p < 0,001, TFD corregida q < 0,01). Sin embargo, como en el contraste ON > UN, no persistieron regiones de activación significativa tras el contraste de OS con US (p < 0,001, agrupación 30 mm2, no corregido).
Calificación del estado de ánimo de las caras infantiles
Al ver las imágenes de la cara de los niños fuera del aparato de neuroimagen, las sensaciones de la madre estuvieron intensamente correlacionadas con la forma en que imaginaban los sentimientos del niño (r = 0,82, p < 0,001). Las caras de niños llorando, fuera cual fuera su identidad, resultaron en unas respuestas de las madres de afectivamente más negativas, pero las respuestas emocionales de las madres estuvieron más estrechamente correlacionadas con el estado de ánimo de la cara de su propio hijo que la de un niño desconocido (hijo: r = 0,87; desconocido: r = 0,80). Es decir, las madres fueron más sensibles a los estados emocionales de sus hijos que al de la cara de un niño desconocido (pendiente hijo = 0,84, pendiente desconocido = 0,49, p < 0,05, test t en dos muestras, bilateral). Las madres también calificaron sus sentimientos como más “despiertos” o intensos para su hijo, comparado con las caras de niños desconocidos (p < 0,01, test t para dos muestras, bilateral).
ANÁLISISComo atestiguarán casi todas las madres, ver la sonrisa de su bebé es una experiencia singularmente placentera y gratificante. Pero ¿qué hay en una sonrisa, cuando consideramos la respuesta cerebral de la madre? Y ¿cómo se relaciona la visión del hijo con el comportamiento motivado? Este estudio demuestra que, cuando las madres primíparas observan la cara de su hijo, activan todas las regiones cerebrales clave del proceso de recompensa asociadas con dopamina, incluyendo las regiones VTA/sustancia negra del mesencéfalo, la corteza del estriado y la prefrontal, así como el área motora primaria. Las caras sonrientes, pero no las neutras o las tristes, activan específicamente las regiones cerebrales negroestriadas, interconectadas por neuronas dopaminérgicas50, con una respuesta gradual dependiente del afecto del recién nacido (feliz > neutro > triste).
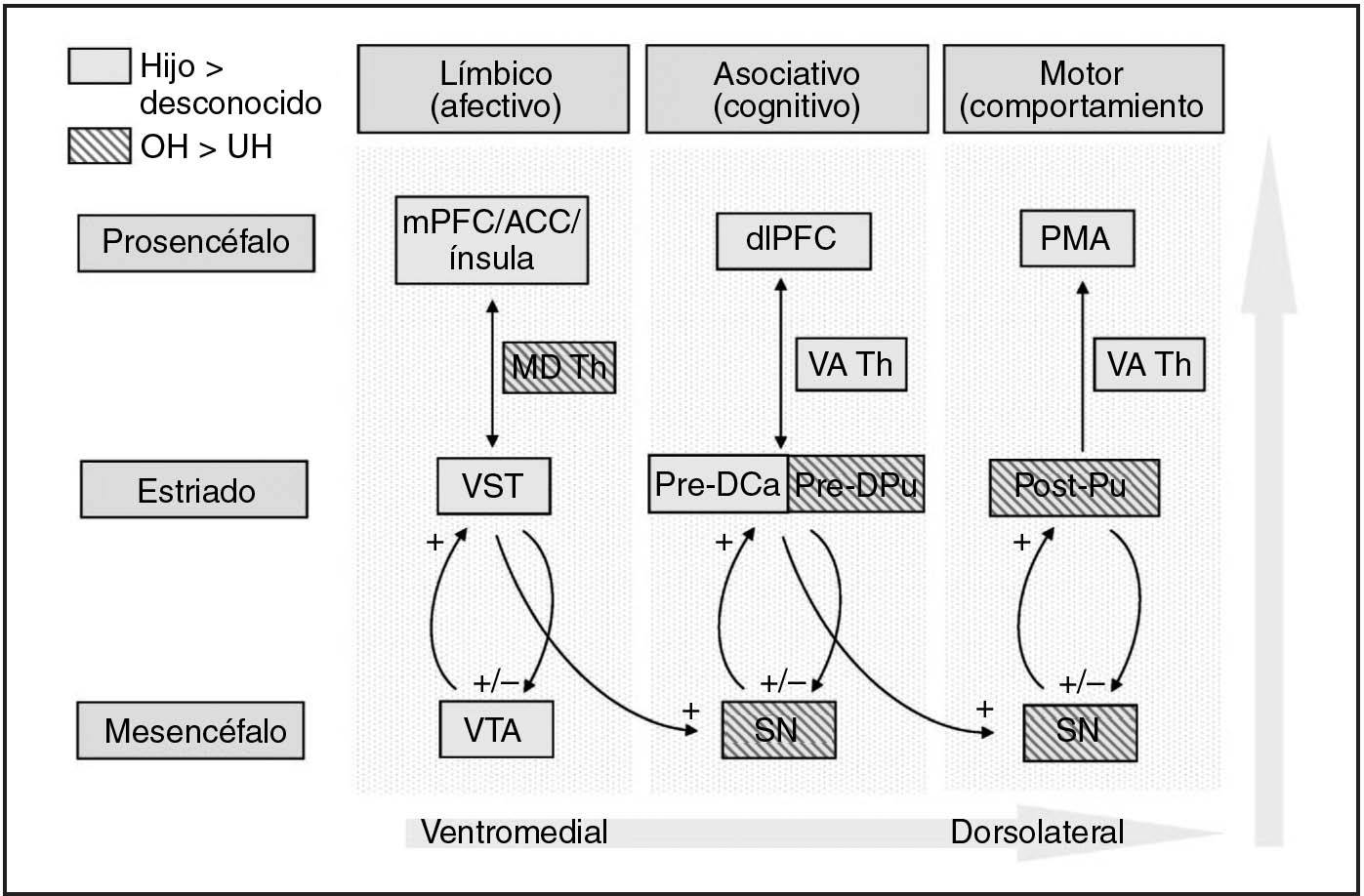
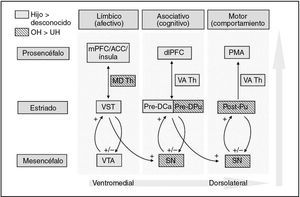
Otros dos estudios también han demostrado la activación del cerebro materno en la VTA/sustancia negra y el estriado en respuesta a los estímulos relacionados con el niño (Bartels y Zeki22 para los estímulos faciales de los niños mayores y Lorberbaum et al18 para los estímulos de llanto del lactante). En los primates, Haber et al50 demostraron importantes asas anatómicas alimentarias anterógradas entre el estriado y la región de la VTA/sustancia negra, sugiriendo que estos circuitos estriadonegroestriados transportan información entre las regiones estriadas ventromediales (límbicas), centrales (asociativas) y dorsolaterales (motoras) (fig. 6). Cada región estriada está relacionada íntegramente con la correspondiente región de la VTA y la sustancia negra del mesencéfalo a través de las neuronas dopaminérgicas ascendentes y descendentes. De forma similar, existen conexiones correspondientes entre el estriado y el prosencéfalo, incluyendo las que intervienen en el proceso de la emoción (prefrontal medial, cingulado anterior, ínsula), la cognición (dorsolateral prefrontal) o respuestas motoras/de la conducta50 (área motora primaria). Así, se cree que el estriado es una importante estación de relevo entre los sistemas límbico y motor, que integran la información afectiva de las regiones límbicas con la información cognitiva de la corteza prefrontal, en el modelamiento de las respuestas motoras/de la conducta.
Fig. 6. Activación por caras de lactante, hijo frente a desconocido, de destacadas regiones cerebrales dopaminérgicas implicadas en el procesamiento cognitivo, afectivo y de la información motora. Contraste hijo/feliz > desconocido/feliz ( ) e hijo >desconocido combinación de todos los estados de ánimo; ( ). ACC: corteza del cingulado anterior; dlPFC: corteza prefrontal dorsolateral; MD Th: tálamo dorsomedial; mPFC: corteza prefrontal medial; OH: cara del hijo feliz; PMA: área motora primaria; Post-Pu: putamen poscomisural; Pre-DCa: caudado dorsal precomisural; Pre-DPu: putamen dorsal precomisural; SN: sustancia negra; VA Th: tálamo ventral anterior; VST: estriado ventral; VTA: área tegmentaria ventral; UH: cara de un lactante desconocido feliz.
En la respuesta a las indicaciones sociales del lactante, positivas o negativas, las madres deben integrar la información, tanto afectiva como cognitiva, de su hijo, y evaluar las demandas competidoras, antes de escoger la respuesta de comportamiento más adecuada51,52. Por ejemplo, un niño con molestias suele evocar una respuesta emocional de la madre, así como los procesos cognitivos para determinar, basándose en la experiencia y el conocimiento previo, las posibles causas y remedios de las molestias de su hijo. De forma similar, la cara sonriente de un niño suele conducir a una situación afectiva positiva en la madre, con asociaciones con otras experiencias gratificantes y respuestas condicionadas del comportamiento, como sonreír, acariciar o jugar.
La diferencia de las respuestas del estriado y el mesencéfalo observadas en este estudio entre el estado de ánimo feliz, neutro y triste (tabla 3; figs. 4 y 5) es congruente con la de otros estudios, que demuestran la activación preferente por estímulos más apetitivos o gratificantes53, incluyendo las caras calificadas como más hermosas25 o la recompensa monetaria54. Los estudios sobre primates han demostrado que la tasa de activación de las neuronas dopaminérgicas aumenta como respuesta a los “errores de predicción positiva”, lo que significa una recompensa natural o condicionada inesperada55. Quizá la sonrisa inesperada de su hijo pueda activar los circuitos de dopamina de la madre mediante un mecanismo similar. En la rata, la liberación extracelular de dopamina en el estriado ventral se asocia con un aumento de los comportamientos maternales, precediendo la señal de dopamina al inicio del comportamiento56. Aunque la RM funcional sólo mide los cambios de la actividad cerebral dependientes del valor de oxígeno en la sangre, el conjunto de estos estudios indica que las indicaciones sensoriales positivas de los lactantes, como la expresión facial sonriente, puede estimular la liberación de dopamina en el estriado, y fomentar la respuesta de cuidados maternales.
TABLA 3. Área de activación significativa por el contraste de la cara del hijo/feliz frente a un lactante desconocido/feliz
En esta población de madres, las caras felices del hijo tendieron a activar las regiones motoras y asociativas del estriado, en lugar de las regiones más relacionadas con los afectos del estriado ventral y la VTA50 (fig. 6). Sin embargo, estas regiones se activaron al combinar todos los grupos en el contraste O > U (tabla 2). Dado que el contraste OH > UH utilizó solamente la tercera parte del número de imágenes utilizadas en el contraste O > U (20 frente a 60), esto puede reflejar sencillamente una potencia estadística insuficiente. En realidad, al aminorar los umbrales estadísticos en el contraste OH > UH se observó un patrón de activación similar (datos no ofrecidos). Sin embargo, la futura investigación explorará si este patrón varía con las características maternas, como la clasificación de apego del adulto, en la que las respuestas afectivas y cognitivas cerebrales se han supuesto como rasgos claves de distinción51.
También fue sorprendente que las madres no muestran una respuesta más intensa a la imagen del llanto de su hijo que a la del llanto de un niño desconocido. Parece que, al menos en esta muestra de madres, el cerebro responde de forma similar a la cara de molestia del hijo y la de un niño desconocido. Esto se manifestó en el contraste entre las caras tristes y la situación inicial, que reveló una activación generalizada como respuesta a las caras tristes tanto del hijo como de un niño desconocido, y con un patrón similar. Así, en el contraste entre OS y US no persistió activación significativa. Sin embargo, las diferencias de la cronología de las dos alteraciones pudieron sesgar los resultados, y se espera que las primeras imágenes produzcan una respuesta hemodinámica más intensa. Aunque la diferencia de cronología entre las imágenes tristes del hijo y las de un niño desconocido no fuera estadísticamente significativa (t = –1,69, p = 0,13), las imágenes tristes del hijo se observaron poco antes de las de un niño desconocido. Sin embargo, esto podría haber sesgado los resultados a favor de las imágenes tristes del hijo, en vez de hacia el niño desconocido triste. Otra posible explicación es que las madres respondieron individualmente de forma distinta a la cara triste de su propio hijo, algunas sintiéndose molestas y otras inhibiendo su propio estado afectivo negativo. El futuro trabajo sobre las estrategias de la vinculación del adulto puede revelar importantes diferencias individuales en la respuesta del cerebro materno al estado de tristeza del lactante.
Una limitación de este estudio es que las madres fueron estudiadas en distintos momentos tras el parto (entre 7 y 17 meses), observando caras de niños de 5 a 10 meses de edad (tabla 1). Pese a no existir datos publicados de la RMf sobre este tema, las madres pueden responder de manera distinta a su hijo a diferentes edades, lo que pudo influir a nuestros resultados. Además, algunas regiones cerebrales maternas clave identificadas en los estudios sobre animales, como el área preóptica medial10 y el lecho ventral del núcleo de la estría terminal, no fueron activadas en este estudio. Sin embargo, otros estudios de RMf sólo han demostrado la activación de estas áreas en las madres de niños pequeños, durante los primeros meses de vida18,24, lo que sugiere que estas regiones pueden ser importantes durante el período postparto temprano.
Aunque la variación individual observada en esta población (como la duración de la lactancia materna, la separación maternofilial y el riesgo de psicopatología) es otra limitación para la interpretación de los hallazgos del estudio, también brinda la oportunidad de proseguir la investigación sobre el significado de estas diferencias individuales. Además de comprender cómo puede influir la experiencia anterior sobre las respuestas cerebrales maternas, este paradigma podría permitir a los investigadores explorar la forma en que estos patrones de respuesta se relacionan con el comportamiento maternal. Por ejemplo, la diferencia de respuesta entre las caras felices del hijo y de un lactante desconocido en estas regiones asociadas con dopamina puede constituir un índice del valor de la recompensa o de la importancia de la cara del lactante para la madre, lo que puede, a su vez, estar relacionado con la sensibilidad materna o la negligencia del niño. Esto podría aumentar nuestra comprensión de los procesos cerebrales que median en el efecto de la experiencia previa sobre el comportamiento maternal actual.
Las diferencias individuales de las respuestas cerebrales afectivas y cognitivas son temas fascinantes para la investigación actual y futura. Por ejemplo, el llanto de un niño puede desencadenar, en algunas madres, una respuesta de enfado, e incluso un abuso físico57, en lugar de unos cuidados empáticos. Del mismo modo, en la depresión11 o la drogadicción materna12, una cara sonriente puede, reiteradamente, no provocar cuidados positivos. Los individuos deprimidos muestran una menor respuesta emocional a la cara feliz, una menor exactitud en el reconocimiento de las expresiones faciales y una mayor memoria de las caras negativas58. La cocaína, una droga de abuso habitual en las mujeres en edad fértil, y que activa tanto el sistema de dopamina mesocorticolímbico como el negro-estriado59-61, parece competir con las señales de recompensa natural relacionadas con el lactante62. Esto puede relacionarse con las tasas relativamente elevadas de negligencia infantil en las madres expuestas a cocaína63.
Las preguntas importantes que se están examinando son: ¿cuáles son los efectos de la depresión o la drogadicción materna sobre las respuestas cerebrales a los estímulos del lactante?; ¿cómo predicen las respuestas cerebrales las diferencias de la sensibilidad o la ligazón materna?; ¿qué efecto pueden ejercer estas diferencias sobre el desarrollo posterior de un niño o la seguridad de los ligámenes?
CONCLUSIONESLa forma en que una madre responde a los estímulos del comportamiento de su hijo puede representar un importante papel en la modelación del desarrollo futuro del niño. Este estudio nos acerca al conocimiento de los procesos y las vías cerebrales subyacentes implicadas en esta importante relación bipersonal.
AGRADECIMIENTOSEsta investigación fue financiada por la beca NIH K23 HD43097 (L.S.), GCRC MO1RR00188 (L.S.), Baylor CHRC: Pediatrics Mentored Research Program K12 HD41648 (L.S.), Kane Family Foundation (P.R.M.), beca NINDS NS-045790 (P.R.M.) y beca NIDA DA-11723 (P.R.M.). Damos las gracias a Laura Lomax-Bream por su asesoramiento en el diseño del estudio y a Jonathan Wrathall por su ayuda en la realización de los experimentos y el análisis de los datos.
Correspondencia: Lane Strathearn, MBBS, FRACP, Meyer Center for Developmental Pediatrics, Clinical Care Center, Suite 1530, 6621 Fannin St, Houston TX 77030-2399, Estados Unidos.
Correo electrónico: lanes@bcm.edu