El citrato de cafeína, es uno de los medicamentos más comúnmente usado en cualquier unidad de cuidados intensivos neonatales; es una metilxantina e inhibidor de los receptores de adenosina. Desde hace más de 30 años es bien conocida su eficacia en el tratamiento de la apnea del prematuro, actualmente se le reconocen otros beneficios como disminución en la incidencia de displasia broncopulmonar, disminución de la falla a la extubación y ser un factor de neuroprotección entre otros. El objetivo del presente artículo fue realizará una revisión sobre las propiedades farmacológicas, mecanismos de acción, dosis adecuadas, niveles séricos y efectos terapéuticos de la cafeína en los recién nacidos.
Caffeine, a methylxantine and nonspecific inhibitor of adenosine receptors, is commonly prescribed in the Neonatal Intensive Care Units. The efficacy of caffeine in an episode of apnea of prematurity has been known for over thirty years, but now it has been found that caffeine have others beneficial actions, such as reduction in the incidence of bronchopulmonary dysplasia, less extubation failure, the need for patent ductus arteriosus treatment, and neuroprotective role. The objective is this review was to update the current knowledge of pharmacologic properties, the mechanisms of action, caffeine dosing and therapeutic effects, in the neonatal population.
Desde hace más de 30 años, el citrato de cafeína, es uno de los medicamentos más utilizados en las Unidades de Cuidados Intensivos Neonatales (UCIN). En la actualidad no solo se reconoce su importante papel en el manejo de la apnea del prematuro, sino que también se han identificado otros efectos favorables, como prevención de la displasia broncopulmonar (DBP), retinopatía del prematuro, reducción de la falla en la extubación, así como actualmente se le considera un factor de neuroprotección. La cafeína disminuye el riesgo de apnea de la prematurez hasta en un 25%, la falla a la extubación en un 27% y la incidencia de displasia broncopulmonar hasta en un 10%1. El objetivo del presente artículo fue hacer una revisión sobre cuál es la participación de la cafeína en el tratamiento de las condiciones de morbilidad del recién nacido (RN).
Mecanismo de acciónLa cafeína es una metilxantina que actúa sobre los receptores de adenosina A1 y A2, los que se encuentran distribuidos en varias partes del organismo, como cerebro, corazón, vasos sanguíneos, riñones, sistema respiratorio y aparato gastrointestinal. La adenosina es un inhibidor del sistema nervioso central (SNC), la cual es producida por las neuronas, principalmente durante los eventos de hipoxia. Las metilxantinas actúan bloqueando los receptores de la adenosina, con ello estimulan al centro respiratorio, incrementan la sensibilidad al dióxido de carbono, inducen broncodilatación, mejoran la contractibilidad diafragmática llevando a un incremento de la ventilación minuto y mejoran el esfuerzo respiratorio al disminuir los eventos de hipoxia.
Existen otros efectos de las metilxantinas, como la liberación de catecolaminas, incremento en la diuresis y antagonismo de la actividad de las prostaglandinas2–4.
Las propiedades fisiológicas y farmacológicas de la cafeína no pueden ser explicadas por un solo mecanismo bioquímico, se han establecido tres hipótesis principales para explicar la diversidad de acciones de la cafeína. El primer efecto bioquímico descrito fue la inhibición de la fosfodiesterasa, enzima que cataliza la degradación de adenosina 3’,5’-fosfato cíclica (AMPc), se demostró que la cafeína incrementa las concentraciones de AMPc en varios tejidos. La translocación de calcio es el segundo mecanismo de acción de la cafeína, mecanismo sugerido a partir de experimentos en músculo esquelético. Se requieren altas concentraciones de cafeína para modificar el almacenamiento intracelular del ión calcio. El tercer mecanismo de la cafeína, es su antagonismo contra el receptor de adenosina, lo que explica la mayoría de los efectos sobre la actividad del SNC, peristaltismo intestinal, respiración, presión arterial, lipólisis, liberación de catecolamina y liberación de renina2–4.
Farmacocinética y farmacodinamia de la cafeínaAbsorciónDespués de la administración oral, la cafeína se absorbe en el tracto gastrointestinal, alcanzando su pico máximo a las 2 horas de su administración. La cinética plasmática puede ser influenciada por la dosis total de cafeína y la presencia de alimento en el estómago. La fracción de cafeína ligada a las proteínas plasmáticas varía entre 10% y 30% y se puede recapturar en todos los fluidos corporales, incluyendo líquido cefalorraquídeo, saliva, bilis, semen, leche y sangre del cordón umbilical.
MetabolismoLa biotransformación de la cafeína ocurre en el hígado, por acción de las monooxidasas microsomales del sistema citocromo P-450, estos sistemas enzimáticos maduran progresivamente con la edad gestacional; los recién nacidos presentan un metabolismo lento, probablemente secundario a la inmadurez enzimática. La vida media plasmática y el índice de eliminación alcanzan los niveles del adulto entre los 3 y 5 meses de vida. En los neonatos prematuros se han reportado vidas medias en plasma de 65 hasta 100 horas, comparados con la vida media de 3 a 6 horas en adultos y ancianos2–4.
EliminaciónEs principalmente por orina y es de muy lenta, lo que determina que su vida media sea muy larga, característica que permite que la cafeína se pueda administrar una sola toma al día. La eliminación de este fármaco se incrementa en presencia de falla hepática, colestasis o en casos de falla renal aguda. No existe acumulación de cafeína o sus metabolitos en el organismo, menos del 2% de la cafeína administrada es excretada sin cambio en la orina. La excreción fecal es una ruta de eliminación menor, con recuperación de solamente el 2 al 5% de la dosis ingerida2–4.
DosificaciónExisten variaciones en las concentraciones plasmáticas durante el tratamiento con cafeína, los niveles plasmáticos terapéuticos se encuentran entre los 8 y 20 μg/ml. Los niveles sanguíneos de cafeína se deben de mantener en un rango óptimo, para evitar concentraciones supra terapéuticas y efectos tóxicos. La dosis recomendada para el tratamiento de la apnea de la prematurez aprobada por la FDA de los EU es de 20 mg/kg en un bolo inicial de citrato de cafeína, seguido por una dosis de mantenimiento de 5mg/kg/día. Las dosis se pueden incrementar si no existe una adecuada respuesta al tratamiento1,2.
Se han reportado variaciones en las dosis que van desde 10 a 40 mg/kg/día para la impregnación, y de 2.5 a 10 mg/kg/día para el esquema de mantenimiento1.
Algunos estudios, como el de Steer5, han mostrado que utilizando dosis altas de cafeína se logra un mejor control de los episodios de apnea, en sus estudios comparó la dosis de 20 mg/kg/d contra dosis 5 mg/kg/d de cafeína en prematuros menores de 30 semanas, encontrando que los pacientes en los que utilizaron dosis alta tenían una reducción significativa de los episodios de apnea posterior a una semana de manejo sin presencia de efectos adversos1,2,5.
La vida media de la cafeína dentro del organismo del humano es de alrededor de 100 horas, existiendo muy poca fluctuación en las concentraciones plasmáticas diarias, por lo que no es necesario monitorizar los niveles sanguíneos de este fármaco; pero si es necesario esperar varios días después de suspender el fármaco para asegurarse que no existen episodios de apnea recurrentes2.
Efectos adversosSe han reportado pocos efectos adversos secundarios al uso de la cafeína. Dentro de los posibles efectos tóxicos se encuentran: taquicardia, polipnea, temblor, opistótonos, crisis convulsivas, vómito, intolerancia a la alimentación, retardo en el vaciamiento gástrico y efectos metabólicos como hiperglicemia, hipokalemia, e ictericia. Estos efectos adversos se han reportado con niveles séricos con un rango entre 50-10 μg/ml, aunque las observaciones iniciales de dichos efectos tóxicos se evidenciaron con concentraciones entre 160 a 300 μg/ml2. La dosis letal en humanos adultos se ha estimado en aproximadamente 10g, lo que corresponde a la ingestión de unos 150 a 200 mg/kg.
Diversas evidencias epidemiológicas han sugerido que el consumo materno de cafeína no causa malformaciones morfológicas en el feto. Aunque por otra parte, la ingestión materna de cafeína se ha relacionado con la presencia de peso bajo para la edad gestacional en sus productos, particularmente cuando la ingestión es superior a 600 mg/día, además se ha sugerido una potencial repercusión embriológica y teratogénica1.
Indicaciones terapéuticasEn 1977 Aranda6 publicó una de las primeras investigaciones donde se observó la efectividad de la cafeína en el tratamiento de las apneas en los RN prematuros; desde entonces se ha demostrado que la cafeína además tiene un efecto benéfico en diversas enfermedades neonatales como displasia broncopulmonar (DBP) y la persistencia de conducto arterioso, por lo que se considera a la cafeína como una de las terapias más seguras, eficaces en el recién nacido6,7.
Apnea de la prematurezLa principal indicación terapéutica de la cafeína es el tratamiento de los episodios de apnea en los RN prematuros. La apnea del prematuro se define como el cese de la respiración de 15 a 20 segundos acompañada de disminución de la saturación de oxígeno (SpO2 menor o igual a 80% por más de 4 segundos), y/o la evidencia de bradicardia (frecuencia cardiaca que disminuye 2/3 del ritmo basal por más de 4 segundos) en neonatos con una edad gestacional < 37 semanas2. Los episodios de apnea se pueden clasificar en lo concerniente a su origen como centrales, que representan del 10 al 25% de los casos, obstructivos que corresponden del 10 al 25% de la etiología y mixtos del 50 a 75% de los casos2,7.
La presencia de apnea de la prematurez se relaciona de forma inversamente proporcional con la edad gestacional al nacimiento, ocurren en aproximadamente el 7% de los RN con edades gestacionales entre 34 a 35 semanas, 15% en aquellos con 32 a 33 semanas, 54% en los RN de 30 a 31 semanas y en prácticamente todos los prematuros < 29 semanas o con un peso al nacimiento < 1,000g1,3.
Los estudios de Cochrane8 señalan que el empleo de metilxantinas es efectivo en disminuir la frecuencia de los episodios de apnea, así como en los días de ventilación mecánica. El mecanismo fisiopatológico subyacente de la apnea de la prematurez no ha logrado ser totalmente esclarecido, pero parece estar ligado a la inmadurez del sistema nervioso central del RN prematuro, particularmente a un retraso en la mielinización. La respuesta a la hipoxia se lleva a cabo en 2 fases, inicialmente ocurre incremento en la ventilación por 1 o 2 minutos, posteriormente la frecuencia respiratoria cae por debajo de nivel basal. Se ha establecido que la frecuencia y la duración de los episodios de apnea no incrementan el riesgo de daño cerebral2.
Uno de los estudios más representativo sobre la utilidad de la cafeína fue el publicado por Schmidt9 en el año de 2006, en que a través de un ensayo clínico con 963 RN prematuros con pesos entre 500 a 1,250g, encontró que a los pacientes tratados con cafeína se les pudo retirar una semana antes la ventilación mecánica, el CPAP o el oxígeno complementario, en comparación con los pacientes no tratados con cafeína; así también observó una menor necesidad de esquema de esteroides postnatales y numero de transfusiones.
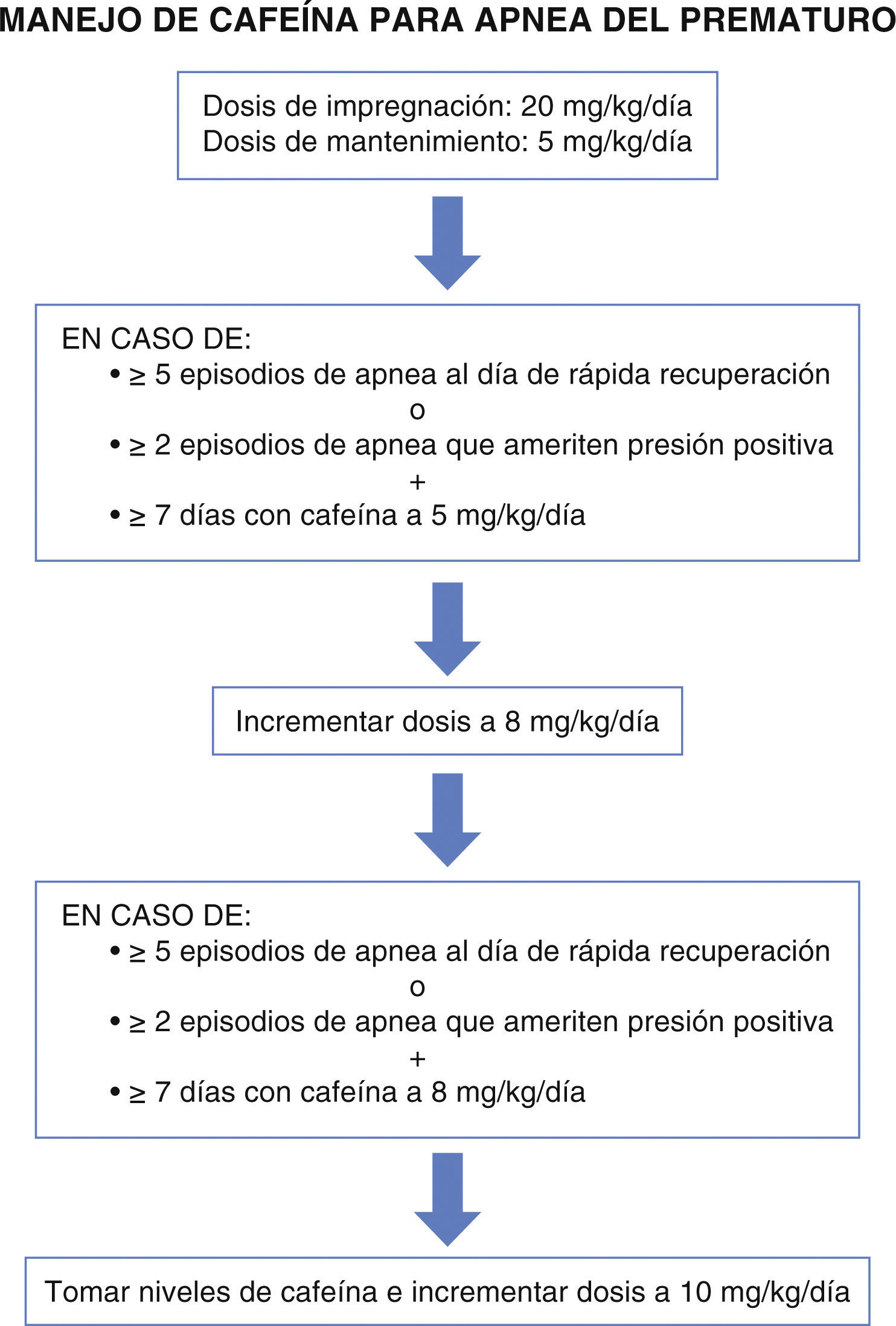
Un metaanálisis que evaluó 6 estudios clínicos sobre el uso de metilxantinas en el tratamiento de apneas concluyó que estas eran efectivas en reducir los episodios de apneas y la necesidad de ventilación mecánica3. Erenberg10 reportó un riesgo de falla al tratamiento de cafeína de 0.46 (IC 95%, 0.27-0.78). Si bien el uso de la cafeína como tratamiento de apneas está bien demostrado, no así es su participación como estrategia profiláctica para prevenir las apneas del prematuro, de hecho en la misma revisión se encuentras que no existe evidencia suficiente para emplearlo de forma profiláctica; sin embargo, a través de los estudios actuales sobre los otros beneficios de la cafeína en las diferentes morbilidades neonatales, se ha justificado el uso temprano de la cafeína en los RN prematuros3. Como ya se ha descrito la cafeína es un medicamento cuya seguridad permite incrementar la dosis en caso de falla al tratamiento y no se requiere estar monitorizando los niveles sanguíneos1–3,11; sin embargo, ante la persistencia de apneas no existe un consenso bien definido que establezca las estrategias a seguir; para unificar criterios en el Instituto Nacional de Perinatología de México a partir del año de 2015 establecimos un plan de manejo en el que los incrementos de las dosis se efectuarán después de una semana efectiva de tratamiento, y se considera falla al tratamiento la presencia de más de 5 apneas al día que responda a estímulos o más de dos apneas que requieran presión positiva12 (fig. 1).
Prevención de apnea postoperatoriaDel 5% al 49% de los RN prematuros, en especial aquellos con antecedente de apnea de la prematurez o enfermedad pulmonar crónica, desarrollaran apneas durante el postoperatorio de manera secundaria a la anestesia general. Investigaciones recientes concluyen que la administración de 5 a 10 mg/kg de cafeína después de la cirugía reduce el riesgo de apnea postoperatoria2,3,13.
Falla en la extubaciónSe ha comprobado que la cafeína previene la falla en la extubación cuando se administra al menos 24 horas antes de una extubación, cuando esta se lleva a cabo de manera programada, o bien cuando se indica dentro de las primeras 6 horas posteriores a una extubación no programada2. El efecto es significativamente mayor cuando se administran dosis altas; la administración de cafeína a una dosis de 20 mg/kg mostró una tasa de falla del 15%, con el 29% con una dosis de 5 mg/kg14. El aumento en la dosis de cafeína no se ha asociado a mayor número de efectos secundarios.
En el caso de disminuir el número de fallas en la extubación, se ha descrito que los pacientes más beneficiados son aquellos RN < 28 semanas de gestación al nacimiento. También habiéndose informado de una tendencia a la disminución en el número de días de ventilación, en aquellos pacientes que reciben dosis altas de metilxantinas2. El estudio de la librería Cochrane8 del año de 2009 concluyó que el empleo de un esquema terapéutico con metilxantinas en la primera semana de vida disminuyó la probabilidad de falla a la extubación sobre todo en los recién nacidos prematuros extremos. El empleo de cafeína para evitar fracaso en la extubación, se ha investigado ampliamente, estableciéndose que un esquema de tratamiento con citrato de cafeína a 20 mg/kg/día para RN < 30 semanas de gestación reduce la posibilidad de fracaso a la extubación con un riesgo relativo de 0.51 (IC 95% 0.31 a 0.85), y el número de días de ventilación mecánica en los RN < 28 semanas de gestación de 22.1 a (p = 0.01) sin presencia de efectos secundarios o morbilidad en el primer año de vida14–16.
Displasia broncopulmonarEs la complicación pulmonar más importante en el RN prematuro que amerita ventilación mecánica en los primeros días de vida. Los estudios realizados por Schmidt9,17 en el 2006 y 2007 sobre el uso de cafeína en la apnea del prematuro, revelaron que este fármaco también tiene un efecto benéfico en la prevención de la DPB. En estos estudios se observó una reducción en la incidencia de DBP en los pacientes tratados con cafeína en comparación con el grupo control en un porcentaje de 47% a 36.3% (p < 0.001). En general la disminución en la incidencia de DBP asociado al tratamiento con cafeína varía de un 10% a 40%, resultado secundario al menor uso de oxígeno complementario, uso de CPAP nasal y de la ventilación mecánica. El efecto protector de la cafeína sobre la DBP al parecer se basa en el bloqueo de los receptores de adenosina A2 que modulan la permeabilidad capilar, la inflamación y remodelación pulmonar; así como mejora la función pulmonar al incrementar la función de los centros respiratorios y mejorar la actividad diafragmática2,3,7.
La cafeína también tiene un efecto relajante en el músculo liso bronquial y mejora la contractilidad del músculo esquelético. Los resultados mostrados por Zainab18 evidencian que la administración de cafeína aumenta la función de los músculos respiratorios, lográndose de forma más temprana el retiro de ventilación mecánica.
Los trabajos de Schmidt y otros investigadores han mostrado que las metilxantinas reducen la frecuencia de la apnea del prematuro y la necesidad de ventilación mecánica durante los primeros siete días de tratamiento2,7,19,20. Cabe mencionar que los beneficios de la cafeína sobre la DBP son más evidentes cuanto el tratamiento se inicia en los primeros 3 días de vida3.
Persistencia del conducto arteriosoLa persistencia del conducto arterioso se asocia con diferentes morbilidades neonatales como DBP, retinopatía del prematuro y enterocolitis entre otras. Más del 60% de los prematuros menores de 1,000g tendrán persistencia del conducto arterioso7. Las metilxantinas incrementan la frecuencia cardiaca, disminuyen los episodios de variabilidad del ritmo cardiaco, incrementan el volumen latido y la presión arterial. Estudios efectuados en el año de 2006 encontraron una reducción en la necesidad de cierre farmacológico del conducto en los pacientes tratados con cafeína contra el grupo control (29.3 vs 38.1% OR 0.67 IC95% 0.55-0.81), así como menor necesidad de cierre quirúrgico (4.5% vs 12.6%, OR 0.32 IC 95% 0.22-0.45)8. El efecto benéfico de la cafeína sobre el cierre del conducto arterioso reside en el antagonismo sobre la actividad de las prostaglandinas y en su efecto diurético2,7,21.
Retinopatía del prematuroEn general, más del 50% de los prematuros con peso menor a 1,250g presentarán algún grado de retinopatía del prematuro, y alrededor del 10% de estos pacientes tendrán retinopatía grave, por lo que constituye un problema serio en cualquier UCIN7.
La hipoxia intermitente se define como ciclos periódicamente repetitivos de corta duración en los que se evidencia una disminución de la saturación de la hemoglobina, seguido de la normalización en la oxigenación y posterior recuperación de la oxemia normal; se ha establecido una asociación entre hipoxia intermitente y la retinopatía de la prematurez2,3,7.
El uso de cafeína redujo el desarrollo de retinopatía de la prematurez de un 43.2% a un 39.2%, aunque esta reducción no fue estadísticamente significativa7. El mayor efecto se encontró en los pacientes con retinopatía severa con disminución de la incidencia de ceguera bilateral secundario a la menor exposición a oxigenoterapia y menor días de CPAP durante el tratamiento con cafeína2,3,7.
Enterocolitis necrosante y reflujo gastroesofágicoLas metilxantinas teóricamente pueden empeorar el reflujo gastroesofágico al incrementar la secreción gástrica y disminuir el tono del esfínter esofágico inferior. No obstante, los estudios clínicos actuales no han demostrado que el tratamiento con cafeína empeore los síntomas de reflujo en los pacientes. La presencia de disminución en la perfusión intestinal es uno de los efectos negativos evidenciados durante el tratamiento con cafeína, lo anterior debido vasoconstricción que la misma causa, en especial con dosis de impregnación de 25 a 50 mg/kg/dosis22,23.
Una hora después a la administración de cafeína en RN prematuros, se ha observado una disminución de la velocidad de flujo sanguíneo en la arteria celíaca del 14%, sin demostrarse desarrollo de comorbilidades por compromiso del flujo sanguíneo en el lecho esplácnico22,23. Por otra parte, no se ha demostrado que haya un incremento en la incidencia de enterocolitis necrosante, incluso con dosis de mantenimiento altas de 20 mg/kg/día2,7,20.
Efecto en sistema nerviosos central: neurodesarrollo y neuroprotecciónComo ya se ha mencionado la cafeína actúa sobre los receptores de adenosina, esta última ejerce un efecto diferente a nivel cerebral dependiendo de la edad del paciente. Durante el periodo neonatal, su liberación puede causar lesión de la materia blanca periventricular, que se asocia a una disminución en la mielinización secundaria a una alteración en la maduración de los oligodendrocitos2. El tratamiento con cafeína parece tener un efecto neuroprotector en los pacientes con encefalopatía hipóxico-isquémica, al atenuar los efectos de la hipoxia3.
Varios autores han postulado el papel de neuroprotección de la cafeína en RN, ya que varios estudios han revelado que pacientes tratados con cafeína presentan menor incidencia de parálisis cerebral y un puntaje mayor en los índices de neurodesarrollo.
Se ha informado que los RN < 1,250g tratados con cafeína desde los 3 días de vida hasta las 34 semanas corregidas tuvieron una reducción en la incidencia de muerte, discapacidad y retraso neurocognitivo al evaluarse a los 18 y 21 meses de vida2,20. La muerte o sobrevida con discapacidad severa en el neurodesarrollo se observó en el 40.2% para los pacientes tratados con cafeína, en comparación con el 46.2% de los pacientes no tratados (OR 0.77; IC 95% 0.64-0.93). Además se encontró una reducción en la incidencia de parálisis cerebral del 7.3% al 4.4% (OR 0.58 IC 95% 0.39-0.87) y retraso cognitivo del 38.3% al 33.8% (OR 0.81 IC 95% 0.66-0.99); sin embargo, la incidencia de ceguera y sordera no mostró diferencia significativa20.
En el año de 2010 Supcun24 demostró, a través de estudios de electroencefalograma de amplitud integrada, que la cafeína también aumenta la actividad neuronal cortical de los RN prematuros, sin embargo no logró establecer de forma fehaciente su papel como neuroprotector. Schmidt y colaboradores9,20 demostraron que el empleo de cafeína no reduce la incidencia de lesiones cerebrales diagnosticadas por ultrasonido, entre las que destacan ecodensidades parenquimatosas, leucomalacia quística periventricular, dilatación ventricular y hemorragia ventricular.
Efectos sobre el crecimiento y metabolismoLos RN prematuros con una edad gestacional al nacimiento de entre 28 a 33 semanas tratados con cafeína, presentan un mayor consumo de oxigeno y energía con pobre ganancia ponderal que se extiende a las primeras 4 semanas de tratamiento. Se ha documentado menor ganancia ponderal y disminución de la velocidad de crecimiento en las primeras 3 semanas de tratamiento con cafeína; sin embargo, cabe señalar que al realizar mediciones a los 18 y 21 meses este efecto desapareció2,3. Steer14 en el año de 2004 evidenció que las dosis de mantenimiento altas en el tratamiento con cafeína a 20 mg/kg/día requieren de un mayor tiempo para recuperar el peso al nacimiento que los pacientes tratados con 5 mg/kg/día (14.8 vs 12.9 días).
La administración aguda de cafeína produce un incremento del 5% al 25% en la tasa de metabolismo basal. Estas modificaciones del metabolismo energético han sido asociadas con incrementos significativos en las concentraciones séricas de ácidos grasos, glicerol y lactato, mientras que se han reportado hallazgos inconsistentes para los niveles de glucosa en sangre. La administración aguda de cafeína disminuye la sensibilidad a la insulina y deteriora la tolerancia a la glucosa, posiblemente como resultado de la elevación de adrenalina en plasma2,3,7. En los RN el empleo de cafeína reduce el incremento de peso de forma temporal. No existe evidencia de una alteración hidroelectrolítica ni en la termorregulación en los pacientes tratados con cafeína.
Efectos sobre la inflamaciónLos receptores de adenosina están presentes en las células que intervienen en los procesos inflamatorios y en las células del sistema inmunitario. El bloqueo de los receptores de adenosina durante el proceso inflamatorio puede generar dos efectos, en primer lugar producir un efecto pro-inflamatorio, y en segundo lugar ocurrir en efecto anti-inflamatorio, dependiendo del subtipo de receptor involucrado. Se ha demostrado la reducción de los niveles de IL-10 en sangre y aspirado traqueal tras la administración de una dosis de cafeína, observándose un efecto antiinflamatorio, sin embargo tras una semana de haber -α, IL-1 e IL-6, mismas que actúan como citocinas proinflamatorias, por lo que se considera que el efecto de la cafeína sobre los procesos inflamatorios es dosis dependiente y puede ocasionar efectos opuestos dependiendo de las concentraciones séricas.
Los niveles séricos de cafeína entre 10 a 20 mg/L se asocian con un efecto antiinflamatorio al disminuir las concentraciones de IL-6 y TNF-α, así como incrementar las concentraciones de IL-10; mientras que niveles de cafeína por arriba de 20 mg/L se asocian a un efecto proinflamatorio2,3.
Es quizás el efecto antiinflamatorio lo que puede contribuir a la reducción en la incidencia de DBP en los pacientes tratados con cafeína2,3.
Efecto en la función renalLas metilxantinas inducen la diuresis al incrementar el flujo sanguíneo renal y la filtración glomerular. Estudios realizados en prematuros confirman el efecto diurético de la cafeína así como un incremento en la depuración de creatinina y en la excreción urinaria de calcio. En humanos, la administración de una sola dosis de 4 mg/kg de cafeína incrementa la excreción urinaria de sodio, calcio, magnesio, potasio y cloro, así como el volumen de orina, aunque estos efectos parecen más pronunciados para una dosis de 10 mg/kg. Una revisión concluyó que el consumo de cafeína estimula una diuresis leve en grado similar a la estimulada por el agua y no afecta las concentraciones séricas de sodio, potasio, calcio o fosforo2.
Duración de la terapia con cafeínaNo existe un consenso sobre el momento de retiro del tratamiento con cafeína, una vertiente dice que debe retirarse al corregir la edad gestacional, mientras que otra vertiente sugiere el retiro del tratamiento al lograrse una semana libre de episodios de apnea con el entendido de reiniciarla en caso de que los episodios recurran. Esta segunda vertiente, y como un consenso en el manejo, ha establecido el retiro del tratamiento con cafeína una semana antes de otorgarse el alta domiciliaria de los pacientes por la posibilidad de la recurrencia de apnea tras la suspensión del manejo25.
La presentación habitual de la apnea de la prematurez sugiere el cese de los episodios a las 36 a 40 semanas de gestación, por lo que el tratamiento debiera extenderse hasta lograr esta edad corregida. Un promedio en el tiempo de empleo de la terapéutica con cafeína sugiere una duración del tratamiento cercana a los 30 a 40 días2.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.