En años recientes México es considerado como el país que tiene el primer lugar mundial de sobrepeso y/o obesidad en la población infantil. Organizaciones internacionales mencionan que el 33% de la población infantil de nuestro país padece sobrepeso y/o obesidad, los que representa un número muy grande de niños con riesgos de alteraciones a nivel metabólico, que al llegar a la edad adulta pueden tener lo que se ha denominado síndrome metabólico, el cual es una constelación de factores de riesgo cardiovascular, que incluye resistencia a la insulina, hipertensión, dislipidemia y obesidad central. En estudios realizados con animales se pudo probar que el feto puede adaptarse a la malnutrición, puede alterar su metabolismo, redistribuir el flujo sanguíneo para proteger los órganos más importantes como el cerebro, incluso, puede adaptarse a un crecimiento más lento para disminuir las exigencias de sustrato, pero esta adaptación lo puede llevar a cambios permanentes en la estructura y función de su organismo. La teoría Barker conocida también como efecto programador intra-útero, fue la primera en proponer el origen fetal de las enfermedades coronarias. El crecimiento y el desarrollo del feto están determinados por tres factores: el estado nutricional de la embarazada, la función placentaria y la capacidad del feto para utilizar los nutrientes.
In the past few years, Mexico has been considered the countrywith the first place in childhood with overweight and obesity. International organizations have reported that 33% of our infant population as being overweight or with obesity. A large number of infants have as risk for metabolic alterations, and when reaching adulthood can present metabolic syndrome, which is a constellation of risk factors for cardiovascular disease that including insulin resistance, hypertension, dyslipidemia and central obesity. It has been found in animal studies that the fetus can adapt to malnutrition, alter its metabolism, redistribute its blood flow to protect important organs such as the brain, and even adapt to a slower growth in order to diminish its substrate demands. On the other hand, those changescan be permanent in the structure and function of the organism. Barker's theory also known as Intrauterine Programming Effect was the first to propose fetal origin for coronary heart disease. According with this theory the growth and development of the fetus are determined by three factors: the mother's nutritional status, placental function and the ability of the fetus to utilize the nutrients.
Actualmente México es el país con mayor número de niños con sobrepeso y/o obesidad, desplazando a los Estados Unidos (EU) que hasta hace pocos años ocupaba el primer lugar en obesidad.
El síndrome metabólico es una constelación de condiciones clínicas y bioquímicas, que incluyen resistencia a la insulina, hipertensión, dislipidemia y obesidad central, las cuales de manera individual y en conjunto predisponen al desarrollo de la enfermedad cardiovascular y la diabetes mellitus tipo 21. El síndrome metabólico influye de manera importante en la mortalidad tanto en los países desarrollados como en los países en vías de desarrollo.
La programación fetal se define como un proceso de adaptación por el que la nutrición y otros factores ambientales alteran las vías de desarrollo durante el período de crecimiento prenatal, induciendo con ello cambios en el metabolismo postnatal y la susceptibilidad de los adultos a la enfermedad crónica2. Estos hallazgos han llevado a estudios en animales y humanos para identificar los mecanismos biológicos responsable de los efectos de la nutrición intrauterina a largo plazo y sus consecuencias para la salud de la descendencia.
Algunos resultados de estudios moleculares indican que la programación fetal puede ser explicada por la epigenética, la que puede ser definida como la serie de alteraciones hereditarias de la expresión génica a través de modificaciones de ADN y las histonas centrales sin cambios en la secuencia de ADN3.
Estudios realizados con animales mostraron que el feto puede adaptarse a la malnutrición, alterando su producción hormonal o la sensibilidad de los tejidos a las hormonas. Entre las hormonas que regulan el crecimiento fetal y, por lo tanto, la necesidad de nutrientes, la insulina tiene una función central4.
El feto puede alterar su metabolismo, por ejemplo, cambiando la oxidación de glucosa a la de aminoácidos. También puede redistribuir el flujo sanguíneo para proteger los órganos más importantes como el cerebro. Incluso, puede adaptarse a un crecimiento más lento para disminuir las exigencias de sustrato. Sin embargo, al contrario de las adaptaciones fisiológicas que ocurren en el adulto, las del feto llevan a cambios permanentes en la estructura y función del cuerpo5.
En experimentos realizados con animales, se ha observado que algunas modificaciones muy pequeñas en la dieta de animales preñadas, pueden dar lugar a cambios fisiológicos o bioquímicos en las crías que duran toda la vida, y pueden compararse con enfermedades humanas como la hipertensión y la alteración del metabolismo glucosa-insulina6. En el nivel molecular, estos cambios “programados” quizá reflejen la alteración de la expresión de los genes in útero de acuerdo con la disponibilidad de nutrientes, que actúa directamente en la célula o por medio de señales hormonales.
Desde finales de la década de los ochenta, varios trabajos señalaron que el origen de la enfermedad cardiovascular (ECV) se remonta al periodo embriogénico7.
Teoría de BarkerConocida también como efecto programador intra-utero, considera el bajo peso al nacer (BPN) como una variable “insignia”, para demostrar la correlación entre un ambiente intrauterino adverso y la posibilidad de la futura instauración de una ECV2. A principio de los años noventa, un estudio llevado a cabo en Inglaterra, mostró por vez primera que las personas con bajo peso al nacer tenían tasas más altas de diabetes mellitus tipo 2 que otras personas al llegar a adultos. El estudio fue parte de un programa de investigación sobre la hipótesis de los orígenes fetales de las enfermedades, la cual declara que la enfermedad coronaria, los accidentes cardiovasculares, la diabetes mellitus tipo 2 y la hipertensión, se originan en adaptaciones del feto a la malnutrición8. Otros estudios en Europa y los EU también habían mostrado la asociación entre el bajo peso al nacer y el desarrollo de diabetes tipo 2 o intolerancia a la glucosa9.
De acuerdo con la Teoría de Baker, las adaptaciones fetales son la causa de cambios permanentes en la estructura y fisiología del organismo, que finalmente derivan en el desarrollo de enfermedades en la vida adulta2.
El peso al nacer sirve como indicador del crecimiento y la nutrición fetales, pero de forma muy poco exacta. El mismo peso al nacer puede representar muchas vías de crecimiento diferentes. Las mediciones detalladas del tamaño del cuerpo al nacer dan una mejor idea de las adaptaciones fetales. Por ejemplo, los niños de bajo peso al nacer que se mantienen delgados tienen la tendencia a ser resistentes a la insulina tanto en su niñez, como en la vida adulta, además son más propensos a desarrollar diabetes mellitus tipo 2. Esto sugiere que los niños delgados respondieron in útero a la malnutrición mediante cambios endocrinos y metabólicos10. Los datos más extensos sobre el tema se publicaron en 1997 y fueron parte de los resultados de un estudio sobre la salud de un grupo grande de enfermeras que fueron seguidas por varios años11.
Es importante resaltar, que la salud de por vida de un individuo se forma durante los períodos críticos del desarrollo. El feto es particularmente susceptible a los estímulos internos y externos, muchos de los cuales pueden alterar la trayectoria de desarrollo y la susceptibilidad posterior a la enfermedad. Los glucocorticoides son fundamentales en el desarrollo normal del feto, ya que están involucrados en el crecimiento y la maduración de muchos sistemas de órganos. El aumento de los niveles fetales de glucocorticoides que se producen en la mayoría de las especies de mamíferos en los últimos días del embarazo es un importante interruptor de desarrollo que lleva a cambios fundamentales en la regulación de genes en muchos órganos, incluyendo el cerebro12.
Muchos estudios epidemiológicos, así como estudios experimentales, indican que los eventos adversos tempranos de la vida como la desnutrición in útero, exposición a toxinas ambientales y cambios en las hormonas juegan un papel determinante en la susceptibilidad a ciertas enfermedades crónicas13. Por lo general, estos eventos son provocados por los desafíos ambientales de la madre; sin embargo, estudios recientes han demostrado que los factores ambientales o nutricionales paternos afectan también el fenotipo de la descendencia13.
La exposición del feto al aumento de los niveles de los glucocorticoides, como el tratamiento con glucocorticoides sintéticos a la madre, puede conducir a largo plazo a “programación” de la función y comportamiento del hipotálamo-hipófisis-suprarrenal12. Por otro lado, los glucocorticoides actúan a múltiples niveles dentro del cerebro del feto. La evidencia reciente indica que los esteroides pueden ejercer efectos poderosos sobre el epigenoma, incluyendo la metilación del ADN, la acetilación de histonas y microRNA, para influir en la expresión génica. Tales influencias probablemente representan un componente crítico del proceso de “programación”, y pueden ser en parte responsables de los efectos transgeneracionales de la exposición prenatal a glucocorticoides en relación a la función neurológica, cardiovascular y metabólica3.
Si la diabetes tipo 2 es consecuencia de una adaptación in útero, obviamente la prevención primaria consiste en proteger el desarrollo fetal. Los estudios epidemiológicos futuros necesitan emplear indicadores más exactos de la condición fetal, no tan solo el peso al nacer. Vale la pena explorar los mecanismos mediante los cuales la desnutrición y el retraso del crecimiento in útero producen cambios que influyen en el metabolismo glucosa-insulina, pues la diabetes tipo 2 es ya una epidemia de alcance mundial
La resistencia a la insulina es un evento fisiopatológico fundamentalmente temprano en el proceso de la enfermedad, impactando en la función metabólica del músculo esquelético y de las respuestas vasculares. Se han encontrado cambios adversos en la sensibilidad a la insulina que se originan en el útero; por ejemplo, eventos prenatales que suceden en la placenta insuficiente, como el estrés oxidativo, que conduce a crecimiento fetal alterado y que están asociados con mayores tasas de síndrome metabólico en la vida adulta4.
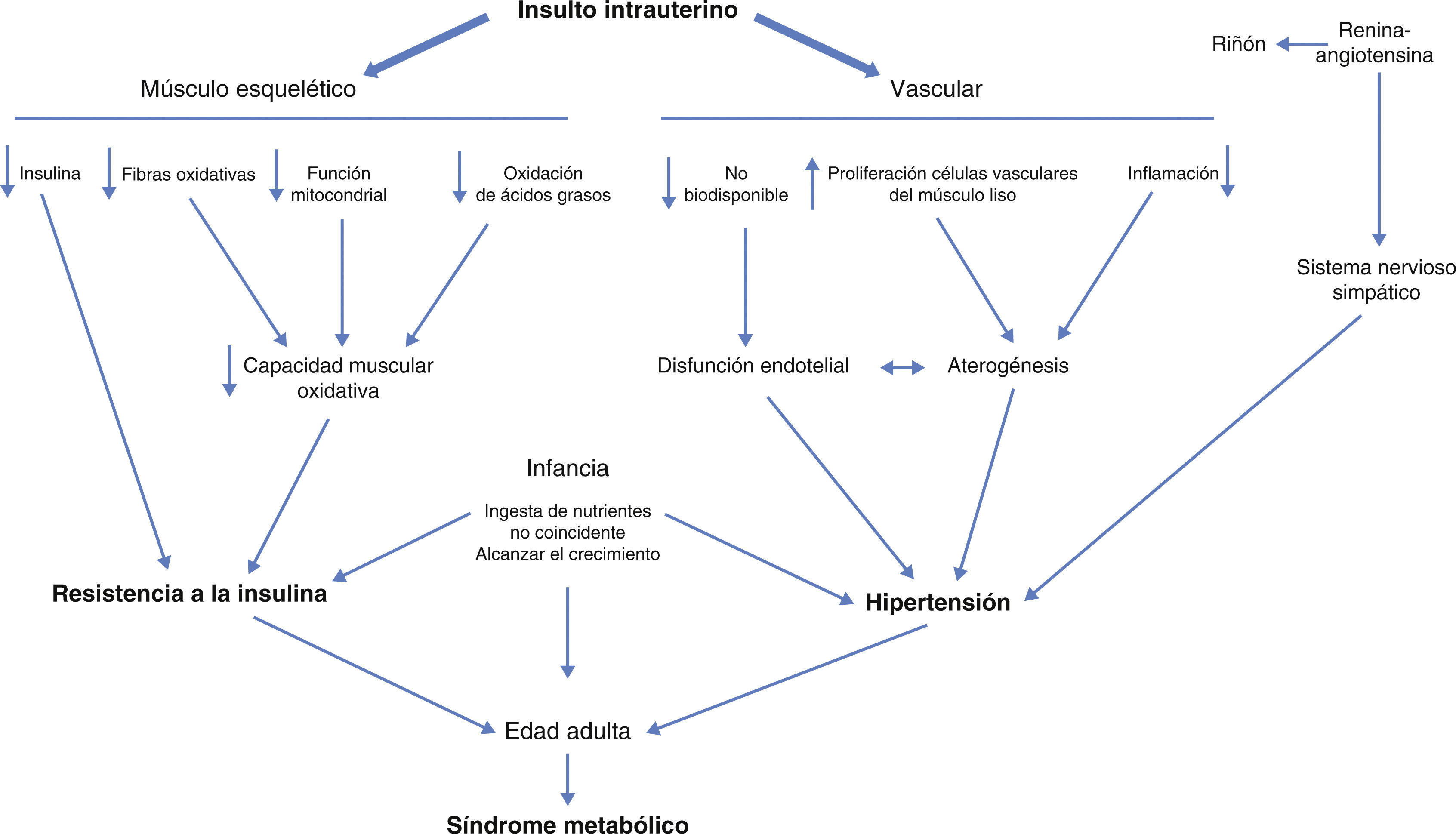
Las anormalidades de la estructura y la función vascular que surgen de las condiciones intrauterinas que se exacerban por la resistencia a la insulina explican la progresión de la hipertensión de la niñez a la edad adulta14 (fig. 1).
La resistencia a la insulina y la hipertensión son componentes clave del síndrome metabólico. Los insultos intrauterinos inducen varios cambios metabólicos en el músculo esquelético que resultan en el desarrollo de los índices de resistencia a la insulina. La hipertensión se puede remontar a los cambios en la vasculatura iniciadas en el útero que conducen a la disfunción endotelial y aterosclerosis.
Mientras que no hay duda de que el consumo de energía en exceso juega un papel central en el sobrepeso y la obesidad, la evidencia científica ha mostrado que el estrés metabólico postnatal puede predisponer al individuo para el desarrollo de síndrome metabólico, especialmente en el aspecto de ganancia de peso postnatal de los RN prematuros, el cual está asociados con un mayor riesgo de obesidad, intolerancia a la glucosa, resistencia a la insulina, dislipidemia y la presión arterial elevada15.
Las tendencias recientes en la ingesta de grasas en la dieta materna son importantes porque es uno de los factores que determinan la calidad de ácidos grasos transferidos a través de la placenta, y se secretan en la leche materna16.
Por lo tanto, el aumento en la ingesta de grasas en la dieta, ofrecen la posibilidad de que, como fenómeno de adaptación, ocurran insuficiencias, desequilibrios o excesos de ácidos grasos, que contribuiría al aumento de la prevalencia de enfermedades metabólicas evitables en los países desarrollados y su aparición en las naciones en desarrollo16.
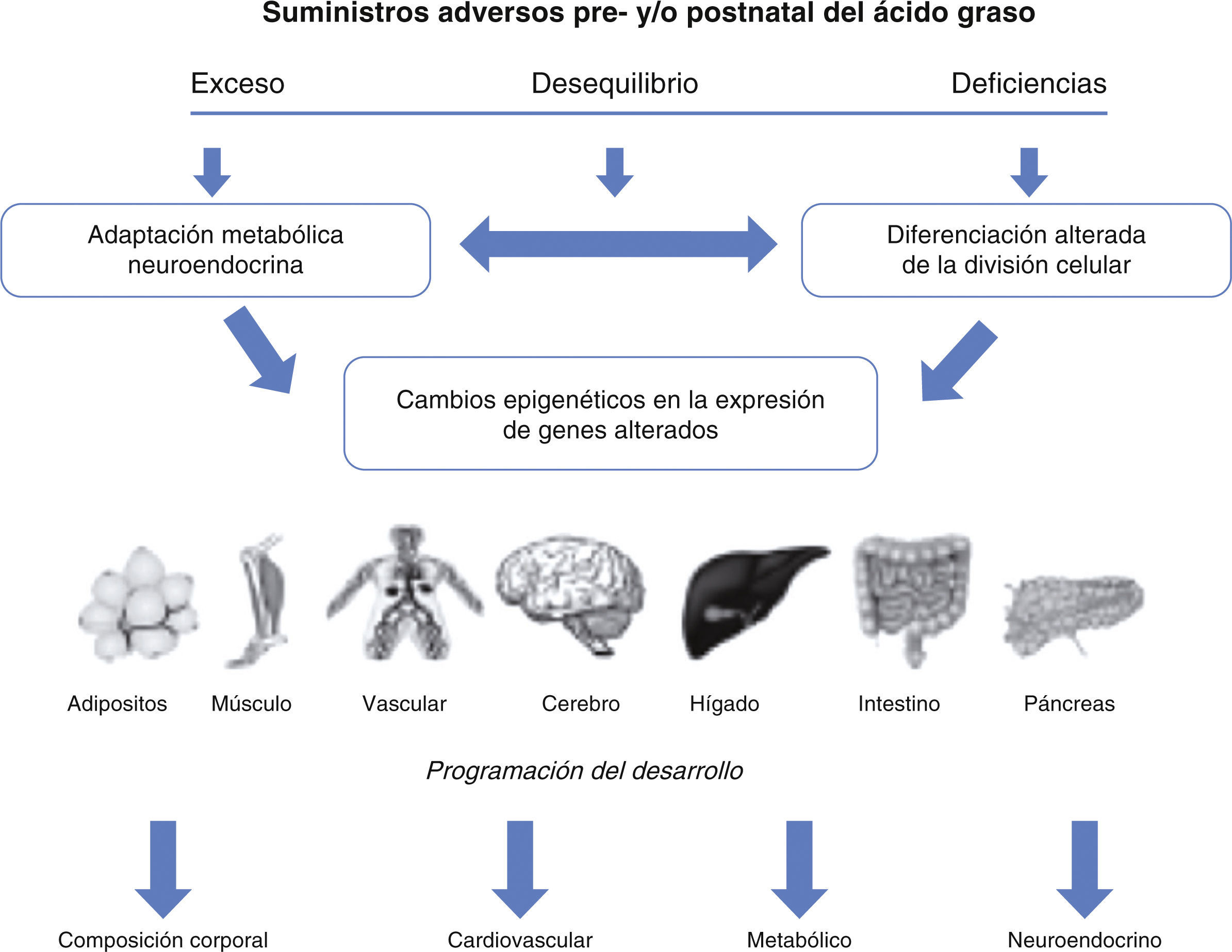
En la figura 2 se muestra un esquema hipotético, que ilustra el concepto de que la deficiencia, exceso o desequilibrio de ácidos grasos en las etapas clave del desarrollo pueden tener consecuencias a largo plazo, debidas a alteraciones en desarrollo celular, la expresión génica, la respuesta metabólica y neuroendocrina o el aporte de ácidos grasos.
Esquema que ilustrar el concepto de que la deficiencia, exceso o desequilibrio de ácidos grasos en las etapas clave del desarrollo pueden tener consecuencias duraderas, debidas a alteraciones en desarrollo celular, la expresión génica o la respuesta metabólica y neuroendocrina o el aporte de ácidos grasos.
Estudios recientes proponen que la deficiencia de dehidroandrosterona (DHA) durante la maduración del cerebro, reduce su plasticidad y compromete la función cerebral en la edad adulta. Los niveles adecuados de DHA en la dieta es un factor crucial para aumentar la resiliencia neuronal a largo plazo para el rendimiento óptimo del cerebro y ayudar en la batalla contra trastornos neuronales, que pueden predisponer al síndrome metabólico en la edad adulta15.
A pesar de que se reconoce la participación de la epigenética en la programación fetal del síndrome metabólico, la investigación sobre terapias es todavía precaria. Entre las posibles intervenciones se incluyen: 1) la inhibición delametilación del ADN, desacetilación de histonas y depresión de microARN; 2) modificación de las vías metabólicas epigenéticamente perturbadas y 3) uso de suplementos dietéticos con ácidos amino funcionales, vitaminas y fitoquímicos.
Evaluación nutricional del recién nacidoEn épocas anteriores, todo recién nacido que pesara menos de 2,500g se le clasificaba como RN prematuro. Posteriormente, se observó que no todos los RN por debajo de 2,500g tenían condiciones de prematuridad, por los que se les designó como RN de bajo peso; en consecuencia, en la actualidad, se define como bajo peso al nacer a todo neonato que pese < 2,500g. Cualquiera que sea la causa y sin tener en cuenta la duración de la gestación.
En 1963, Lubchenco y cols. presentaron unos patrones de crecimiento intrauterinos en los que se relacionó el peso con la edad gestacional (EG). En vista de que con frecuencia resulta difícil estimar con exactitud la edad gestacional sobre la base de los datos obstétricos, como fecha de última gestación, aparición de ruidos cardiacos, altura del fondo uterino o ecosonografía abdominal, se planteó la necesidad de desarrollar técnicas en la valoración del RN que permitiera estimar la edad gestacional mediante estudios de maduración física y neurológica en el niño, como la valoración de Capurro y Ballard. Pero, independientemente de la EG, la valoración clínica del estado nutricional es muy importante; actualmente para efectuar la valoración nutricional del RN se explora la consistencia del pelo, así como la presencia de grasa en cara, cuello, tronco, brazos y glúteos. Esta valoración puede tener un valor numérico, utilizando la escala CANS de Metcoff17,18.
Jack Metcoff propuso para la evaluación clínica del estado nutricional del RNa través de la escala de CANS: clinical assessment of nutritional status at birth; y su calificación (CANSCORE)17,18. En la escala de CANS se usan nueve signos fácilmente detectables, en el RN con malnutrición fetal se observa disminución del tejido celular subcutáneo y del musculo subyacente en los brazos, piernas, codos y rodillas; las regiones interescapulares están muy laxas, los cúmulos adiposos bucales y de los glúteos se encuentran disminuidos, además de que el cabello puede ser grueso, en parches o “recto y parado”.
Los niños con una talla y un perímetro cefálico (PC) conservados, un peso de dos desviaciones estándar (DE) por debajo de la media y depleción de depósitos grasos, está cursando con una desnutrición fetal producida al final de la gestación. La disminución de la masa muscular supone un grado más en cuanto a duración y severidad de la desnutrición, y en el último extremo se encuentran los niños con valores inferiores a dos DE para todos estos parámetros. De ellos, los que guarden una proporción con su edad gestacional serán los prematuros verdaderos, y los que no presenten esta proporcionalidad serán niños con un retraso de crecimiento intrauterino prolongado. Cuanto más prolongado y grave sea el periodo de desnutrición fetal, peor será el pronóstico en cuanto al desarrollo intelectual y físico del niño, así como más lenta, la recuperación del peso, talla y perímetro cefálico.
En la actualidad y tomando en cuenta el peso en relación a la edad gestacional, se divide a los RN en las siguientes categorías: apropiados en peso para la edad gestacional (AEG), pequeños para edad gestacional (PEG) y grandes para edad gestacional (GEG); al mismo tiempo son preterminos (< 37 semanas de gestación) a término (entre 37 y 42 semanas gestacionales) y postérminos o posmaduros (> 42 semanas).
El bajo peso al nacer como factor de programación fetalBarker2,5 y otros autores10,11,13 ajustándose a los principios de la teoría de programación fetal, le brindaron al bajo peso al nacer (BPN) una gran importancia como factor de riesgo para el desarrollo de enfermedades en el futuro, como podrían ser la HTA, la enfermedad coronaria, dislipidemias, obesidad e hiperfibrinogenemia. Todos estos autores concluyen en que la influencia del BPN no se modifica, incluso ante la presencia de covariables de riesgo que pudieran coexistir dentro de un ámbito fetal hostil, como serían el hábito tabáquico materno, el consumo exagerado de alcohol o la existencia de alguna enfermedad ateroesclerótica materna. Según la hipótesis de Barker2, una agresión in útero es capaz de producir una programación anormal de diversos sistemas relacionados entre sí, que se manifestarán durante la vida del individuo. Esta programación ocurre, según la definición de Lucas15, cuando un estímulo o agresión, en especial condiciones como el BPN o la desnutrición in útero, que actuaría en un periodo sensitivo o crítico, producen un cambio permanente en la estructura o la función del organismo humano en desarrollo o formación.
La confirmación de esta hipótesis modificaría, en alguna medida, las estrategias clásicas de prevención cardiovascular, basadas en la actuación sobre los marcadores clásicos de riesgo cardiovascular, así como la prevención de problemas crónicos degenerativos como la diabetes mellitus o la hipertensión arterial.
El bajo peso al nacimiento no solo se asocia a un riesgo aumentado de padecer complicaciones en el periodo neonatal, y a un aumento en la mortalidad perinatal, sino que además, se asocia a mayor riesgo de enfermedad en la vida adulta.
Datos epidemiológicosLos primeros estudios epidemiológicos, que apoyan la Teoría de Barker fueron los realizados por Rose y Forsdahl18,19. El primero, describió la elevada incidencia de fetos muertos y la alta mortalidad infantil entre hermanos de pacientes con enfermedad coronaria, mientras que el segundo encontró que aquellas regiones de Noruega en las que había mayor incidencia de enfermedad coronaria eran las mismas que habían tenido una elevada mortalidad infantil 50 años antes. Más tarde, Barker y Osmond20,21 mostraron que las tasas de mortalidad por enfermedad coronaria en diferentes aéreas de Inglaterra y Gales coincidían con las de mayor mortalidad neonatal en las primeras décadas del siglo xx. Estos hallazgos sirvieron para postular la hipótesis de que un crecimiento intrauterino pobre, manifestado como un bajo peso al nacer, se asociaba a un mayor riesgo de desarrollar enfermedad coronaria en la edad adulta, siendo los resultados independientes de factores ambientales, clase social y consumo de tabaco o alcohol durante el embarazo. Posteriormente, la malnutrición fetal se postuló como un factor asociada al desarrollo de resistencia a la insulina, hipertensión arterial, hiperlipidemia y aumento en los valores de fibrinógeno en plasma22.
La propuesta de que la nutrición fetal podía tener efectos a largo plazo se inició con los estudios clásicos de Widdowson y McCance23,24 en animales, en los cuales se observó que aquellos que tuvieron bajo peso al nacimiento no llegaron a alcanzar el tamaño de sus congéneres nacidos con peso normal al llegar a la madurez.
Crecimiento y desarrollo del fetoEl crecimiento y el desarrollo del feto están determinados por tres factores: el estado nutricional de la embarazada, la función placentaria y la capacidad del feto para utilizar los nutrientes.
Estado nutricional de la embarazadaUna disminución de la ingesta materna o de su capacidad de absorción, puede ocasionar un crecimiento fetal menor. Sin embargo, la variabilidad individual en la respuesta a la restricción energética y proteica es grande. La malnutrición durante la gestación puede producir defectos persistentes, como la reducción del número de células de los tejidos, la modificación estructural de los órganos, la selección de ciertos clones de células y la modificación en el ajuste de ejes hormonales clave25. El impacto a largo plazo, dependerá del estadio en el que se produzca la malnutrición, de su duración e intensidad. Cada órgano y tejido, tiene un periodo crítico o sensible, de mayor replicación celular, durante el cual se verá más afectado. La hiperglucemia y la hipoglucemia en la embriogénesis precoz, pueden asociarse a un bajo peso al nacer. Si se produce una deficiencia en nutrientes en la mitad de la gestación, sobre todo si es moderada, afecta al feto pero no a la placenta. La hipertrofia placentaria es un mecanismo de adaptación para mantener el aporte de nutrientes. Al final de la gestación, el efecto de la malnutrición materna es inmediato: se retrasa el crecimiento fetal y se altera la relación entre el feto y la placenta25.
Los hijos nacidos de madres holandesas sometidas a una ingestión muy reducida de calorías (400-800kcal/día) durante el tercer trimestre de embarazo, fenómeno que se observó durante la Segunda Guerra Mundial, presentaron bajo peso al nacer. Estos individuos durante la edad adulta, tuvieron una menor tolerancia a la glucosa y una mayor resistencia insulínica. La asociación entre malnutrición materna e intolerancia a la glucosa podría explicarse por una alteración permanente en la función de las células beta del páncreas o por una modificación en la sensibilidad tisular a la insulina que ocurriría durante la vida fetal pero que se manifestaría con posterioridad26.
Función placentariaLa insuficiencia placentaria causa una disminución en el crecimiento fetal. La falta o el inadecuado desarrollo del lecho vascular producen una merma en la circulación placentaria que, a su vez, origina fenómenos de trombosis e infartos, que condicionan una reducción en la masa de tejido placentario funcional27. La consecuencia final, es un aporte disminuido de oxígeno y nutrientes al feto, y un retraso del crecimiento intrauterino. No obstante, se señala que en situaciones de déficit de aporte nutritivo a la madre, se encuentran placentas incrementadas de tamaño, como en madres anémicas, con aumento de ejercicio o en las que viven a grandes altitudes27,28. No parece, por tanto, claro el papel de la placenta en la teoría de la programación fetal. Estudios en animales mostraron que si una madre era bien alimentada antes de la concepción y mal alimentada al comienzo de ella, la placenta se agrandaba; esto no ocurría si la madre estaba mal alimentada antes de la concepción29.
Capacidad del feto para utilizar los nutrientesExisten situaciones en las que, a pesar de la buena nutrición de la madre y de la adecuada función placentaria, se produce un crecimiento intrauterino pobre. Este es el caso de las cromosomopatías, las malformaciones uterinas o fetales o las infecciones intrauterinas29.
Experiencia en el Instituto Nacional de PerinatologiaEn el Instituto Nacional de Perinatología (INPer) de México, la mayor parte de los embarazos son de alto riesgo, el número de nacimientos en promedio por año es de 4,500, y el porcentaje de pacientes que tienen prematurez y bajo peso va más allá del 16%, por lo que anualmente cerca de 700 pacientes nacen con bajo peso, es por eso que dada la actual situación que la niñez en nuestro país tiene con respecto al sobrepeso y/o obesidad y sabiendo que dentro del origen de estos problemas, que conforman el síndrome metabólico, la participación de la programación fetal es importante, se plantea la necesidad de contribuir de manera importante al control y disminución de esta grave problemática nacional, con el diseño de modelos de vigilancia metabólica desde la etapa fetal, y un adecuado control metabólico durante el periodo neonatal.
Por otra parte, se requiere ampliar el conocimiento sobre las asociaciones señaladas en este trabajo, a través del diseño de modelos animales, que permitan comprender los mecanismos básicos responsables de las funciones de los nutrientes específicos en la programación fetal y neonatal. Tal conocimiento nuevo es crucial para diseñar estrategias terapéuticas eficaces para la prevención y tratamiento de las alteraciones metabólicas en los hijos nacidos de madres con una experiencia previa de desnutrición.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.