Gracias al perfeccionamiento de las técnicas de atención prenatal y perinatal se ha logrado una mayor sobrevida de pacientes prematuros con edades gestacionales cada vez menores; su grado de inmadurez los hace susceptibles al desarrollo de enfermedades en los diferentes aparatos y sistemas, comorbilidades que merman su crecimiento y desarrollo afectando su calidad de vida a corto, mediano y largo plazo. El cerebro, al ser un órgano de gran importancia por estar relacionado con la funcionalidad integral del individuo, no se escapa, y las complicaciones que lo afectan pueden ser transitorias o permanentes, e incluyen una amplia gama de manifestaciones clínicas que van desde un retraso en el neurodesarrollo hasta parálisis cerebral. Es por eso que debemos preocuparnos por la prevención de las mismas con mejoras en la atención prenatal y neonatal que incluyan estrategias de ventilación gentiles, adecuada nutrición, terapias farmacológicas, maniobras de estimulación temprana, rehabilitación oportuna de los pacientes y el seguimiento a largo plazo, pues las alteraciones en el neurodesarrollo pueden afectar hasta una tercera parte de los pacientes prematuros.
The improvement in prenatal and perinatal care techniques has led to achieving better survival rates of premature babies with increasingly lower gestational ages. It is known that their immaturity makes them more susceptible to the development of diseases in different organs and systems, with comorbidities that can affect their growth and quality of life. The brain is one of the most important organs because it is related with the comprehensive functionality of the individual, and complications (temporary or permanent) in health care management can lead to a wide range of clinical manifestations ranging from delayed neurodevelopment to cerebral palsy. For this reason, the neonatologist must be aware of this in order to prevent adverse outcomes, doing their best to ensure improved assisted ventilation strategies, adequate nutrition, drug therapies, early intervention therapies, timely rehabilitation, and long-term follow-up. It is important to remember that neurodevelopmental disorders (intellectual, sensorial, and motor alterations) may affect up to one third of preterm patients.
Los niños prematuros, y en especial aquellos con bajo peso al nacer, bajo peso para la edad gestacional y restricción en el crecimiento intrauterino presentan mayores complicaciones neuropsicológicas. Del 25% al 40% de los pacientes nacidos de forma prematura presentan secuelas en el desarrollo cognitivo1,2.
Debido a que la sustancia gris se desarrolla en el tercer trimestre de la gestación, en los prematuros existe mayor propensión a lesiones neurológicas perinatales. El nacimiento prematuro predispone a menor superficie cortical y menor complejidad de la estructura cerebral debido a que es hasta el tercer trimestre cuando ocurre mayor desarrollo de los giros secundarios y terciarios; además de menores dimensiones de cerebelo, ganglios basales, amígdala, hipocampo y cuerpo calloso, que son características de prematuros.
La mielinización se afecta con el nacimiento prematuro, predisponiendo a alteraciones neurosensoriales, motoras y cognitivas durante la infancia temprana1–4. La leucomalacia periventricular es la lesión cerebral más frecuente en los prematuros, con prevalencia del 30% en prematuros extremos, en especial en aquellos con muy bajo peso, que predispone a la reducción significativa del volumen cerebral mielinizado3.
Los recién nacidos prematuros, en especial aquellos nacidos antes de las 33 semanas de gestación, son susceptibles de desarrollar problemas neurocognitivos en la adolescencia. Se ha evidenciado que el 35% de los infantes con antecedentes de prematurez y bajo peso experimentan problemas de aprendizaje en una o más asignaturas. Los niños con antecedente de prematurez presentan trastornos de la esfera psiquiátrica, entre los que destacan trastornos de somatización, ansiedad y síntomas depresivos. Un tercio de los niños con antecedente de prematurez presentarán dificultades de lenguaje, relacionadas con la rapidez y comprensión de conceptos (disnomia)1.
La lesión cerebral neonatal tiene como antecedente un evento de hipoxia con un trastorno en el intercambio de gases, generando hipoxemia e hipercapnia que establecen acidosis. Con la progresión del tiempo, la hipoxia ocasiona asfixia que puede producir hipotensión e isquemia, determinantes de la lesión neurológica causada por el insulto hipóxico-isquémico4.
Son muchas las alteraciones derivadas de la prematurez, pero lo verdaderamente importante y trascendente es encontrar formas para prevenir el desarrollo de lesiones, limitarlas o corregirlas.
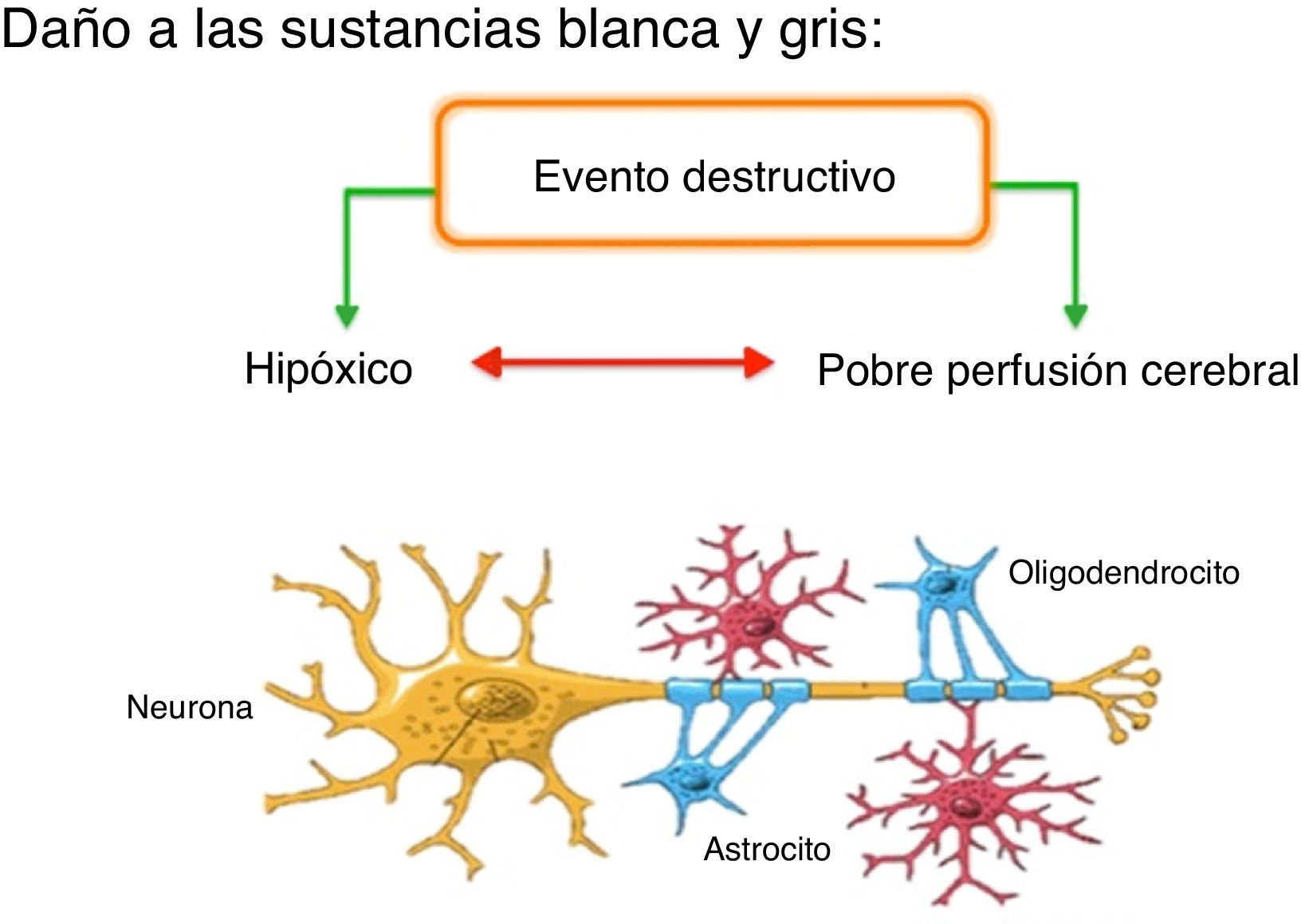
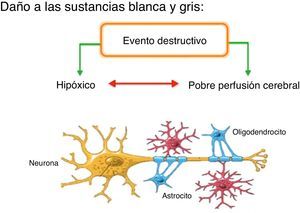
Origen del daño cerebral perinatalLas células de la sustancia blanca (preoligodendrocitos y macrófagos de la microglía) desempeñan un rol fundamental en la patogénesis del daño de la sustancia blanca periventricular; estas son vulnerables al estrés oxidativo y a la exposición excesiva al glutamato, pues sus medios de defensa son limitados. La microglía y los macrófagos cerebrales se activan rápidamente en respuesta a muchos estímulos incluyendo inflamación, liberación excesiva de glutamato e hipoxia-isquemia. Una vez activados pueden liberar factores tóxicos como especies reactivas de oxígeno y nitrógeno5 (fig. 1).
Fisiopatología de la muerte neuronalLos eventos de hipoxia-isquemia inducidos por la falta de oxígeno y glucosa ocasionan una despolarización de la membrana neuronal mediante la inactivación de la bomba de sodio-potasio-adenosina trifosfato, que por acumulación de glutamato, sodio y calcio activa sistemas enzimáticos incluyendo fosfolipasas, proteasas, endonucleasas y la sintetasa de óxido nítrico. Durante la fase de reperfusión existe liberación de especies superóxido y la generación de radicales libres ocasionando daño mitocondrial por oxidación de lípidos y proteínas que dañan el ADN, que permite concluir que la muerte neuronal es la combinación de necrosis, apoptosis y mecanismos intermedios5 (fig. 2).
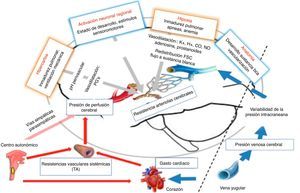
Regulación del flujo sanguíneo cerebralLa regulación del flujo sanguíneo cerebral (FSC) es un factor determinante entre los mecanismos implicados en el desarrollo de la lesión cerebral neonatal, siendo por ello objetivo prioritario de muchos investigadores en las últimas décadas encontrar técnicas fiables de medición de los parámetros hemodinámicos cerebrales4.
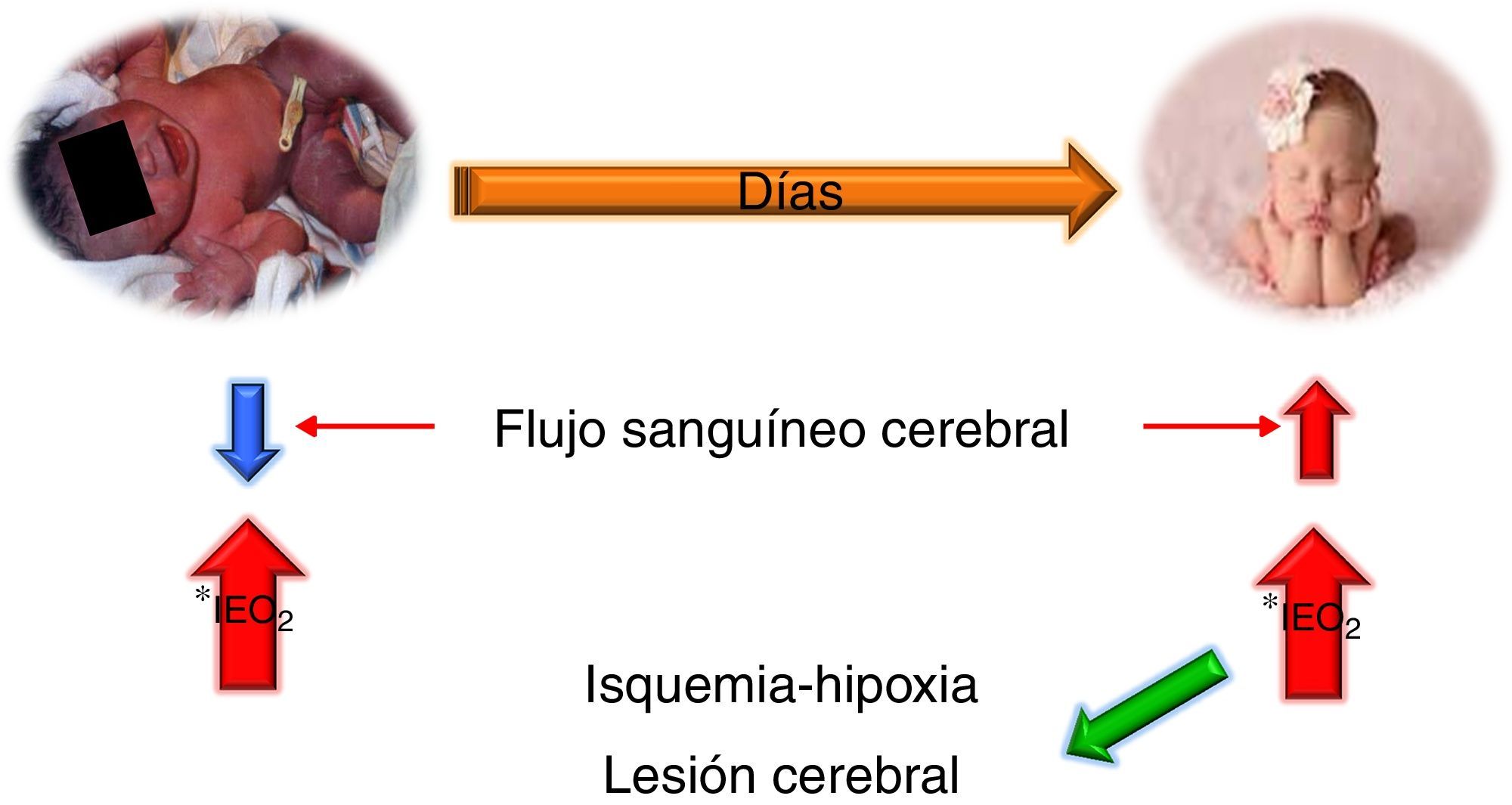
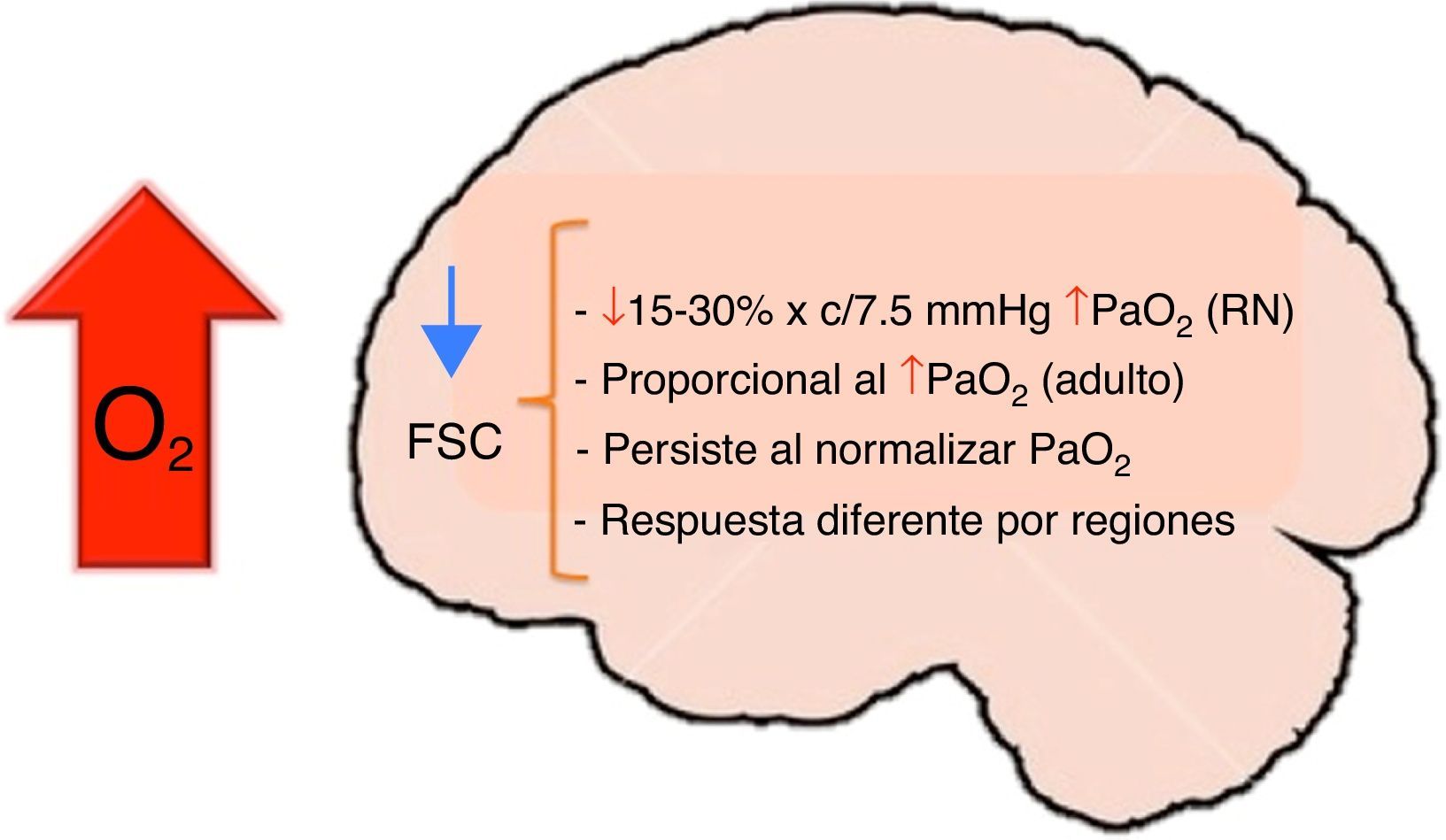
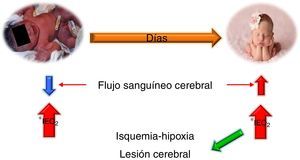
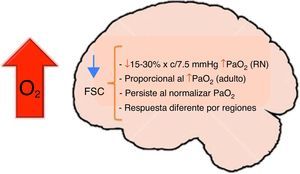
Al nacimiento sobretodo en los prematuros hay una disminución transitoria del flujo sanguíneo cerebral pero el índice de extracción de oxígeno incrementa notablemente para mantener una adecuada oxigenación cerebral, con el paso de los días, estos cambios se compensan y normalizan, sin embargo ante una lesión que comprometa seriamente la entrega de oxígeno (anemia, vasodilatación ó vasoconstricción severa), el índice de extracción de oxígeno ya no puede incrementar más lo que potencializa el riesgo de lesiones hipóxico-isquémicas (fig. 3).
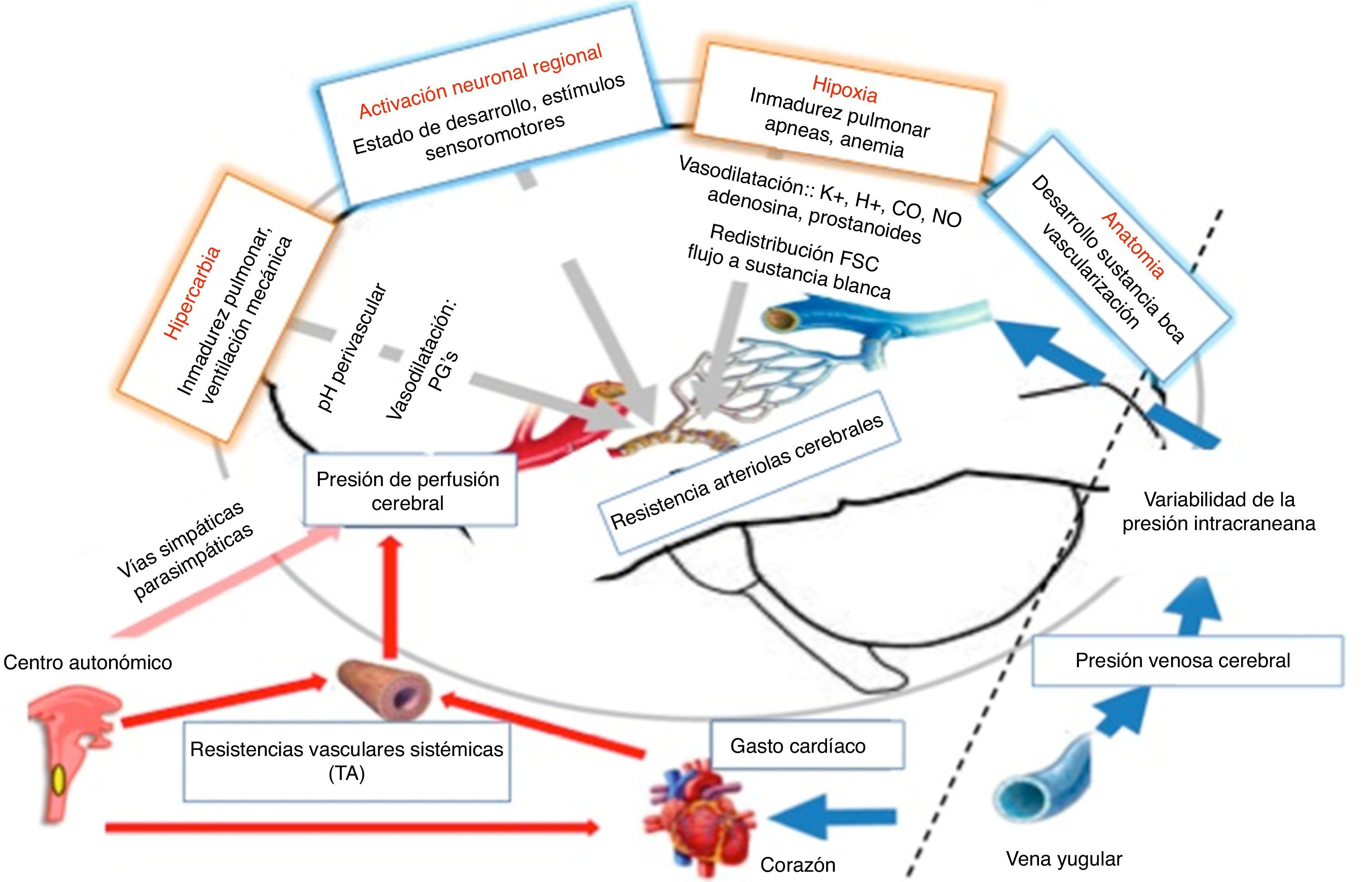
Cambios hemodinámicos y del flujo sanguíneo cerebralLa hipoxia condiciona cambios adaptativos que, de perpetuarse, ocasionan una cascada de eventos que amplificarán el daño tisular al nivel de los diferentes órganos y sistemas (asfixia). Centrándonos en los cambios hemodinámicos, la primera respuesta adaptativa es bradicardia con incremento de la tensión arterial sistémica (TA) para mantener el gasto cardíaco adecuado, seguidos de redistribución del flujo sanguíneo, con perfusión preferencial de los órganos vitales (territorio cerebral, suprarrenal y coronario)4.
El cerebro posee la propiedad de mantener un flujo constante dentro de un amplio margen de valores de la TA (autorregulación), durante la asfixia esa propiedad se pierde y el FSC se modifica en relación directa con los cambios de TA. Si se mantiene el evento de hipoxia-asfixia se produce depresión miocárdica y caída de la TA, ocasionando compromiso de la perfusión cerebral. El edema cerebral es secundario al daño isquémico, con la consiguiente necrosis celular. Las zonas de desarrollo vascular y celular son las más vulnerables a la agresión hipóxico-isquémica, existiendo un estrecho paralelismo entre los procesos críticos del desarrollo y los patrones de lesión4.
¿Qué se puede hacer para evitarlo?Intervenciones terapéuticas como la ventilación mecánica, el apoyo hemodinámico, el manejo hidroelectrolítico, la terapia con esteroides, el control de los niveles de la glucosa sanguínea y el tratamiento de las crisis convulsivas afectan al desarrollo cerebral y ocasionan daño neurológico5.
La ventilación mecánica actúa como un factor agravante de las lesiones establecidas que ocasiona alteraciones severas en los recién nacidos de muy bajo peso que reciben ventilación mecánica. Durante la ventilación mecánica se producen eventos de hipoxia, hiperoxia, hipercapnia e hipocapnia, acidosis, variaciones de la tensión arterial y el gasto cardiaco que pueden repercutir en el FSC y la oxigenación del mismo durante la fase de reoxigenación y reperfusión6.
Redefiniendo las prácticas actualesLos recién nacidos, en especial los nacidos de forma prematura, requieren asistencia respiratoria mecánica, sin embargo el apoyo ventilatorio se ajusta según las condiciones clínicas del paciente, pudiendo ocasionar alteraciones clínicas y gasométricas del estado ácido base. Se piensa que los niveles de dióxido de carbono muy bajos (hipocapnia), producidos por la asistencia respiratoria a los pulmones causan daño pulmonar y problemas del neurodesarrollo. La hipercapnia (niveles altos de dióxido de carbono en sangre) no demostró beneficios generales, ya que al compararse una estrategia de hipercapnia permisiva/asistencia respiratoria mínima en comparación con la estrategia de asistencia respiratoria regular no se encontraron diferencias, y no pueden ser recomendadas para reducir la mortalidad o la morbilidad pulmonar y del neurodesarrollo. Las estrategias de asistencia respiratoria que intenta alcanzar altos niveles de PaCO2 (>55mmHg) solamente se deben llevar a cabo en el contexto de ensayos clínicos controlados bien diseñados7.
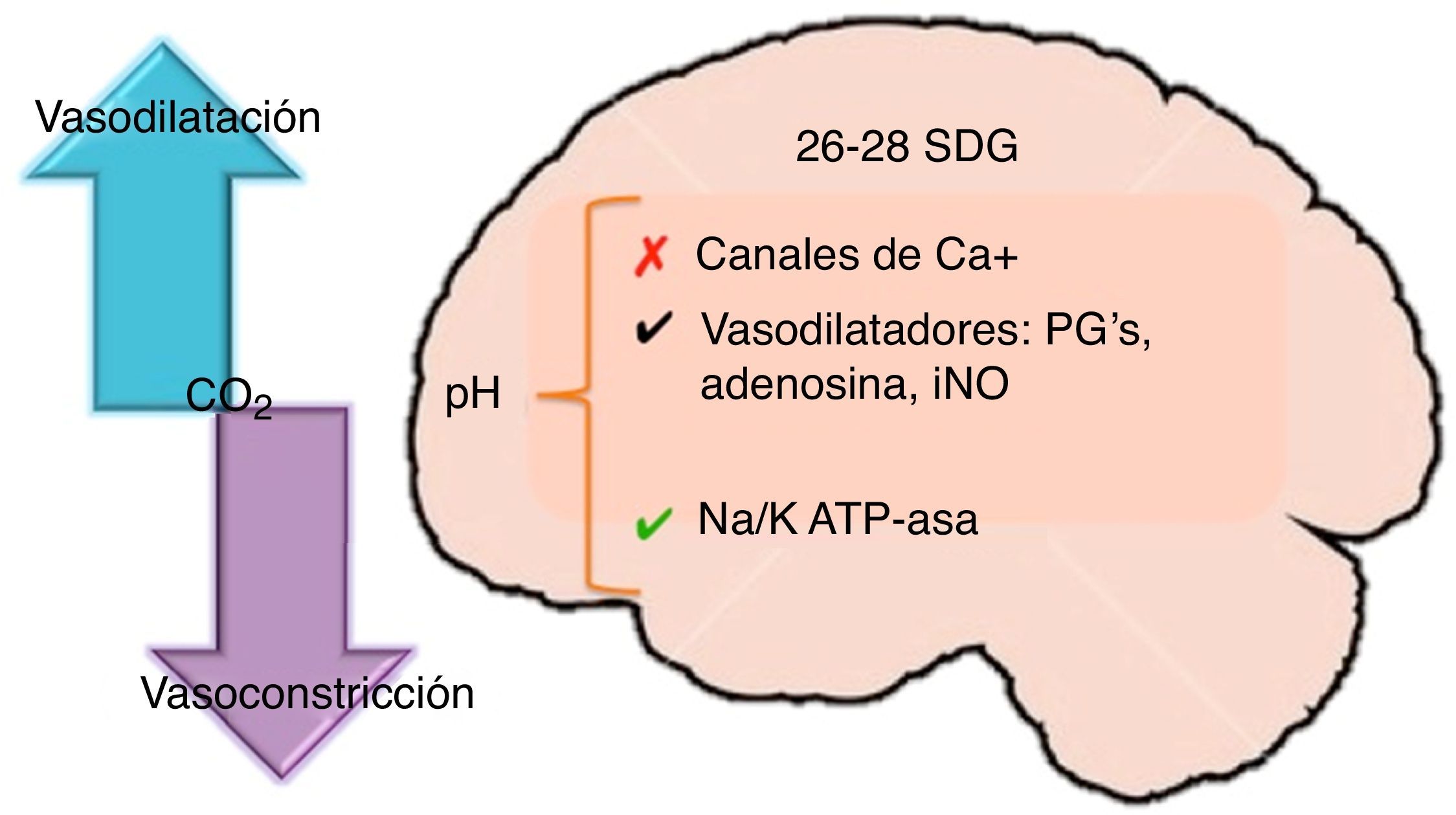
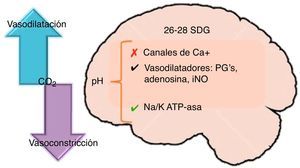
Dióxido de carbono y cerebroLos niveles de dióxido de carbono desempeñan un rol complejo en la lesión cerebral neonatal que aún no está bien dilucidado. Se ha establecido que los niveles normales de dióxido de carbono e incluso una hipercapnia moderada tienen un papel neuroprotector durante un insulto hipóxico isquémico, ya que permiten preservar un adecuado FSC, menor fosforilación oxidativa y niveles menores de glutamato en el líquido cefalorraquídeo. El FSC es muy sensible a los cambios en los niveles de dióxido de carbono circulante. La hipocapnia, hipercapnia y las fluctuaciones en los niveles de PaCO2 se asocian a el incremento en el riesgo de hemorragia intraventricular8,9 (fig. 4).
HipocapniaLa evidencia sugiere que la hipocapnia, particularmente con niveles de PaCO2 que oscilan entre 25 a 30mmHg son de riesgo para el desarrollo cerebral en recién nacidos de término y pretérmino. Muchos estudios han establecido una correlación entre hipocapnia severa o prolongada con la presencia de leucomalacia periventricular y parálisis cerebral. La presencia de hipocapnia produce vasoconstricción, que se asocia con un incremento en el riesgo de leucomalacia periventricular, retraso en el neurodesarrollo y parálisis cerebral, por un mecanismo que aún permanece incierto. La hipocapnia severa ≤15mmHg que se presenta en las primeras 24horas después del nacimiento se asocia con secuelas en el neurodesarrollo (diplejía espástica o paresias). La hipocapnia moderada =20mmHg (PaCO2<30mmHg) disminuye el metabolismo oxidativo cerebral y favorece la fragmentación nuclear del ADN en la corteza cerebral al activar proteasas y endonucleasas, y se ha relacionado con el desarrollo de leucomalacia periventricular quística9,10.
La hipocapnia prolongada se ha asociado a ecodensidades periventriculares severas, hemorragia intraventricular grado 3 o 4 y leucomalacia periventricular. Así mismo se ha visto retraso en el neurodesarrollo en recién nacidos asfixiados que presentan hipocapnia o hipoxia severa (hipocapnia severa produce peroxidación lipídica de la membrana a nivel mitocondrial de las neuronas corticales cerebrales y muerte celular apoptótica), efecto que no se observa con hipocapnia moderada8–10.
Los efectos de la hipocapnia en los recién nacidos de término predisponen a sordera, ocasionan anormalidades motoras o mentales severas, sobre todo cuando los niveles detectados de PaCO2 son menores de 25mmHg10.
HipercapniaLos efectos hemodinámicos de hipercapnia propician la disminución de la contractilidad miocárdica, favorecen la vasodilatación sistémica, incrementan la actividad simpática y el gasto cardiaco, además desencadenan arritmias que repercuten en el FSC10.
La acidosis hipercápnica severa causa vasodilatación cerebral, la misma que puede conducir a edema cerebral e incremento en la presión intracraneal. Este incremento en el FSC desempeña un papel importante en el desarrollo de infartos cerebrales en los recién nacidos de término y en la patogenia de hemorragias intraventriculares en los prematuros. Se ha observado que la hipercapnia altera el metabolismo energético neuronal e incrementa la expresión de proteínas apoptóticas en la corteza cerebral9,10.
La hipercapnia severa, PaCO2>60mmHg, se asocia directamente con el desarrollo de hemorragia intraventricular. Se considera que la presencia de hipercapnia moderada, PaCO2<60mmHg, podría ser una estrategia protectora contra el daño isquémico en el cerebro maduro. En prematuros se considera que la hipercapnia moderada previene la atrofia cerebral y la cavitación quística (según lo observado en ratas). Un riesgo potencial de la hipercapnia permisiva es el incremento de la neovascularización retiniana10.
Se considera que la presencia de hipercapnia leve a moderada es rápidamente compensada por el organismo, por tanto está libre de efectos adversos, ya que los pacientes desarrollan tolerancia progresiva que les permite compensar adecuadamente el pH intracelular. La hipercapnia severa, por su parte, es mal tolerada en los pacientes bajo ventilación mecánica. Los pacientes manejados con hipercapnia permisiva leve a moderada respiran más rápido, con volúmenes corriente más altos, en respuesta a los niveles más altos de PaCO2, lo que incrementa el trabajo respiratorio y el consumo de oxígeno, que favorece una pobre ganancia ponderal10.
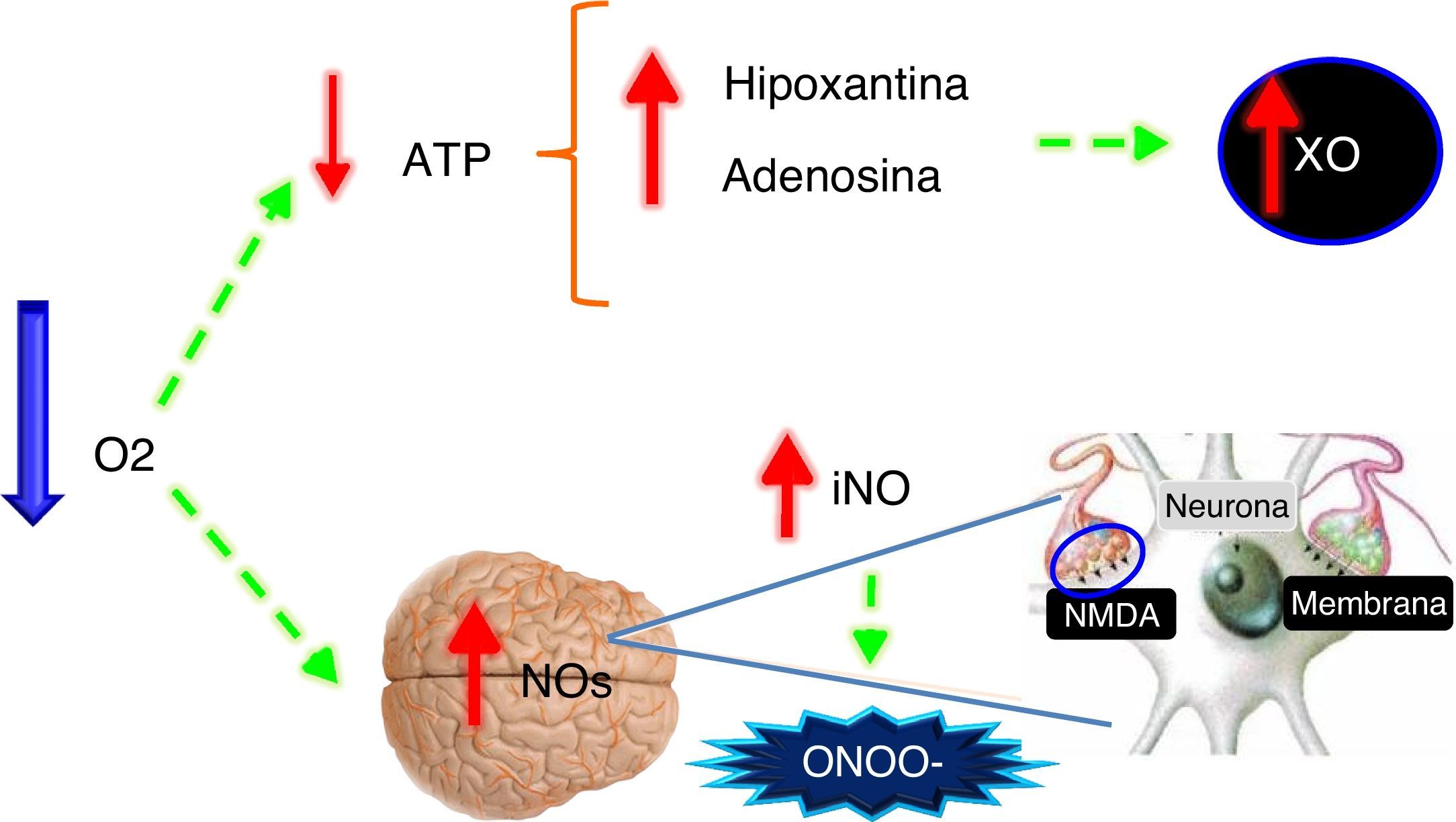
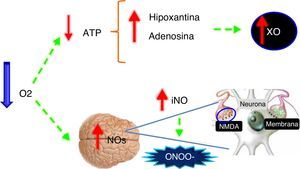
Oxigenoterapia y su influencia en el cerebroDurante el metabolismo celular normal los radicales libres se generan como producto de la cadena de transporte mitocondrial pero son rápidamente inactivados por los sistemas antioxidantes. Cuando incrementan las concentraciones de oxígeno se producen grandes cantidades de radicales hidroxilos y superóxidos por la conversión de hipoxantina a xantina y de ácidos grasos a prostaglandinas; pero cuando el oxígeno disminuye, la disminución en la producción de ATP provoca también incremento en las concentraciones de hipoxantina y de óxido nítrico sintetasa aumentando la producción de peroxinitritos e hidroxilos8 (fig. 5).
Radicales libres de oxígeno.
Fuente: adaptada de Trindade y Rugolo13.
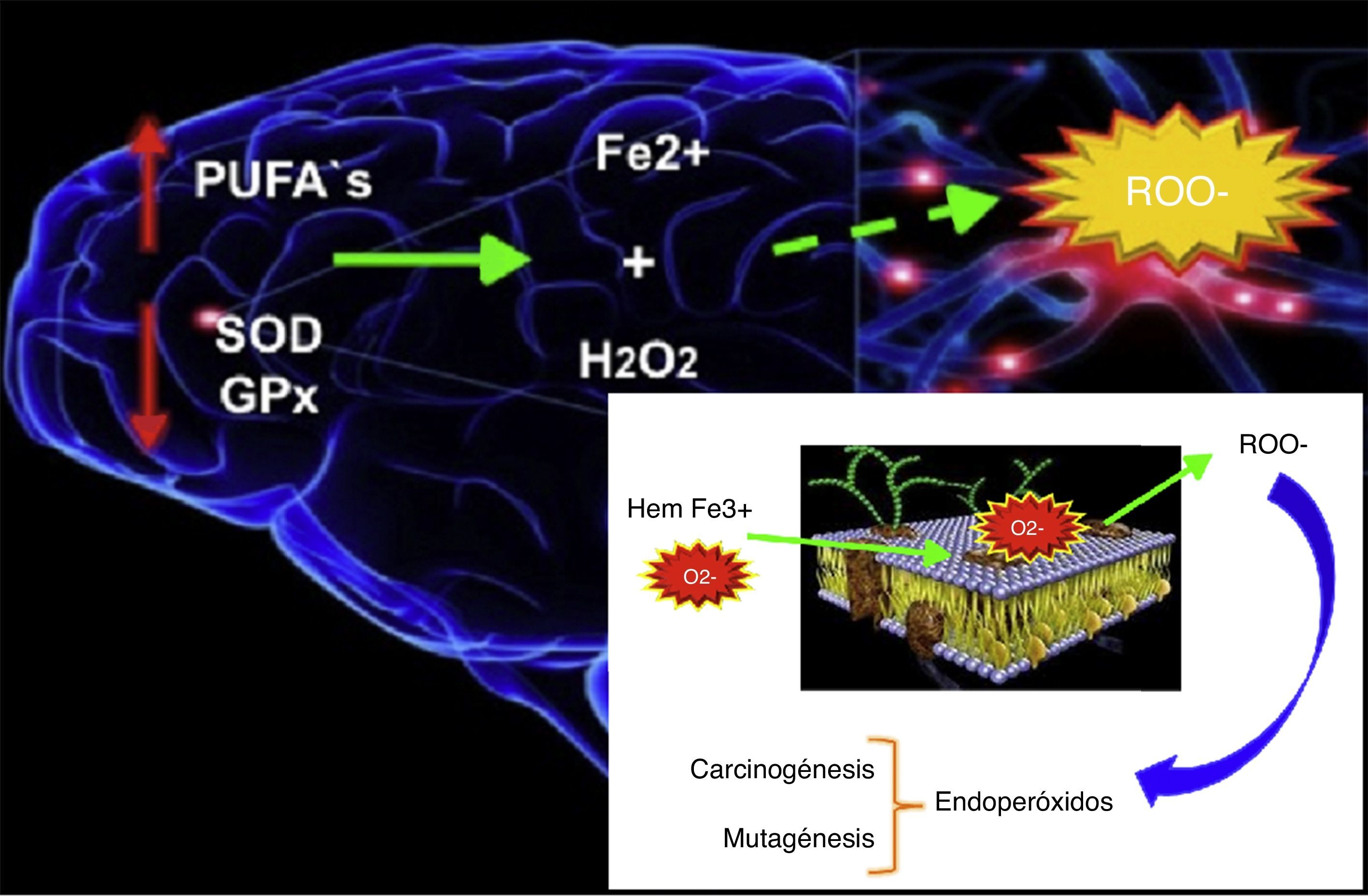
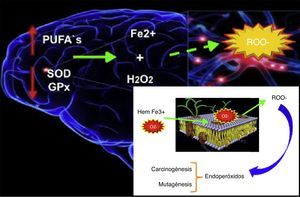
En el cuerpo humano los radicales libres más comunes son el superóxido y el peróxido de hidrógeno que, en su mayoría, suelen ser derivados del oxígeno, debido a que se generan normalmente durante la respiración celular. En condiciones normales el cuerpo contiene agentes antioxidantes que son capaces de contrarrestar estos compuestos; en el cerebro, la superóxido dismutasa, la catalasa y la peroxidasa de glutatión, así como otros llamados reductores de bajo peso molecular11.
El estrés oxidativo se define como una tasa de producción de radicales libres mayor a la de su eliminación, por lo cual el grado de estrés que puede tener una célula es directamente proporcional a la tasa a la cual se produce el O2– y el H2O2. La base del daño se sustenta en el radical hidroxilo, que es muy reactivo y se encuentra en gran cantidad, lo que lleva a la peroxidación de las membranas, a la carboxilación de las proteínas y al daño del ADN. Los radicales libres también pueden funcionar como mensajeros intracelulares e iniciar un círculo vicioso que potenciaría el daño y la producción de radicales a través de complejos de transducción de señales11 (fig. 6).
Radicales libres y estrés oxidativo.
Fuente: adaptada de Buonocore et al.14.
Se determinó que la lesión por reperfusión es el principal factor promotor del estrés oxidativo en las zonas de penumbra de las lesiones isquémicas, donde se encuentra tejido cerebral viable. La reperfusión temprana se acepta como una opción terapéutica, ya que existe un tiempo denominado «ventana terapéutica» durante el cual la restauración del FSC puede disminuir el volumen final del área afectada. Con la lesión por reperfusión el daño de los vasos sanguíneos cerebrales y la activación del proceso inflamatorio pueden producir transformación hemorrágica del tejido afectado y edema cerebral grave. El daño inducido por la reperfusión se basa en la alteración celular provocada por el periodo isquémico, propiciada por cambios enzimáticos y metabólicos que facilitan los mecanismos fisiopatológicos de la lesión. La producción de radicales libres, particularmente superóxido (O2–) después de la reperfusión es muy rápida. Dentro de la mitocondria la pérdida de la función de la citocromo oxidasa altera el mecanismo de fosforilación oxidativa de los ácidos grasos, lo cual incrementa la producción de radicales libres al no presentarse un efectivo proceso de oxidación en ellos por parte de la mitocondria11.
Efectos del oxígeno sobre el cerebroNuestra preocupación es la generación excesiva de radicales libres de oxígeno, ya que estos son una especie química altamente reactiva que media a ambas cadenas de daño tisular la apoptosis y la necrosis8.
La función mitocondrial puede alterarse después de un evento de hipoxia-isquemia, ocasionando menor utilización del oxígeno mitocondrial; por tanto, se ha cuestionado realizar maniobras de reanimación de recién nacidos asfixiados en un ambiente hiperoxigenado. Realizar maniobras de reanimación con oxígeno al aire ambiente (21%) es más efectivo si se compara con reanimaciones otorgadas con oxígeno al 100%, ya que los pacientes presentan una menor puntuación Apgar a los 5 minutos, y la recuperación en menor tiempo del esfuerzo respiratorio8.
El uso de oxígeno suplementario en la reanimación de pacientes asfixiados ocasiona vasoconstricción, con un fenómeno paradójico de isquemia causado por la inhibición del efecto vasodilatador de la prostaciclina, resultado de la inactivación de la ciclooxigenasa por los radicales libres8 (fig. 7).
OxigenoterapiaEl objetivo de la oxigenoterapia es entregar suficiente oxígeno en respuesta a las demandas tisulares, minimizando las la toxicidad por oxígeno y el estrés oxidativo (fig. 8). Aún se desconoce el valor puntual de la saturación arterial de oxígeno que nos permita alcanzar este balance en los pacientes prematuros, quienes son los más vulnerables a los efectos nocivos del oxígeno. Desde el inicio de su empleo en 1940 se ha alternado entre periodos de uso liberal y periodos de uso restringido, durante los cuales los clínicos han buscado encontrar el balance entre los riesgos del uso excesivo de oxígeno y la privación del mismo. Múltiples estudios, entre los que destacan el SUPPORT y el COT, se han puesto en marcha para encontrar un valor blanco para la saturación de oxígeno, sin embargo no existe un criterio unificado12.
Se ha evidenciado que saturaciones entre el 90% y 95% son adecuadas durante la terapia con oxígeno suplementario, y son el valor objetivo mínimo y máximo para establecer límites de alarma, ya que saturaciones por debajo del 90% pueden relacionarse con mayor riesgo de muerte o discapacidad (retraso en el neurodesarrollo) a los 18 meses de edad; así mismo, saturaciones por encima del 95% se relacionan con mayor incidencia de retinopatía y ceguera12.
ConclusionesLos estudios demuestran que aun en nuestro tiempo no existe una estrategia de ventilación ideal para favorecer la neuroprotección, tanto hipercapnia como hipocapnia pueden presentar beneficios y efectos secundarios. Un ambiente hiperoxigenado libera radicales libres que incrementan el estrés oxidativo en el organismo. Niveles de PaCO2<25-30mmHg se asocian con la presencia de leucomalacia periventricular quística y parálisis cerebral en los prematuros; la exposición prolongada a hipocapnia entre 25 a 30mmHg se relaciona con sordera en niños nacidos a término, y la hipercapnia a su vez como estrategia ventilatoria para prevenir el daño por ventilación se ha asociado con alteraciones en el neurodesarrollo. El estrés oxidativo causa hipoperfusión y un fenómeno isquémico en el cerebro que favorece alteraciones en el neurodesarrollo. Saturaciones de oxígeno por debajo de 85% se asocian a retraso en el neurodesarrollo, y por otra parte saturaciones mayores del 95% se asocian a retinopatía y ceguera. Por tanto, nos damos cuenta de que la mejor estrategia para ventilar a un recién nacido debe individualizarse y ajustarse a las recomendaciones en un marco de seguridad. Requerimos continuar la búsqueda de esa ventilación ideal que nos permita disminuir las secuelas en el neurodesarrollo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.