Las infecciones urogenitales constituyen causas comunes de infertilidad masculina. Este tipo de infecciones incluye la orquitis, la epididimitis, la prostatitis, la vesiculitis y la uretritis.
El seminograma refleja su presencia debido al cambio en las características seminales por el establecimiento de los microorganismos en el tracto genital y su multiplicación. La espermatogénesis, la maduración y el transporte del espermatozoide por la vía seminal pueden ser afectados por la infección. No solamente el sitio de infección sino también el tipo de microorganismo causante de la infección urogenital es importante para el diagnóstico y el tratamiento.
Este trabajo involucra los principales grupos de microorganismos asociados a infecciones urogenitales, el deterioro en la calidad seminal, el acercamiento fisiopatológico de los mecanismos relacionados con infertilidad y su trascendencia en los tratamientos de reproducción asistida.
Urogenital infections are common causes of male infertility. This type of infections include orchitis, epididymitis, prostatitis, seminal vesiculitis, and urethritis.
Semen analysis reflects its presence due to impared seminal caracteristics for the establishment of microbes in the genital tract, as well as their replication. Spermatogenesis, sperm maturation and transport can be affected by infection. Not only the site of infection is important for the diagnosis and treatment, but also the type of microorganism.
This work involves the principal groups of microorganisms associated with urogenital infection, impaired seminal characteristics, a pathophysiological approach of the mechanisms related to infertility and its trascendence in assisted reproduction treatments.
La infertilidad masculina es considerada una condición multifactorial en la cual influye el estilo de vida, los factores genéticos, ambientales, ocupacionales, metabólicos, infecciosos, presencia de varicocele, entre otros1. Las infecciones del tracto genitourinario (ITGU) representan aproximadamente un 15% de los casos de infertilidad2. Estas pueden afectar diferentes sitios del tracto reproductor masculino como testículos, epidídimo, glándulas accesorias e incluso uretra.
El seminograma representa una de las herramientas más importantes para evaluar la fertilidad masculina. El hallazgo de una ITGU se relaciona directamente con la presencia de inflamación en el eyaculado. El corte se ha establecido≥1×106leucocitos/ml3, siendo este indicativo de estudio infeccioso.
El establecimiento de la ITGU así como la influencia del microorganismo en la fisiología espermática es dependiente de los mecanismos patogénicos de cada agente etiológico específico, de su concentración, del tiempo de evolución de la infección, del tiempo de contacto de la bacteria con los espermatozoides, del desarrollo de inmunidad protectora contra la infección y de otros factores asociados al hospedero4.
El objetivo de este trabajo lo constituye la descripción de los agentes etiopatogénicos relacionados con ITGU y el mecanismo fisiopatológico asociado a infertilidad.
MetodologíaSe realizó una búsqueda de artículos en inglés y español publicados entre 2003 y 2015 relacionados con infecciones genitales y alteraciones seminales. El tipo de análisis de la información que se llevó a cabo fue descriptivo. Se buscó extraer información relacionada con los microorganismos patógenos recuperados de pacientes con infertilidad de origen infeccioso.
DiscusiónPatógenos involucrados en la infección del tracto genitourinarioBacteriasEnterobacterias, no fermentadores y grampositivosLas enterobacterias representan uno de los grupos aislados de semen en pacientes con ITGU. Según varios autores, en casos agudos o crónicos de prostatitis, Escherichia coli (E. coli) es el patógeno más comúnmente reportado (50-80%)5,6. Otras enterobacterias como Klebsiella y Proteus son encontradas con menor frecuencia (10-30%). Los no fermentadores son los menos relacionados (<5%), pero, por ejemplo, Pseudomonas aeruginosa se ha encontrado causando infecciones como la epididimitis y la prostatitis2. E. coli es también la causa más común de epidídimo-orquitis no transmitida sexualmente2. Entre los grampositivos, el patógeno más prevalente como agente microbiano de prostatitis crónicas es Enterococcus faecalis. Este grampositivo se ha asociado con un impacto negativo de la movilidad y morfología espermáticas5. Staphylococcus y Streptococcus también son aceptados como patógenos6.
El rol en infertilidad masculina de E. coli ha sido evaluado in vitro. El serotipo 06 de E. coli uropatogénica inhibió significativamente in vitro la movilidad de espermatozoides seleccionados por la técnica de capacitación swim up. La microscopia electrónica revela adhesiones de la bacteria al espermatozoide, principalmente en pieza media; y se muestra daño a la membrana espermática y posterior lisis celular7. Antiguamente también se evaluaron los filtrados de E. coli y se encontró que los factores solubles de esta bacteria al parecer no tienen influencia en la movilidad espermática7,8. Sin embargo, recientemente fue purificado un factor denominado factor espermático de inmovilización secretado por E. coli y se demostró que causa daños estructurales en el espermatozoide que correlacionan con la inmovilización9 (ver tabla 1).
Resumen de los principales microorganismos bacterianos asociados a infertilidad ocasionada por infecciones urogenitales
| Grupo/Especies | Mecanismo fisiopatológico asociado a infertilidad | Cuadro clínico asociado al tracto reproductor masculino | Calidad seminal | Trascendencia en TRA |
|---|---|---|---|---|
| Enterobacterias y grampositivos | Adhesiones a la pieza media in vitro (rol de pili y flagelo). Factor espermático de inmovilización asociado a daños estructurales que correlacionan con inmovilidad. Apoptosis espermática in vitro | Pseudomonas aeruginosa agente etiológico de epididimitis y prostatitis. E. coli causa más común de epidídimo-orquitis no transmitida sexualmente y de prostatitis aguda y crónica. Enterococcus faecalis causante de prostatitis crónicas | Disminución motilidad por E. coli uropatogénica | Infección por Streptococcus agalactiae transmisión a tracto reproductor femenino (TRF) y riesgo de sepsis neonatal |
| Familia Mycoplasmataceae: Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum, Ureaplasma parvum | Variación antigénica de adhesinas. Ureaplasma urealyticum adhesión in vitro a la pieza media espermática. Mycoplasma hominis adhesión e internalización al espermatozoide demostradas in vitro. Localización intranuclear de Mycoplasma genitalium (evasión inmune y multiplicación). Citotoxicidad por residuos metabólicos de Ureaplasma urealyticum en bovinos | Agentes de uretritis no gonocócica, prostatitis crónica, prostatovesiculitis, epididimitis, orquitis | Mycoplasma hominis disminución de motilidad y concentración. Mycoplasma genitalium disminución concentración. Fragmentación ADN principalmente en infección a largo plazo | No hay reportes |
| Chlamydia trachomatis | Adhesión e infección de los cuerpos elementales a la célula epitelial. Lisis de células del epitelio reproductivo. LPS alta toxicidad. Asociación CE con los espermatozoides y fosforilación de proteínas del espermatozoide | Uretritis, epidídimo-orquitis y prostatitis | Disminución motilidad in vitro, necrozoospermia. Ac antiespermatozoide | Espermatozoide como vehículo de infección para el TRF |
| Neisseria gonorrhoeae | La regulación positiva de los genes involucrados en la antiapoptosis del epitelio, permite su proliferación | Uretritis | No hay reportes de afectación de los parámetros seminales | No hay reportes |
| Gardnerella vaginalis | Inflamación asociada a descamación de las células epiteliales | Cistitis, balanopostitis y prostatitis | No se ha demostrado asociación con alteraciones en los parámetros seminales | Transmisión a TRF por descamación de células epiteliales. Puede llevar a un factor de infertilidad tubario |
| Mycobacterium tuberculosis | Usualmente obstructivo (lo más común es de epidídimo) | Segunda causa más común de TB extrapulmonar. Epididimitis, prostatitis, vasiculitis, epidídimo-orquitis | Azoospermia, hipospermia y aspermia reportadas en pacientes con TB extrapulmonar | No se describe |
Los espermatozoides incubados con E. coli resultaron en un porcentaje mayor de espermatozoides con externalización de fosfatidilserina (marcador temprano de apoptosis celular)8. Otros autores también apoyan la afirmación de que quienes proponen que E. fecalis, E. coli y Staphylococcus aureus inducen apoptosis espermática in vitro10.
De esta manera los 2 mecanismos putativos mediante los cuales E. coli produce daño al espermatozoide son la actividad citotóxica de sus toxinas y la adhesión mediante el pili o flagelo. Las propiedades adhesivas del pili y los flagelos a los receptores de manosa del espermatozoide indican un rol en la patogenicidad, tanto para bacterias gramnegativas como para grampositivas (ver tabla 1). Se ha encontrado que las bacterias aisladas del sitio de infección son más propensas a expresar su pili que aquellas que simplemente colonizan el tracto uretral10.
MycoplasmataceaeLos micoplasmas no poseen pared celular, diferente al resto de procariotas. La familia Mycoplasmataceae incluye 2 géneros importantes Mycoplasma y Ureaplasma. Este grupo representa los procariotas más pequeños (0.2-0.3μm) capaces de replicación autónoma. Se caracteriza por su pleiomorfismo, no se tiñen con Gram y tampoco se identifican por microscopia óptica11.
Mycoplasma genitalium (M. genitalium), Mycoplasma hominis (M. hominis), Ureaplasma urealyticum (U. urealyticum) y Ureaplasma parvum son las 4 especies de micoplasmas que se encuentran en el tracto urogenital como flora normal de uretra, contaminando al semen durante la eyaculación. Sin embargo estos microorganismos son patogénicos, tienen un rol en ITGU11,12. Varios estudios señalan la alta prevalencia de los micoplasmas en la infertilidad masculina. U. urealyticum es la causa más común de infección genital en hombres infértiles, con una prevalencia del 10-40%8,13.
El mecanismo de patogénesis usualmente involucra adhesinas que les permiten unirse a las células epiteliales. Estas adhesinas son usualmente focos de reconocimiento para el sistema inmunológico del hospedero, de tal manera que se ha descrito que para subsistir estos microorganismos cuentan con variación antigénica de estas proteínas11. Seguido a la adhesión, continúa la invasión. Para M. genitalium, se ha documentado su localización extracelular e intracelular específicamente en el núcleo de la célula epitelial11. Probablemente esto represente un mecanismo de evasión del sistema inmunológico.
Los micoplasmas carecen de toxinas y se responsabiliza a sus productos metabólicos del daño tisular (por ejemplo el H2O2 es el producto final de la respiración celular de M. genitalium)11. U. urealyticum debido a su actividad urealítica y a la consecuente liberación de iones amonio induce citotoxicidad en una variedad de líneas celulares14. El cese de la actividad ciliar y la descamación del epitelio epididimario ha sido descrito en el tracto reproductivo de los bovinos infectados con U. urealyticum14 (ver tabla 1).
Los micoplasmas son considerados agentes de uretritis no gonocócica, prostatitis crónica, prostato-vesiculitis, epididimitis y raramente orquitis2.
Respecto a la asociación entre la ITGU por micoplasmas y la calidad seminal, algunos estudios indican que hay una disminución de la misma4,12, otros señalan que no hay efecto y que tampoco se observa leucocitospermia en este tipo de pacientes15. Algunos proponen que su presencia indica más una colonización que una infección16.
Las diferencias encontradas en estos estudios pueden ser adjudicadas a las distintas sensibilidades de los métodos utilizados en la detección. Las técnicas de detección de microorganismos mediante cultivo son muy rudimentarias y su sensibilidad suele ser baja para este grupo de microorganismos, mientras que esta es mayor con técnicas moleculares.
En un estudio realizado con la técnica de amplificación de los ácidos nucleicos a partir de la primera orina de la mañana, se determinó que la infección de U. urealyticum en pacientes infértiles no genera diferencias significativas en los parámetros seminales al compararlos con pacientes infértiles no infectados, no así la infección por M. hominis que sí puede afectar los parámetros de concentración y morfología12 (ver tabla 1). La infección por M. genitalium también demostró disminuir significativamente la concentración espermática en pacientes infértiles infectados respecto a los no infectados12. Sin embargo, el estudio únicamente comparó los valores seminales de poblaciones infértiles infectadas o no infectadas.
A pesar de no observar diferencias en los parámetros seminales de pacientes infértiles infectados con U. urealyticum, este se puede adherir masivamente al espermatozoide in vitro, especialmente en la pieza media, afectando su movilidad14 (ver tabla 1). En el caso de M. hominis, se encontró capacidad adherente y de internalización en el espermatozoide, lo cual a pesar de no tener efecto en la viabilidad parece ser importante en las alteraciones morfológicas de pieza media y cola17. Se especula que la fosfolipasa de membrana de la bacteria, similar al mecanismo de invasión de Mycoplasma penetrans en células Hep-2, puede desencadenar cascadas de señalización y rearreglos en el citoesqueleto que resulta en su internalización17.
Otro posible mecanismo de daño genital de los micoplasmas es a través de la inducción de la fragmentación del ADN, más allá de esto, la afectación del proceso de fertilización. Un estudio demostró que la generación de la descondensación nuclear, desnaturalización y cortes simples en el ADN por el grupo de los micoplasmas no tiene efectos a corto plazo pero sí en la infección a largo plazo17.
Chlamydia trachomatisEs la causa bacteriana más común de infecciones de transmisión sexual18,19. Chlamydia trachomatis (C. trachomatis) es una bacteria gramnegativa, aunque también se le reporta como gramvariable, inmóvil y de vida intracelular obligada15.
C. trachomatis puede ocasionar ITGU sintomáticas o asintomáticas en hombres y mujeres. En hombres, se reportan casos de uretritis, epidídimo-orquitis y prostatitis. El 50% de las uretritis no cursan con sintomatología, y por tanto no buscan tratamiento. La epididimitis es causada en el 30% de los pacientes sintomáticos en los cuales se ha encontrado C. trachomatis15.
La entrada de este microorganismo al cuerpo ocurre por las superficies epiteliales húmedas como la conjuntiva, la vagina, la uretra, el recto y se adhiere a ellas por la presencia de un sulfato de heparina parecido al glicosaminaglicano que actúa como ligando para que la bacteria pueda ingresar a la célula20.
Dentro de su metabolismo están descritas 2 formas, una extracelular, con un tamaño de 200 a 400nm, esférica, infecciosa denominada cuerpo elemental (CE). El CE no tiene actividad metabólica porque carece de la maquinaria energética (se la provee la célula infectada) y no se pueden replicar. Sin embargo, esta forma se adhiere e induce la fagocitosis de la célula hospedera (célula epitelial). La otra forma corresponde a los cuerpos reticulados, los cuales presentan morfología bacilar, su tamaño es de 600 a 1000nm y no son infecciosos. Los cuerpos reticulados son el resultado de la diferenciación de los CE al ser fagocitados por la célula hospedera. Después de ser fagocitados, dentro de la vacuola de la célula hospedera, los cuerpos reticulados se dividen por fisión binaria y dan origen a nuevos CE formando una inclusión en el citoplasma de la célula hospedera. Los CE son liberados por lisis celular y se diseminan por toda la superficie epitelial húmeda4,15.
El rol de C. trachomatis en infertilidad masculina es protagónico19. El epitelio reproductivo del paciente infectado liberará periódicamente CE en el tracto reproductivo de ambos cónyuges, y tendrán contacto con los gametos que se encuentren ahí en ese momento. Experimentos antiguos realizados mediante la técnica de microscopia electrónica demostraron una asociación cercana de los espermatozoides con los CE15,21. Otros experimentos posteriores cuestionan la naturaleza y el efecto de esta interacción y coincubaron proteínas espermáticas con CE. Se demostró un aumento en la fosforilación de tirosina de las proteínas espermáticas, lo cual fue asociado con la posible adhesión de esta bacteria y la infección. Además, como el proceso de capacitación espermática está regulado por la fosforilación proteica podría sugerirse que la interacción de la bacteria con el espermatozoide también afecta su función21. De esta manera el mecanismo de daño del microorganismo al espermatozoide podría ser independiente del daño del epitelio reproductivo21. Investigaciones más recientes no encontraron datos que apoyen la infección del espermatozoide mismo (ver tabla 1).
Respecto a las anormalidades en los parámetros seminales encontradas en pacientes infectados. Se ha descrito que hasta en un 76% de los pacientes poseen disminución de la movilidad espermática19; demostrado cuando se incuban los espermatozoides con la bacteria in vitro. Por otro lado, se reportó también el efecto del lipopolisacárido de su pared bacteriana en el aumento de la muerte celular y por ende en la aparición de necrozoospermia15,21. Las propiedades espermicidas del lipopolisacárido de C. trachomatis son hasta 500 veces más poderosas que los de una E. coli. Además, la producción de anticuerpos antiesperma se ha relacionado con esta infección2,15.
De esta manera, la necesidad de un diagnóstico de ITGU por C. trachomatis radica en que no solo ocasiona infertilidad masculina mediante los mecanismos que conlleva la respuesta inflamatoria asociada a la infección, citados en capítulos anteriores, y a través del daño directo de los CE sobre el espermatozoide, también su efecto trasciende a que el espermatozoide puede transmitir el microorganismo a la pareja y ocasionar en ella alteraciones graves en el tracto reproductor femenino también asociadas a infertilidad (ver tabla 1). De hecho, se ha sugerido al espermatozoide como un vehículo de infección para el tracto reproductor femenino, ya que este se encuentra infectado, o se lleva el microorganismo consigo21.
Neisseria gonorrhoeaeNeisseria gonorrhoeae ocasiona uretritis, y raramente la infección se complica a otras partes del tracto genital incluyendo los testículos2.
Neisseria gonorrhoeae no produce modificación en la movilidad espermática según lo observado en evaluación por métodos automatizados. Sin embargo, respecto a los mecanismos que producen subfertilidad, se reportó que esta bacteria sobrevive y prolifera en el epitelio gracias a la regulación positiva de mecanismos antiapoptóticos del hospedero8,22 (ver tabla 1). La Vignera et al. sugieren que un mecanismo similar pueda ocurrir en las células germinales8.
Gardnerella vaginalisGardnerella vaginalis (G. vaginalis) es un cocobacilo gramvariable que puede estar presente como flora normal en el tracto reproductivo femenino y su sobrecrecimiento está asociado al cuadro de vaginosis23. Este cuadro cursa con manifestaciones clínicas moderadas, pero un ascenso puede llevar a un factor de infertilidad tubario2. G. vaginalis puede aislarse en altas tasas (>90%) de la uretra de hombres cuya pareja cursa con vaginosis23, y raramente se asocia a alguna sintomatología en el hombre. No obstante, ha sido detectada en cultivos de hombres con cistitis, prostatitis y balanopostitis24.
La prevalencia de esta bacteria en hombres que asisten a clínicas de infertilidad es usualmente mayor que en la población masculina normal (22%)24. Debido a su asociación con infecciones urogenitales y a la alta prevalencia en pacientes infértiles, se pensó que esta bacteria afectaría la calidad seminal, causando infertilidad. Sin embargo, no se ha demostrado una asociación con alteraciones en los parámetros seminales24 (ver tabla 1).
Hasta el momento la colonización de G. vaginalis debe ser considerada clínicamente importante puesto que es transmitida al tracto genital femenino a través de la descamación de células epiteliales que ocurre durante el coito24. Aunque su asociación con la disminución de los parámetros seminales no ha sido demostrada, la posible relación con las ITGU masculinas justifica su búsqueda.
Mycobacterium tuberculosisLa tuberculosis (TB) tiene como agente etiológico a Mycobacterium tuberculosis. La TB genitourinaria representa la segunda causa más común de TB extrapulmonar en los países del oeste de Europa. En este caso cuando se involucran los órganos genitales, el epidídimo es el sitio más común de infección, seguido de la próstata y las vesículas seminales (ver tabla 1). La epidídimo-orquitis también ha sido reportada para las infecciones extrapulmonares por este patógeno25. Aunque no es tan común, la TB epididimaria puede ser la única ubicación con evidencia de infección26.
La infertilidad usualmente es el resultado de obstrucción epididimaria o de los vasos deferentes; por tanto, la azoospermia, hipospermia y aspermia se han reportado en pacientes con manifestaciones extrapulmonares de TB27.
Mycobacterium tuberculosis así como Mycobacterium leprae pueden ocasionar daño en los testículos e infertilidad en hombres2.
Patógenos fúngicosCandida albicansCandida albicans (C. albicans) es un patógeno oportunista, comúnmente coloniza la uretra pero difícilmente las glándulas accesorias4. Es virulenta cuando se presenta en su forma filamentosa por que se adhiere a muchos sustratos28.
Se ha descrito que este hongo es capaz de disminuir la movilidad espermática in vitro, algunos autores precisan que en concentraciones>104UFC/ml8, otros plantean>105UFC/ml4. Un grado significativo de aglutinaciones espermáticas inespecíficas y específicas de cabeza-cabeza con C. albicans interpuesta han sido encontradas8,29, y esto podría estar relacionado con la disminución en la movilidad (ver tabla 2).
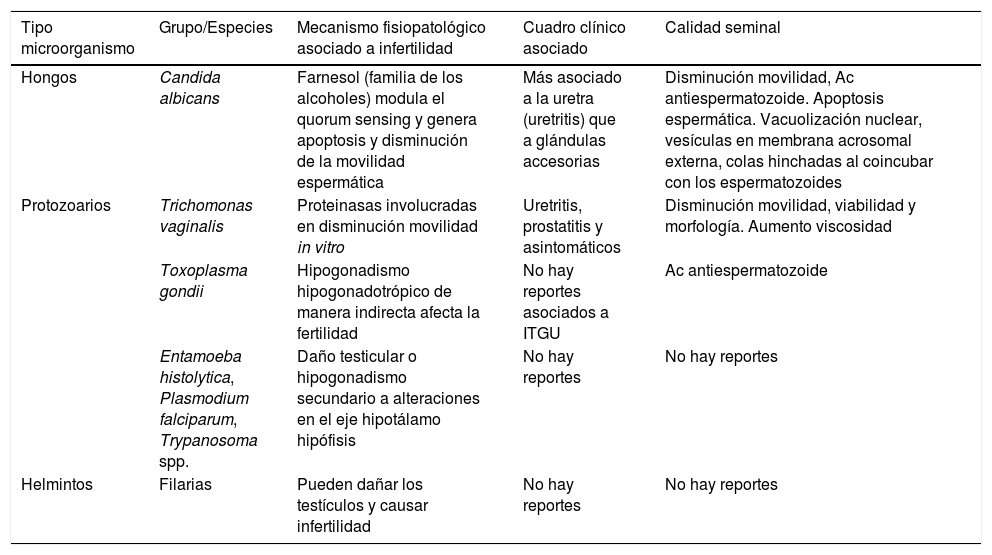
Resumen de los principales hongos, protozoarios y helmintos asociados a infertilidad ocasionada por infecciones urogenitales
| Tipo microorganismo | Grupo/Especies | Mecanismo fisiopatológico asociado a infertilidad | Cuadro clínico asociado | Calidad seminal |
|---|---|---|---|---|
| Hongos | Candida albicans | Farnesol (familia de los alcoholes) modula el quorum sensing y genera apoptosis y disminución de la movilidad espermática | Más asociado a la uretra (uretritis) que a glándulas accesorias | Disminución movilidad, Ac antiespermatozoide. Apoptosis espermática. Vacuolización nuclear, vesículas en membrana acrosomal externa, colas hinchadas al coincubar con los espermatozoides |
| Protozoarios | Trichomonas vaginalis | Proteinasas involucradas en disminución movilidad in vitro | Uretritis, prostatitis y asintomáticos | Disminución movilidad, viabilidad y morfología. Aumento viscosidad |
| Toxoplasma gondii | Hipogonadismo hipogonadotrópico de manera indirecta afecta la fertilidad | No hay reportes asociados a ITGU | Ac antiespermatozoide | |
| Entamoeba histolytica, Plasmodium falciparum, Trypanosoma spp. | Daño testicular o hipogonadismo secundario a alteraciones en el eje hipotálamo hipófisis | No hay reportes | No hay reportes | |
| Helmintos | Filarias | Pueden dañar los testículos y causar infertilidad | No hay reportes | No hay reportes |
Además, mediante microscopia electrónica se logró observar la ultraestructura de los espermatozoides incubados con C. albicans y sus filtrados, estos presentan vacuolización del núcleo, rotura de la membrana plasmática, agrandamiento del acrosoma e incluso rotura, formación de vesículas en la membrana acrosomal externa, desorganización mitocondrial y mitocondrias hipodensas, colas hinchadas y desintegración del citoplasma2,29 (ver tabla 2).
Al igual que con E. coli, cuando se coincuba espermatozoides de pacientes normospérmicos sanos con C. albicans se reporta reducción de la movilidad pero también se aumenta el porcentaje de externalización de fosfatidilserina, marcador temprano de apoptosis28. Recientemente una molécula conocida como farnesol, un alcohol, se cree que actúa como mediador de la comunicación microbiana en el quorum sensing y como factor de virulencia por su efecto reductor de la movilidad y generador de apoptosis30 (ver tabla 2).
En experimentos in vitro, C. albicans no tiene efectos en la fragmentación del ADN espermático o en la integridad de la cromatina, pero in vivo sí se ha demostrado31. Lo anterior sugiere que C. albicans per se no induce el daño al material genético, se requiere la presencia de otros factores inflamatorios8.
ProtozoariosTrichomonas vaginalisTrichomonas vaginalis es un parásito flagelado anaerobio común del tracto genital masculino, se distribuye alrededor de todo el mundo y se transmite sexualmente2,32. Su prevalencia es mayor en las mujeres probablemente debido a que en los hombres la infección es asintomática y no buscan tratamiento2. Este parásito sobrevive e incluso crece en el fluido seminal32. En pocos casos causa uretritis, prostatitis y otros desórdenes del tracto genital (ver tabla 2).
La infección en pacientes asintomáticos resulta en un aumento significativo de la viscosidad y detritos celulares, disminución de la movilidad, formas normales y viabilidad8. In vitro se reporta que las proteinasas liberadas por este parásito inhiben la movilidad espermática incluso después de eliminar el microorganismo del medio2.
Otros protozoariosToxoplasma gondii puede causar infertilidad mediante la producción de anticuerpos antiesperma o, como se ha visto en modelos animales, ocasionando hipogonadismo hipogonadotrópico2 (ver tabla 2).
Se ha visto que Entamoeba hystolytica, Acanthamoeba spp., Plasmodium falciparum y Trypanosoma spp. producen daño testicular en el tracto genital masculino o hipogonadismo secundario a alteraciones en el eje hipotálamo-hipófisis2.
HelmintosLas filarias se ha descrito que pueden dañar los testículos y causar infertilidad2 (ver tabla 2).
Patógenos viralesEl rastreo bacteriológico de semen es usualmente rutina en la consulta andrológica, no obstante el diagnóstico viral no lo es. Las infecciones virales en pacientes con baja calidad seminal deben ser consideradas. Los microorganismos son omnipresentes y a pesar de que las bacterias son las que aportan mayor biomasa a la Tierra, los virus son los microorganismos más abundantes y no deben dejarse de lado. Es posible que la infertilidad de origen infeccioso viral represente un porcentaje dentro de la infertilidad de origen idiopático (la cual ronda el 30%33).
Como se observó anteriormente la mayoría de las bacterias que ocasionan ITGU son extracelulares a excepción de C. trachomatis; por el contrario, todos los virus son parásitos intracelulares, que necesitan apoderarse de la maquinaria de la célula hospedera para poder multiplicarse. Por dicha razón, los virus también representan un riesgo aún mayor de transmisión por TRA que los otros microorganismos. Por tanto, además de generar daño a través de la respuesta inflamatoria, estos pueden ocasionarlo mediante invasión directa de las células del tracto.
Generalmente, el aislamiento y la identificación de bacterias y hongos mediante cultivo es un método sencillo, barato y fácil de instaurar. Por su parte, para hacer diagnóstico viral se necesitan métodos moleculares, los cuales son un poco más costosos; esta puede ser la razón de que no sea comúnmente realizado. Sin embargo, el fin de esta sección es promover la importancia que tienen los virus, no únicamente centrándonos en el diagnóstico andrológico sino también desde una visión más integral, ya que del espermatozoide infectado o no infectado que fecunde depende el desarrollo embrionario.
HerpesvirusLos herpes genitales son enfermedades transmitidas sexualmente por el virus herpes simplex tipo 1 (VHS-1) o tipo 2 (VHS-2). En los Estados Unidos el CDC reporta que el 15.7% de las personas entre 14 y 49 años tiene infección por VHS-2; la prevalencia de infección por herpes virus puede aumentar un poco por el incremento en las infecciones genitales causadas por VHS-1 también34. Las infecciones por VHS son para toda la vida. Como la mayoría de las infecciones por VHS-1 y VHS-2 son subclínicas, muchas personas infectadas por el virus no lo saben35. El herpes genital puede ser asintomático en la primoinfección o en la recurrencia; y la liberación de partículas virales infecciosas es común36,37.
Se determinó una prevalencia de VHS-1 y VHS-2 en hombres infértiles asintomáticos que asistían a una clínica de infertilidad del 22.9% y del 14.3%, respectivamente. No se encontró asociación entre la infección viral y las anormalidades en morfología y movilidad, pero sí con una disminución en el recuento espermático en semen36 (ver tabla 3).
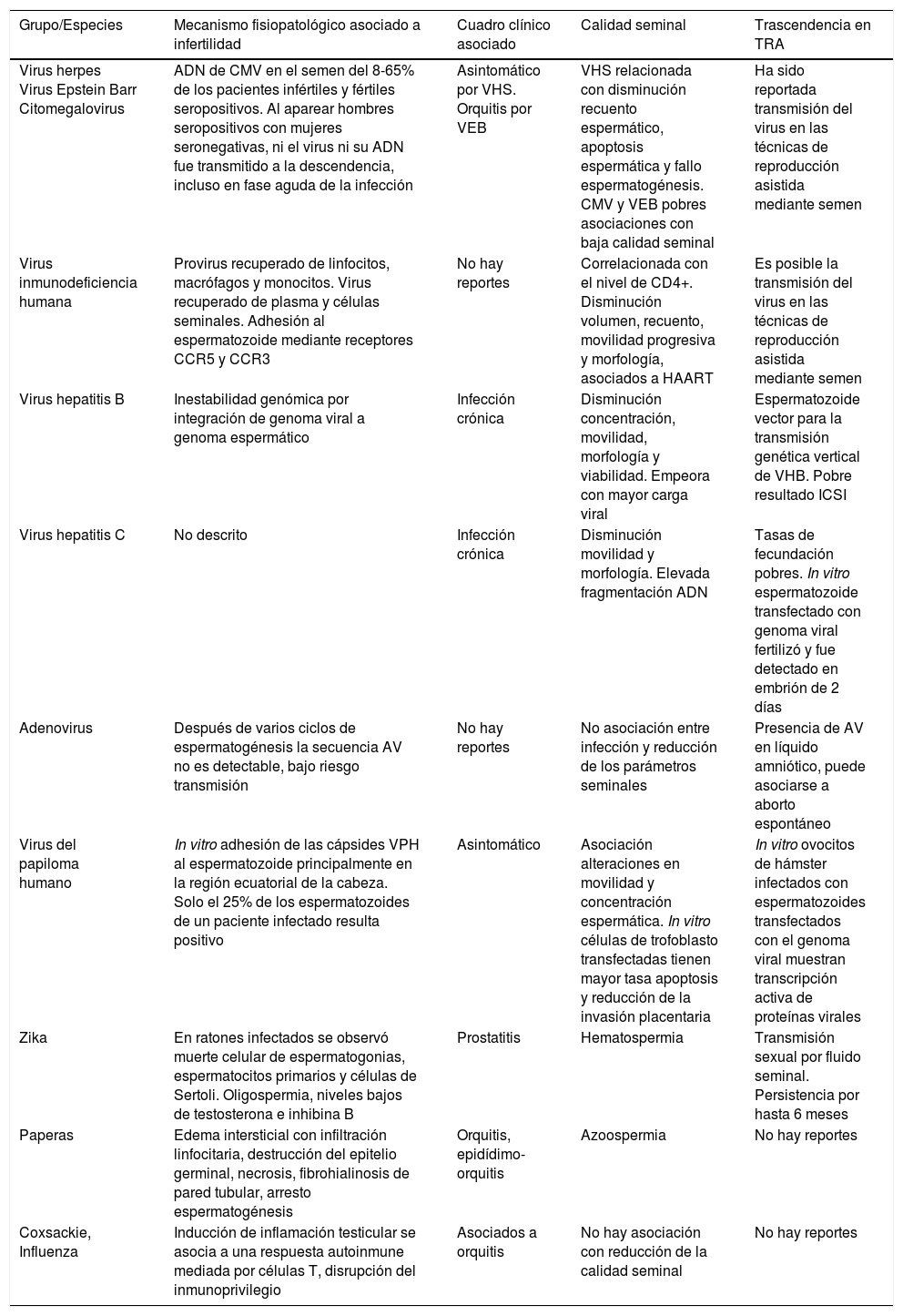
Resumen de los principales microorganismos virales asociados a infertilidad ocasionada por infecciones urogenitales
| Grupo/Especies | Mecanismo fisiopatológico asociado a infertilidad | Cuadro clínico asociado | Calidad seminal | Trascendencia en TRA |
|---|---|---|---|---|
| Virus herpes Virus Epstein Barr Citomegalovirus | ADN de CMV en el semen del 8-65% de los pacientes infértiles y fértiles seropositivos. Al aparear hombres seropositivos con mujeres seronegativas, ni el virus ni su ADN fue transmitido a la descendencia, incluso en fase aguda de la infección | Asintomático por VHS. Orquitis por VEB | VHS relacionada con disminución recuento espermático, apoptosis espermática y fallo espermatogénesis. CMV y VEB pobres asociaciones con baja calidad seminal | Ha sido reportada transmisión del virus en las técnicas de reproducción asistida mediante semen |
| Virus inmunodeficiencia humana | Provirus recuperado de linfocitos, macrófagos y monocitos. Virus recuperado de plasma y células seminales. Adhesión al espermatozoide mediante receptores CCR5 y CCR3 | No hay reportes | Correlacionada con el nivel de CD4+. Disminución volumen, recuento, movilidad progresiva y morfología, asociados a HAART | Es posible la transmisión del virus en las técnicas de reproducción asistida mediante semen |
| Virus hepatitis B | Inestabilidad genómica por integración de genoma viral a genoma espermático | Infección crónica | Disminución concentración, movilidad, morfología y viabilidad. Empeora con mayor carga viral | Espermatozoide vector para la transmisión genética vertical de VHB. Pobre resultado ICSI |
| Virus hepatitis C | No descrito | Infección crónica | Disminución movilidad y morfología. Elevada fragmentación ADN | Tasas de fecundación pobres. In vitro espermatozoide transfectado con genoma viral fertilizó y fue detectado en embrión de 2 días |
| Adenovirus | Después de varios ciclos de espermatogénesis la secuencia AV no es detectable, bajo riesgo transmisión | No hay reportes | No asociación entre infección y reducción de los parámetros seminales | Presencia de AV en líquido amniótico, puede asociarse a aborto espontáneo |
| Virus del papiloma humano | In vitro adhesión de las cápsides VPH al espermatozoide principalmente en la región ecuatorial de la cabeza. Solo el 25% de los espermatozoides de un paciente infectado resulta positivo | Asintomático | Asociación alteraciones en movilidad y concentración espermática. In vitro células de trofoblasto transfectadas tienen mayor tasa apoptosis y reducción de la invasión placentaria | In vitro ovocitos de hámster infectados con espermatozoides transfectados con el genoma viral muestran transcripción activa de proteínas virales |
| Zika | En ratones infectados se observó muerte celular de espermatogonias, espermatocitos primarios y células de Sertoli. Oligospermia, niveles bajos de testosterona e inhibina B | Prostatitis | Hematospermia | Transmisión sexual por fluido seminal. Persistencia por hasta 6 meses |
| Paperas | Edema intersticial con infiltración linfocitaria, destrucción del epitelio germinal, necrosis, fibrohialinosis de pared tubular, arresto espermatogénesis | Orquitis, epidídimo-orquitis | Azoospermia | No hay reportes |
| Coxsackie, Influenza | Inducción de inflamación testicular se asocia a una respuesta autoinmune mediada por células T, disrupción del inmunoprivilegio | Asociados a orquitis | No hay asociación con reducción de la calidad seminal | No hay reportes |
En otro estudio se determinó la prevalencia de enfermedades de transmisión sexual en semen de pacientes asintomáticos con infertilidad masculina, el 3.7% correspondió a ADN de VHS y de entre todos los patógenos estudiados el mayor efecto en calidad espermática y en niveles de marcadores de las glándulas accesorias se adjudicó al VHS36. Otro estudio indicó la asociación de VHS con fallos en la espermatogénesis, aumento de la apoptosis celular y baja concentración espermática38 (ver tabla 3).
Más importante aún es la utilización de semen obtenido de un paciente con infección asintomática de VHS-2 en las técnicas de reproducción asistida. En ese sentido, la transmisión de VHS-2 mediante inseminación artificial ha sido reportada36.
Citomegalovirus y adenovirusEl citomegalovirus (CMV) es también un herpesvirus. No se observó asociación entre la presencia de infección por CMV o adenovirus (AV) y disminución en los parámetros seminales (ver tabla 3). Estos virus parecen no tener papel en la infertilidad masculina39.
En el caso de AV, se demostró que su ADN se puede encontrar en semen. Un estudio subsecuente determinó ADN de AV en el tejido testicular en una región conocida como AAVS1, del cromosoma 1940. El seguimiento a largo plazo de la infección mostró que después de cientos de ciclos de espermatogénesis la secuencia no es detectable y esto representa un riesgo bajo para la transmisión a la línea germinal41.
No hay datos del efecto de la infección seminal por AV en los resultados de la reproducción asistida, pero la presencia de AV en líquido amniótico indica que podría asociarse con resultados reproductivos indeseados o aborto espontáneo39 (ver tabla 3).
Por otro lado, la prevalencia de ADN de CMV en semen en los pacientes fértiles e infértiles seropositivos varía del 8 al 65%. El virus inoculado en testículos demostró infectar células endoteliales, Leydig y células peritubulares; la espermatogénesis se vio afectada pero ni las células germinales ni Sertoli fueron infectadas39. En un experimento se apareó a hombres infectados con mujeres sin infectar. Ni el virus, ni su ADN se encontró en los espermatozoides recuperados de fluido uterino, oocitos fertilizados, blastocistos, demostrándose así que el CMV que se encontraba en los órganos genitales no fue transmitido a la descendencia, incluso cuando se encontraban en la fase aguda de la infección42 (ver tabla 3).
En un estudio reciente, in vitro las células germinales inmaduras infectadas (espermatogonias, espermatocitos y espermátides) presentaron efectos líticos producto de la expresión de antígenos y partículas virales; sin embargo, los espermatozoides producto de la maduración de las células germinales inmaduras no acarreaban al CMV43. Los procedimientos de lavado utilizados en reproducción asistida se espera que eliminen la carga viral de la muestra seminal pero el riesgo no se puede excluir especialmente en casos de inyección intracitoplasmática de espermatozoides44.
Virus de la inmunodeficiencia humanaEl virus de la inmunodeficiencia humana-1 (VIH-1) se puede encontrar en grandes cantidades en el semen, se puede recuperar del plasma o de las células seminales. El provirus VIH-1 se ha encontrado en linfocitos, macrófagos y monocitos45,46. En pacientes infectados que estén recibiendo terapia antirretroviral que no tienen niveles detectables de ARN en plasma, el virus se presenta en las células seminales y es capaz de transmitirse sexualmente.
En humanos, los espermatozoides son probablemente portadores pasivos del virus, el cual se adhiere a la superficie celular mediante los receptores CCR5 y CCR347.
Los parámetros seminales no se ven afectados en pacientes infectados por VIH asintomáticos, mientras que el recuento, movilidad progresiva y la morfología se dañan con el avance de la enfermedad39. Los niveles de CD4+ se han correlacionado positivamente con la calidad seminal8. En pacientes con sida se reporta semen anormal y leucocitospermia. Las alteraciones encontradas se atribuyen a los efectos de la terapia antirretroviral, por ejemplo menor volumen de eyaculado, movilidad progresiva y morfología anormal espermática39 (ver tabla 3).
En el caso del manejo de la muestra seminal para pacientes VIH positivos, la Asociación Americana de Medicina Reproductiva recomienda preparar las muestras mediante una técnica de capacitación doble, realizando la técnica de gradientes en combinación con un swim up. Además, el empleo de inyección intracitoplasmática de espermatozoides en parejas serodiscordantes puede reducir el riesgo de exposición del oocito al agente infeccioso48.
Virus hepatitis BEl virus de la hepatitis B (VHB) es capaz de atravesar la barrera testicular, entrar a las células germinales e integrar su genoma. Se demostró que el ADN del VHB se puede integrar en los cromosomas espermáticos y transmitirse verticalmente. El genoma viral integrado ocasiona mutaciones múltiples e inespecíficas en los cromosomas del espermatozoide, llevando a inestabilidad genómica; las aberraciones cromosómicas que se produzcan serán heredadas39. Lo anterior es importante durante los procedimientos de reproducción asistida.
Zhou et al. reportaron una asociación negativa entre la calidad seminal y los resultados de la inyección citoplasmática de espermatozoides y la transferencia embrionaria49 (ver tabla 3).
Respecto al impacto de la infección en los parámetros seminales, Lorusso et al. reportan una disminución en la concentración, movilidad, morfología y viabilidad en los pacientes VHB seropositivos50. Otros estudios reportan que cuanto mayor es la carga viral más dañinas son las alteraciones en los parámetros seminales en la infección crónica por VHB39,51 (ver tabla 3).
Virus hepatitis CEl virus de la hepatitis C (VHC) también ha sido encontrado en el semen de un tercio de pacientes virémicos. La carga viral es baja, sin embargo hay posibilidad de transmitir la infección39.
Respecto a la alteración de los parámetros seminales, la reducción en la movilidad y morfología espermática ha sido asociada a la infección por VHC50. Se reportó también una elevada fragmentación de ADN en pacientes con infección crónica por VHC (ver tabla 3).
Por otro lado, cuando se detectó ARN de VHC en el fluido seminal, las tasas de fecundación fueron pobres51. Otro experimento reportó que en los espermatozoides transfectados con un plásmido recombinante que contenía el ARN del VHC, el virus se logró integrar al ADN espermático y fue capaz de fertilizar un oocito. El VHC fue detectado en el embrión de 2 días48 (ver tabla 3).
A pesar de que el riesgo de transmisión viral es bajo, durante los procedimientos de fecundación in vitro es posible; es necesario emplear medidas de reducción durante la reproducción asistida de pacientes infectados39.
Virus del papiloma humanoEl virus del papiloma humano (VPH) es frecuentemente detectado en semen e hisopados uretrales de hombres asintomáticos39. En un estudio reciente, las secuencias de ADN viral estuvieron presentes en el 10% de las muestras de semen de pacientes adultos jóvenes asintomáticos que tenían relaciones sexuales sin protección52.
La prevalencia de la infección por VPH en pacientes infértiles (10.2%) es significativamente mayor que en pacientes fértiles (2.2%), lo cual apoya la hipótesis de que la infección podría representar un factor de riesgo para la infertilidad masculina52. Varios autores han investigado la relación del VPH y alteraciones en los parámetros seminales2,39,53. Los resultados indican una asociación entre VPH y alteraciones en la movilidad espermática. Se propone que este virus podría desempeñar un papel importante en los casos de astenozoospermia idiopática y por tanto en infertilidad masculina52. Solo un estudio presentó relación del VPH con una reducción en el recuento espermático junto con la reducción en la movilidad54 (ver tabla 3).
Se determinó mediante microscopia que luego de incubar el semen con las cápsides del VPH- 16 el virus estaba presente en la superficie de las células espermáticas. Los autores indican que los glicosaminoglicanos, o factores solubles de estructura similar, pueden tener un papel en la interacción y unión entre el espermatozoide y el VPH39,52. Posteriormente, mediante análisis de inmunofluorescencia y citometría de flujo de espermatozoides infectados expuestos a la cápside del VPH-16, se demostró que el espermatozoide expresa el sindecano-1 exclusivamente en la región ecuatorial de la cabeza y que la cápside viral también se localiza en este punto, indicando que la primera unión virus-espermatozoide puede ser por el glicosaminoglicano sindecano-139,53 (ver tabla 3).
Por otro lado, es importante conocer cuál es el rol de la infección seminal por VPH en las tasas de implantación, aborto y en la fertilización asistida. No se sabe si el semen del paciente con VPH es capaz de fecundar, transferir el ADN al oocito y si los oocitos pueden generar un embrión normal39,52. La presencia de VPH en semen puede infectar a la pareja y esta transmitir el virus al feto mediante mecanismos transplacentarios. En ensayos in vitro, las células del trofoblasto transfectadas con VPH tienen una aumentada tasa de apoptosis y una reducción en la invasión de la placenta a la pared uterina comparada con los controles39.
En la concepción natural las tasas de aborto espontáneo de las pacientes expuestas al VPH parecen no ser mayores que las que no fueron expuestas39. En ese sentido, solo una parte de los espermatozoides resulta positiva, la media es del 25% de toda la población52 (ver tabla 3). Cabría la posibilidad de que los espermatozoides no infectados sean seleccionados naturalmente para concebir en el embarazo espontáneo.
Sin embargo, la información de las muestras seminales infectadas con VPH es especialmente importante en las técnicas de reproducción asistida. Se reportó que mujeres con infección cervical por VPH que llevaron a cabo procedimientos de fertilización in vitro presentaron una reducción en la tasa de embarazos respecto a las no infectadas. Además, en experimentos con oocitos de hámster los oocitos que fueron fecundados con espermatozoides transfectados con el genoma viral demostraron la expresión de los genes virales, indicando una transcripción activa en el oocito infectado55. Por lo anterior se han propuesto nuevas medidas en el manejo de las muestras seminales infectadas con VPH56.
ZikaEl virus del Zika (VZ) es un flavivirus responsable de un fuerte brote en Sur y Centroamérica. La principal preocupación respecto a este agente infeccioso la representa el riesgo de microcefalia por la infección materna en primer trimestre (0.88-13.2%). El VZ es transmitido por mosquitos pero también se ha descrito la transmisión sexual entre pacientes sintomáticos y asintomáticos57.
La Organización Mundial de la Salud aconsejó que los viajeros hombres deberían tener prácticas sexuales seguras o considerar abstinencia en un periodo de 6 meses después de dejar un país con transmisión activa de Zika. Esta recomendación fue conservadora porque se estimó que la persistencia del ARN viral en semen es de 62 días. Sin embargo otros estudios han reportado que el máximo periodo de detección de ARN en pacientes sintomáticos puede ser alrededor de 6 meses58 (ver tabla 3).
Síntomas de prostatitis y hematospermia han sido detectados en pacientes sintomáticos infectados por VZ (ver tabla 3). Estos casos proveen evidencia de que el VZ está infiltrando el tracto reproductivo masculino48.
Govero et al. realizaron un modelo animal en ratón. El VZ se detectó en el fluido seminal de los machos por periodos extendidos de tiempo y se transmitió sexualmente. Se observó la persistencia de este virus en testículos y epidídimo de los ratones. El virus principalmente infectó espermatogonias, espermatocitos primarios y células de Sertoli, en los testículos, resultando en muerte celular en los túbulos seminíferos y en la luz del epidídimo. El daño tisular se asoció a niveles disminuidos de testosterona e inhibina B, oligospermia (ver tabla 3). Todos estos daños se relacionan con disminución de la fertilidad al menos en ratones59. Es necesario realizar más estudios para determinar el impacto en la infertilidad masculina de la infección por ZV a largo plazo.
Entender el mecanismo mediante el cual el VZ infecta tejidos humanos es crucial para comprender el riesgo de VZ en la práctica de las técnicas de reproducción asistida. Aún no se sabe si el espermatozoide actúa como vector llevando el material directamente al oocito, ni tampoco si este y el embrión internalizan su material genético de una manera pasiva o activa60.
En Brasil, uno de los países con mayor cantidad de casos por VZ, la serología por IgM fue interpuesta como obligatoria por la Agencia de Vigilancia Nacional; los gametos podían ser colectados para técnicas de reproducción asistida solo si los resultados eran negativos. Sin embargo, los resultados indeterminados, además de sumar costo, retrasaban los tratamientos de pacientes de edades mayores de los 35 años. Se argumenta además que la incidencia de la infección por el VZ asintomática es muy baja. Se presenta entonces la interrogante de si se debe evaluar a los pacientes asintomáticos que van a ser sometidos a técnicas de reproducción asistida60. De acuerdo al CDC los hombres y mujeres con posible exposición al VZ sin enfermedad clínica deben esperar 8 semanas después de intentar la concepción61.
Otros virusLas paperas corresponden a una infección viral contagiosa que usualmente produce parotiditis en niños62. Corresponde a un virus ARN que se transmite mediante gotas o aerosoles infectados originados en la orofaringe. Específicamente, se ha estimado que el 14-35% de los casos de pacientes pospúberes presentan complicación de orquitis63,64, el 16-65% de estos casos es bilateral y el 30-50% de los testículos afectados muestran algún grado de atrofia testicular62 (ver tabla 3).
Histológicamente, los testículos afectados muestran edema intersticial con infiltración linfocitaria, destrucción del epitelio germinal, necrosis, fibrohialinosis de la pared tubular y varios grados de arresto en la espermatogénesis dependiendo de la severidad de la infección. La azoospermia, en este tipo de paciente, se presenta usualmente bilateral y con un daño extensivo de los testículos ocasionado por el virus62.
Se debe considerar que la fertilidad de los niños no inmunizados está en juego2,64. Además, el clínico debe estar consciente que la epidídimo-orquitis puede ser secundaria a una infección por paperas incluso sin haber habido evidencia clínica de parotiditis2,64 (ver tabla 3).
Aparte de las paperas, un gran número de infecciones virales incluyendo los virus Coxsackie, Epstein-Barr, Influenza y VIH pueden asociarse a orquitis. La inducción de la inflamación testicular se asocia con una respuesta autoinmune mediada por células T, por ejemplo luego de la disrupción del inmunoprivilegio65 (ver tabla 3). La orquitis también puede presentarse como una complicación de la brucelosis2,25.
ConclusiónRevisando la literatura se concluye que las alteraciones seminales detectadas en la infertilidad ocasionada por un proceso infeccioso pueden deberse a 3 posibles mecanismos fisiopatológicos:
- a.
Las alteraciones en las estructuras anatómicas ocasionadas por la respuesta inmunológica hacia el agente etiológico
- b.
El metabolismo microbiano
- c.
Las especies reactivas de oxígeno incrementadas por la respuesta inmunológica y el metabolismo microbiano
Los autores declaran no tener ningún conflicto de intereses.