El síndrome de dificultad respiratoria o de distress respiratorio es la principal causa de insuficiencia respiratoria en recién nacidos prematuros. Desde hace tres décadas el tratamiento con surfactante pulmonar exógeno y ventilación mecánica han sido el estándar de tratamiento; sin embargo, en los últimos años con el incremento y sistematización en el uso de dispositivos de ventilación no invasiva, la postura actual ha cambiado. El objetivo del artículo fue conformar un protocolo de manejo clínico, mediante la integración de algoritmos de decisiones clínicas para el manejo eficaz y seguro del síndrome de dificultad respiratoria neonatal.
Material y métodosLa metodología seguida para la construcción de este protocolo fue la adopción de las guías de práctica clínica existentes en la literatura. Las guías seleccionadas fueron evaluadas con el instrumento AGREE II, seleccionándose las guías de mayor puntaje. En los casos de no haberse encontrado en las guías seleccionadas la información necesaria para contestar las preguntas clínicas, se buscaron otras fuentes e información, como revisiones sistemáticas y metaanálisis.
ResultadosSe realizó una revisión de las guías de práctica clínicas internacionales, con el análisis de la evidencia y recomendaciones para integrar algoritmos clínicos de atención en el contexto de México.
ConclusionesLa sistematización del uso de ventilación no invasiva y surfactante pulmonar exógeno en los recién nacidos pretérmino con síndrome de dificultad respiratoria optimiza el uso del mismo y reduce la necesidad de ventilación mecánica.
Respiratory distress syndrome is the leading cause of respiratory failure in preterm infants. For three decades, the treatment with exogenous pulmonary surfactant and mechanical ventilation has been the standard treatment; however with the increased and systematic use of non-invasive ventilation devices the current position has changed.
ObjectiveTo prepare a clinical protocol for the effective and safe management of neonatal respiratory distress syndrome, through the integration of clinical decision algorithms.
Materials and methodsThe technique used was the adoption of existing clinical practice guidelines in the literature. Selected guides were evaluated with the AGREE II tool, and guidelines with highest score were selected. In the event that the information necessary to answer the clinical questions were not found in the selected guidelines, other sources and information, such as systematic reviews and meta-analyses were reviewed.
ResultsAdoption of international clinical practice guidelines was carried out with the analysis of the evidence and recommendations in the selected guidelines. The clinical care algorithms were integrated in the context of México.
ConclusionsThe systematic use of non-invasive ventilation and exogenous pulmonary surfactant in preterm infants with RDS optimises and reduces the need for mechanical ventilation.
El síndrome de distress respiratorio (SDR) es una condición pulmonar que produce insuficiencia respiratoria, que es ocasionada por una deficiencia en el surfactante alveolar, asociado con una inmadurez de la estructura pulmonar; en la mayoría de los casos se presenta en recién nacidos (RN) prematuros menores de 34 semanas de gestación (SDG)1.
La incidencia de SDR se incrementa con una edad gestacional menor; en el año de 2010 el EuroNeoNet informó una incidencia del 92% en RN de 24 a 25 semanas, del 88% entre RN de 26 a 27 semanas, del 76% en prematuros de 28 a 29 semanas y del 57% en niños que nacieron entre las 30 y 31 SDG1. Los estudios multicéntricos más recientes muestran que en pacientes de 26 a 29 semanas, que son manejados de forma inicial con presión positiva continua a las vías aéreas (CPAP), se reduce la necesidad de intubación o uso de surfactante hasta en un 50%1.
Como parte del tratamiento el SDR se debe iniciar con prevención y manejo integral oportuno, con la intención de minimizar complicaciones a corto y largo plazo. Con el objetivo de disminuir la morbimortalidad neonatal por el SDR, se han descrito diversos protocolos de manejo2.
Diversas guías de práctica clínica recomiendan la administración de surfactante al inicio de la sintomatología del SDR. En modelos animales el uso de surfactante profiláctico produce una distribución más homogénea con menor evidencia de daño pulmonar; sin embargo, su administración requiere intubación y el tratamiento innecesario para pacientes que no desarrollarán SDR2–5.
Recientemente, múltiples ensayos clínicos aleatorizados han mostrado que el tratamiento inicial debe ser la utilización de CPAP administrado por vía nasal, con aplicación de surfactante selectivo de forma temprana, con uso breve de ventilación mecánica y subsecuente extubación continuando con CPAP nasal, resultando en una menor necesidad de ventilación mecánica y menor uso de oxígeno a los 28 días, aunque sin diferencias en displasia broncopulmonar (DBP) al compararlo con el uso de surfactante profiláctico3–7.
Al estudiar al grupo de pacientes que han sido manejados de forma rutinaria con CPAP nasal previo a la administración de surfactante, se ha demostrado una disminución del riesgo de enfermedad pulmonar crónica o muerte8, por lo que la estabilización inicial con CPAP nasal aunado al uso de surfactante selectivo es una de las terapias más recomendadas en la actualidad7,8.
Antecedentes internacionalesLos primeros estudios sobre los cambios patológicos en el pulmón inmaduro y el surfactante datan desde 1854, en Alemania por Virchow y en 1903 por Hochheim; posteriormente en 1929, su función fue analizada por von Neergaard, quien describió las fuerzas de tensión superficial en el alvéolo y su asociación con el surfactante9. Sin embargo la introducción del surfactante para administración exógena como tratamiento del SDR no se inició hasta 1980 en Japón, por Fujiwara9.
Posteriormente a la publicación de Fujiwara, se iniciaron múltiples ensayos clínicos controlados, comparando diversas preparaciones de surfactante, como la natural contra la sintética, así como el tipo óptimo de administración, clasificándolo como profiláctico o selectivo (temprano y tardío), y comparando su administración en dosis única contra múltiples dosis10. Fue en 1989, cuando la Food and Drug Administration en Estados Unidos de Norteamérica autorizó su uso para el tratamiento de SDR11.
En 1973 se presentó la CPAP como uno de los primeros tratamientos exitosos del SDR, con lo cual se disminuyó la mortalidad hasta en un 20%, sin embargo su utilización rutinaria quedó en desuso con los avances en ventilación mecánica neonatal. En 1994 se publicó el primer ensayo clínico controlado aleatorizado administrando surfactante exógeno durante la aplicación de CPAP nasal, describiendo la técnica intubación-surfactante-extubación mostrando una reducción en la necesidad de ventilación mecánica de 85 a 43%12.
Otro de los grandes avances fue la introducción de esteroides prenatales en el año de 1968 por Liggins, quien estudió la maduración pulmonar debido a inducción enzimática y demostró una menor mortalidad neonatal por SDR, realizando un ensayo clínico controlado con la administración de betametasona en mujeres embarazadas con menos de 32 semanas de gestación.
Actualmente se cuenta con la evidencia suficiente como para recomendar la administración de surfactante natural exógeno (porcino o bovino) en una dosis inicial de 200 mg/kg de fosfolípidos, para obtener una mejor respuesta clínica en los RN con SDR1.
Respecto al tiempo óptimo de administración del surfactante exógeno, actualmente se consideran dos modalidades: 1) como profiláctico, se administra antes de los primeros 15 min de vida, usualmente aplicado en la sala de partos y 2) como tratamiento de rescate (selectivo), dividiéndose este último en rescate temprano (administración antes de las 2 primeras h de vida), y tardío (administración después de las 2 primeras h de vida.
El surfactante de rescate temprano se ha asociado con menor riesgo de muerte (RR 0.84, IC 95% 0.74, 0.95) y enfermedad pulmonar crónica (RR 0.69, IC 95% 0.55, 0.86). En pacientes intubados, el surfactante de rescate temprano se asoció a un menor riesgo de síndromes de fuga aérea (RR 0.61, IC 95% 0.48, 0.78), al compararlo con surfactante de rescate tardío13.
Antecedentes del uso de surfactante en el Instituto Nacional de PerinatologíaLa introducción del surfactante exógeno se inició en México en el año 199514, sistematizándose a partir de entonces como tratamiento para el SDR en RN pretérminos de < 34 SDG y < 1,750 g, únicamente en modalidad de rescate. En este periodo de tiempo, se utilizó principalmente un surfactante artificial (exosurf) y con menor frecuencia algunos naturales (beractant)14.
De manera simultánea se inició el uso de CPAP nasal para RN con dificultad respiratoria que no cumplieran con criterios para aplicación de surfactante y como estrategia de destete de ventilación mecánica14.
Posteriormente se realizó un estudio controlado aleatorizado multicéntrico en pretérminos de menos de 32 SDG, comparando un nuevo surfactante artificial con modificación de proteínas en la modalidad de profilaxis (colfosceril vs. lucinactant vs. beractant). El estudio mostró menor mortalidad asociada a SDR a los 14 días de vida con lucinactant comparado con colfosceril (4.7 vs. 9.4%, OR 0.43, IC 95% 0.25-0.73); así como una menor mortalidad por otras causas a las 36 semanas de edad posmenstrual con lucinactant vs. beractant (21 vs. 26%, OR 0.67, IC 95% 0.45-1.0). Desafortunadamente nunca se pudo introducir al mercado; sin embrago ayudó a que se sistematizara la modalidad profiláctica para menores de <32 SDG y de rescate para 32-34 SDG con datos clínicos y radiográficos de SDR15.
Continuando con la búsqueda de un mejor surfactante se realizó un estudio controlado aleatorizado en RN pretérmino <32 SDG; donde se compararon dos surfactantes naturales: 1) beractant 100mg/kg vs. 2) poractant alfa 200mg/kg, encontrando disminución del riesgo para desarrollar SDR (OR 0.23, IC95% 0.11-0.45), DBP (OR 0.40, IC95% 0.18-0.87) y variable combinada de SDR y mortalidad (OR 0.15, IC95% 0.07-0.32) con el uso de alfa-poractant, siendo este el surfactante natural exógeno utilizado actualmente en esta institución16.
El objetivo del artículo fue integrar algoritmos de decisiones clínicas para el manejo eficaz y seguro del SDR neonatal, con la finalidad de crear un protocolo clínico de manejo de los RN prematuros con este padecimiento, que se sustente en la mejor evidencia disponible y que pueda ser aplicado en el ámbito de los servicios de salud de México.
MetodologíaLa técnica utilizada en la construcción del protocolo clínico de manejo fue la adopción de las guías de práctica clínica existentes en la literatura mundial de acuerdo a:
- I.
Definición de preguntas clínicas.
- II.
Estructura de la estrategia de búsqueda.
- a.
Identificación de los descriptores en salud (términos MESH).
- b.
Identificación de las guías de práctica clínica.
- a.
- III.
Selección de las guías de práctica clínica.
Las guías seleccionadas fueron evaluadas con el instrumento AGREE II y se seleccionaron las guías de mayor puntaje. En caso de que la información necesaria para contestar las preguntas clínicas no fuera encontrada en las guías seleccionadas, se obtuvieron de otras fuentes e información, como revisiones sistemáticas y metaanálisis, las cuales fueron evaluadas por el grupo de trabajo. El nivel de evidencia y grado de recomendación fue establecido de acuerdo a la clasificación modificada de Shekelle17. Posteriormente se realizó la integración de los algoritmos clínicos, con la intención de estandarizar las acciones acerca de:
- 1.
Factores de riesgo y manejo prenatal de SDR.
- 2.
Manejo y estabilización en la sala de partos en recién nacidos con riesgo de SDR.
- 3.
Tratamientos para el manejo de SDR:
- a.
Uso de surfactante.
- b.
CPAP temprano y ventilación mecánica.
- a.
Se utilizaron las GPC disponibles así como revisiones sistemáticas y metaanálisis con la estrategia de búsqueda descrita previamente. Se anexan las recomendaciones a las cuales llegó el grupo de estudio (tablas 1–3).
Factores de riesgo y manejo prenatal de SDR
| E R | E: evidencia R: recomendación | Nivel de evidencia Grado de recomendación Fuente |
|---|---|---|
| E | Los siguientes antecedentes incrementan la incidencia de SDR: • Hipotermia • Asfixia perinatal • Fetopatía diabética • No haber recibido esteroides prenatales • Género masculino | I México. Secretaria de Salud, 200918 |
| R | Se recomienda efectuar la reanimación neonatal de acuerdo a las normas de la American Heart Association/American Academy of Pediatrics | A México. Secretaria de Salud, 200918 |
| E | Con la administración de esteroides prenatales se ha observado: • Reducción de muerte neonatal (RR 0.55, IC 95% 0.43–0.72 NNT 9) • Menor riesgo de SDR (RR 0.66, IC 95% 0.59–0.73; NNT 11), este efecto se limita a las madres que recibieron la primer dosis de esteroides en los días 1 a 7 antes del nacimiento (RR 0.46, IC 95% 0.35–0.60; NNT 7) • Menor riesgo de hemorragia intraventricular (RR 0.54 IC 95% 0.43–0.69) • Menor riesgo de enterocolitis necrosante (RR 0.46, IC 95% 0.29–0.74) • Menor necesidad de soporte respiratorio y admisión a UCIN (RR 0.80, IC 95% 0.65–0.99) | I México. Secretaria de Salud, 200918 I Sweet et al., 201319 |
| R | Toda mujer con amenaza de parto prematuro debe recibir al menos un esquema completo de esteroides prenatales entre la semana 23 a 35 de gestación, para disminuir el riesgo de SDR | A México. Secretaria de Salud, 200918 A Sweet et al., 201319 |
| E | La betametasona disminuye la incidencia de SDR y la incidencia de leucomalacia periventricular Al comparar los regímenes de betametasona contra dexametasona, se encontró: • Menor incidencia de hemorragia intraventricular con dexametasona, comparada con betametasona (RR 0.44, IC 95% 0.21 a 0.92) • En uno de los estudios incluidos (105 pacientes), los pacientes que recibieron dexametasona tuvieron mayor riesgo de ser admitidos en la unidad de cuidados intensivos neonatales, comparado con betametasona (RR 3.83, IC 95% 1.24–11.87) • El uso de dexametasona oral comparada con intramuscular, incrementó la incidencia de sepsis neonatal (RR 8.48, IC 95% 1.11- 64.93) en un estudio de 183 pacientes | I México. Secretaria de Salud, 200918 I Brownfoot et al., 200820 |
| R | Se administrará betametasona en mujeres con riesgo de parto prematuro, porque disminuye el riesgo de SDR y leucomalacia periventricular • La dosis única de corticoesteroides consiste: • Betametasona 12 mg intramuscular cada 24 h por 2 dosis • Dexametasona 6 mg intramuscular cada 12 h por 4 dosis | A México. Secretaria de Salud, 200918 A Ministerios de Salud de la República de Chile, 200621 I Brownfoot et al., 200820 |
| E | El nacimiento prematuro debe ser retrasado con el uso de antibióticos en caso de rotura prematura de membranas y permitir el traslado de la madre a un centro de atención perinatal y esperar el efecto de los esteroides prenatales (idealmente 24 h, después de la primer dosis) | I Sweet et al., 201319 |
| R | Debe manejarse con antibióticos a las madres con trabajo de parto prematuro y rotura prematura de membranas, para reducir el riesgo de nacimiento prematuro | A Sweet et al., 201319 |
| E | A pesar de que el uso de cursos repetidos de corticoesteroides prenatales disminuyen el riesgo de SDR si se dan en los 7 días siguientes del curso previo, los recién nacidos expuestos a cursos repetidos de esteroides prenatales tienen un menor peso y disminución del perímetro cefálico al nacimiento | I Sweet et al., 201319 |
| R | Un segundo curso de esteroides prenatales puede ser considerado si el riesgo de SDR sobrepasa los posibles beneficios y efectos a largo plazo | A Sweet et al., 201319 |
Manejo y estabilización en la sala de partos en recién nacidos con riesgo de SDR
| E R | E:evidencia R: recomendación | Nivel de evidencia Grado de recomendación Fuente |
|---|---|---|
| E | El retraso en el pinzamiento del cordón umbilical (30 a 120 segundos), comparado con el pinzamiento temprano, se asoció con: • Mayor hematocrito a las 4 h de vida (diferencia de medias 5.31, IC 95% 3.42 a 7.19) • Menos transfusiones por anemia (RR 2.01, IC 95% 1.24 a 3.27) • Menos hipotensión (RR 2.58, IC 95% 1.17 a 5.67) • Menos hemorragia intraventricular (RR 1.74, IC 95% 1.08 a 2.81) | I Rabe et al., 200422 |
| R | Si es posible, se debe retrasar el pinzamiento del cordón umbilical al menos durante 60 segundos, con el bebé sostenido por debajo de la madre, para promover la transfusión placento-fetal | A Swett et al., 201319 |
| E | Evitar la hipotermia reduce la mortalidad No se conocen las repercusiones de la hipertermia en la mortalidad | I México. Secretaria de Salud, 200918 |
| R | • La reanimación neonatal en sala de parto se realizará según las normas de la American Heart Association y de la American Academy of Pediatrics: 1. Incrementar la temperatura de la sala de partos entre 25 y 26°C 2. Precalentar la cuna radiante 3. Colocar bolsas precalentadas debajo de las sábanas en la mesa de reanimación 4. Use una bolsa de polietileno para cubrir a los bebés menores de 29 semanas de gestación, inmediatamente después del nacimiento 5. Al transportar al bebé a la sala de cuidados intensivos neonatales deberá realizarse en una incubadora de transporte precalentada 6. El objetivo es mantener la temperatura axilar del bebé en 36.5°C • Mantener el ambiente térmico neutro • Evitar la hipotermia | A México. Secretaria de Salud, 200918 D Perlman et al., 201023 |
| E | Se ha observado que la administración de oxígeno al 21%, comparado con 100%, durante la reanimación en recién nacidos pretérmino produce: • Disminución de la mortalidad (RR 0.32, IC 95% 0.12 a 0.84) El uso de una FiO2 al 100% durante la reanimación: • Disminuye el flujo sanguíneo cerebral en un 20% a las 2 h de vida • Disminuye el gradiente alvéolo/arterial • No se han demostrado beneficios con el uso a esta concentración | I Saugstad et al., 200824 I Sweet et al., 201019 |
| R | Los recién nacidos prematuros se encuentran en mayor riesgo de daño por reperfusión y los mecanismos que protegen del daño oxidativo, no están completamente desarrollados, por lo que durante la reanimación neonatal se usará la menor concentración de oxígeno que sea suficiente para mantener una frecuencia cardiaca mayor de 100 latidos por minuto Se debe iniciar la reanimación con un oxímetro de pulso preductal y mezclador de oxígeno para permitir variaciones en la cantidad de fracción inspirada de oxígeno (FiO2) Este equipo es especialmente importante en los recién nacidos pretérmino menores de 32 semanas de gestación Con el uso de oximetría de pulso como guía en los <32 semanas de gestación, la mayoría de los pacientes pueden ser estabilizados con una concentración inicial de FiO2 de 30% Los incrementos en la FiO2 se pueden realizar en un 10%, cada 60 a 90 segundos si persiste la FC <100 latidos por minuto, y así mismo disminuir la FiO2 un 10% sin la saturación es mayor de 85% | D Perlman et al., 201023 A México. Secretaria de Salud, 200918 A Sweet et al., 201019 D Perlman et al., 201023 |
| R | Se usará CPAP nasal temprana en los recién nacidos con peso <1,500 g que inicien con manifestaciones de dificultad respiratoria y que tengan factores de riesgo para desarrollar SDR Considere utilizar CPAP si el bebé está respirando espontáneamente, tiene una frecuencia cardiaca >100 latidos por minuto, pero tiene dificultad respiratoria, está cianótico o tienen una baja saturación de oxígeno. Durante la reanimación la CPAP puede ser administrada en la cara del bebé, con una pieza en T o una bolsa inflada por flujo, ajustando con la válvula de control el flujo o utilizando una válvula de presión positiva al final de la espiración (PEEP) en la pieza en T. Generalmente una presión de 4 a 6 cmH2O es adecuada Si la CPAP va a ser utilizada por un periodo prolongado, es más fácil instalar puntas nasales. (Manual de Reanimación Neonatal 6.ª ed, 2011) | A México. Secretaria de Salud, 200918 D Perlman et al., 201023 |
| E | La oximetría de pulso provee información de la frecuencia cardiaca y la saturación de oxígeno durante la reanimación | I México. Secretaria de Salud, 200918 |
| R | Se utilizará la oximetría de pulso para mantener la saturación arterial de oxígeno adecuada durante la reanimación del recién nacido prematuro con la finalidad de evitar eventos de hiperoxemia | A México. Secretaria de Salud, 200918 |
| E | En el recién nacido prematuro con dificultad respiratoria que no responde al manejo con CPAP nasal y además requiere la administración de surfactante exógeno debe intubarse al menos hasta lograr su estabilización | I Ministerios de Salud de la República de Chile, 200621 |
| R | Se realizará intubación traqueal al recién nacido prematuro que presente: • Dificultad respiratoria progresiva a pesar del uso de CPAP • Quien no logre mantener saturación arterial oxígeno preductal de >85% • Aquellos pacientes que requieren administración de surfactante • Si el bebé es intubado, utilice PEEP, generalmente 5 cmH2O (Manual de Reanimación Neonatal, 6.ª ed, 2011) | I Ministerios de Salud de la República de Chile, 200621 I Sweet et al., 201019 |
| E | La asistencia mecánica a la ventilación al inicio debe ser: • Lo más moderada posible • Con tiempos inspiratorios cortos porque disminuyen el riesgo de fuga de aire y de mortalidad • Los tiempos inspiratorios largos (>0.45 s) se asocian con: • Mayor incidencia de fuga de aire (RR 1.56, IC 95% 1.25-1.94) • Mayor riesgo de mortalidad (RR 1.26, IC 95% 1.00- 1.59) | I México. Secretaria de Salud. 200918 |
| R | La asistencia mecánica a la ventilación se iniciará con tiempos inspiratorios cortos entre 0.30 y 0.40 segundos | A México. Secretaria de Salud. 200918 |
Tratamientos para el manejo de SDR
| a. Uso de surfactante | ||
|---|---|---|
| E R | E:evidencia R: recomendación | Nivel de evidencia Grado de recomendación Fuente |
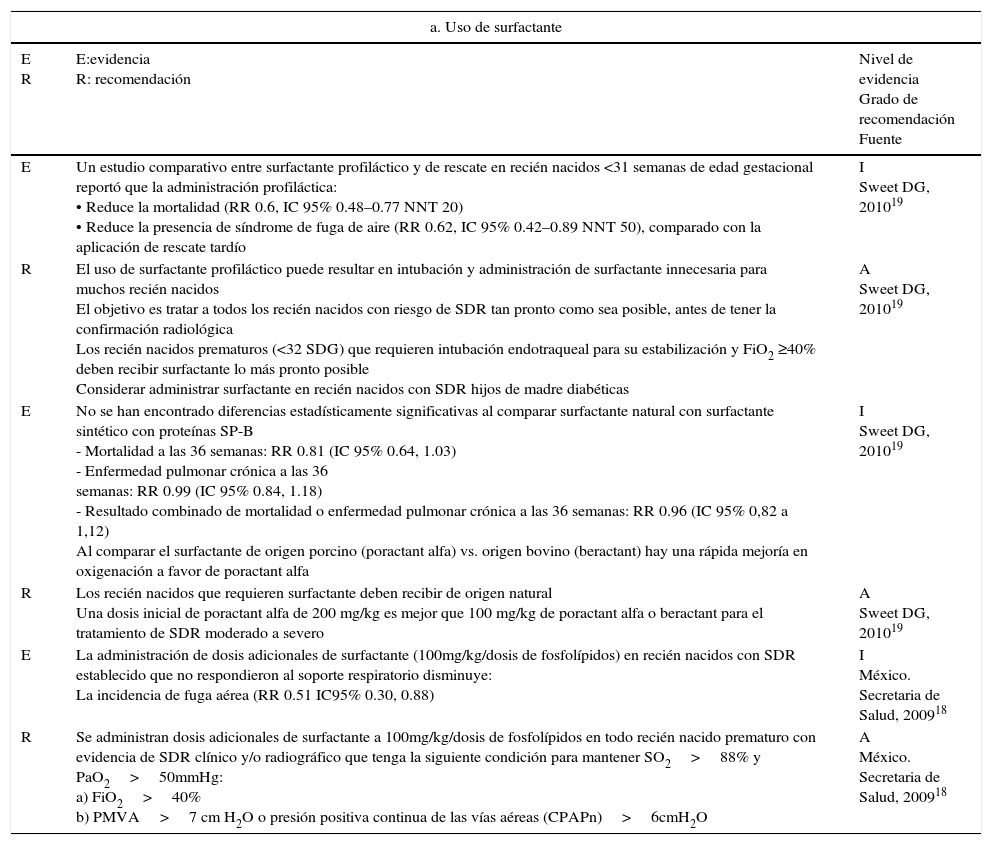
| E | Un estudio comparativo entre surfactante profiláctico y de rescate en recién nacidos <31 semanas de edad gestacional reportó que la administración profiláctica: • Reduce la mortalidad (RR 0.6, IC 95% 0.48–0.77 NNT 20) • Reduce la presencia de síndrome de fuga de aire (RR 0.62, IC 95% 0.42–0.89 NNT 50), comparado con la aplicación de rescate tardío | I Sweet DG, 201019 |
| R | El uso de surfactante profiláctico puede resultar en intubación y administración de surfactante innecesaria para muchos recién nacidos El objetivo es tratar a todos los recién nacidos con riesgo de SDR tan pronto como sea posible, antes de tener la confirmación radiológica Los recién nacidos prematuros (<32 SDG) que requieren intubación endotraqueal para su estabilización y FiO2 ≥40% deben recibir surfactante lo más pronto posible Considerar administrar surfactante en recién nacidos con SDR hijos de madre diabéticas | A Sweet DG, 201019 |
| E | No se han encontrado diferencias estadísticamente significativas al comparar surfactante natural con surfactante sintético con proteínas SP-B - Mortalidad a las 36 semanas: RR 0.81 (IC 95% 0.64, 1.03) - Enfermedad pulmonar crónica a las 36 semanas: RR 0.99 (IC 95% 0.84, 1.18) - Resultado combinado de mortalidad o enfermedad pulmonar crónica a las 36 semanas: RR 0.96 (IC 95% 0,82 a 1,12) Al comparar el surfactante de origen porcino (poractant alfa) vs. origen bovino (beractant) hay una rápida mejoría en oxigenación a favor de poractant alfa | I Sweet DG, 201019 |
| R | Los recién nacidos que requieren surfactante deben recibir de origen natural Una dosis inicial de poractant alfa de 200 mg/kg es mejor que 100 mg/kg de poractant alfa o beractant para el tratamiento de SDR moderado a severo | A Sweet DG, 201019 |
| E | La administración de dosis adicionales de surfactante (100mg/kg/dosis de fosfolípidos) en recién nacidos con SDR establecido que no respondieron al soporte respiratorio disminuye: La incidencia de fuga aérea (RR 0.51 IC95% 0.30, 0.88) | I México. Secretaria de Salud, 200918 |
| R | Se administran dosis adicionales de surfactante a 100mg/kg/dosis de fosfolípidos en todo recién nacido prematuro con evidencia de SDR clínico y/o radiográfico que tenga la siguiente condición para mantener SO2>88% y PaO2>50mmHg: a) FiO2>40% b) PMVA>7 cm H2O o presión positiva continua de las vías aéreas (CPAPn)>6cmH2O | A México. Secretaria de Salud, 200918 |
| b. CPAP temprano y ventilación mecánica | ||
|---|---|---|
| E R | E:evidencia R: recomendación | Nivel de evidencia Grado de recomendación Fuente |
| E | En pacientes con signos y síntomas de SDR, la administración temprana de surfactante, con una breve ventilación mecánica (<1 hora) seguido de extubación a presión positiva continua ya sea CPAP nasal o VPPIN (ventilación con presión positiva intermitente nasal) versus surfactante selectivo tardío, disminuye: - Necesidad de asistencia respiratoria mecánica RR 0.67 (IC 95% 0.57,0.79) - DBP RR 0.51 (IC 95% 0.26,0.99) En el grupo de pacientes que recibieron surfactante temprano, el número de dosis por paciente fue mayor vs. surfactante tardío: - Dosis de surfactante DM 0.57 dosis/paciente (IC 95% 0.44, 0.69) Al estratificar a los pacientes por menor umbral de FiO2 para recibir surfactante (FiO2 <45%), resultó en un menor índice de: - Fuga aérea RR 0.46 (IC 95% 0.23,0.93) - DBP RR 0.43 (IC 95% 0.20, 0.92) En los pacientes con un umbral mayor (FiO2<45%) tuvieron una mayor incidencia de PCA que requirió tratamiento - PCA RR 2.15 (IC 95% 1.09, 4.13) | I Stevens et al., 200725 |
| R | Se recomienda la extubación rápida tras una breve asistencia mecánica a la ventilación y pasar a presión positiva continua nasal (CPAP o VPPIN) tras la administración de surfactante de rescate temprano o precoz Utilizar un umbral bajo (FiO2<45%) confiere una mayor protección para fuga aérea y DBP, así como una menor incidencia de PCA que requiera tratamiento | A Stevens et al., 200725 |
| E | Durante la extubación el uso de presión positiva nasal continua en las vía aéreas (CPAP nasal) en recién nacidos prematuros vs. cámara cefálica reduce: - Necesidad de soporte ventilatorio adicional RR 0.62 (IC 95% 0.49, 0.77), reducción del riesgo -0.17 (-0.24, -0.10), NNT 6 | I Davis y Henderson-Smart, 200326 |
| R | Se recomienda extubar a CPAP nasal o ventilación con presión positiva nasal en recién nacidos prematuros con adecuado esfuerzo respiratorio y así evitar falla a extubación | A Davis y Henderson-Smart, 200326 |
| E | La presión positiva continua de las vías aéreas (CPAPn) utilizada de forma inicial para estabilización del paciente en riesgo de SDR con administración de surfactante profiláctico vs. surfactante selectivo, incrementa el riesgo de EPC (uso de oxígeno a las 36 SDG corregidas): - RR 1.12 (IC 95% 1.02, 1.24) | I Rojas-Reyes et al., 20128 |
| R | Iniciar con presión continua de las vías aéreas en todo recién nacido con dificultad respiratoria para su estabilización y administración de surfactante selectivo al desarrollar SDR | A Rojas-Reyes et al., 20128 |
| E | Los recién nacidos prematuros que requieran maniobras de reanimación neonatal avanzadas sin respuesta deben ser tratados con asistencia mecánica a la ventilación ya que reduce: - Mortalidad: RR 0.67, IC del 95% (0.52, 0.87) | I México. Secretaria de Salud, 200918 |
| R | Utilizar asistencia mecánica a la ventilación en los recién nacidos prematuros que recibieron maniobras de reanimación avanzadas | A México. Secretaria de Salud, 200918 |
| E | Al comparar ventilación sincronizada versus ventilación mecánica convencional se observa que disminuye: - Duración de ventilación (h) DM -34,8 h; (IC del 95% -62,1 a -7,4) Al comparar ventilación con volumen objetivo versus limitada por presión, se observa que disminuye: - Duración de la asistencia respiratoria (días) (DM -2.36 (IC 95% -3.9, -0.8) - Neumotórax RR 0.46 (IC 95% 0.25, 0.84), NNT 17 - Descenlace combinado de muerte y DBP RR 0.73 (IC 95% 0.57, 0.93) NNT 8 | I Greenough et al., 200827 I Wheeler et al., 201028 |
| R | Se recomienda durante la asistencia mecánica a la ventilación utilizar: Ventilación desencadenada por el paciente (sincronizada) y de volumen objetivo. Iniciar con un volumen corriente de 4-5 mL/kg y realizar ajustes de acuerdo a niveles de PaCO2. Los pacientes con SDR que requirieron ventilación mecánica deben ser extubados lo más pronto posible a CPAP nasal o ventilación no invasiva mientras tengan gases sanguíneos adecuados y presión media de la vía aérea de 6 a 7 cmH2O | A Greenough et al., 200727 A Wheeler et al. 201028 A Sweet et al., 201319 |
| E | No existe evidencia actual de que la ventilación de alta frecuencia electiva mejore la evolución de los recién nacidos prematuros con SDR | I Ministerios de Salud de la República de Chile, 200621 |
| R | No se recomienda el uso electivo de ventilación de alta frecuencia en recién nacidos con SDR | A Ministerios de Salud de la República de Chile, 200621 |
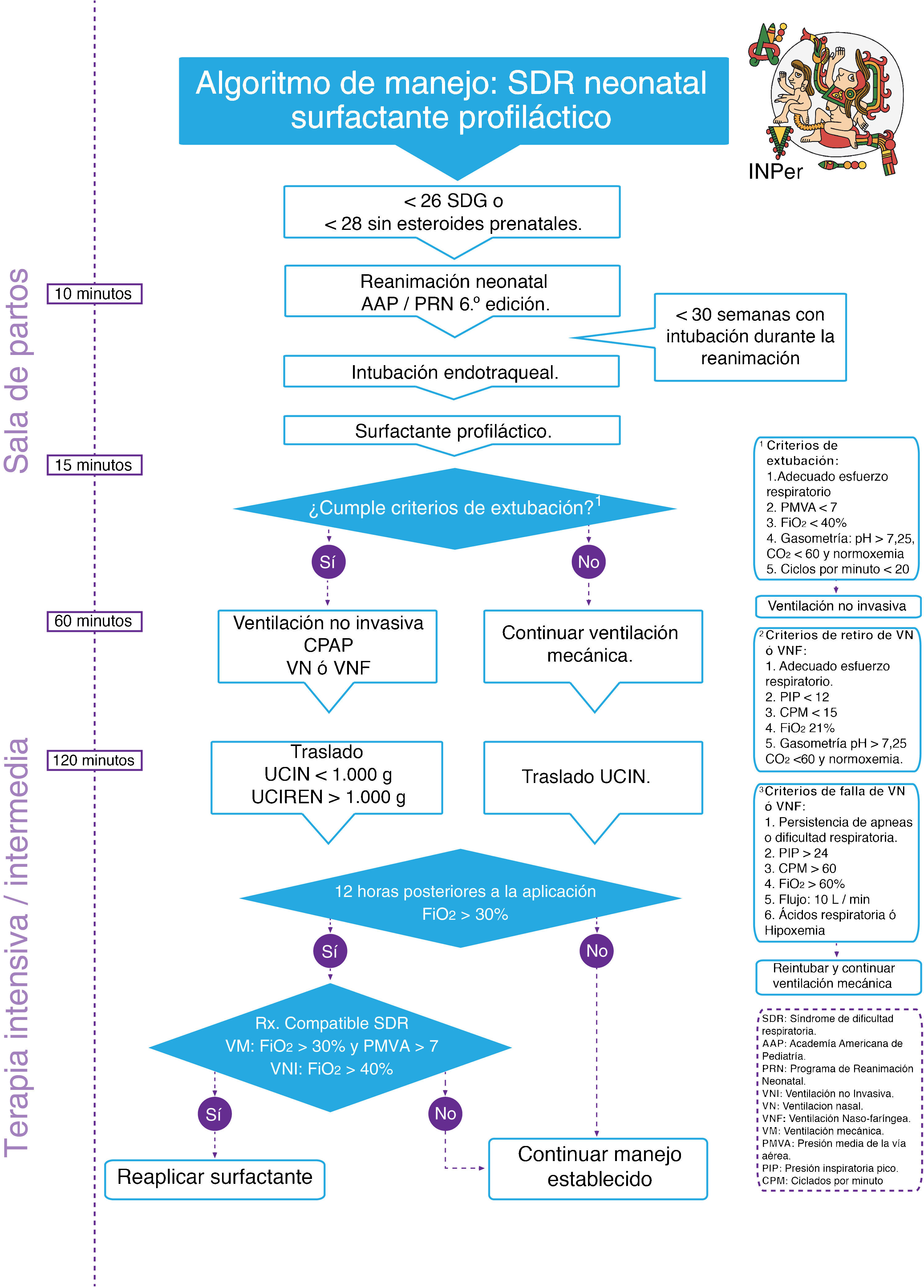
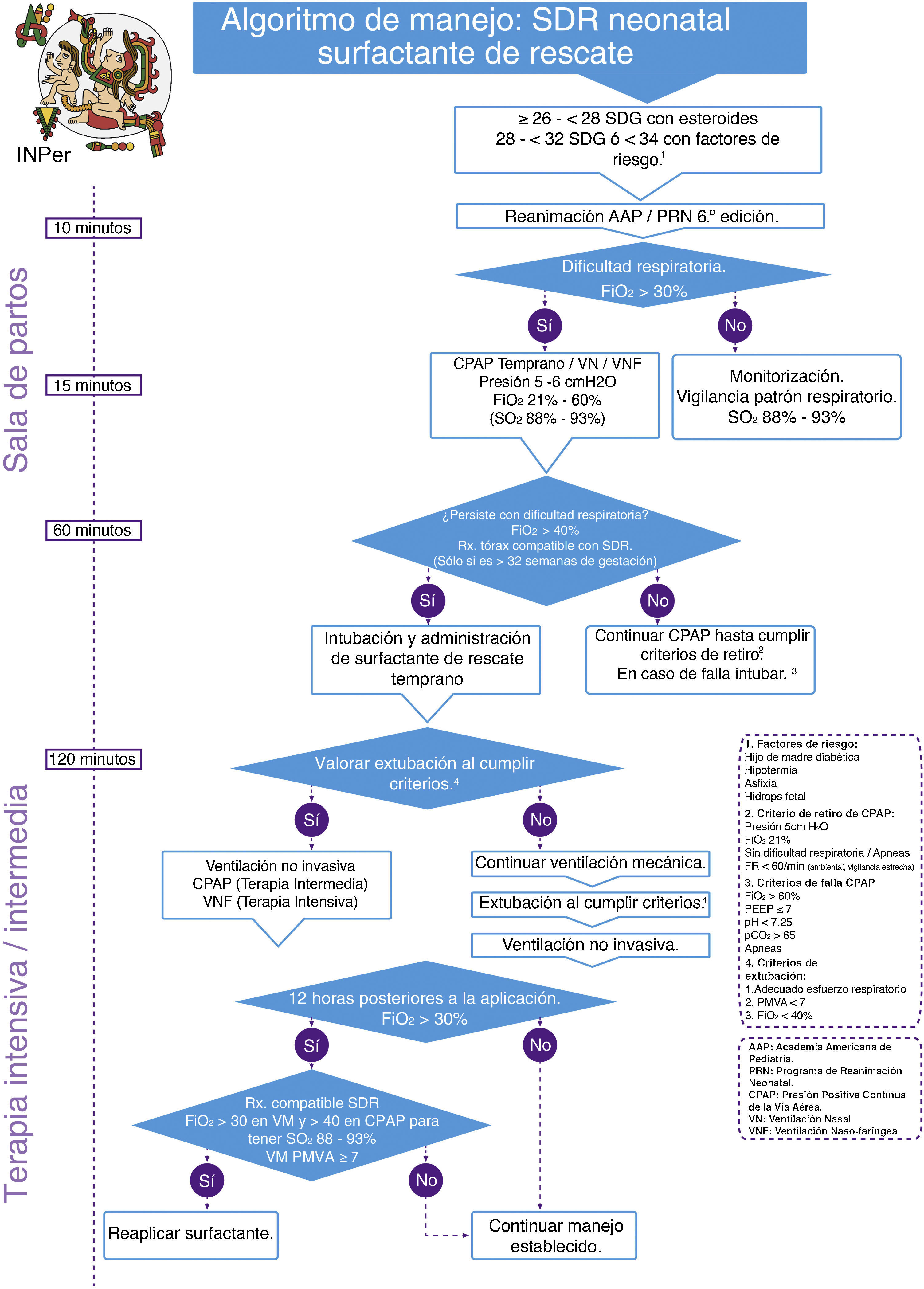
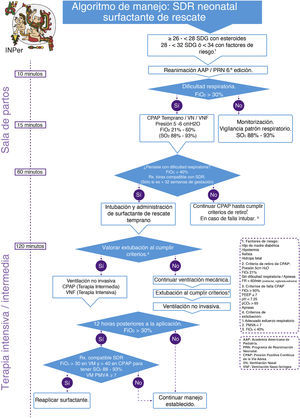
Se realizó una adopción de guías de práctica clínicas internacionales, con el análisis de la evidencia y recomendaciones de las guías seleccionadas para finalmente integrar algoritmos clínicos de atención, en el contexto de México, clasificando los esquemas de administración en: 1) surfactante profiláctico y 2) surfactante de rescate (figs. 1 y 2).
ConclusionesLa sistematización del uso de ventilación no invasiva y surfactante pulmonar exógeno en los recién nacidos pretérmino con SDR optimiza las indicaciones y utilización de estos recursos, así mismo reduce la necesidad de emplear la ventilación mecánica.
Los pacientes prematuros pueden ser tratados con CPAP nasal en la sala de partos, tan pronto como se identifiquen datos de dificultad respiratoria, con el uso de surfactante en forma selectiva y temprana (<2 h de vida), lo que permite una rápida extubación a CPAP nasal, lo cual a su vez disminuye la necesidad subsecuente de ventilación mecánica, siendo un procedimiento eficaz y seguro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.