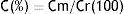Reportar la utilidad de un método simplificado con extracción directa de la leche materna y detección por cromatografía líquida de alta resolución en fase inversa, para la cuantificación de retinol y α-tocoferol.
Material y métodosSe empleó un diseño experimental 23 con las variables de temperatura, tipo de solvente y efecto antioxidante, en 2 niveles. Posterior a la extracción de la leche materna, las muestras se saponificaron con hidróxido de potasio-metanol, se extrajeron con éter de petróleo y se secaron y reconstituyeron con etanol. Para establecer las condiciones del sistema cromatográfico se utilizaron columnas microbondapack con detector UV/visible: fase móvil metanol-agua (96:4 v/v), longitud de onda 325 para retinol y 290nm para α-tocoferol.
ResultadosLos parámetros analíticos fueron linealidad: r2=0.9955 (retinol), r2=0.9808 (α-tocoferol); límites de detección y de cuantificación: 1.1 y 2.7μg/dL (retinol), 0.9 y 2.3μg/dL (α-tocoferol); precisión del método: desviación estándar relativa 4.5% intradía y 4.8% entre días (retinol) y 4.9% intradía y 4.1% entre días (α-tocoferol); exactitud: recuperación=85.8±7.8% para retinol y 98±1.9% para el α-tocoferol. El método permitió cuantificar la concentración de retinol y α-tocoferol eficientemente. Una vez validado el método, se aplicó para la cuantificación de retinol y α-tocoferol en 100 muestras de leche materna. Los valores fueron para retinol 63.9±5.2 y para α-tocoferol 359±115μg/dL.
ConclusiónEl método fue selectivo, lineal, preciso, sensible y exacto, características que junto con su sencillez hacen de él un método conveniente para la determinación de retinol y α-tocoferol simultáneamente en leche materna.
To present the results obtained in the development of a simplified method, with a direct extraction of breast milk and detection by reverse phase high-performance liquid chromatography of retinol and α-tocopherol.
Materials and methodsAn experimental 2x3 factorial design was used, with temperature variables, type of solvent and antioxidant effect, at 2 levels. Subsequent to the extraction, the samples were saponified with potassium hydroxide in methanol, then extracted with petroleum ether, and dried and reconstituted with ethanol. The chromatography conditions were established using microbondapak columns with UV/visible detector: methanol/water (96:4) mobile phase, wavelength for retinol 325, and 290nm for α-tocopherol.
ResultsThe analytics parameters were: linearity; r2=0.9955 (retinol), r2=0.9808 (α-tocopherol); detection and quantification limits: 1.1μg/dL and 2.7μg/dL (retinol), 0.9μg/dL and 2.3μg/dL (α-tocopherol). Method accuracy: the within-day relative standard deviation was 4.5%, and a between-day relative standard deviation of 4.8% for retinol, and 4.9% within-day and 4.1% between-day forα-tocopherol. For accuracy, recovery=85.8±7.8% for retinol and 98±1.9% for α-tocopherol. Once validated, the method was applied to the quantification of retinol and α-tocopherol in 100 samples of breast milk. The values obtained were 63.9±5.2μg/dL for retinol and 359.0±115.0μg/dL for α-tocopherol.
ConclusionThe method is selective, linear, precise, sensitive and accurate. These characteristics together with their simplicity make the validated method convenient for the determination of retinol and α-tocopherol in breast milk.
La leche materna se ha recomendado como la principal fuente de alimentos para el recién nacido y el lactante durante al menos los primeros 6 meses de vida, por su calidad y economía. Su elección se basa en el aporte de nutrientes y, de forma especial, en proporcionar al lactante diversos compuestos de acción benéfica que mejoran su crecimiento y le protegen frente a enfermedades propias de la etapa neonatal y del lactante1.
Las vitaminas presentes en la leche materna cubren todas las necesidades del recién nacido y lactante, pero su cantidad es variable y este hecho depende del estado nutricional materno y el aporte de vitaminas que pueda haber recibo la madre durante el embarazo. Es decir, que existe una estrecha relación entre la alimentación y los depósitos de la madre y la concentración de vitaminas en la leche2, sin embargo su cuantificación se ha reportado de forma selectiva, por ejemplo, con la determinación de vitamina A en leche materna utilizando el método cromatografía líquida de alta resolución (HPLC) en etapas de la lactancia y estratos socioeconómicos variables3.
En la actualidad la técnica de análisis de elección y la más reportada para la cuantificación de vitaminas es la cromatográfica gaseosa y líquida, principalmente esta última, utilizando la modalidad de fase normal con columnas de sílica, como en fase inversa, con columnas tradicionales C-18 o con columnas monolíticas4. En 1997 Spencer y Purdy5 separaron las vitaminas D2, D3 y E utilizando metanol-agua (90:10) como fase móvil adicionada de betaciclodextrina y una columna C-18. Ceugni et al.6 utilizaron la misma fase estacionaria para la separación y determinación de vitamina A y E utilizando como fase móvil una mezcla de metanol-agua (99:1), Quian y Sheng7 separaron acetato de retinol, vitamina D3, E y provitamina D2, utilizando una longitud de onda de 290nm para su detección. Albalá-Hurtado et al.8 reportaron la separación de vitamina A-trans-retinol y vitamina E-α-tocoferol sobre una columna C-18 utilizando como fase móvil agua-acetonitrilo-metanol (4:1:95).
Por lo cual hay que considerar que los métodos previos de extracción y medición involucraban largos y tediosos pasos9, con la utilización de costosos equipos como es el caso del cromatógrafo de gases-masas10, también involucraba derivatizaciones y en algunas circunstancias el uso de estándares internos marcados con deuterio, los cuales por lo general no están disponibles comercialmente y actualmente no son la opción para su análisis11.
La determinación de vitamina A y E en fórmulas infantiles por HPLC en fase inversa fue publicada por primera vez por Rodas et al.12. Otros investigadores reportaron el empleo de duodecil sulfato de sodio en la cromatografía capilar electrocinética para el análisis de vitaminas oleosolubles13 y la cromatografía líquida micelar14. En el caso de la determinación de vitaminas en muestras como leche materna, son necesarios procedimientos de extracción, saponificación y preconcentración previos a la cuantificación, pues las vitaminas se encuentran asociadas a lipoproteínas, membranas celulares u otras estructuras, así como en bajas concentraciones y se degradan con la luz, oxígeno y temperaturas elevadas, lo cual aparentemente dificulta su análisis12.
Por otra parte, para determinar si una población presenta deficiencia de vitamina A y E es necesario el uso de instrumentos, equipo, reactivos y de recursos humanos capacitados para realizar este trabajo. Los métodos más comúnmente empleados para la determinación de vitaminas liposolubles en la leche son la cromatografía de papel, en capa fina, de gases, métodos colorimétricos y espectrofotométrico de inactivación con radiación ultravioleta15, pero es indudable que la HPLC es la técnica cromatográfica más adecuada, específica y rápida, para el análisis de vitaminas liposolubles, es la herramienta que ha otorgado un aporte muy importante para la determinación de estos compuestos en muestras biológicas. En el caso de la espectrometría tiende al desuso debido a que sobreestima las concentraciones de retinol. En la actualidad existe una franca tendencia al empleo exclusivo de la HPLC para las evaluaciones de vitaminas en muestras biológicas. En las reuniones internacionales de expertos, como el grupo Internacional Consultor para la deficiencia de vitamina A, abiertamente recomienda que los estudios deban ser realizados por este método para poder ser aceptados por la comunidad científica16.
Además la ventaja que ofrece la HPLC se manifiesta en que es posible separar los derivados de cada vitamina de las sustancias interferentes. Tiene aplicación tanto la cromatografía en fase reversa como en fase normal. La mayoría de los extractos se suelen evaporar y redisolver para incrementar la concentración de las vitaminas antes de realizar su inyección al sistema HPLC. Por lo cual el propósito del estudio fue reportar los resultados obtenidos en la validación de un método simplificado con una extracción directa de la leche materna y detección por HPLC en fase inversa, utilizando un detector ultravioleta/visible, para la cuantificación simultánea de retinol y α-tocoferol.
MétodosEquipoSe contó con una bomba binaria HPLC modelo Flexar (Perkin-Elmer, EE. UU.) con inyector Flexar (loop size de 100μL), un detector ultravioleta/visible (modelo Flexar) y 3 columnas microbondapak rp-18 Scavenger C-18 de 5μm y 33x4.6mm marca Perkin-Elmer y acrodiscos CR 13mm Syringe Filter con 0.2μm PTFE.
ReactivosMetanol y etanol grado HPLC marca OmniSolv (México), all-trans-retinol con una pureza del 99%+ (tlc) de 100mg marca Acros (EE. UU.), all-trans-retinil acetato de 1g marca Acros (EE. UU.), D-alpha-tocopherol 99% (gc) de 100mg marca Acros, éter de petróleo, marca productos químicos de Monterrey (México), e hidróxido de potasio, marca J.T. Baker (México). Todos los otros reactivos fueron de la mayor pureza disponible, se utilizó agua ultrapura proveniente de un equipo Milli-Q academic (Millopore).
Adecuación del sistema cromatográficoPara la estandarización de la metodología analítica se realizaron diferentes ensayos con la finalidad de obtener las mejores condiciones cromatográficas para la determinación de las vitaminas objeto del estudio. Se contemplaron principalmente aspectos relacionados con la influencia de la longitud de onda de la detección, el tipo de columna, la composición y flujo de la fase móvil. Para la selección de la longitud de onda se realizaron los espectros de absorción de las vitaminas en una mezcla de metanol y agua (96:4 v/v), una de las mezclas ensayadas en la selección de la fase móvil, y para ello, se tomó el espectro ultravioleta-visible de cada vitamina, realizando un barrido en la región de 190 a 780nm. Durante el proceso de selección de la fase móvil se estudiaron, de acuerdo con la literatura científica17, diferentes mezclas de metanol-agua y flujos de 0.5, 0.7, 0.9, 1.0, 1.3, 1.5 y 1.7mL/min.
Determinación de las figuras analíticas de mérito para cromatografía líquida de alta resoluciónSe determinaron las figuras de mérito, tales como precisión (expresada como repetitividad y reproducibilidad), nivel mínimo de detección y de cuantificación, rango dinámico lineal, sensibilidad, según lo recomendado por la Conferencia Internacional sobre Armonización de Requerimientos Técnicos para Registro de Fármacos para uso Humano18.
Exactitud del métodoSe evaluó como el porcentaje de recuperación de las vitaminas analizadas. Se realizó un diseño experimental factorial 23 con las variables de temperatura, tipo de solvente y efecto antioxidante, en 2 niveles lo cual permitió seleccionar las condiciones en la etapa de preparación de la muestra, para obtener la recuperación más alta de las vitaminas.
MuestrasPara la validación del ensayo se utilizaron muestras de leche materna madura que provenían de mujeres sanas con edades comprendidas de 18 y los 40 años de edad durante su primer mes posparto. Una vez validado el método se aplicó para la cuantificación de vitamina A y E en leche donada por 100 mujeres sanas, no fumadoras que acudían al banco de leche del Instituto Nacional de Perinatología, para la extracción de leche materna con el fin de alimentar a su hijo que se encontraba ingresado en la unidad médica. Con la colaboración del personal técnico del banco de leche se seleccionaron al azar las mujeres donantes de acuerdo a su disponibilidad y características, estas eran informadas sobre el interés y el propósito del estudio y, en su caso, daban su consentimiento para participar en él. La recogida de muestras de leche materna se llevó a cabo con la aprobación del Comité de Investigación y Ética del Instituto. Las muestras se obtuvieron por extracción manual de un seno, vaciándolo por completo. La leche se colocó en tubos Falcón obscuros con una capacidad de 15mL, se trasladó en la obscuridad y a temperatura de 2-4°C, para ser inmediatamente conservada a −70°C y protegida de la luz y oxígeno hasta su procesamiento. La recolección de las muestras de leche materna se realizó entre las 8 y 10h de la mañana, recogidas bajo condiciones estandarizadas con el fin de eliminar al máximo las fuentes de variabilidad entre ellas. Las mujeres no tuvieron ninguna restricción dietética, ni se encontraban con complementos vitamínicos.
Los parámetros a estudiar se seleccionaron en función de las características y de los objetivos del método analítico utilizado y el rango de concentraciones en que se encuentra cada vitamina. La metodología aplicada al análisis de cada uno de los parámetros fue la descrita por la European Medicines Agency19.
Preparación de las muestrasPara aislar las vitaminas presentes en las muestras de leche, se contemplaron 2 métodos: 1.- Extracción directa del material lipídico y 2.- Saponificación de la matriz con posterior extracción de los analitos de interés.
Saponificación y extracciónLos ésteres de retinil fueron hidrolizados a retinol por medio de un proceso de saponificación. A un volumen de 15mL de leche materna se le mezcló con 24mL de hidróxido de potasio en solución de metanol al 16% (peso/volumen). Se calentó la mezcla alcalina a 75°C por 30min y posteriormente se enfrió durante 5min; para la extracción de las vitaminas, se le adicionaron 16mL de éter de petróleo en un embudo de separación mezclando y dejando reposar por 30min; la fase acuosa fue drenada y desechada en 3 ocasiones. La disolución etérea se lavó con agua desionizada para eliminar el exceso alcalino, que se determinó con papel pH (pH 7). Se recuperó el solvente en tubos Falcón de 50mL para ser evaporado en un baño maría a 70°C; el residuo fue disuelto con 2mL de etanol. La disolución se filtró utilizando acrodiscos CR 13mm Syringe Filter con 0.2μm PTFE membrana, y de esta solución se utilizó un volumen de inyección para el cromatógrafo de 50μL, con un tiempo de corrida de 10min. Para el blanco de reactivos se realizó el proceso de saponificación y de extracción en ausencia de leche materna. Todas las muestras fueron procesadas por duplicado y cada replicado se inyectó 2 veces.
Preparación del estándarSe preparó una solución madre de all-trans-retinol con una pureza del 99%, disolviendo 0.1g de retinol en 100mL con etanol, para obtener una solución con una concentración final de 1μg/μL. De igual manera se disolvió 0.1g de retinil-acetato en 100mL de etanol para obtener la misma concentración de 1mg/mL. Así como también se disolvió 0.1g de α-tocoferol en 100mL de etanol, para obtener una solución con una concentración de 1mg/mL. Para verificar la concentración real del retinol y del α-tocoferol debido a la degradación que sufren estas vitaminas durante su almacenamiento, se tomó de la solución madre 25μL del retinol y 25μL de α-tocoferol y se aforaron cada una por separado con 10mL de etanol. Las concentraciones stock de las vitaminas se calcularon basadas en la ley de Lambert y Beer utilizando el coeficiente de extinción del retinol que es 1,835 a una longitud de onda de 325nm y el de α-tocoferol que es 75.8 a una longitud de onda de 290nm para corregir la pureza de las vitaminas.
Curva de calibraciónEn 5 matraces aforados de 10mL se transfirió 8, 12, 16, 20, y 24μL de la solución de retinol con una concentración de 1mg/mL, 16μL de la solución de retinil-acetato con una concentración de 1mg/mL. La concentración final obtenida para el retinol fue de 80, 120, 160, 200 y 240μg/dL; en el caso del α-tocoferol se transfirió 30, 60, 90, 120 y 150μL de la solución de α-tocoferol con una concentración de 1mg/mL. Todos los matraces se aforaron a 10mL con etanol, la concentración final obtenida para α-tocoferol fue de 300, 600, 900, 1200 y 1500μg/dL. Se inyectaron 50μL de cada una de las concentraciones.
El retinil-acetato se utilizó como estándar interno y todas las concentraciones empleadas se basaron en los valores reportados de acuerdo a la literatura científica3,20.
Las curvas de calibración fueron lineales con ordenada al origen; estas curvas se utilizaron para el cálculo de la concentración de cada una de las vitaminas analizadas en las muestras de leche materna, y los cálculos se realizaron con las alturas de cada uno de los picos.
Recuperación de retinol y α-tocoferol en las muestrasEn el análisis de cada parámetro se calculó la concentración de la recuperación de retinol y α-tocoferol expresada en porcentaje, según la fórmula siguiente:
Donde: Cm: Valor promedio de la concentración de retinol y α-tocoferol según corresponda en microgramos por decilitro.Cr: Valor promedio de la concentración teórica de retinol y α-tocoferol, según corresponda en microgramos por decilitro.Controles de calidadCon el objeto de validar las mediciones realizadas se corrieron junto con las muestras 3 controles de calidad preparados a 3 diferentes concentraciones: baja, media y alta, tanto para retinol como para α-tocoferol.
Análisis estadísticoLa adquisición de los datos cromatográficos se realizó con el programa Total Chrom Navigator versión 6.3.2. Los valores se expresan en valor medio±desviación estándar. Para la evaluación estadística de los resultados se aplicó el test de ANOVA con el programa SPSS versión 21 para Windows. Las diferencias estadísticas se consideraron con una probabilidad del 95% (p<0.05).
Consideraciones éticasEl estudio fue aprobado por el Comité de Ética e Investigación Institucionales, y se le solicitó a cada una de las participantes su consentimiento informado y firmado.
ResultadosValidación de la metodología analíticaCon respecto a los diferentes ensayos realizados, se establecieron para la validación las siguientes condiciones cromatográficas de la determinación simultánea de retinol y α-tocoferol en leche materna.
El tiempo de corrida por muestra fue de 10min. De acuerdo con los espectros obtenidos, se seleccionó 290nm como longitud de onda para la detección cromatográfica de α-tocoferol y 325nm para la determinación de retinol.
SelectividadSe refirió a la propiedad del método de producir una señal medible debida solo a la presencia del analito, libre de interferencias de otros componentes, en la matriz de la muestra. La selectividad del método para las 2 vitaminas con la fase móvil óptima metanol y agua (96:4 v/v), se indicó en el cromatograma que se obtuvo con una mezcla de ellas, donde se observó que la resolución fue adecuada. El estudio se realizó con concentraciones aproximadas de 10 y 50μg/dL de retinol y de α-tocoferol respectivamente.
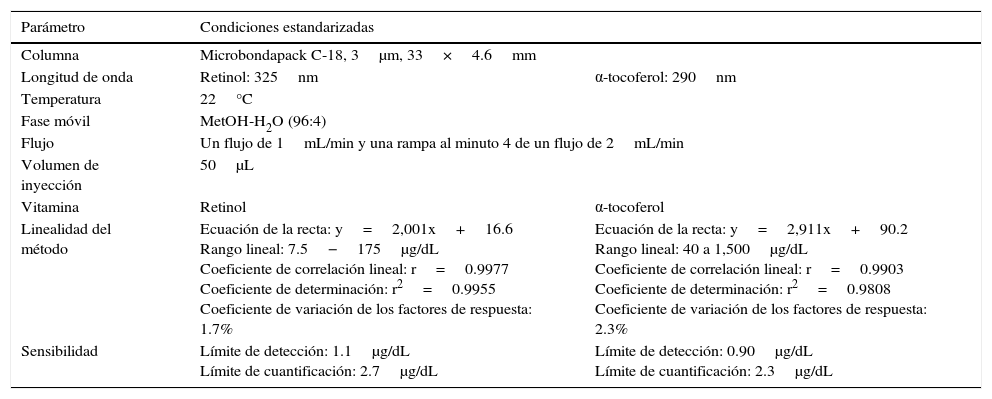
LinealidadLa respuesta lineal se demostró en el rango de 7.5-175μg/dL (n=18) para retinol y 40- 1,500μg/dL para α-tocoferol (n=18). Se determinó: r (coeficiente de correlación lineal), r2 (coeficiente de determinación), a (intercepto) y b (pendiente), para el 95% de confianza. Se obtuvo un valor de r2 de 0.9955, con una ecuación de la recta y=2,001x+16.6 y un coeficiente de variación del 1.7% para retinol. En el caso del α-tocoferol un valor de r2 de 0.9808, con una ecuación de la recta y=2,911x+90.2 y un coeficiente de variación del 2.3%. La prueba de proporcionalidad del método analítico o hipótesis nula de la ordenada en el origen fue a=0, y para la prueba de la hipótesis nula de la pendiente, b=0, se determinó a partir de una prueba de ANOVA de la regresión, teniendo en cuenta la probabilidad asociada al valor de la pendiente, es decir, si la p<0.05, el valor de «b» difirió significativamente de cero. Además la DER de la pendiente fue del 1.7% para retinol y del 2.3% para α-tocoferol (ver tabla 1).
Resultados de la validación del método para la determinación de retinol y α-tocoferol en leche materna
| Parámetro | Condiciones estandarizadas | |
|---|---|---|
| Columna | Microbondapack C-18, 3μm, 33×4.6mm | |
| Longitud de onda | Retinol: 325nm | α-tocoferol: 290nm |
| Temperatura | 22°C | |
| Fase móvil | MetOH-H2O (96:4) | |
| Flujo | Un flujo de 1mL/min y una rampa al minuto 4 de un flujo de 2mL/min | |
| Volumen de inyección | 50μL | |
| Vitamina | Retinol | α-tocoferol |
| Linealidad del método | Ecuación de la recta: y=2,001x+16.6 Rango lineal: 7.5−175μg/dL Coeficiente de correlación lineal: r=0.9977 Coeficiente de determinación: r2=0.9955 Coeficiente de variación de los factores de respuesta: 1.7% | Ecuación de la recta: y=2,911x+90.2 Rango lineal: 40 a 1,500μg/dL Coeficiente de correlación lineal: r=0.9903 Coeficiente de determinación: r2=0.9808 Coeficiente de variación de los factores de respuesta: 2.3% |
| Sensibilidad | Límite de detección: 1.1μg/dL Límite de cuantificación: 2.7μg/dL | Límite de detección: 0.90μg/dL Límite de cuantificación: 2.3μg/dL |
Los límites de detección y de cuantificación fueron realizados con base en la desviación estándar de la respuesta del blanco y a la pendiente de la curva de linealidad, obteniéndose valores de para el límite de detección de 1.1μg/dL y de 2.7μg/dL para el límite de cuantificación en el caso del retinol; para α-tocoferol el límite de detección fue de 0.9μg/dL y de 2.3μg/dL para el LC (ver el tabla 1).
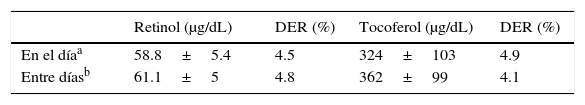
ExactitudPara evaluar la exactitud del método se determinó el nivel basal de cada una de las vitaminas en una muestra proveniente de una mujer sana (n=6), luego se realizó la adición de retinol y α-tocoferol en cantidades correspondientes al 50, 100 y 125% de la concentración basal. Las muestras de cada concentración se procesaron por triplicado. El porcentaje de recuperación promedio para retinol fue de 85.8±7.8 (n=9) y para α-tocoferol de 98±1.9 (n=9).
PrecisiónEste parámetro se estableció mediante los ensayos de repetibilidad y reproducibilidad. Se evaluó la precisión como la DER intradía y entre días. Para ello se realizaron 5 determinaciones de una muestra durante 3 días consecutivos. Cada día se trabajó con una alícuota distinta de la misma muestra mantenida a −70°C y al abrigo de la luz. Para el ensayo en el día (n=5) se obtuvo una DER del 4.5% y para el ensayo entre días (n=15) una DER de 4.8% para retinol; en el caso de los valores de la precisión de α-tocoferol para el ensayo en el día se obtuvo una DER del 4.9% y para el ensayo entre días (n=15) una DER del 4.1% (ver tabla 2).
Aplicación del método para la cuantificación de retinol y α-tocoferol en un grupo de mujeres mexicanas: En la tabla 3 se presentan los resultados correspondientes a las 100 muestras analizadas. La concentración media de retinol en leche materna fue de 63.9μg/dL y de α-tocoferol de 359μg/dL.
Estabilidad de retinol y α-tocoferol en las muestras: Se determinó la estabilidad de retinol y α-tocoferol y los resultados mostraron que solo fue posible someter las muestras de leche materna a 3 ciclos de descongelación.
DiscusiónEn la selección de la fase móvil y utilizando diferentes combinaciones de esta desde el punto de vista tanto cualitativo como cuantitativo, diferentes flujos, columnas y temperatura, se obtuvieron resultados variables con cada una de ellas. Los resultados se analizaron principalmente desde 3 puntos de vista, selectividad, simetría de las señales y tiempo de corrida. En algunos casos la separación o resolución de las señales debidas a las vitaminas no fueron las adecuadas, en otros los tiempos de corrida para la separación fueron demasiado altos. Se optimizó la resolución de la separación cromatográfica trabajando con las muestras de leche materna como lo establece la European Medicines Agency19.
Considerando los resultados, se pudo ratificar que el método estudiado resultó lineal en el rango de concentraciones determinado, pues el coeficiente de correlación lineal y el coeficiente de determinación fueron iguales a 0.9955 y 0.9808 respectivamente, de acuerdo a lo establecido por la Association of Official Analytical Chemist y por la European Medicines Agency18,19.
Con respecto a los resultados obtenidos para la exactitud y precisión del método analítico, estos responden a las tolerancias recomendadas para este tipo de muestras, y para estas concentraciones de los analitos de acuerdo a lo establecido por la Association of Official Analytical Chemist y por la European Medicines Agency18,19.
En los resultados de nuestra investigación se observa que el método fue suficientemente selectivo y sensible para determinar la concentración de retinol y α-tocoferol en leche materna en forma simultánea. No se registraron interferencias en el rango de interés analítico de ambas vitaminas, los resultados fueron muy similares a lo reportado por Chatzimichalakis et al., Qian et al., Taibi y Nicotra4,7,21.
La validación de la cuantificación de retinol y α-tocoferol en leche materna fue un proceso que conllevó etapas previas: la extracción de los analitos; luego de estas etapas la metodología de análisis fue validada tomando en cuenta los criterios analíticos de precisión, exactitud, linealidad, límite de cuantificación, rango, selectividad, robustez y estabilidad de muestras en solución. Todo este procedimiento se llevó a cabo con el fin de contar con un método confiable y preciso para el análisis de retinol y α-tocoferol en leche materna de acuerdo a la metodología que es aplicada al análisis de cada uno de los parámetros y que es descrita por la European Medicines Agency19.
El método analítico propuesto cumple con el parámetro de límites de detección y cuantificación, pues permite detectar y cuantificar concentraciones muy bajas de retinol y α-tocoferol en leche materna. Como resultado del análisis de la linealidad del método, este parámetro cumplió con los criterios de aceptación establecidos, y hubo una relación lineal entre las concentraciones de las vitaminas estudiadas y las áreas obtenidas para cada una, de acuerdo a la European Medicines Agency19. El sistema cromatográfico empleado es adecuado para la determinación de estas vitaminas, pues las variables analizadas en el parámetro de adecuabilidad cumplieron con los límites establecidos, ya que se obtuvieron picos finos, bien definidos y con buena resolución entre ellos.
Además la revisión de la literatura permitió observar que la detección espectrofotométrica al ultravioleta es aún utilizada, aunque también se ha reportado el empleo de otros sistemas como detección fluorométrica22 y amperométrica21. Brisaert y Plaizir-Vercanmen23 emplearon la densitometría con cromatografía en capa delgada sobre placas C-18 de alta resolución para el análisis de tetrinoína en lociones, pero con un sinnúmero de inconvenientes para la determinación de vitaminas liposolubles en muestras biológicas como es la leche materna.
La determinación de vitamina A y E en productos pediátricos por HPLC en fase inversa fue reportada por Rodas et al., en 200312. Otros investigadores reportaron para el análisis de vitaminas oleosolubles el empleo de duodecil sulfato de sodio en cromatografía capilar electrocinética24 y cromatografía líquida micelar14, pero por lo general, con una mayor sensibilidad, mayor facilidad para la eliminación de contaminantes y mayor estabilidad en caso de la utilización de la cromatografía líquida de alta resolución en fase de reversa.
El método tiene la capacidad de cuantificar los analitos sin ser necesaria una derivación de estos y puede utilizar diferentes detectores en función de sus requerimientos. Las 2 técnicas más importantes de HPLC son la cromatografía en fase normal y en fase reversa25. La cromatografía líquida de alta resolución en fase reversa presenta una serie de ventajas con relación a la de la fase normal como son la menor sensibilidad a los cambios de los tiempos de retención debido a la presencia de agua, mayor facilidad para eliminar posibles contaminantes, mayor estabilidad ante pequeños cambios de la fase móvil, se equilibra más rápidamente cuando se producen cambios de la fase móvil facilitando la utilización de gradientes, y mayor capacidad de determinar compuestos con un amplio rango de polaridades, como se demostró en la validación de este método para la determinación simultanea de retinol y α-tocoferol en leche materna25.
ConclusiónEl método validado permitió cuantificar en forma eficiente el retinol y α-tocoferol en muestras de leche materna. La metodología implementada para el análisis simultáneo de retinol y α-tocoferol por la técnica analítica de HPLC cumple con los requerimientos establecidos por las buenas prácticas de laboratorio y los parámetros analíticos de linealidad, límite de detección y de cuantificación, exactitud, especificidad, sensibilidad, reproducibilidad, rapidez y precisión del método para el ensayo en el día y para el ensayo entre días.
FinanciaciónFinanciado por el Instituto Nacional de Perinatología Isidro Espinosa de los Reyes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.