El ambiente hospitalario representa un riesgo para la diseminación de múltiples microorganismos, con la posibilidad del desarrollo de infecciones nosocomiales. Las superficies pueden contribuir a la contaminación cruzada por medio de las manos de los profesionales de la salud y de los instrumentos o productos que podrían ser contaminados o entrar en contacto con esas superficies.
ObjetivoEvaluar la efectividad del hipoclorito de sodio al 6% versus la solución sanitizante bromo-cloro-dimetil-hidantoína para eliminar los agentes patógenos presentes en las superficies de distintos ambientes hospitalarios.
Materiales y métodosSe diseñó un estudio prospectivo, transversal, analítico y comparativo para evaluar la efectividad de la limpieza de superficies en áreas hospitalarias con hipoclorito de sodio al 6% a diferentes diluciones.
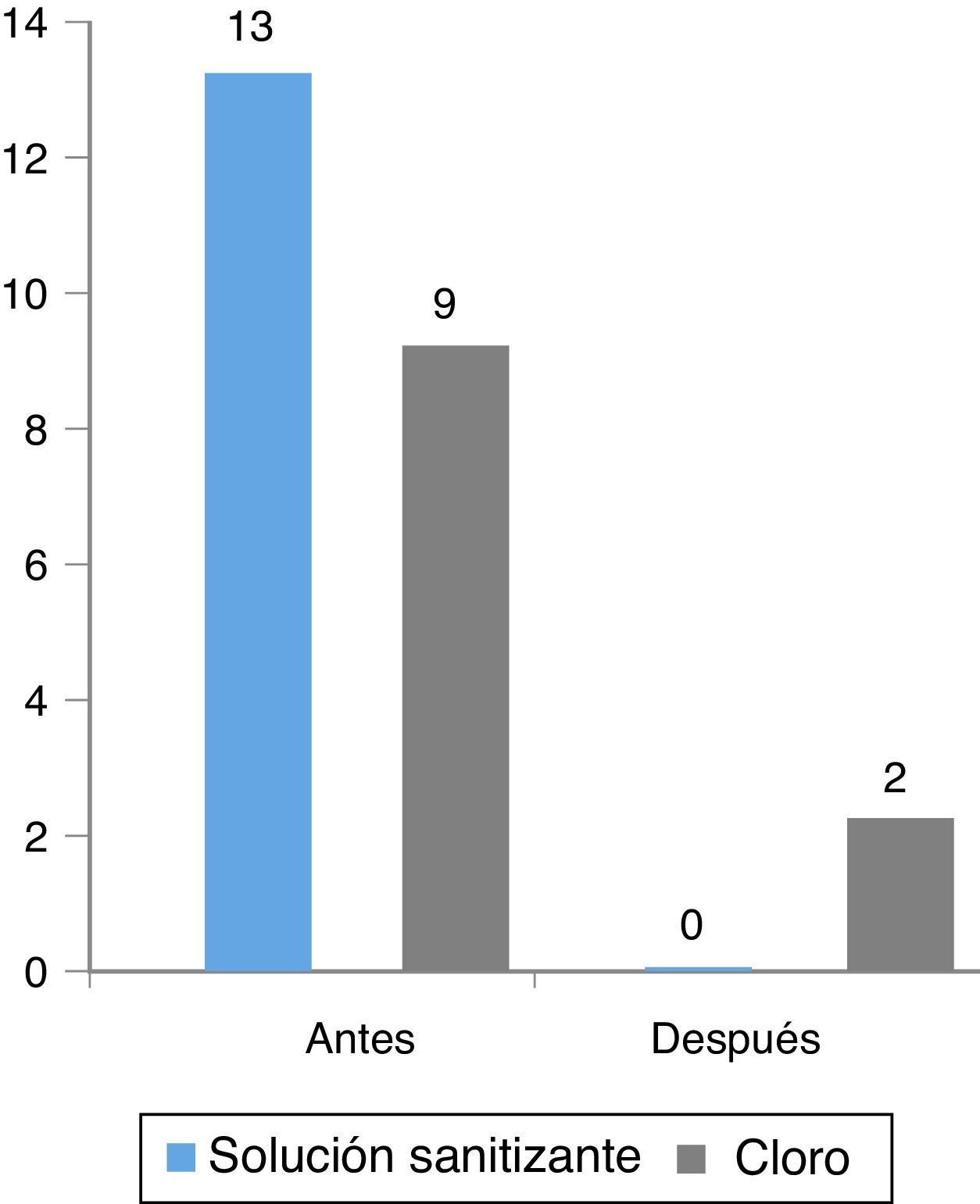
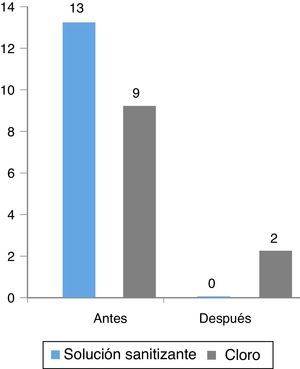
ResultadosSe muestrearon en total 21 superficies de diferentes áreas. En las superficies desinfectadas con la solución sanitizante bromo-cloro-dimetil-hidantoína e hipoclorito de sodio diversos microorganismos crecieron en 13/21 y 9/21 superficies respectivamente antes del proceso de desinfección. Después de aplicarse el desinfectante el crecimiento de microorganismos fue en 0/21 y 2/21 respectivamente (p=NS).
ConclusionesLos 2 agentes desinfectantes de superficies fueron efectivos, sin encontrarse diferencias entre ellos en su efectividad desinfectante.
There is a risk of spreading multiple microorganisms in the hospital environment, with the possibility of the development nosocomial infections. The surfaces can contribute to cross-contamination through the hands of health professionals and the instruments that could be contaminated when they come into contact with those surfaces.
ObjectiveTo evaluate the effectiveness of 6% sodium hypochlorite versus a disinfectant solution of bromine-chloro-dimethyl-hydantoin to eliminate pathogens on the surfaces of different hospital environments.
Materials and methodsA prospective, cross-sectional, analytical, and comparative study was designed to evaluate the effectiveness of the cleaning of surfaces in hospital areas with 6% sodium hypochlorite at various dilutions.
ResultsSamples were taken from a total of 21 surfaces of different areas. In the surfaces disinfected with the solution bromine-chloro-dimethyl-hydantoin, and sodium hypochlorite, several microorganisms grew in 13/21, and 9/21, respectively, before the disinfection process. After application of disinfectants, the microorganisms grew in 0/21, and 2/21 surfaces, respectively, which was non-significant.
ConclusionsThe two surface disinfectants were effective, and there were no differences between their disinfecting effectiveness.
Actualmente, el ambiente hospitalario es foco de especial atención en relación con el riesgo que representa como un área de diseminación de microorganismos (MO) diversos. Los hospitales pueden actuar como reservorios de patógenos potencialmente causantes de infecciones relacionadas con la asistencia en salud (IAAS), incluidas bacterias multirresistentes1. El mantenimiento de las superficies limpias y desinfectadas consigue reducir hasta en un 99% el número de MO existentes, mientras que en las superficies que solo fueron limpiadas la reducción de los MO existentes solo es del 80%2.
Las superficies tienen un riesgo mínimo de trasmisión directa de infecciones, pero pueden contribuir a la contaminación cruzada secundaria por medio de las manos de los profesionales de la salud y de los instrumentos o productos que podrían ser contaminados o entrar en contacto con esas superficies y, posteriormente, contaminar a equipos y pacientes3.
Entre los factores que favorecen la contaminación de los ambientes y las áreas hospitalarias se encuentran:
- ∘
Las manos de los profesionales de salud en contacto con las superficies.
- ∘
La ausencia de la utilización de técnicas básicas de asepsia por los profesionales de la salud.
- ∘
Mantenimiento de superficies húmedas o mojadas.
- ∘
Mantenimiento de superficies polvorientas.
- ∘
Condiciones precarias de revestimientos.
- ∘
Mantenimiento de la materia orgánica.
Con anterioridad se ha evaluado la necesidad de seleccionar los materiales desinfectantes más adecuados para destinarlos a procesos de desinfección del equipo biomédico y el medio ambiente hospitalario. Asimismo, se ha documentado la infección de pacientes, después de efectuar en el hospital procesos inadecuados de desinfección2. Los desinfectantes son sustancias químicas capaces de destruir gérmenes patógenos; sin embargo, dada su alta toxicidad solo se aplican a superficies inanimadas. Si consideramos que un número creciente de formulaciones químicas de esterilizantes y desinfectantes están disponibles en el comercio, y que han proliferado distintas técnicas de uso, debemos concluir que cada institución debe aplicar una política clara en los procesos de desinfección del ambiente hospitalario que incluya la selección de los desinfectantes más adecuados y el uso de los mismos de manera apropiada. Por lo tanto, el objetivo de este estudio fue evaluar la efectividad del hipoclorito de sodio al 6% a una dilución de 200 y 5,000 partes por 1,000 para la eliminación de agentes patógenos en superficies de distintos ambientes hospitalarios, comparado con la solución sanitizante bromo-cloro-dimetil-hidantoína bajo condiciones habituales de uso.
Materiales y métodosSe diseñó un estudio prospectivo, transversal, analítico y comparativo para evaluar la efectividad de la limpieza de superficies en áreas hospitalarias, de acuerdo a la clasificación de Spaulding de áreas críticas, semicríticas y no críticas con hipoclorito de sodio al 6% a diferentes diluciones. De la misma manera se comparó la efectividad de la solución sanitizante bromo-cloro-dimetil-hidantoína bajo condiciones habituales de uso en el procedimiento de limpieza.
Las áreas de intervención se definieron de la siguiente manera:
- 1.
Áreas críticas. Los quirófanos de la unidad tocoquirúrgica, quirófanos del área de medicina materno fetal, la unidad de toco-cirugía, la central de equipos y esterilización, la unidad de cuidados intensivos neonatales, la unidad de cuidados intermedios del recién nacido y la unidad de cuidados intensivos de adultos.
- 2.
Áreas semicríticas. La unidad de terapia intermedia de adultos, la unidad de urología ginecológica, el banco de leche y el servicio urgencias.
- 3.
Áreas no críticas. Áreas en las cuales no hay contacto directo con los pacientes, como área administrativa, de investigación o consulta externa.
- 4.
Las concentraciones de la solución sanitizante bromo-cloro-dimetil-hidantoína se utilizó de acuerdo a las concentraciones estipuladas en la ficha técnica del producto establecida por el fabricante4.
Criterios de inclusión:
- •
Todas las áreas del Instituto Nacional de Perinatología de México consideradas para desinfección de alto nivel: se incluyen áreas críticas y semicríticas.
- •
Que se cuente con toma de cultivos previos y posteriores a la desinfección efectuada a base de hipoclorito de sodio al 6% y solución sanitizante bromo-cloro-dimetil-hidantoína, para el análisis microbiológico cualitativo y cuantitativo.
Criterios de exclusión:
- •
Áreas en las que no se requiere efectuar desinfección de alto nivel, como consulta externa, hospitalización, administrativas y de investigación.
Criterios de eliminación:
- •
Toma inapropiada de cultivos ambientales, de acuerdo a lo estipulado en este protocolo.
- •
Muestras en las cuales falte alguno de los cultivos, el previo o el posterior a la desinfección de alto nivel.
Para evaluar la efectividad de la intervención bajo condiciones habituales de uso, se efectuaron muestreos de superficies seleccionadas en áreas hospitalarias con técnica de hisopado. Una primera muestra se obtuvo antes de efectuar la desinfección de alto nivel con la dilución apropiada de hipoclorito de sodio al 6%, o solución sanitizante bromo-cloro-dimetil-hidantoína, al terminar la desinfección se realizó un nuevo muestreo de las superficies predeterminadas. La toma de muestras fue efectuada por personal del laboratorio de microbiología del Instituto Nacional de Perinatología y se tuvo la participación del Laboratorio de Análisis Ambiental de la empresa AMPLIBIO para efectuar la determinación cuantitativa de las unidades formadoras de colonias (UFC) bacterianas en superficies sólidas e inertes.
Procedimiento para la toma de la muestra por método del hisopoLa técnica de toma de muestra consistió en frotar con un hisopo previamente humedecido en una solución diluyente el área determinada con un hisopo de algodón de 12cm. Con el hisopo inclinado en ángulo de 30° se frotó 4 veces la superficie delimitada por la plantilla de 10×10cm, cada una en dirección opuesta a la anterior. Una vez obtenida la muestra el hisopo se depositó en un tubo de ensayo con tapa hermética con 10ml de solución diluyente estéril.
Las muestras recolectadas se colocaban en un contenedor isotérmico, con gel refrigerante, para asegurar que la temperatura no excediera los 10°C hasta llegar al laboratorio de microbiología.
Procesamiento de la muestraCada muestra se inoculó en 3 cajas de Petri con los medios: 1) Agar de papa-dextrosa para el crecimiento de hongos y levaduras; 2) MacConkey, medio selectivo para crecimiento de bacterias gram negativas y fermentadores de lactosa; y 3) sangre de carnero, medio de enriquecimiento para una gran variedad de bacterias. El crecimiento se verificó a las 24 y 72horas, realizando una o 2 resiembras de las cajas en las que se observó un crecimiento de colonias.
La función del laboratorio fue determinar de forma cualitativa la ausencia de agentes patógenos posdesinfección con solución de hipoclorito de sodio al 6%. El laboratorio de análisis ambiental se encargó de efectuar la cuantificación de UFC bacterianas.
Método de la aplicación y uso de solución sanitizante bromo-cloro-dimetil-hidantoínaSe diluyó una parte de solución sanitizante en 3 partes proporcionales de agua, y se aplicó a través de un aspersor o directamente con una franela sobre techos, paredes y pisos, con una espera de 15minutos hasta secar4.
De acuerdo a la normativa vigente, para determinar la actividad microbiana se llevó a cabo el método basado en la determinación del porcentaje de reducción de un número de UFC del microorganismo evaluado, cuando se pone en contacto con un agente germicida, en este caso el hipoclorito de sodio al 6%, bajo condiciones habituales de uso. En el anexo 1 se describe el procedimiento completo de la toma de muestras en las áreas y superficies donde se evaluó la efectividad de las soluciones desinfectantes5–8.
En el anexo 2 se describe el procedimiento completo del análisis microbiológico ambiental, con las técnicas efectuadas por el laboratorio ambientalista.
ResultadosSe muestrearon en total 21 superficies de diferentes áreas, que comprendieron urgencias, unidad tocoquirúrgica, unidad de cuidados intermedios del recién nacido, unidad de cuidados intensivos neonatales, unidad de cuidados intensivos del adulto, quirófanos, área de medicina materno fetal y área de uroginecología.
Del total de las áreas sometidas a desinfección con los 2 agentes antisépticos los resultados fueron los siguientes: en las superficies desinfectadas con solución sanitizante e hipoclorito de sodio diversos microorganismos crecieron en 13/21 y 9/21 superficies respectivamente antes del proceso de desinfección. Después de aplicarse el desinfectante el crecimiento de microorganismos fue en 0/21 y 2/21 respectivamente (fig. 1).
No hubo diferencia estadística en el número de superficies con crecimiento bacteriano entre los 2 desinfectantes (prueba de Chi cuadrado; p=0.4). Posterior a la aplicación de los desinfectantes se redujo notablemente el número de superficies con crecimiento bacteriano; no obstante, tampoco existió diferencia significativa entre los 2 tipos de desinfectantes (prueba exacta de Fisher; p=0.15).
Cuando se analizaron los desinfectantes de manera independiente se encontró que en el caso del complejo sanitizante bromo-cloro-dimetil-hidantoína después de la aplicación del producto no se encontró crecimiento de ningún microorganismo, y con hipoclorito de sodio solo 2 superficies tuvieron crecimiento posterior a la limpieza. En todos los casos hubo una reducción significativa del número de colonias bacterianas encontradas. Hubo una eliminación del 100% de las bacterias cultivadas antes de la limpieza con la solución sanitizante, esta reducción fue del 77% con hipoclorito de sodio (prueba exacta de Fisher p=0.24).
La lista de microorganismos que se lograron cultivar en las diferentes superficies con los 2 desinfectantes se presentan en las tablas 1 y 2, en las cuales se observa que predominaron gérmenes saprofitos, aunque también se recuperaron agentes potencialmente patógenos como Pseudomonas sp. y Staphylococcus sp.
Microorganismos recuperados entre el antes y después del proceso de desinfección con solución sanitizante bromo-cloro-dimetil-hidantoína
| Desinfectante | Antes | Después |
|---|---|---|
| Solución sanitizante bromo-cloro-dimetil-hidantoína | SCN, Bacillus sp., Escherichia vulneris | Negativo |
| Staphylococcus haemolyticus | Negativo | |
| Micrococcus luteus | Negativo | |
| Pseudomonas aeruginosa | Negativo | |
| Kokuria kristinae | Negativo | |
| Achromobacter denitrificans | Negativo | |
| Pantoea sp. | Negativo | |
| Hongos filamentosos | Negativo |
SCN: Staphylococcus coagulasa negativa.
Microorganismos recuperados entre el antes y después del proceso de desinfección con cloro
| Desinfectante | Antes | Después |
|---|---|---|
| Solución de cloro | Proteus vulgaris, Bacillus sp. | Negativo |
| Bacillus sp, SCN | Bacillus sp., SCN | |
| Bacillus sp. | Negativo | |
| Bacillus sp. | Negativo | |
| SCN, Bacillus sp. | SCN, Bacillus sp. | |
| SCN, Staphylococcus epidermidis | Negativo |
SCN: Staphylococcus coagulasa negativa.
El medio ambiente hospitalario inanimado contaminado se considera como un factor de riesgo en la transmisión de infecciones; los centros para el control de enfermedades de Atlanta, Georgia, establecen que la transmisión de infecciones a través del contacto directo con las superficies o sustancias del cuerpo, e indirecto por objetos inanimados, es una de las principales vías de transmisión de MO con potencial patógeno9. La clasificación de las distintas áreas y ambientes de acuerdo al grado de desinfección es fundamental como estrategia en el control de IAAS. Las áreas se clasifican en:
- •
Áreas críticas o de alto riesgo de infección: se consideran áreas críticas aquellas donde se realizan procedimientos invasivos, donde los pacientes por su condición están más expuestos a contraer una infección, y donde se realiza el lavado del material contaminado. El procedimiento requerido es la limpieza de alto nivel. En estas áreas no se barre; el procedimiento básico de limpieza para las paredes es el lavado. Para los pisos el método utilizado es el barrido húmedo. La limpieza concurrente (aseo rutinario) se realiza por lo menos una vez al día, utilizando agua y jabón. En las áreas críticas, donde se presentan derrames de fluidos corporales (sangre, materia fecal, pus, orina, líquido amniótico) se realiza limpieza y desinfección de alto nivel entre un procedimiento y el siguiente, y cada vez que sea necesario. En un medio hospitalario se catalogan como áreas críticas: los quirófanos, las salas de parto, el área de urgencias, la central de esterilización, las unidades de diálisis, las áreas de preparación de soluciones parenterales y terapia intensiva.
- •
Áreas semicríticas: laboratorios, radiología, morgue, servicios de hospitalización, oncología y servicios de alimentos.
- •
Áreas no críticas: áreas donde se encuentra personal administrativo y docente.
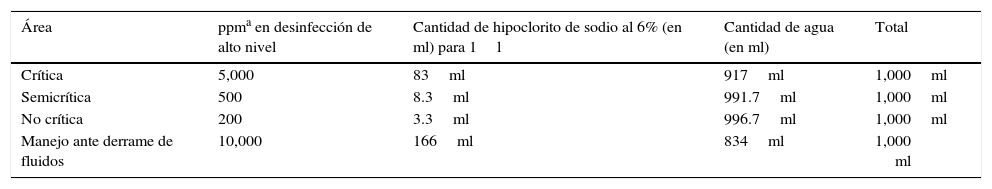
En nuestro medio el uso de soluciones a base de cloro al 6% es una alternativa útil para efectuar la limpieza en las distintas áreas de un hospital. Las soluciones cloradas son bactericidas de elevada potencia. Son activas frente a bacterias gram positivas y gram negativas, virus, esporas y Mycobacterium tuberculosis, aunque su actividad frente a otras micobacterias es variable. En combinación con peróxido de hidrogeno ha mostrado mayor actividad bactericida contra cepas de Pseudomonas aeruginosa10. Las soluciones o pastillas son estables durante 3 años, son muy irritantes para la piel y las mucosas. El agua corriente (de pH normalmente ácido) activa los clorados, generando una concentración importante de ácido hipocloroso y llevando la solución a un pH de 8, punto máximo de la actividad desinfectante de este clorado. La materia orgánica reduce la actividad de los clorados, y tampoco deben prepararse soluciones con agua caliente, debido a que se forma trihalometano. Las soluciones concentradas de hipoclorito de sodio tienen un pH alcalino cercano a 12 que favorece su conservación, pero son inactivas como desinfectantes; además es muy corrosivo y las salpicaduras pueden producir quemaduras y lesiones oculares, por lo que se requiere tomar todas las precauciones necesarias cuando se manejen estas soluciones. No se debe almacenar diluido en sitios húmedos o envases sin protección de la luz3. La dilución a la que se utiliza el cloro para efectuar procedimientos de limpieza y desinfección varía de acuerdo a la categorización por áreas y tipo de procedimientos que en ellas se realizan, como se muestra en la tabla 3.
Dilución de cloro de acuerdo al tipo de desinfección en distintas áreas
| Área | ppma en desinfección de alto nivel | Cantidad de hipoclorito de sodio al 6% (en ml) para 1l | Cantidad de agua (en ml) | Total |
|---|---|---|---|---|
| Crítica | 5,000 | 83ml | 917ml | 1,000ml |
| Semicrítica | 500 | 8.3ml | 991.7ml | 1,000ml |
| No crítica | 200 | 3.3ml | 996.7ml | 1,000ml |
| Manejo ante derrame de fluidos | 10,000 | 166ml | 834ml | 1,000 ml |
ppm: partes por 1,000.
En la realización de desinfección de alto nivel en áreas críticas como UCIA, UCIREN I, II, III y UCIN, debido a que se trata de pacientes que no se pueden movilizar debido a su gravedad, y tomando en cuenta los vapores que se desprenden del manejo de hipoclorito de sodio a 5,000ppm, se considera efectuar desinfección a 200ppm.
Evaluación antes: prueba de Chi cuadrado; p=0.21.
Evaluación después: prueba exacta de Fisher; p=0.48.
La solución sanitizante bromo-cloro-dimetil-hidantoína (GV-GERM®) es una solución desinfectante de amplio espectro, que elimina cerca del 99% de los agentes patógenos. Tiene una fórmula a base de bromo, cloro y dimetil-hidantoína, con lo que se eliminan bacterias, hongos, virus y MO esporulados. Es útil en un rango de pH de 6.0 a 9.5, manteniéndose activo en presencia de materia orgánica5.
La Norma oficial mexicana NOM-045-SSA2-2005 «para la vigilancia epidemiológica, prevención y control de las infecciones nosocomiales»11 establece la importancia de contar con un manual de procedimientos en el que se estipulen las características, frecuencia de aseo y limpieza de las distintas áreas. Con el conocimiento de los distintos modos de transmisión de los MO patógenos a partir de las superficies, se hace imperativa la necesidad de desinfección habitual en los distintos ambientes hospitalarios para evitar la propagación de IAAS. En este estudio, aunque se identificaron microorganismos comensales principalmente, también se recuperaron agentes potencialmente patógeneos como Pseudomonas, estafilococos y otros relacionados con brotes de infecciones nosocomiales12.
ConclusionesLos 2 agentes desinfectantes mostraron una reducción significativa de los microorganismos recuperados entre el antes y después del proceso de desinfección; sin embargo, cuando se compararon contra sí mismos no se encontró ninguna diferencia en su efectividad desinfectante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Transporte:
- •
Para el muestreo ambiental de superficies inertes se llevó a cabo la técnica de hisopado, en el que se utiliza un hisopo de algodón estéril y una solución de caldo de infusión de cerebro y corazón (BHI o caldo nutritivo), en el cual el hisopo se humedece antes de muestrear.
- •
Finalizado el hisopado del área muestreada el hisopo se deposita en el caldo en el que previamente se humedeció y posteriormente se cierra herméticamente.
- •
La finalidad de utilizar el caldo nutritivo es que este ayuda a mantener la viabilidad de las bacterias sin que estas mueran por el efecto residual de algún desinfectante o microbicida, para esto también se necesita mantener el caldo a una temperatura de 4°C-6°C durante el transporte; esto tiene la finalidad de bajar la actividad metabólica de las bacterias mesófilas (bacterias que crecen óptimamente de 35 a 37°C), ya que si no se mantiene esta temperatura las bacterias que se encuentran en el caldo nutritivo desde el principio del muestreo empiezan a crecer.
- •
En el caso de que se utilizara agua destilada estéril en vez de caldo nutritivo, a la temperatura de 4°C o temperatura ambiente durante el transporte, el efecto residual del desinfectante o el microbicida que se utilizó en la prueba de desinfección seguiría teniendo su efecto en el agua, por lo que no se recuperarían bacterias en el cultivo.
Preparación:
- •
El cultivo de las muestras debe ser lo más pronto posible; esto se debe a que las bacterias estando en actividad metabólica baja (a temperatura de 4°C a 8°C), llegan a multiplicarse muy lentamente, de 60 a 90minutos por célula, hablando específicamente de células mesófilas.
- •
Teniendo en cuenta que el hisopo con el que se realizó el muestreo viene en un tubo con 3ml de caldo nutritivo a una temperatura de 4-8°C, lo que se realiza es el recuento de bacterias aerobias, Escherichia coli, mohos, levaduras, Staphylococcus aureus y Salmonella sp.