En las últimas décadas se ha incrementado el número de pacientes inmunodeprimidos debido al aumento de trasplantes de órganos sólidos, de precursores hematopoyéticos utilizados en el tratamiento más intensivo del cáncer y a la epidemia del sida.
Los pacientes inmunodeprimidos pueden presentar lesiones cutáneas, resultado de infecciones fúngicas superficiales que afectan a estructuras queratinizadas, infecciones cutáneas profundas y también manifestaciones cutáneas de micosis invasivas diseminadas. Las primeras son clínicamente parecidas a las que aparecen en inmunocompetentes, por lo que nos centraremos en las 2 últimas.
Los principales grupos de inmunodeprimidos con riesgo aumentado de micosis1 son los pacientes con VIH y los trasplantados de órganos hematopoyéticos o de órganos sólidos (tabla 1). Otros grupos importantes son los siguientes:
- a)
Pacientes en unidades de críticos.
- b)
Pacientes neutropénicos.
- c)
Pacientes en tratamiento crónico con corticoides.
- d)
Pacientes con neoplasias hematológicas.
- e)
Pacientes en tratamiento con quimioterapia.
- f)
Pacientes diabéticos.
Micosis sistémicas más frecuentes y factores de riesgo en los principales grupos de inmunodeprimidos
| Micosis sistémicas más frecuentes | Factores de riesgo | |
| VIH | Criptococosis | Niveles bajos de CD4 |
| Trasplantados de órgano sólido | Aspergilosis y candidiasis | El período entre 1–6 meses postrasplante es el de mayor riesgo. La dosis de inmunosupresores son mayores |
| Trasplantados de precursores hematopoyéticos | Aspergilosis y candidiasis | Neutropenia |
| Trasplante alogénico | ||
| Corticoides en dosis altas |
VIH: virus de la inmunodeficiencia humana.
Las micosis más frecuentes en inmunodeprimidos son las producidas por Aspergillus spp. y Candida spp., aunque otros hongos están adquiriendo cada vez mayor importancia2,3. Algunos tipos o patrones de lesiones cutáneas pueden ser orientadoras hacia un determinado hongo. La clínica puede estar alterada por la inmunodepresión y las enfermedades intercurrentes.
Toma de muestrasEn un paciente en el que sospechemos una micosis profunda o invasiva debemos tomar muestra del exudado, realizar una biopsia cutánea y cultivos del exudado y del tejido. En determinados casos se pueden realizar test serológicos específicos. Los hemocultivos pueden ser de ayuda en algunas micosis diseminadas4.
Si un paciente tiene lesiones diferentes o lesiones distantes entre sí debemos tomar muestras de cada una de las lesiones, ya que pueden tener varias infecciones simultáneas. Además, una misma lesión puede estar infectada por más de un hongo4.
Técnica de la biopsia: se debe limpiar la piel con alcohol para disminuir la contaminación de bacterias y hongos. Se realizará una toma del centro de una lesión reciente. Si sospechamos infección por hongos con angiotropismo (Aspergillus, Fusarium, Mucor) la biopsia debe ser profunda. Una parte de la pieza se envía en solución salina para cultivo. El resto se tiñe con hematoxilina-eosina, ácido peryódico de Schiff (PAS) y metenamina argéntica. La tinción de Fontana-Masson es útil para identificar feohifomicetos, como Alternaria.
Cultivo: debemos enviar siempre muestra para cultivo porque permite realizar antifungigrama y confirmar el diagnóstico. En algunos casos, el cultivo puede no evidenciar microorganismos viables (zigomicosis) o puede ser muy lento (feohifomicetos)4.
Hemocultivos: pueden ser positivos en infecciones diseminadas, aunque su negatividad no debe excluir el diagnóstico. En candidiasis invasiva es positivo en un 25–35% y en fusariosis es positivo en el 41%. Es poco sensible para aspergilosis diseminada4.
Test serológico de detección de antígeno de criptococo: muy sensible, aunque las lesiones cutáneas sean la única manifestación de la enfermedad.
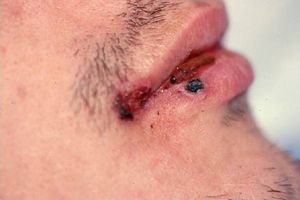
Hongos frecuentesAlternariaEl género Alternaria incluye varias especies de feohifomicetos que se encuentran en el suelo, plantas y en piel humana y de animales. Provocan infecciones que aparecen generalmente por inoculación tras la rotura de la barrera cutánea. En individuos sanos causan infecciones cutáneas o subcutáneas localizadas, y en inmunodeprimidos pueden originar, además, infecciones multiloculares y más raramente diseminadas. También se han descrito oculomicosis, rinosinusitis y onicomicosis5.
Los trasplantados de órganos sólidos y los tratados con inmunosupresores por éste u otros motivos constituyen los principales grupos de riesgo5.
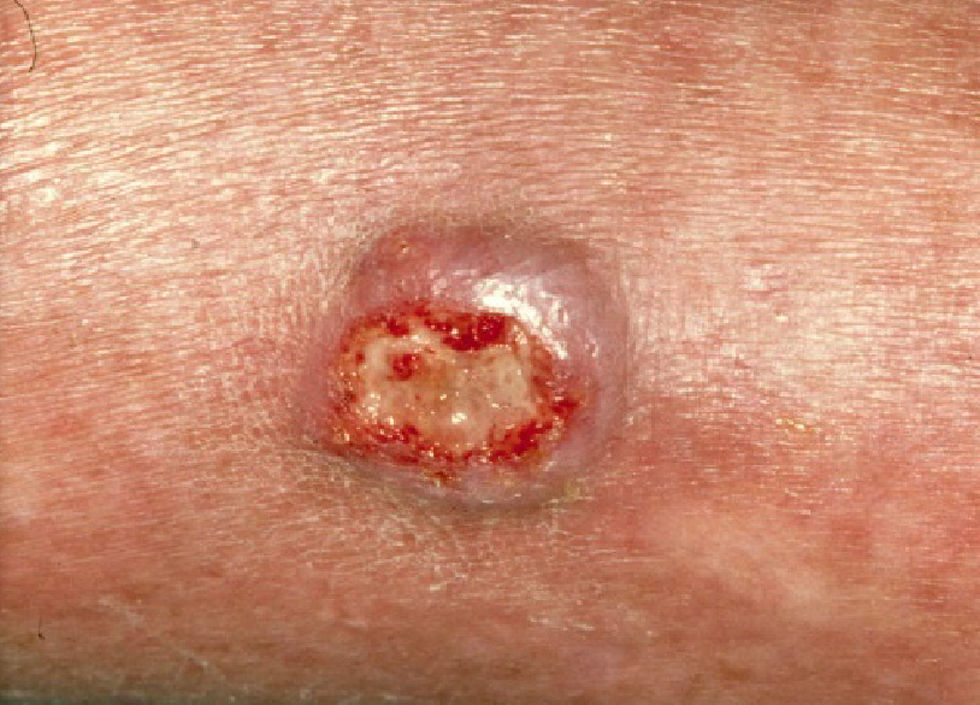
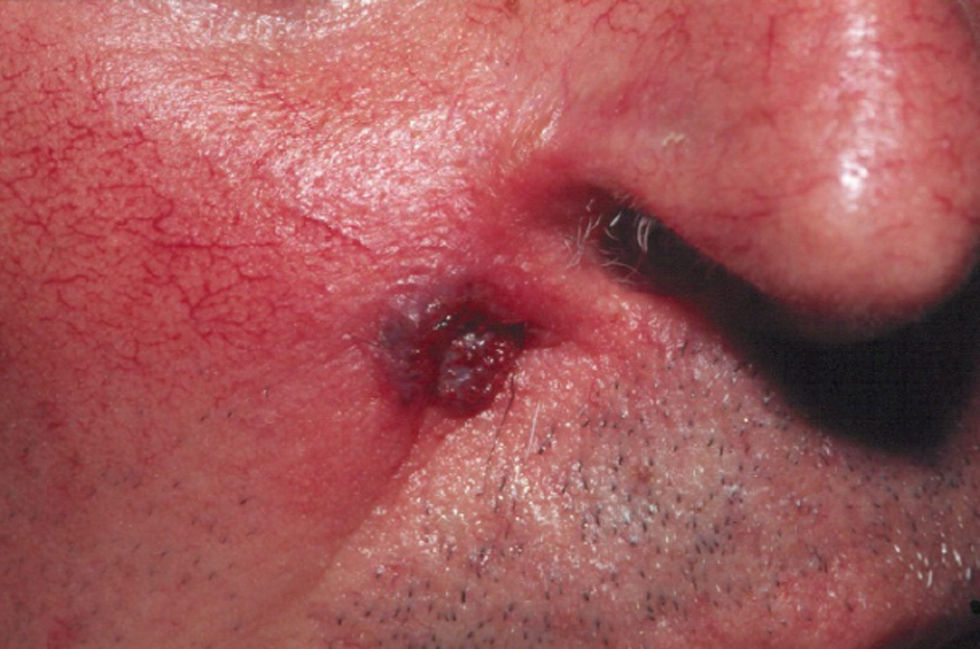
Clínica: suele presentarse como lesiones de aspecto maculoso o papuloso, eritematosas, que evolucionan a la ulceración, en zonas de traumatismo previo6. La infección diseminada se caracteriza por elementos tuberosos o nódulos no dolorosos (fig. 1)5.
Diagnóstico: la biopsia muestra hifas irregularmente melanizadas. La tinción de Fontana-Masson es de utilidad porque pone de manifiesto la melanina que producen los feohifomicetos. Se debe realizar cultivo para la identificación5.
Tratamiento: responde bien a los antifúngicos clásicos. El itraconazol suele ser efectivo. Se ha usado también voriconazol. Siempre que sea posible, se deben disminuir la dosis de inmunosupresores y realizar desbridamiento o escisión quirúrgica de las lesiones5.
FusariumFusarium spp. son mohos patógenos de plantas y animales. Son ubicuos en la naturaleza y se encuentran en el suelo, aunque también se han aislado en sistemas de agua hospitalarios7.
Las principales puertas de entrada de Fusarium son la vía aérea y la vía percutánea tras traumatismo7.
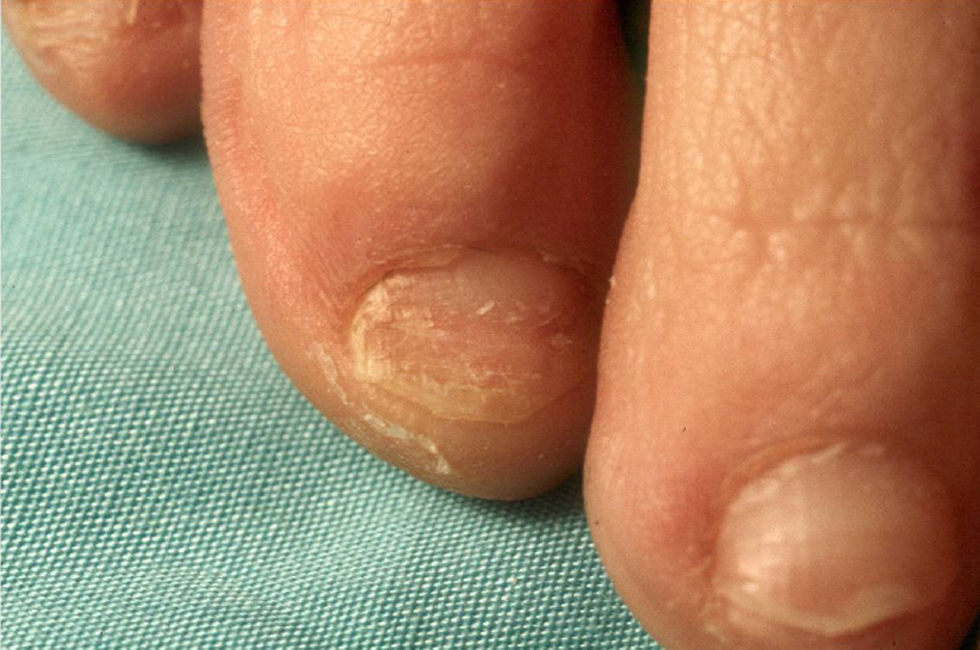
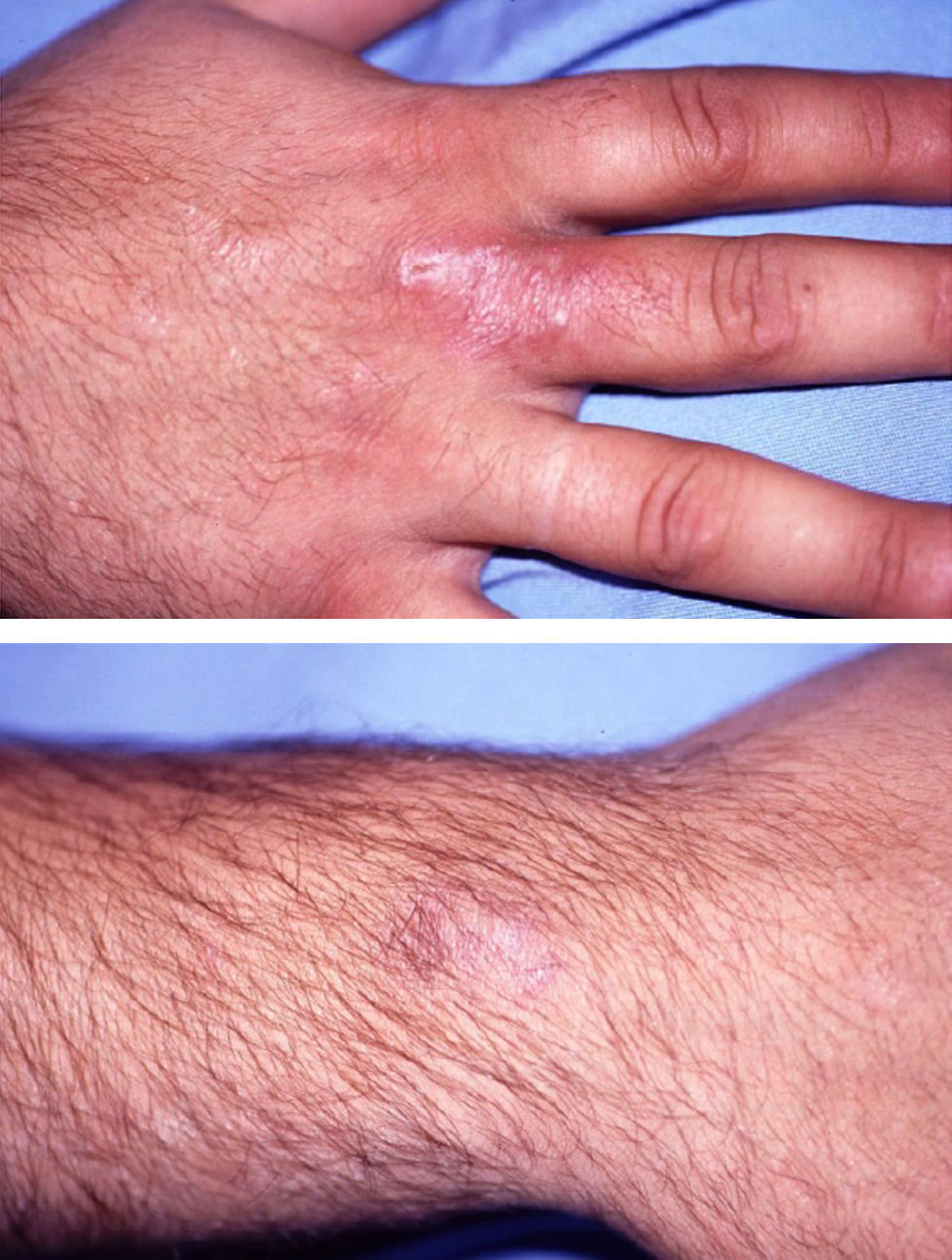
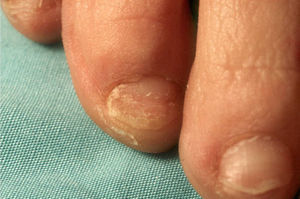
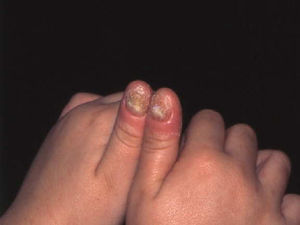
El grado de inmunidad y la vía de entrada determinan el tipo de infección.7 En inmunocompetentes, la onicomicosis (fig. 2) y la queratitis son los cuadros más frecuentes, aunque también pueden tener infecciones cutáneas localizadas tras traumatismos o heridas7.
En inmunodeprimidos pueden provocar neumonía e infecciones cutáneas localizadas. A partir de éstas pueden producirse infecciones diseminadas, que suponen hasta el 70% de las infecciones por Fusarium en este grupo de pacientes. En pacientes hospitalizados, la vía de entrada puede ser un catéter7.
Los principales grupos de riesgo para la fusariosis diseminada son los pacientes con neutropenia o con inmunodeficiencia de células T debido a leucemia o a trasplante de precursores hematopoyéticos7.
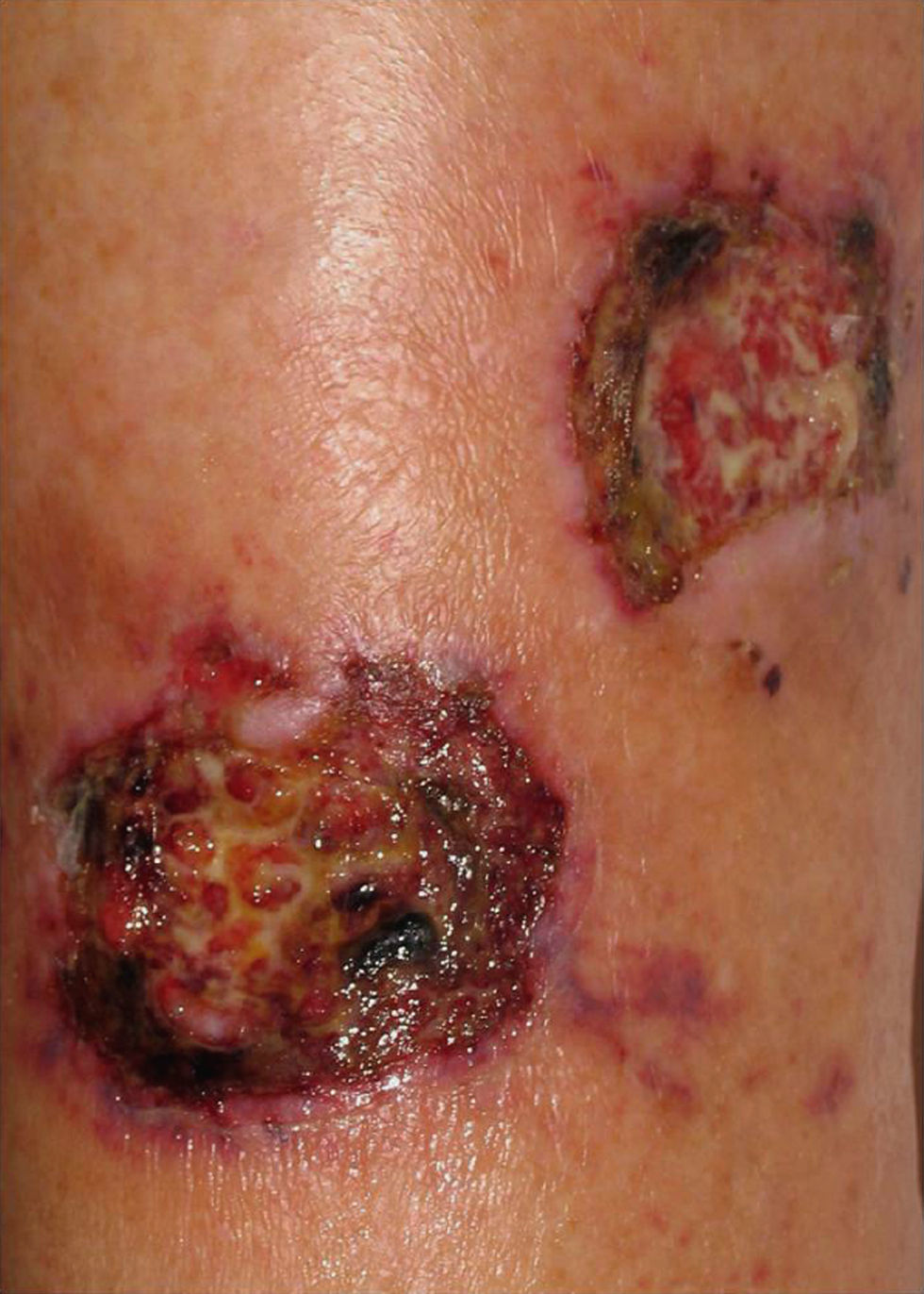
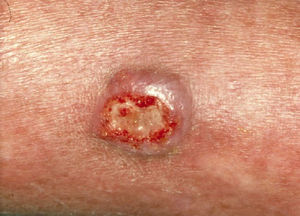
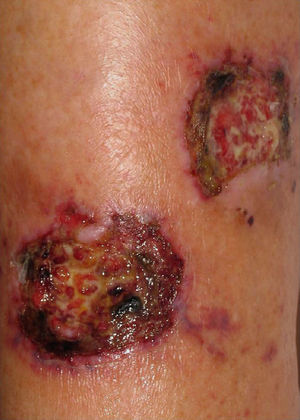
En el 70% de los pacientes con infección diseminada por Fusarium aparecen lesiones cutáneas8. Se han descrito múltiples tipos de lesiones cutáneas, que se han unificado en varios patrones: tubérculos aislados formando placas o distribuidos en patrón esporotricoide, úlceras y lesiones purpúricas o necróticas9. Las lesiones comienzan como máculas eritematosas o grisáceas, que desarrollan necrosis central con formación de escara o ulceración (fig. 3). Afectan más a las extremidades que al tronco y la cabeza. Se han descrito también nódulos, pápulas purpúricas, pústulas y ampollas hemorrágicas8. Las lesiones crónicas pueden presentarse como placas infiltradas con descamación remedando al lupus vulgar (fig. 4)10.
La mortalidad de la fusariosis diseminada es del 80%8.
Diagnóstico: en infecciones diseminadas, el cultivo de sangre es positivo en un 41%7.
En lesiones cutáneas se debe realizar estudio histopatológico, que mostrará filamentos septados que se dividen en ángulo recto y agudo. Una porción de la biopsia se debe enviar para cultivo7.
Tratamiento: se propone anfotericina B en altas dosis como tratamiento de elección, ya que Fusarium solani es el agente causal más frecuente, es resistente a los azoles y tiene una elevada concentración mínima inhibitoria para anfotericina in vitro7.
Se debe realizar, además, desbridamiento quirúrgico de los tejidos infectados y retirada de los catéteres venosos. Dado que el pronóstico de la fusariosis se relaciona con el grado de inmunidad del paciente, se suelen usar transfusiones de granulocitos, estimulantes de colonias e interferón gamma, si bien su utilidad no está claramente establecida. Siempre que se pueda, se deben disminuir las dosis de inmunosupresores7.
EsporotricosisProducida por Sporothrix schenckii, que se encuentra principalmente en restos vegetales y en la tierra11.
La vía de transmisión más frecuente es la inoculación postraumática que da lugar a la infección cutánea. Son menos frecuentes la infección pulmonar tras inhalación y la infección diseminada11.
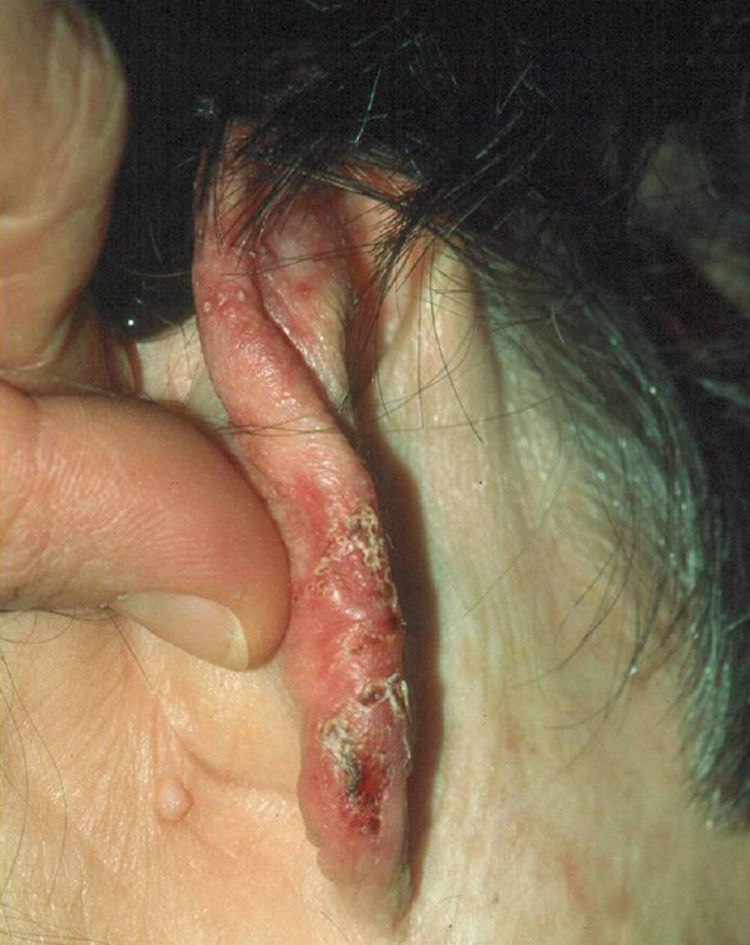
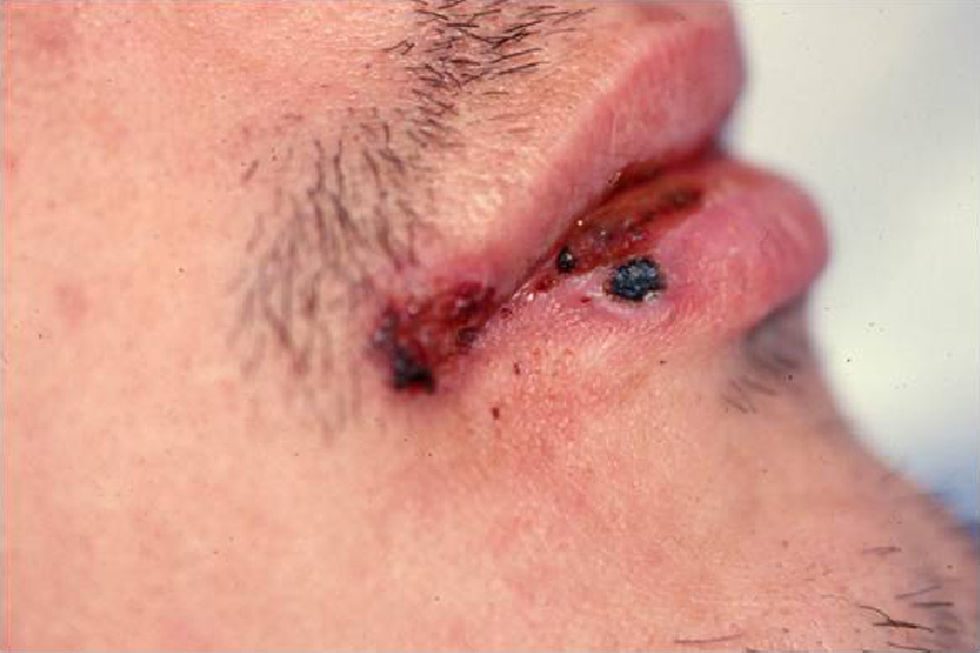
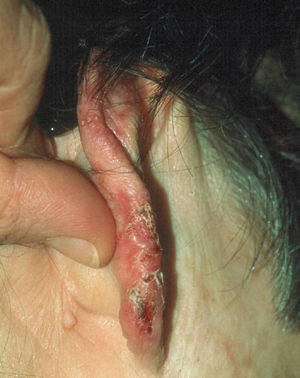
Clínica: la forma cutánea se presenta como lesiones palpables, eritematosas o eritematovioláceas de superficie lisa o verrucosa que aparecen en zonas expuestas y que aumentan de tamaño en días o semanas (fig. 5). Pueden formarse nódulos o placas por confluencia de las lesiones papulosas y en su evolución pueden ulcerarse y drenar un líquido seroso o purulento4. Al curar dejan cicatriz. Es característico que aparezcan nuevas lesiones similares a las primeras en zonas más proximales y que sigan el trayecto de los vasos linfáticos (fig. 6), en el llamado patrón de extensión esporotricoide. Puede haber adenopatías en la zona de drenaje11.
La forma cutánea diseminada es rara y aparecen múltiples lesiones en localizaciones distantes entre sí. Se cree que es debida a la diseminación hematógena y preludia la afectación articular. También se puede afectar el sistema nervioso central (SNC)11.
Diagnóstico: la histopatología muestra inflamación granulomatosa con cuerpos asteroides y escasas hifas. La tinción con PAS o metenamina argéntica ayuda al diagnóstico. El cultivo de las lesiones cutáneas confirma el diagnóstico11.
Tratamiento: se recomienda itraconazol (100–200mg diarios) durante 3 o 6 meses si es afectación cutánea, y durante 12 meses si es osteoarticular. En infección diseminada o meníngea se recomienda anfotericina B11.
CriptococosisCryptococcus neoformans es una levadura presente en vegetales y en la tierra, con distribución mundial y se relaciona con los excrementos de paloma12. La criptococosis se adquiere por inhalación y suele ser resultado de reactivación de una infección preexistente en estados de inmunosupresión, aunque se ha descrito una forma cutánea primaria postraumática13. Se distinguen 4 serotipos (A, B, C, D), y el D es el que tiene mayor riesgo de producir lesiones cutáneas4,13.
Los principales grupos de riesgo son los pacientes con VIH en tratamiento corticoideo o con otros inmunosupresores.
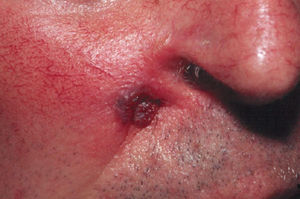
La infección por C. neoformans es la infección fúngica invasiva más frecuente en pacientes con VIH y suele presentarse como meningitis y más raramente puede provocar infección respiratoria. Un 10–20% de los pacientes con criptococosis tienen lesiones cutáneas. El 5% de los pacientes con meningitis desarrollarán lesiones cutáneas, resultado de diseminación hematógena. Pueden ser el primer o único signo y facilitar el diagnóstico (fig. 7)13,14. Las lesiones características son pápulas umbilicadas dispersas por toda la superficie corporal. No son específicas, ya que son similares a las producidas por molluscum contagiosum, y además, la criptococosis invasiva puede cursar con úlceras o placas eritematosas4,14.
También se reconoce una forma de criptococosis primaria cutánea debido a la inoculación directa postraumática que puede afectar a inmunocompetentes o inmunodeprimidos. La presentación clínica es como un panadizo, úlcera o celulitis en una zona expuesta13.
Diagnóstico: la biopsia teñida con metenamina argéntica permite la detección de levaduras esféricas solitarias o con esporas. Se cultiva fácilmente. En infecciones invasivas, el test de látex de detección de antígeno de criptococo tiene una sensibilidad del 60%12.
Tratamiento: si las lesiones son localizadas y no hay afectación del SNC, se debe realizar desbridamiento quirúrgico de las lesiones cutáneas localizadas y administrar fluconazol. Si hay infección del SNC, inicialmente se debe administrar anfotericina B y flucitosina durante 2 semanas, seguido de fluconazol durante 10 semanas. En inmunodeprimidos se debe considerar tratamiento antifúngico de mantenimiento4.
ZigomicosisSon mohos ubicuos en la naturaleza, se encuentran en el suelo y la materia orgánica en descomposición3,12. Se comportan como patógenos oportunistas. Se distinguen 2 órdenes: mucorales y entomophthorales. Ambos pueden provocar cuadros indistinguibles3.
Producen infecciones rápidamente progresivas con alta mortalidad, por lo que se hace imperativo establecer diagnóstico y tratamiento precozmente12.
Se transmiten por inhalación, ingestión o por inoculación directa. Pueden contaminar heridas o quemaduras3.
Los principales factores de riesgo son diabetes mellitus, acidosis metabólica, tratamiento con dexferroxamina, sobrecarga férrica, quemaduras, adictos a drogas por vía parenteral (ADVP) e inmunosupresión3,4,12.
Clínica: en función de la puerta de entrada, puede haber varias formas clínicas: rinocerebral, pulmonar, cutánea, gastrointestinal y diseminada.
La forma rinocerebral es la más frecuente en diabéticos y en general. Se presenta como una escara necrótica en el paladar o la mucosa oral, con rinorrea serosanguinolenta, fiebre, dolor y malestar. Puede afectar a la órbita y al encéfalo12.
La forma cutánea puede verse en inmunocompetentes tras inoculación postraumática o contaminación de una quemadura. Se presenta como una placa eritematosa que puede necrosarse. En inmunodeprimidos puede haber lesiones cutáneas, resultado de la diseminación hematógena, y se presenta como escaras necróticas con eritema periférico en un paciente con signos de sepsis12. Puede iniciarse como una lesión papulosa o placa eritematoedematosa sobre la que pueden aparecer pústulas y posteriormente una úlcera cubierta por una escara necrótica. Si la infección es profunda puede provocar nódulos, abscesos y fascitis necrosante4.
Diagnóstico: la biopsia cutánea mostrará hifas grandes que se ramifican en ángulo obtuso, con escasos septos en su interior, con angiotropismo y necrosis del tejido12. La tinción con PAS es de ayuda. La tinción de metenamina argéntica suele ser negativa; este hecho lo distingue de otros hongos y es altamente indicativo de zigomiceto12.
Tratamiento: la anfotericina B en preparación lipídica es el tratamiento de elección. Posaconazol es muy efectivo12.
CandidiasisLas levaduras del género Candida son ubicuas. Hay múltiples especies pero sólo unas pocas son patógenas.
Las infecciones por Candida spp. son las micosis más frecuentes15, y dentro de ellas Candida albicans ocupa el primer lugar16. Gracias a la profilaxis con fluconazol en inmunodeprimidos, se ha producido un descenso en la incidencia de la candidiasis invasiva. Ha aumentado el aislamiento de cepas de C. albicans y no albicans resistentes a fluconazol, como Candida krusei2,16, pero C. albicans sigue siendo la más frecuente. Candida tropicalis tiene mayor riesgo de producir lesiones cutáneas15.
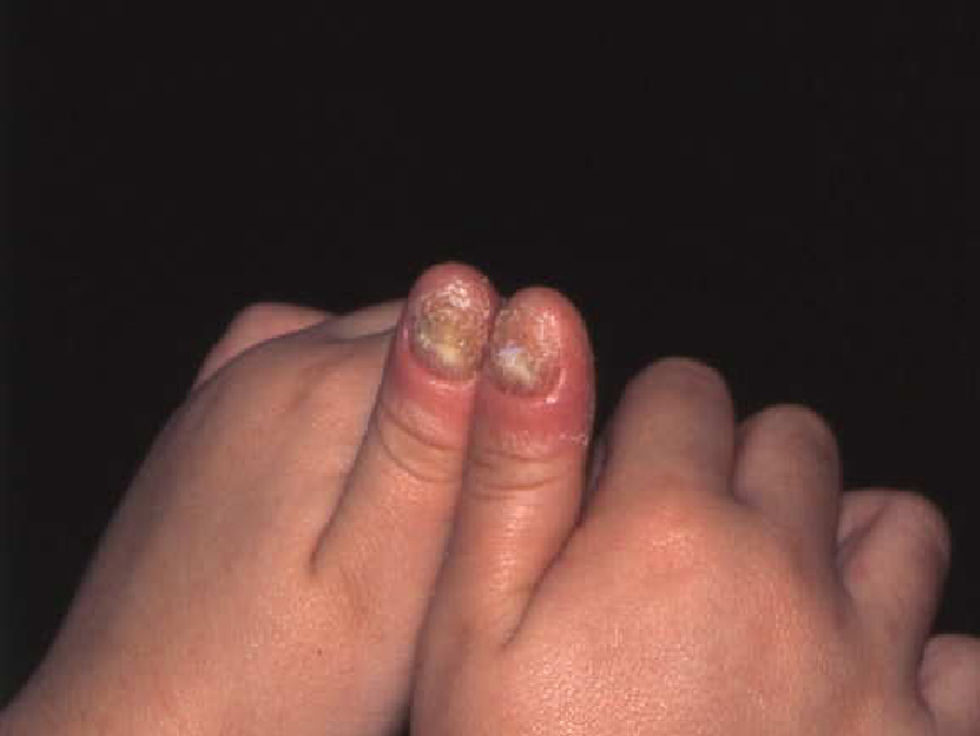
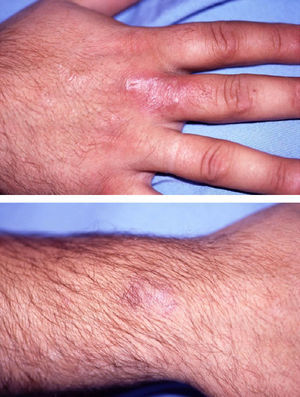
C. albicans coloniza el tubo digestivo y la piel. Provoca onicomicosis (fig. 8), intertrigos, candidiasis oral, epiglotitis, esofagitis e infección genitourinaria (vaginitis, cistitis, pielonefritis y balanitis). La infección diseminada puede ser resultado de la diseminación desde el tubo digestivo o de catéteres venosos o urinarios12,17.
Son factores de riesgo para la candidiasis diseminada las neoplasias hematológicas y los tratamientos con corticoides u otros inmunosupresores15. La profilaxis con fluconazol ha disminuido la infección diseminada en pacientes de riesgo18, pero en los últimos años ha aumentado en pacientes hospitalizados en unidades de críticos sin inmunosupresión clásica3,19. En estos pacientes se consideran factores predictivos de candidiasis sistémica: colonización por candida en múltiples localizaciones, tratamiento antibiótico previo, cirugía abdominal mayor o pancreatitis, nutrición parenteral y fallo renal agudo tratado con diálisis17.
La mortalidad de la candidiasis sistémica es elevada y según las series se encuentra entre el 40–80%15,16,19.
En pacientes con candidiasis sistémica, entre el 13–35% presenta lesiones cutáneas. Suelen presentarse como una erupción que afecta al tronco y las extremidades, formada por máculas eritematosas que evolucionan a pápulas, pústulas o nódulos. Característicamente, las máculas y pápulas debidas a candidiasis sistémica tienen borde eritematoso y centro pálido, aunque pueden incluso hacerse purpúricas. También puede presentarse como escaras necróticas y foliculitis15.
Diagnóstico: biopsia cutánea: muestra agregados de hifas o seudohifas en dermis. Puede haber áreas de necrosis y hemorragia12,15. El cultivo permite identificar la especie12.
Cultivo de sangre periférica: es de poca ayuda, ya que sólo es positivo entre el 25–53% de las candidiasis sistémicas15.
El examen directo de exudados (orina, secreciones vaginales, gástricas y respiratorias) puede poner de manifiesto blastoconidias o seudohifas12.
Tratamiento: en pacientes en los que se sospecha una candidiasis sistémica (por factores de riesgo o por aislamiento de levaduras en hemocultivo) se debe iniciar tratamiento precozmente con caspofungina o anidulafungina. Cuando el paciente esté apirético, hemodinámicamente estable y los cultivos se hayan negativizado, se sustituirá la candina por un azol por vía oral. Si la infección es por C.albicans, Candida parapsilopsis o Candida ÿitroÿresÿ tropicalis se debe usar fluconazol. Si es por C. krusei o Candida glabrata se sustituirá por voriconazol. La duración del tratamiento será de 15 días desde el primer hemocultivo negativo. Si hay coriorretinitis se mantendrá 30–45 días17.
En los siguientes casos es preferible inicio de tratamiento con fluconazol en lugar de candina: infección del tracto urinario, endoftalmitis y meningitis, así como en pacientes de bajo riesgo (sin fiebre, neutropenia o antecedentes de profilaxis con fluconazol)17.
Si hay afectación visceral se debe mantener el tratamiento durante 4–6 semanas17.
AspergilosisAspergillus spp. son hongos que se encuentran en el suelo y en vegetales en descomposición. Son contaminantes habituales de muestras en el laboratorio4, por lo que la relevancia de un cultivo positivo debe establecerse correlacionándolo con el cuadro clínico del paciente.
Aspergillus spp. puede provocar infecciones pulmonares (50–60%) tras inhalación de esporas, sinusitis (20%) o lesiones cutáneas primarias (5%) por inoculación postraumática o infección de una quemadura o herida preexistente. En el 5% de los casos afecta exclusivamente al SNC20. Las lesiones cutáneas pueden ser expresión de una aspergilosis primariamente cutánea o de la afectación cutánea por diseminación hematógena en pacientes con aspergilosis invasiva21.
El principal factor de riesgo para la aspergilosis invasiva es la neutropenia profunda y prolongada21,22 que suele afectar a pacientes en tratamiento quimioterapéutico por neoplasias hematológicas o por trasplante de precursores hematopoyéticos. Otros factores de riesgo son depleción de células T, infección concomitante por citomegalovirus, profilaxis con fluconazol y polimorfismos de los receptores tipo Toll20. Otros grupos de riesgo son los quemados, los neonatos, los receptores de trasplantes de órganos sólidos y los pacientes con cáncer21.
La mortalidad de la aspergilosis en general es del 60%22, y en las formas diseminadas llega al 85–90%20.
La aspergilosis cutánea primaria es resultado de la inoculación directa postraumática y se manifiesta como una mácula eritematosa que evoluciona a una pápula o placa infiltrada que se necrosa. Si se produce sobreinfección de una herida previa la clínica es la de un cambio en las características de la herida, con aumento del dolor, edema y ocasionalmente fiebre21.
El 11% de los pacientes con aspergilosis invasiva tiene lesiones cutáneas, que se presentan como lesiones maculosas o papulosas eritematosas que pueden desarrollar ampollas hemorrágicas en el centro o necrosarse debido a la tendencia de Aspergillus a invadir los vasos sanguíneos. Estas lesiones no son específicas y se han descrito otras lesiones, como pápulas umbilicadas similares a molluscum contagiosum, placas verrucosas y pústulas21.
Diagnóstico: las manifestaciones clínicas no son específicas, por lo que el diagnóstico debe confirmarse mediante cultivo. Se debe tomar una biopsia profunda del centro de la lesión y teñirla con hematoxilina-eosina y con metenamina argéntica. Con esta tinción se ponen de manifiesto las hifas septadas en ángulo agudo que invaden los vasos y provocan necrosis ÿitroÿres tisulares. El cultivo de un fragmento de tejido confirmará el diagnóstico21.
Los cultivos sanguíneos tienen baja sensibilidad4,22.
Detección de antígenos: en aspergilosis invasiva se ha realizado detección de los antígenos galactomanano y 1,3-beta-D-glucano en suero. La determinación del galactomanano tiene elevada sensibilidad y especificidad. El descenso en sus niveles se relaciona con buena respuesta al tratamiento, aunque puede observarse un incremento inicial. Puede haber falsos negativos si el paciente está en tratamiento antifúngico, y puede haber falsos positivos durante tratamiento con betalactámicos20.
El antígeno 1,3-beta-D-glucano puede ser positivo en aspergilosis, candidiasis, fusariosis y criptococosis. Su negatividad puede ayudar a excluir infecciones fúngicas. Puede dar falsos positivos en pacientes con bacteriemia o en tratamiento con amoxicilina-clavulánico20.
Tratamiento: formas cutáneas localizadas: escisión o limpieza quirúrgica de los tejidos cuando sea posible, asociado a itraconazol21.
Formas diseminadas: voriconazol es el tratamiento de elección. Una alternativa válida es anfotericina B liposomal20.
Tratamiento antifúngicoEl tratamiento adecuado debe incluir uso de fármacos antifúngicos, exéresis o limpieza quirúrgica de las lesiones y disminución de la inmunosupresión cuando sea posible3.
Durante mucho tiempo el tratamiento antifúngico fue muy limitado. En los últimos años se han producido avances significativos en los fármacos antifúngicos:
- a)
nuevas preparaciones de anfotericina B que consiguen disminuir su toxicidad;
- b)
desarrollo de una nueva generación de triazoles que amplían el espectro de acción,
- c)
y desarrollo de las equinocandinas, una nueva familia de antifúngicos cuyo mecanismo de acción es distinto de los previos4.
Con estos avances, las opciones de tratamiento se han incrementado notablemente (tabla 2).
Tratamientos antifúngicos
| Espectro de acción | Vía de administración | Dosis | Interacciones | Efectos secundarios | ||
| Fluconazol | Candida, Candida neoformans | Oral/i.v. | 100–400mg | Fármacos metabolizados por CYP3A4 | Hepatotoxicidad | No activo frente a Candida krusei y algunas cepas de Candida albicans y Candida glabrata |
| 1–2 v/día | Rifampicina, fenitoína, warfarina, inhibidores bomba de protones, cisclosporina A, tacrolimus, sirolimus, estatinas | No efectivo frente a mohos | ||||
| Itraconazol | Candida, Cryptococcus neoformans y algunos mohos (Aspergillus) | Oral | 100–400mg/2v/día | CYP3A4: CyA, tacrolimus, indinavir ritonavir, saquinavir | Hepatotoxicidad | Riesgo de interacción con antirretrovirales e inmunosupresores. |
| Absorción oral errática | ||||||
| Voriconazol | Candida spp. resistente a fluconazol Cryptococcus neoformans | Oral/i.v. | Dosis de carga: | Inhibe CYP3A4 | Hepatotoxicidad | Activo frente a Aspergillus |
| Aspergillus (elección) y otros mohos | 400mg/12h v.o. | Alteraciones visuales | Buena biodiodisponibildiad | |||
| 6mg/kg/12h i.v. | Se recomienda monitorizar enzimas hepáticas | |||||
| Mantenimiento: | ||||||
| 200mg/v.o. | ||||||
| 4mg/kg/12i.v. | ||||||
| Posaconazol | Candida. Cryptococcus neoformans. Asperigillus y otros mohos | Oral | 400mg/12h | Fármacos metabolizados por CYP3A4: | Buena actividad frente a zigomicetos | |
| rifampicina, fenitoína, carbamacepina, fenobarbital, efiravenz, cimetidina | ||||||
| Zigomicetos | ||||||
| Anfotericina B | Aspergillus, Candida, Zygomicetos, Cryptococcus neoformans, Sporothrix | i.v. | 03–1mg/kg/día | Uso concomitante con otros nefrotóxicos | Nefrotoxicidad. Reacciones a la infusión, hipopotasemia | Reacciones adversas relacionadas con la infusión (70–90%): nauseas, vómitos, fiebre, hipotensión, escalofríos |
| Anfotericina B liposomal | Aspergillus, Candida, zigomicetos | i.v. | 3–5mg/kg/día | Igual | Es la que presenta menor frecuencia de toxicidad renal y reacciones adversas | |
| Anfotericina B, complejo lipídico | Aspergillus, Candida, zigomicetos | i.v. | 5mg/kg/día | Igual | Reacciones a la infusión poco frecuentes | |
| Anfotericina B suspensión coloidal | Aspergillus, Candida, zigomicetos | i.v. | 0,5–1,5mg/kg/día | Igual | Menor nefrotoxicidad. Reacciones a la infusión igual de frecuentes que con anfotericina B | |
| Caspofungina | Candida spp., Aspergillus | i.v. | 70mg el primer día y 50mg los siguientes | Ciclosporina A, tacrolimus, efiravenz, nevirapina, rifampicina, dexametasona, fenitoína, carbamacepina | Hepatotoxicidad | Estrecho espectro de acción. Eficaz en candidiasis invasiva. Pocas interacciones farmacológicas. En insuficiencia hepática ajuste de dosis: 70mg inicial y luego 35mg diarios. |
| Micafungina | Candida spp. | i.v. | 100mg/d/24h | Ciclosporina A, sirolimus, nifedipino, itraconazol | Hepatotoxicidad, hemólisis, insuficiencia renal | No interacciona con fármacos metabolizados por CYP3A4. |
| Anidulafungina | Candida spp. | i.v. | 200mg el primer día y 100mg los siguientes | Ciclosporina A | Riesgo de toxicidad hepática |
i.v.: intravenoso; v.o.: vía oral.
Los triazoles inhiben la síntesis del ergosterol. Son muy activos frente a Candida spp., incluyendo C. krusei, C. glabrata, las cepas resistentes a fluconazol y frente a Aspergillus1.
Posaconazol es activo frente a zigomicetos1.
La principal desventaja de los triazoles es que interaccionan con fármacos que se metabolizan por CYP3A4.
Anfotericina BDurante muchos años, la anfotericina B ha sido el único tratamiento disponible para las micosis invasivas. Su uso se ve limitado por la toxicidad renal. Ésta empeora con el uso concomitante de otros nefrotóxicos, como ciclosporina, vancomicina, aminoglucósidos y cisplatino23. Recientemente se han desarrollado nuevas formulaciones lipídicas de la anfotericina B (ver más abajo), que consiguen disminuir su nefrotoxicidad y pueden administrarse en mayores dosis4. Provoca frecuentes reacciones adversas a la infusión (70–90%), que consisten en náuseas, vómitos, fiebre, escalofríos e hipotensión. Se debe administrar lentamente para evitarlas23.
- a)
Anfotericina B en dispersión coloidal: baja toxicidad renal. Reacciones a la infusión igual de frecuentes e intensas que con la anfotericina B. Disminuyen con pretratamiento con paracetamol, difenhidramina y meperidina23.
- b)
Anfotericina B complejo lipídico: baja frecuencia de reacciones a la infusión.
- c)
Anfotericina B liposomal: es la que presenta mejor tolerabilidad.
Son lipopéptidos que inhiben las síntesis de los glucanos presentes en la pared de algunos hongos.
Son el tratamiento de elección en la candidiasis invasiva, ya que son activas frente a muchas especies de candida1.
La concentración mínima inhibitoria in vitro no se correlaciona con la respuesta clínica.
Sólo disponibles para uso intravenoso. Se deben administrar lentamente para disminuir el riesgo de reacciones adversas relacionadas con la infusión24.
Bien toleradas. Causan pocas interacciones farmacológicas, pero sí interaccionan con ciclosporina y se debe evitar su uso conjunto por riesgo de hepatotoxicidad25. Pueden provocar elevación de aminotransferasas24.
Pueden usarse en combinación con anfotericina B o triazoles por un posible efecto sinérgico, aunque no hay recomendaciones firmes al respecto. La indicación de tratamiento combinado se debe hacer individualmente24.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.