- El pioderma gangrenoso es una enfermedad cutánea crónica, ulcerativa y dolorosa de probable etiología autoinmunitaria.
- El pioderma gangrenoso progresa en pocos días desde una pequeña pústula hasta formar una gran úlcera.
- En el 50% de los casos se relaciona con una enfermedad sistémica; las más frecuentes son las enfermedades inflamatorias del intestino, la artritis reumatoide y las discrasias sanguíneas.
- Puede aparecer de forma espontánea o en zonas que han sufrido pequeños traumatismos o cirugía, como resultado de la expresión del fenómeno de patergia.
- El diagnóstico es fundamentalmente clínico, y la biopsia únicamente es una herramienta de apoyo que ayuda a descartar otros procesos.
- Existen cuatro variantes clínicas de pioderma gangrenoso: clásico o ulceroso, pustuloso, ampolloso y vegetante.
- Los tratamientos de elección son los corticoides y la ciclosporina A por vía oral; las formas leves pueden controlarse con corticoides o tacrolimus tópicos.
El pioderma gangrenoso (PG) es una enfermedad cutánea infrecuente en la consulta de dermatología, pero en ocasiones puede ser la clave para el diagnóstico de una enfermedad interna. Se clasifica dentro de las denominadas dermatosis reactivas, junto a una serie de cuadros clínicos de etiopatogenia poco clara que se relacionan con diversas noxas, como el síndrome de Sweet, el eritema elevatum diutinum y otras dermatosis neutrofílicas1.
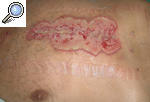
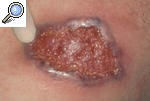
El PG se manifiesta como una úlcera estéril muy dolorosa, asociada en ocasiones a una enfermedad sistémica. Entre ellas, las más frecuentes son las enfermedades inflamatorias del intestino (EII), la artritis reumatoide, las discrasias sanguíneas y las neoplasias. Alguno de estos procesos está presente hasta en un 50% de los pacientes. El PG puede aparecer espontáneamente o en zonas de traumatismos, heridas quirúrgicas inclusive (fig. 1), como resultado del fenómeno de patergia. El antecedente traumático se detecta en un 25-50% de los casos, si bien tan sólo se han publicado unos 80 casos desencadenados por actos quirúrgicos2.
Figura 1. Pioderma gangrenoso posquirúrgico aparecido sobre la cicatriz de una toracotomía tras un recambio valvular.
La primera descripción del PG la realizaron Brunsting et al3 en 1930. En su artículo incluían a 5 pacientes con úlceras dolorosas recurrentes, con una base necrótica y unos bordes sobreelevados eritemato-violáceos. Cuatro de estos pacientes tenían colitis ulcerosa, por lo que consideraron que el PG estaba en relación con la enfermedad intestinal subyacente. Como hipótesis fisiopatogénica propusieron que las lesiones cutáneas serían el resultado de una infección bacteriana diseminada en el contexto de una inmunodeficiencia, de ahí el nombre pioderma.
La etiología del PG sigue siendo desconocida, pero la mayoría de los estudios apuntan a que se trata de un proceso autoinmunitario. En cualquier caso, la infección bacteriana como causa etiológica ha sido descartada. El término pioderma es equívoco, pero por razones históricas se sigue manteniendo. Además, desde la descripción
incial se ha ampliado considerablemente la lista de procesos asociados al PG, y resulta evidente que es mucho más que una manifestación dérmica de la enfermedad inflamatoria del intestino. Finalmente, se ha ampliado también el concepto clínico y se ha descrito formas no ulcerosas de la enfermedad4.
EPIDEMIOLOGÍAHay pocos datos sobre la incidencia real del PG, pero sin duda es una enfermedad infrecuente. La incidencia máxima se encuentra entre los 20 y los 50 años, y afecta más a las mujeres. Se ha descrito casos en niños y adolescentes, que suponen alrededor del 4% del total de PG. En ancianos parece una enfermedad aún más excepcional5,6.
ETIOPATOGENIAInicialmente se creyó que la causa del PG era una infección baceriana en pacientes inmunodeficientes. Hoy día esta teoría se ha descartado, pero la causa real es todavía desconocida. Fulbright et al7 propusieron la existencia de una alteración en el sistema inmunitario como explicación para la frecuente asociación a una enfermedad sistémica. Recientemente se ha descrito otros factores implicados en la etiopatogenia, como alteraciones en la función de los neutrófilos y en la expresión de determinadas interleucinas6.
CLÍNICAPowell et al8 describieron 4 variantes de PG, de las que la forma clásica o ulcerosa es la más frecuente (tabla I).
TABLA I. Variantes clínicas de pioderma gangrenoso segun Powell et al7
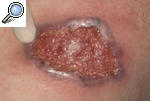
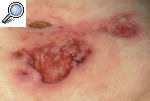
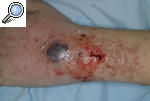
Pioderma gangrenoso clásico o ulcerosoLa forma de presentación más característica del PG es una úlcera profunda con un borde bien definido, sobreelevado y eritemato-violáceo, rodeado por un área eritematosa e indurada. Las lesiones pueden ser únicas o múltiples y lo más frecuente es que, a partir de una pústula estéril o nódulo, aparezca progresivamente una úlcera hasta formar un verdadero cráter en sólo 24-48 h (fig. 2). Con frecuencia la lesión es dolorosa y se acompaña de manifestaciones sistémicas como malestar general, fiebre, artralgias y mialgias. La resolución de las lesiones deja una cicatriz atrófica con una epidermis con aspecto de «papel de fumar». Habitualmente se localiza en las zonas pretibiales, lo que refleja la tendencia a aparecer en zonas de traumatismo, pero se ha descrito casos de aparición en otras zonas del tegumento, como las mamas, el dorso de las manos, el tronco, la cabeza, el cuello y las zonas periostomales8,9.
Figura 2. Pioderma gangrenoso incipiente originado a partir de un nódulo fluctuante que se ha expandido periféricamente hasta formar una úlcera de bordes violáceos y supurativos.
En ocasiones pueden aparecer manifestaciones extra-cutáneas en forma de infiltrados neutrofílicos estériles en la mucosa de las vías respiratorias superiores y en los pulmones, los músculos, la mucosa genital, el hígado, el bazo y los huesos6.
Una forma especial del PG clásico es el llamado PG maligno. Se manifiesta como una úlcera necrótica persistente que afecta a la cabeza y el cuello, e incluso puede ser letal. Actualmente se considera que algunos de estos casos corresponden a lesiones vasculíticas propias de la granulomatosis de Wegener10,11.
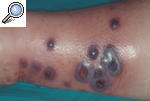
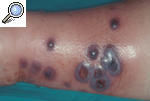
Pioderma gangrenoso pustulosoLa forma pustulosa es una variante excepcional de la enfermedad. Suele iniciarse como una o varias pústulas agrupadas que progresivamente confluyen y pueden ulcerarse y dan lugar a una lesión muy dolorosa y persistente durante meses. Se localiza sobre todo en el tronco y la superficie extensora de las extremidades (fig. 3). Parece que esta forma se encuentra limitada a los pacientes con EII12,13.
Figura 3. Pioderma gangrenoso pustuloso en el punto de entrada de una vía periférica, puesto de manifiesto por el fenómeno de patergia en una paciente ingresada para estudio de un cuadro intestinal.
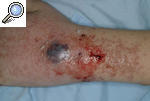
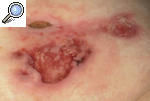
Pioderma gangrenoso ampollosoEsta variante se caracteriza por la aparición de lesiones ampollosas de varios centímetros de tamaño que semejan un impétigo ampolloso y se rompen con facilidad; dejan una erosión o úlcera más superficial que en el caso de la forma clásica. Suele afectar a la cara y las extremidades superiores más que a las inferiores. Se asocia con enfermedades mieloproliferativas y puede ser la forma de presentación de leucemias, síndromes mieloproliferativos y cuadros mielodisplásicos. A todo paciente al que se diagnostique un PG de tipo ampolloso, se le debería realizar un estudio para descartar una neoplasia hemática. El pronóstico está condicionado por la hemopatía de base13-15 (fig. 4).
Figura 4. Pioderma gangrenoso ampolloso asociado a paraproteinemia IgA.
Pioderma gangrenoso vegetanteEs la forma de presentación de la enfermedad menos agresiva. Aparece como una placa inflamatoria única, superficial, con úlceras cribiformes, en pacientes sin otra enfermedad concomitante y se resuelve con tratamiento tópico16.
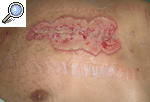
Pioderma gangrenoso periostomalLa lesión en estos pacientes tiene una morfología similar al PG clásico, pero con frecuencia aparecen puentes de epitelio sano que atraviesan el suelo de la úlcera. Se localiza cerca de las ostomías abdominales (colostomías, ileostomías y ureterostomías), lo que suele interferir con la colocación de la bolsa colectora. La mayor parte de estos pacientes tienen una EII asociada, aunque también se ha descrito alrededor de ostomías secundarias a intervenciones por neoplasias o diverticulitis17 (fig. 5).
Figura 5. Pioderma gangrenoso periostomal en un paciente con colitis ulcerosa.
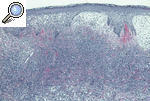
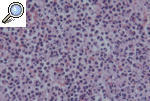
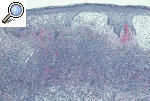
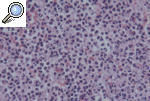
HISTOPATOLOGÍALa histopatología del PG es inespecífica y cambiante según el momento evolutivo en que practiquemos la biopsia. Por ello, nos sirve para descartar otros procesos y apoyar el diagnóstico de PG, pero no es patognomónica. En general encontraremos un marcado infiltrado inflamatorio, constituido básicamente por leucocitos polimorfonucleares formando un gran absceso que ocupa la dermis y se extiende incluso al tejido celular subcutáneo. Es frecuente la leucocitoclasia. Los vasos pueden estar dilatados y no es excepcional encontrar trombos intraluminales y extravasación de hematíes, pero en pocas ocasiones hallamos verdaderas imágenes de vasculitis. En la actualidad, la mayoría de los autores aceptan que la vasculitis no excluye el diagnóstico de PG. La epidermis suele estar ulcerada, y en fases iniciales puede haber un marcado edema en la dermis papilar9,13,18 (figs. 6 y 7).
Figura 6. Imagen histopatológica de un pioderma gangrenoso: epidermis con espongiosis y exocitosis neutrofílica, dermis con un infiltrado neutrofílico en banda e intenso edema de la dermis papilar.
Figura 7. Detalle histopatológico de un pioderma gangrenoso clásico. Muestra un infiltrado neurofílico masivo con extravasación hemática.
ENFERMEDADES ASOCIADASEn las series largas publicadas se ha visto que aproximadamente el 50% de los pacientes diagnosticados de PG tienen una enfermedad sistémica asociada, que puede ser conocida o no en el momento del diagnóstico. La colitis ulcerosa fue la primera afección que se describió asociada al PG y actualmente sigue siendo la más frecuente, seguida de la enfermedad de Crohn9.
En cerca del 30% de los casos, el PG aparece en pacientes afectos de una EII que puede ser tanto colitis ulcerosa como enfermedad de Crohn. Sin embargo, tan sólo el 2% de los pacientes con EII tendrán un PG en su vida8,9. En estos casos, el PG cursa de forma independiente del estado de la enfermedad subyacente; así, puede aparecer cuando ésta se encuentre en período de remisión e incluso después de haber practicado una colectomía19.
Aproximadamente un 25% de los PG se asocian a artritis reumatoide, si bien ambos procesos también pueden evolucionar de forma independiente. Las neoplasias hemáticas son las siguientes en frecuencia, y predominan las de tipo mieloide sobre las linfoides, sobre todo la leucemia mieloide aguada (más la forma mielomonocíti-ca)8,9. Finalmente, hay casos descritos de PG asociado a otras enfermedades13, como la granulomatosis de Wegener, la enfermedad de Takayasu, la hepatitis crónica activa, la enfermedad pulmonar obstructiva crónica, la diabetes mellitus, el tumor carcinoide, el lupus eritematoso sistémico, la dermatomiositis, la dermatitis herpetiforme o la malaria20, entre otras13 (tabla II).
TABLA II. Enfermedades más frecuentemente relacionadas con el pioderma gangrenoso
Recientemente ha sido descrito el síndrome PAPA, transmitido de forma autosómica dominante y con un curso tórpido. Se caracteriza por la tríada pioderma gangrenoso, artritis purulenta y acné quístico21.
DIAGNÓSTICOLas claves para el diagnóstico son una historia clínica detallada y reconocer la lesión característica (tabla III). La biopsia no es patognomónica, pero apoyará el diagnóstico y ayudará a descartar otras afecciones. Deben tomarse cultivos repetidos del lecho ulceroso para bacterias aerobias y anaerobias, micobacterias, virus y hongos con la intención de descartar una infección. En nuestra experiencia, el aislamiento de una bacteria puede corresponder a una sobreinfección y no siempre excluye la posibilidad de que se trate de un PG22.
TABLA III. Actitud diagnóstica ante la sospecha de pioderma gangrenoso
No hay parámetros de laboratorio específicos para el diagnóstico de PG, pero de forma bastante constante encontramos leucocitosis a expensas de células polimorfonucleares y elevación de los reactantes de fase aguda. Sin embargo, algunas determinaciones concretas, como la serología luética, los anticuerpos anticardiolipínicos y otros autoanticuerpos, contribuirán a excluir otras enfermedades23. Se ha descrito algunos casos de PG que presentaron anticuerpos anticitoplasma de neutrófilo, por lo que se ha postulado que estos anticuerpos podrían estar implicados en la patogenia del PG24. Sin embargo, parece que este hecho estaría relacionado con la asociación del PG a una EII o una granulomatosis de Wegener.
Una radiografía de tórax y una ecografía abdominal nos ayudarán a descartar la presencia de infiltrados neutrofílicos en otras localizaciones6,9,23.
DIAGNÓSTICO DIFERENCIALEl diagnóstico diferencial del PG es amplio23 (tabla IV). Es de destacar el síndrome de Sweet, que se caracteriza por la aparición brusca de fiebre y una erupción dolorosa de pápulas eritematosas. En la biopsia se observa un denso infiltrado neutrofílico en la dermis con edema subepidérmico. Ambos procesos pueden coincidir en el mismo paciente. Se los considera formas clínicas diferentes de las denominadas dermatosis neutrofílicas13.
TABLA IV. Diagnóstico diferencial del pioderma gangrenoso
Especial mención merecen las infecciones. Las lesiones iniciales del PG pueden confundirse con foliculitis, forunculosis o ectima. A menudo, la falta de respuesta a un tratamiento antibiótico empírico es lo que alerta deque estamos ante un PG. Úlceras producidas por leishmanias, micobacterias o micosis profundas, como la esporotricosis, pueden parecer un PG. La sífilis tardía, así como las infecciones herpéticas profundas, también puede manifestarse con úlceras supurativas23. Antes de establecer el diagnóstico de un PG sobre una herida quirúrgica (fenómeno de patergia) debemos descartar unasobreinfección, sobre todo una gangrena sinérgica. Ésta aparece como consecuencia de una infección bacteriana mixta de la herida quirúrgica, que produce una necrosis de la dermis, la grasa subcutánea, la aponeurosis o incluso del músculo.
Una neoplasia ulcerada también puede parecer un PG. En pacientes con linfomas o leucemias puede producirse una infiltración específica de la piel en forma de úlceras supurativas que pueden confundirnos en el diagnóstico. Lo mismo ocurriría con un carcinoma ulcerado6.
Finalmente, ante la sospecha de un PG tenemos que descartar también una vasculitis, sobre todo si se trata de pacientes afectos de enfermedades sistémicas como el lupus eritematoso sistémico, la artritis reumatoide, la enfermedad de Behçet o la granulomatosis de Wegerr6,23. Si la úlcera aparece en las extremidades inferiores, debemos descartar la causa isquémica, la insuficiencia venosa y la causa infecciosa. En el contexto del síndrome antifosfolipídico, pueden aparecer úlceras que semejan un verdadero PG6,22.
TRATAMIENTOEl diagnóstico temprano del PG es importante, porque permite iniciar con rapidez un tratamiento adecuado que evite la progresión de la lesión y sus secuelas, y se nota una rápida mejoría en las primeras semanas. Además, evita maniobras intervencionistas capaces de acelerar el curso de la enfermedad. Sin embargo, el tratamiento del PG continúa siendo un reto y, a pesar de los avances en terapéutica, el pronóstico se mantiene incierto. Apenas existen ensayos clínicos prospectivos, aleatorizados y multicéntricos sobre el tratamiento y el pronóstico del PG9.
Conviene tener en cuenta la posibilidad de que haya alguna enfermedad subyacente; si bien cuando se trata de una EII el curso de la clínica cutánea y el de la intestinal no siempre son paralelos, cuando hay una neoplasia hemática su tratamiento a menudo conlleva la resolución de la lesión cutánea13.
La inmunosupresión es la base en el manejo del PG y, por el momento, los fármacos mejor estudiados son los corticoides sistémicos y la ciclosporina A. Se han utilizado otros muchos inmunosupresores y combinaciones de ellos, como por ejemplo los corticoides con agentes citotóxicos para formas recalcitrantes. Se ha observado que los PG asociados a enfermedad de Crohn responden rápidamente al tratamiento con inhibidores del factor de necrosis tumoral alfa (anti-TNFµ)25,26. En todos los casos son útiles los tratamientos tópicos para minimizar el riesgo de infecciones secundarias y, cuando ésta se produce, son necesarios los antibióticos sistémicos9,13,22,27.
Tratamientos sistémicosCorticoides. El tratamiento sistémico inicial del PG consiste en prednisona oral a dosis de 1-2 mg/kg/día. La respuesta, cuando se produce, se observa en 2-4 semanas; a partir de ese momento, se recomienda una pauta lentamente descendente durante semanas o meses hasta la suspensión9. Varias series apoyan el uso de pulsos de metilprednisolona (1 g/día durante 1-5 días), sobre todo para casos resistentes a otros tratamientos. Las ventajas de esta pauta son la respuesta más rápida y el menor daño iatrogénico a largo plazo28.
Macrólidos inmunosupresores. La ciclosporina A inhibe la activación de los linfocitos T y es sin duda uno de los tratamientos de elección para el PG. Permite ahorrar corticoides y es eficaz incluso en casos corticorresistentes. La mayoría de las series publicadas refieren una buena respuesta clínica en 1-3 semanas con bajas dosis de ciclosporina (3-5 mg/kg/día). Debe mantenerse durante meses hasta obtener la curación. Los efectos secundarios inherentes a la ciclosporina, tales como la nefrotoxicidad, la hipertensión arterial y la inmunosupresión, no suelen ser un problema significativo con estas dosis, pero deben ser monitorizados29,30. El tacrolimus (FK 506) también ha sido utilizado con éxito en ensayos clínicos controlados a dosis de 0,1 mg/kg/día22.
Inhibidores del factor de necrosis tumoral alfa. Los anti-TNFµ (infliximab, etanercept y adalimumab) son una opción terapéutica prometedora para el PG. El infliximab a dosis de 5 mg/kg, administrado en infusión intravenosa las semanas 0, 2 y 6, parece ser muy eficaz para el PG, asociado o no a EII. Según la respuesta, se recomiendan dosis de mantenimiento cada 8 semanas hasta lograr la curación. Su relación riesgo-beneficio parece aceptable, si bien su elevado coste hace que esta opción se reserve para casos resistentes a corticoides y ciclosporina, cuando éstos estén contraindicados o hayan producido toxicidad. Cuando se trate de un PG asociado a EII activa, en especial enfermedad de Crohn, probablemente la primera alternativa terapéutica sea infliximab. No obstante, se requieren más estudios comparativos a largo plazo para determinar tanto la eficacia como la seguridad de los anti-TNFµ en el PG25,26.
Otros inmunosupresores. La dapsona (100-200 mg/día), por su capacidad para inhibir la migración de los neutrófilos, tiene utilidad en casos leves de PG. Se suele asociar a corticoides sistémicos y precisa de controles hematológicos para monitorizar sus efectos secundarios (metahemoglobinemia y hemólisis). La clofazamina tiene un efecto inmunomodulador, pero en ocasiones puede exacerbar la EII, y además tiene otros efectos secundarios como la hiperpigmentación. La talidomida ha sido utilizada ocasionalmente en el tratamiento del PG por su efecto supresor de la función de los linfocitos T colaboradores y su actividad anti-TNFµ. Sus principales efectos secundarios son la teratogenia, la polineuropatía, la somnolencia y el estreñimiento. La azatioprina, a dosis de 100-150 mg/día, se utiliza como ahorrador de corticoides. Tiene una acción lenta que puede demorarse de 2 a 4 semanas. Antes de iniciar el tratamiento hay que determinar las concentraciones de tiopurina metiltranferasa (TPMT) para ajustar la dosis y evitar la hemotoxicidad; periódicamente deben realizarse controles hematológicos y hepáticos. Es una buena opción que considerar cuando se trata de pacientes afectos de EII. El micofenolato mofetilo ha sido utilizado en algún caso de PG periostomal o recalcitrante a dosis de 2 mg/día, con un buen perfil de seguridad hematológico, hepático y renal. En PG recalcitrantes o muy graves podemos recurrir a los agentes citotóxicos (ciclofosfamida, metotrexato y clorambucilo), sin olvidar sus riesgos (mielosupresión y carcinogénesis)13,22.
Tratamientos tópicosEl tratamiento tópico del PG tiene una doble finalidad: por un lado, reducir la exudación, eliminar detritos, prevenir y controlar la sobreinfección, reducir el dolor y favorecer la cicatrización; por otro, controlar el proceso inflamatorio con inmunosupresores tópicos17,20. Son útiles las curas húmedas con soluciones astringentes y antisépticas, así como los antibióticos tópicos (p. ej., sulfadiazina argéntica). En formas leves de PG o como tratamiento coadyuvante de los medicamentos sistémicos, se ha empleado corticoides tópicos (en oclusión o no), corticoides intralesionales e inhibidores tópicos de la calcineurina (tacrolimus)9,22. Este último se ha utilizado con éxito como tratamiento único en algún caso de PG periostomal31.
Tratamiento quirúrgicoLa cirugía debe indicarse con precaución, ya que puede desencadenar el PG a través del fenómeno de patergia y debe utilizarse únicamente como adyuvante a la terapia inmunosupresora en casos con enfermedad estable o remisión parcial. Algunos casos se han beneficiado de un injerto autólogo de piel, sobre todo en las mamas, aunque no hay que olvidar el riesgo de que aparezca una nueva lesión de PG en la zona donante. Hoy se están utilizando injertos de piel procesados por bioingeniería, que evitan la realización de maniobras quirúrgicas capaces de desencadenar un fenómeno de patergia22.
Correspondencia: Dra. C. Ferrándiz-Pulido. Hospital Universitario Vall d’Hebron. Pg. de la Vall d’Hebron, 119-129. 08035 Barcelona. España. Correo electrónico: 40879cfp@comb.es