PROGRESOS
DE OBSTETRICIA
Y GINECOLOGÍA
Volumen 41
Número 2
Marzo 1998
GinecologíaS. González-González
F. Díaz 1
H. González-Pardo
G. Vallejo
J. L. Arias
Alteraciones en los cuerpos mamilares de ratas adultas después de la manipulación hormonal en períodos neonatal y adultoLaboratorio de Psicobiología
1 Departamento de Biología Funcional (Fisiología).
Facultad de Medicina. Universidad de Oviedo
Oviedo. España
Correspondencia:
Jorge L. Arias
Laboratorio de Psicobiología. Facultad de Psicología
Universidad de Oviedo
Plaza Feijoo, s/n
33003 Oviedo
Changes in mamillary bodies of adult rats after hormonal manipullation in neonatal and adult periodsGonzález-González S, Díaz F, González-Pardo H, Vallejo G, Arias JL. Alteraciones en los cuerpos mamilares de ratas adultas después de la manipulación hormonal en períodos neonatal y adulto. Prog Obstet Ginecol 1988;41:93-99Aceptado para publicación 16/7/97RESUMEN
Los cuerpos mamilares (CCMM) son una estructura hipotalámica con células que contienen ARNm de receptores andrógenos (RA) y cuyo dimorfismo estructural y funcional ya ha sido descrito. Nosotros estudiamos los efectos de la testosterona sobre las regiones de organizadores nucleolares (AgNORS) de las células nerviosas en ratas hembras y machos adultas. La manipulación hormonal fue realizada en el período neonatal a través de la castración o la inyección de propionato de testosterona (PT) y en edad adulta con la castración de ambos sexos. Hallamos un incremento estadísticamente significativo (p < 0,001) en la actividad de síntesis proteica global de las neuronas en los grupos de recién nacidos de hembras inyectadas con PT y en el grupo de machos castrados; lo cual no responde a una real inversi6n hormonal. Estos resultados sugieren que los CCMM responden anómalamente ante la manipulación hormonal.
PALABRAS CLAVE
Cuerpos Mamilares; AgNORs; Testosterona; Receptores de andrógenos; Rata.
ABSTRACT
The mamillary bodies (MB) are a hypothalamic structure that contains cells with mRNA of androgen receptors, and which present an structural and functional dimorphism already reported. We studied the effects of testosterone on the nucleolar organizer regions (AgNORs) of the nervous cells in male and female adult rats. Hormonal manipulation was performed during the neonatal period by castration or injection of testosterone propionate (TP) and during the adult stage with castration of both sexes. We found an statistically significant increase
(p < 0.001) of global protein synthesis activity in neurons of female groups injected with TP and in the group of castrated males; this fact does not correspond to a real hormonal inversion. These results suggest that the MB show an anomalous response instead of a real hormonal inversion.
KEY WORDS
Mamillary body; AgNORs; Testosterone; Androgen receptors; Rat.
INTRODUCCIÓN
Los efectos de los esteroides gonadales sobre el sistema nervioso central suponen la acción de los mismos sobre muchos grupos celulares diferentes, cada uno de los cuales puede contribuir al conjunto conductual o a las respuestas neuroendocrinas (1). Los estrógenos y la testosterona juegan un papel importante en la diferenciación sexual del cerebro. En el cerebro, la testosterona se ligará a los receptores de estrógenos después de la aromatización a estradiol (2). Sin embargo, la testosterona también puede ligarse a receptores de andrógenos directamente o después de la reducción a 5-*-Dihidrotestosterona (DHT) (3). La acción de los andrógenos sobre el cerebro por medio de los receptores de andrógenos (RA) no requiere de una previa conversión de los esteroides a estrógenos.
Los cuerpos mamilares (CCMM) son una estructura hipotalámica localizada sobre la base del diencéfalo y está compuesta de tres núcleos principales: núcleo mamilar medial (NMM) y dos núcleos mamilares laterales (NML), localizados a ambos lados del NMM (4). Los CCMM se han relacionado experimentalmente con diferentes funciones tales como la conducta sexual. De hecho, lesiones de esta estructura en la rata macho producen un incremento de la conducta sexual (5), afectan a los procesos de memoria, debido principalmente a su interacción anatómica y funcional con el hipocampo (6) y también se han involucrado en procesos de memoria espacial (7). Además, algunas de éstas y otras funciones relacionadas con los CCMM muestran importantes diferencias respecto al sexo (5). En seres humanos, es relevante el papel que juegan los CCMM en el síndrome de Wernicke-Korsakoff (8,9). Estudios neuropatológicos muestran que el núcleo mamilar medial (NMM) es necrótico en pacientes que sufren este síndrome. Diferentes tipos de respuesta se encontraron atendiendo al sexo del sujeto en pruebas de aprendizaje espacial en ratas y en pacientes humanos con el síndrome de Korsakoff.
Por último, los CCMM son una estructura cerebral que contiene células con ARNm para RA localizadas en el NMM y en los NML (10). Recientes estudios sobre la biología molecular de los receptores de hormonas esteroideas sugieren que la acción primaria de estas hormonas sobre los genes de expresión parece ocurrir en el ADN o a nivel transcripcional (11).
Tras lo anteriormente expuesto, el objetivo de este trabajo es estudiar los efectos en los CCMM de la manipulación hormonal, analizando los niveles funcionales en la actividad de síntesis proteica neuronal de ratas macho y hembras tratadas en períodos neonatales (machos gonadectomizados y hembras inyectadas con PT) y en períodos adultos (gonadectomización de ambos sexos).
MATERIAL Y MÉTODOS
En la presente investigación fueron empleadas 56 ratas Wistar (250-300 g) suministradas y mantenidas por el Bioterio de la Universidad de Oviedo. La experimentación se ajustó a la normativa legal vigente sobre experimentación animal (BOE n.º 256, 1990).
Las ratas fueron divididas en siete grupos diferentes: un primer grupo de ocho ratas macho y dos grupos de ocho ratas hembras cada uno en dos de las fases del ciclo estral que estudiamos: estro y diestro.
Un cuarto grupo de ocho ratas macho recién nacidas, fueron castradas en el primer dia de vida y sacrificadas tres meses más tarde y un quinto grupo de ocho ratas hembras recién nacidas fueron inyectadas subcutáneamente con propionato de testosterona (PT) (1,5 mg; SIGMA, St. Louis, EE.UU.), disuelta en 0,2 ml de aceite de sésamo, en el primer día de vida y sacrificadas tres meses más tarde. El sexo de los recién nacidos fue diferenciado en base a la distancia ano-genital. Un sexto grupo de ocho ratas macho adultas fueron castradas y sacrificadas un mes más tarde. Finalmente, un séptimo grupo de ocho ratas hembras adultas fue ovariectomizado y sacrificado un mes más tarde.
La ciclicidad estro-diestro fue determinada en las ratas hembras por un frotis vaginal diariamente al principio de la mañana (entre las 9.00 a.m y las 10.00 a.m) y la fase del ciclo fue determinada mediante análisis microscópico (contraste de fases) de los frotis vaginales.
Los animales fueron anestesiados con éter etílico (PROBUS, España) antes de la perfusión vascular, con formaldehído al 10% en un buffer de fosfato (0,1M, pH 7,4). Tras su decapitación, se extrajeron los encéfalos rápidamente, y la parte caudal del hipotálamo fue seleccionada con un corte coronal del tejido. Las piezas obtenidas de cada animal fueron colocadas en el mismo fijador utilizado para la perfusión y más tarde fueron incluidas en parafina.
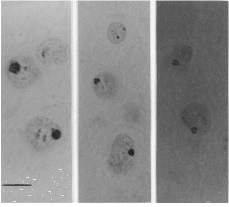
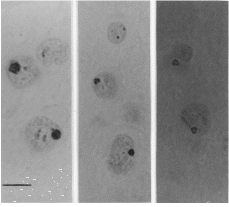
Se realizaron cortes coronales de cuatro micrómetros de todo el complejo mamilar, siguiendo el atlas de Paxinos y Watson (12) y fueron seleccionadas al menos 7 secciones de cada cerebro para cada núcleo en orden a obtener una muestra arbitraria. Las secciones fueron teñidas con nitrato de plata, según el método de Ploton y colaboradores (13), que consiste en sumergir las secciones en una solución de un volumen de gelatina al 2% (PANREAC, España) con ácido fórmico acuoso y dos volúmenes de nitrato de plata al 50% (MERCK, Alemania) durante 20 minutos en una habitación a temperatura ambiente y en oscuridad. La técnica de impregnación argéntica nos permite marcar los centros fibrilares (CFs), un componente de los nucleolos que es importante en la síntesis de ARNr. Los CFs mantienen una correlación morfológica con las regiones de los organizadores nucleolares (NORs) (14), lugares formados por ARNr y proteínas, algunas de las cuales son argirofílicas (15). La técnica de impregnación argéntica marca selectivamente las proteínas asociadas con los NORs y el resultado de esta estructura teñida se denomina AgNOR (Fig. 1). Por lo tanto, los AgNORs representan un indicador indirecto de los NORs, regiones de cromosomas acrocéntricos que contienen genes ARNr. Un NOR en sí mismo no es teñido, pero la cantidad de proteínas dentro del nucleolo que son positivas a la técnica de plata dependen de la actividad de los NORs. Por ello, la cantidad de AgNOR detectados es un indicador de la actividad celular cuando es expresada en términos de síntesis proteica global. La efectividad de esta técnica ha sido demostrada durante trabajos de desarrollo normal y desnutrición (16), deshidratación (17) y en el campo clínico (18).
La cuantificación de las secciones se realizó a través de un sistema de análisis de imagen (IMCO 2, MICROM, Barcelona, España) con un software (MIP) desarrollado específicamente para medir parámetros celulares (área, perímetro, etc.) en cada imagen seleccionada. Las siguientes variables fueron consideradas para el análisis: la media del número de AgNORs y el área relativa del AgNOR (AgNOR área/área del núcleo; AgNORs/N). Se seleccionaron 100 neuronas de cada uno de los ocho animales, con un total de 800 células para cada grupo estudiado. Los núcleos elegidos para su estudio fueron: el NMM, el NML izquierdo (NMLi) y el NML derecho (NMLd). El método de cuantificación seguido en orden a evitar la repetición de las medidas ya ha sido descrito por nosotros (16).
El análisis estadístico de las posibles diferencias en las medidas obtenidas fue realizado con un análisis de varianza (ANOVA) y la prueba a posteriori de Tukey (Diferencia Honestamente Significativa) fue aplicada en caso de significación estadística para comprobar las diferencias entre medias.
RESULTADOS
Se realizó un análisis de varianza unifactorial (ANOVA) para estudiar los datos del primer parámetro, es decir, el número de AgNORs que se encuentran en cada núcleo celular. Este análisis estadístico se utilizó entre los tres grupos de estudio: grupo control, y los dos grupos experimentales de recién nacidos y en estado adulto.
La prueba a posteriorit de Tukey reveló la existencia de diferencias significativas (p < 0,001) en todos los núcleos estudiados, NMM, NMLd y NMLi, entre el grupo control de ratas macho respecto a los grupos de ratas macho castradas recién nacidas y adultos (Fig. 2). También se encontraron diferencias significativas estadísticamente (p < 0,001) entre los dos grupos control de ratas hembras en las dos fases del ciclo estral estudiadas --estro y diestro-- y los dos grupos de hembras tratadas, recién nacidas inyectadas con PT y adultas ovariectomizadas. El grupo de ratas hembras en fase de diestro muestra diferencias significativas con los dos grupos de hembras tratadas, recién nacidas y adultas, mientras que el grupo de hembras en fase diestro sólo muestra diferencias significativas (p < 0,001) con el grupo de hembras recién nacidas tratadas con PT.
Los resultados para el parámetro superficie de AgNORs/N reveló la existencia de diferencias significativas estadisticamente (p < 0,05) entre los grupos control y grupos tratados (Fig. 3). La prueba a posteriori t de Tukey reflejó diferencias entre el grupo de machos control y el grupo de machos castrados recién nacidos. Los dos grupos de hembras en las dos fases del ciclo estral mostraron diferencias significativas estadísticamente (p < 0,001) frente al grupo de hembras tratadas con PT.
DISCUSIÓN
Nuestros resultados apoyan la hipótesis de que los CCMM son una estructura cerebral que presenta dimorfismo estructural y funcional (19) en el cual la
manipulación hormonal por castración y adminis-
tración de testosterona no parecen producir una
inversión hormonal, pero sí una reacción anormal ante el tratamiento hormonal, especialmente en
los grupos de ratas recién nacidas, lo cual se refle-
ja en la producción de síntesis proteica global en
las neuronas de los CCMM. La importancia del pe-
ríodo perinatal en el proceso de diferenciación
sexual, junto con los efectos organizacionales den-
tro del cerebro después de la manipulación perinatal de sus gónadas, es conocido desde hace muchos años (20).
Asimismo, nuestro trabajo refleja un incremento en la síntesis proteica neuronal en los grupos de machos y hembras que fueron manipulados hormonalmente, y aunque los animales tratados en edad adulta muestran una tendencia a incrementar el número de AgNORs en comparación a los grupos control, las diferencias drásticas aparecen en aquellos grupos tratados en etapas muy tempranas del desarrollo. Sin embargo, este incremento en la producción de síntesis proteica no parece responder a una clara inversión hormonal, pero sí a una respuesta teratogénica de los AgNORs como efecto de la manipulación hormonal.
También hemos observado un incremento significativo en los parámetros de los AgNORs estudiados en los CCMM del grupo tratado con PT. La testosterona puede ligarse a los RA en el cerebro después de ser reducido a DHT, de la misma forma que la testosterona se liga a los receptores de estrógenos (RE) después de ser aromatizados a estradiol. Los CCMM son una estructura cerebral con células que expresan ARNm para RA en el NMM y los NML (21). Diferentes estudios han demostrado los efectos de los andrógenos y estrógenos sobre el ARN y la síntesis proteica, produciendo un incremento en esta última (22,23). Desde esta perspectiva, una mayor actividad de la enzima reductasa podría permitir la conversión del PT a DHT produciendo un mayor incremento de la síntesis proteica en aquellas neuronas que contienen RA.
Por otro lado, los resultados reflejan una mayor actividad funcional de los CCMM en el grupo de machos recién nacidos castrados, lo cual podría ser explicado como un incremento de los niveles de ARNm para RA. Los niveles que circulan de esteroides gonadales parecen regular los niveles intracelulares de RA y RE en el cerebro, y el tratamiento androgénico puede alterar los niveles de receptores de estrógenos y andrógenos (24,25). Este incremento ha sido ya demostrado en los RE del área preóptica con machos gonadectomizados (26).
Por lo tanto, de nuestros resultados se deduce que los CCMM son una estructura cerebral que presenta diferencias sexuales en la producción de síntesis proteica neuronal y que la manipulación hormonal modifica severamente la actividad de las células nerviosas de los CCMM, lo que queda puesto de manifiesto mediante el método AgNOR. Este resultado nos hace pensar más bien en una respuesta anómala o una posible acción funcional hoy sin descubrir, y no en una inversión hormonal real.
AGRADECIMIENTOS
Deseamos agradecer la ayuda prestada a las siguientes personas: Ángel Martínez-Nistal (Servicio de Análisis de Imagen, Universidad de Oviedo), Fernando Sánchez-Santed por su ayuda en el desarrollo de las técnicas quirúrgicas, Piedad Burgos y Laudino López por su asistencia técnica. Este estudio fue subvencionado por FEDER 94 y la Universidad de Oviedo (NP-97-1), España.
1 Yuan H, Bowlby DA, Brown TJ, Hochberg RB, Maclusky NJ. Distribution of occupied and unoccupied estrogen receptors in the rat brain: effects of physiological gonadal steroid exposure. Endocrinology 1995;136:96-105.
2 Roselli CE, Resko JA. The distribution and regulation of aromatase activity in the central nervous system. Steroids 1987;50: 495-508.
3 Zhou L, Blaustein JD, DeVries GJ. Distribution of androgen receptor immunoreactivity in vasopressin and oxytocin-immunoreactive neurons in the male rat brain. Endocrinology 1994; 134:2622-7.
4 Allen GV, Hopkins DA. Mamillary body in the rat: a cytoarchitectonic, Golgi, and ultrastructural study. J Comp Neurol 1989; 275:39-64.
5 Lisk RD. Increased sexual behavior in the male rat following lesions in the mamillary region. J Exp Zool 1966;161:129-36.
6 Sziklas V, Petrides M. Memory impairments following lesions to the mamillary region of the rat. Eur J Neurosci 1993;5:525-40.
7 Beracochea DJ, Jaffard R. Impairment of spontaneous alternation behavior in sequential test procedures following mamillary body lesions in mice: evidence for time-dependent interference-related memory deficits. Behav Neurosci 1987;101:187-97.
8 Becker JT, Furman MR, Panisset M, Smith Ch. Characteristics of the memory loss of a patient with Wernicke-Korsakoff''s syndrome without alcoholism. Neuropsychologia 1990;28:171-9.
9 Mair GP, Warrigton EK, Weiskrantz L. Memory disorder in Korsakoff psychosis. A neuropathological and neuropsychological investigation of two cases. Brain 1979;102:749-83.
10 Don Carlos LL, McAbee M, Ramer-Quinn DS, Stancik DM. Estrogen receptor mRNA levels in the preoptic area of neonatal rats are responsive to hormone manipulation. Dev Brain Res 1995;84:253-60.
11 Beato M, Arnemann J, Chalepakis G, Slater E, Willmann T. Gene regulation by steroid hormones. J Steroid Biochem 1987;27:9-14.
12 Paxinos G, Watson C. The rat brain in stereotaxic coordinaties. In: Harcourt Brace, Jovanovich Publishers. New York Academic Press; 1986. p. 166.
13 Ploton D, Menager M, Jeannesson P, Himber G, Pigeon F, Adnett JJ. Improvement in the staining and in the visualization of the argyrophilic proteins of the nuclear organizer region at the optical level. Histochem J 1986;18:5-14.
14 Hernández-Verdún D. The nucleolar organizer regions. Biol. Cell 1983;49:191-202.
15 Tröster H, Spring H, Meissner B, Schultz P, Onder P, Trendelenburg MF. Structural organization of an active chromosomal nucleolar organizer region (NOR) identified by light microscopy and subsequent TEM and STEM electron microscopy. Chromosoma 1985;91:151-63.
16 González-Pardo H, Gutiérrez S, Menéndez PA, Arias JL. Postnatal development of argyrophilic nucleolar organizer regions in the mamillary body of undernourished rats. Brain Res 1994; 527:116-22.
17 Lafarga M, Andrés MA, Berciano MT, Maguieri E. Organization of nucleoli and nucleolar bodies in osmotically stimulated supraoptic neurons of the rat. J Comp Neurol 1991;308:329-33.
18 Crocker J, Nar P. Nucleolar organizer regions in lymphomas. J Pathol 1987;151:111-8.
19 López L, Braña M, Burgos P, Arias JL. Structural dimorphism in the mamillary bodies of the rat. Neurosci Lett 1994;176:197-200.
20 MacLusky NJ, Naftolin F. Sexual differentiation of the central nervous system. Science 1981;211:1294-303.
21 Simerly RB, Chang C, Muramatsu M, Swanson LW. Distribution of androgen and estrogen receptor mRNA-containing cells in the rat brain: an in situ hybridization study. J Comp Neurol 1990;294:76-95.
22 Cohen RS, Chung SK, Pfaff FW. Alteration by estrogen of the nucleoli in nerve cells of the rat hypothalamus. Cell Tissue Res 1984;235:485-9.
23 Berliner JA, Gerschensen LE. Sex steroid induced morphological changes in primary uterine cell cultures. J Steroid Biochem 1976;7:153-8.
24 Handa RJ, Reid DL, Resko JA. Androgen receptors in brain and pituitary of female rats: cyclic changes and comparisons with the male. Biol Reprod 1986;34:293-303.
25 Krey LC, MacLusky NJ, Davis PG, Lieberburg I, Roy EJ. Different intracellular mechanisms underlie testosterone suppression of basal and stimulation of cyclic luteinizing hormone release in male and female rats. Endocrinology 1982;110: 2159-67.
| Figura 1.AgNORs teñidos de células del núcleo mamilar medial (NMM) en ratas adultas A: hembras tratadas con propionato de testosterona. B: machos castrados de recién nacidos. C: control. Barra: 5 µm (x 2.000). |
Alteraciones en los cuerpos mamilares de ratas adultas después de la manipulación hormonal en períodos neonatal y adulto3
2,5
2
1,5
1
0,5
0
PTrn
MCrn
HCad
MCad
Machos
Estro
Diestro
// * *+++****............
..
..
////////////////////////////////////////////////**............
..
..
............
..
..
*Media del número de AgNOR/NO**ooOooOooNMLdNMLiNMM
| Figura 2.Media del número de AgNORs por neurona ± ESM para cada uno de los núcleos de los CCMM estudiados. Los datos fueron analizados por una ANOVA, que reflejó la existencia de diferencias significativas (p < 0,05) entre los grupos control y los grupos tratados. La prueba a posteriori de Tukey reveló diferencias estadísticamente significativas (p < 0,001) entre: (o) el grupo control de machos con cada uno de los cuatro grupos tratados; (oo) el grupo de hembras estro con cada uno de los cuatro grupos tratados; (*) el grupo de hembras diestro con cada uno de los cuatro grupos tratados; (**) el grupo PTrn con cada uno de los grupos control y con MCrn pero no con MCad y con HCad; (+) el grupo MCrn con todos los grupos. |
| Hembras tratadas con propionato de testosterona recién nacidas (PTrn); machos castrados recién nacidos (Mcrn); hembras adultas castradas (HCad) y machos adultos castrados (MCad). |
14,00
12,00
10,00
8,00
6,00
4,00
2,00
0,00
Machos
Estro
Diestro
PTrn
MCrn
//HCad
MCad
* *******++**+oo............
..
..
oo............
..
..
////////////////*OOoo............
..
..
% AgNOR/NO////////////////////////////////ONMLdNMLiNMM
| Figura 3.Área de AgNOR por neurona (AgNORs/N) (%) ± ESM. Los valores representan la media del porcentaje del área de cada núcleo que es ocupado por el AgNORs. Los datos fueron analizados por una ANOVA, los cuales reflejan la existencia de diferencias significativas (p < 0,05) entre los grupos control y los grupos tratados. La prueba a posteriori de Tukey reveló diferencias estadísticamente significativas (p < 0,001) entre: (o) el grupo control de machos con PTrn y MCrn pero no con HCad y MCad; (oo) el grupo de hembras estro con PTrn y MCrn pero no con HCad y MCad; (*) el grupo de hembras diestro con PTrn y Mcrn pero no con HCad y MCad; (**) el grupo de PTrn con todos los grupos menos con Mcrn; (+) el grupo de MCrn con todos los grupos menos con PTrn. |
| Hembras tratadas con propionato de testosterona recién nacidas (PTrn); machos castrados recién nacidos (Mcrn); hembras adultas castradas (Hcad) y machos adultos castrados (Mcad). |
BIBLIOGRAFÍA