La existencia de un ductus arterioso fetal aneurismático es un diagnóstico infrecuente. Los motivos pueden ser varios. No se trata de una de las cardiopatías fetales que se busque rutinariamente y, en general, es una entidad poco conocida y de aparición rara. Sin embargo, saber de su existencia de forma prenatal es importante, pues tras el nacimiento puede causar una clínica que es preciso reconocer. Se presenta un caso de diagnóstico fetal con las imágenes correspondientes.
The existence of an aneurysmatic ductus arteriosus, is rarely diagnosed. There may be several reasons. It is not one of the routinely looked for foetal heart diseases, and is generally a liitle known condition that rarely occurs. However, to be aware of its existence in the prenatal stage is important as it may cause an post-natal illness that requires a diagnosis. A case is presented of a foetal diagnosis along with its images.
El aneurisma del ductus arterioso (ADA) se puede producir de manera espontánea (es el caso en nos centraremos) o como complicación quirúrgica tras el cierre de un ductus persistente1. La frecuencia del aneurisma ductal espontáneo es baja y los casos asintomáticos pueden pasar inadvertidos. En la ecografía, el ductus se muestra dilatado y fusiforme2. Muchos neonatos afectados son asintomáticos, pues el conducto arterioso se cierra espontáneamente; sin embargo, en otros casos aparece clínica como disnea, otros síntomas respiratorios, fenómenos tromboembólicos e incluso la rotura ductal y la muerte del paciente1. Por todo ello, el diagnóstico prenatal y el seguimiento cardiológico de estos niños son importantes.
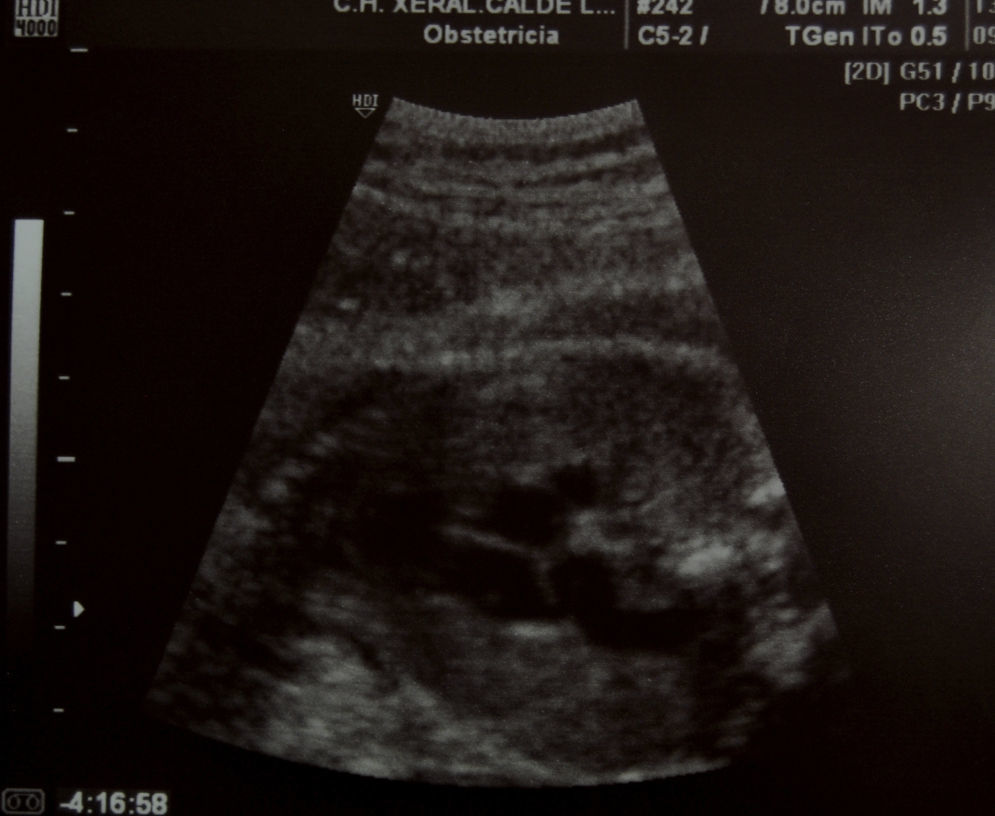
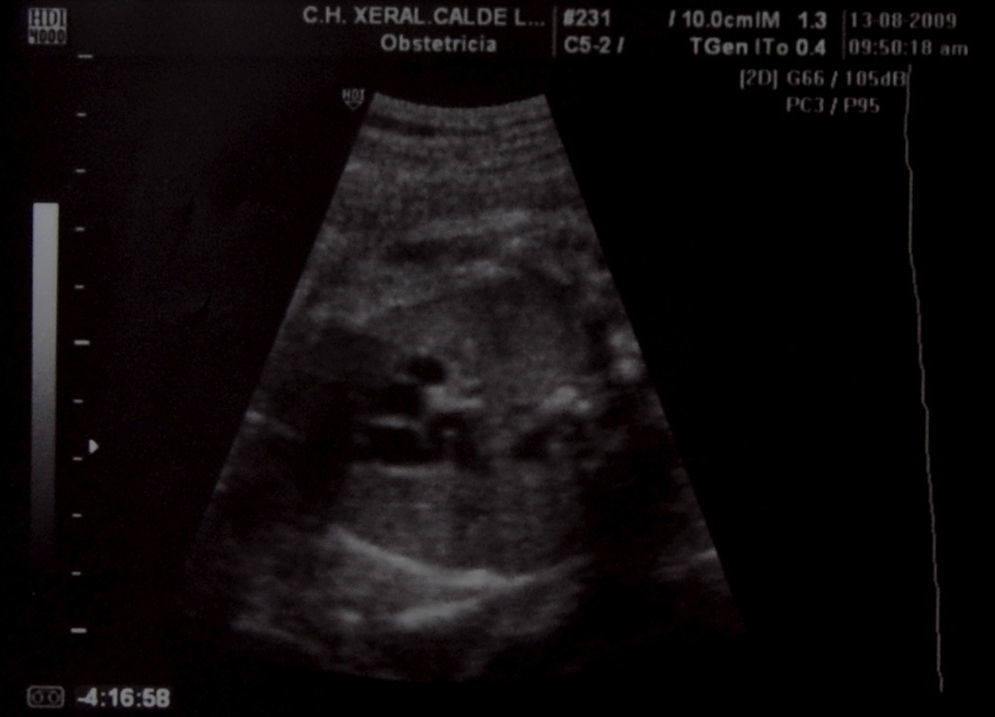
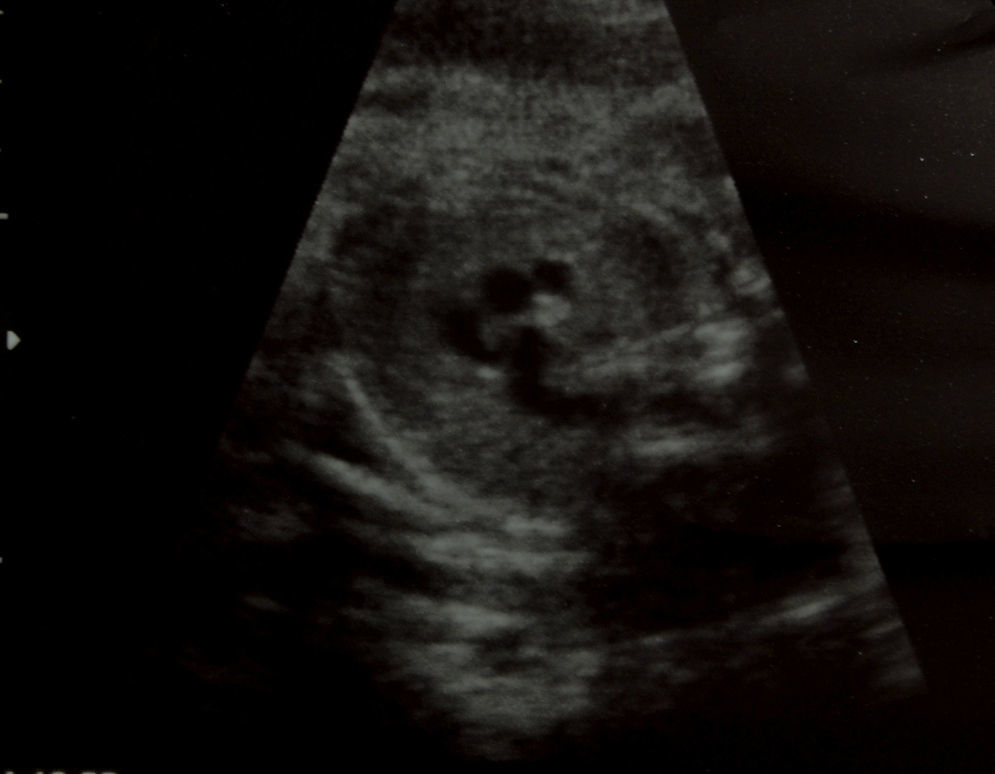
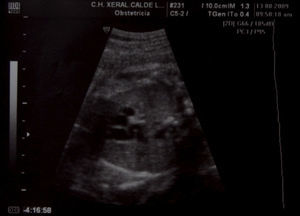
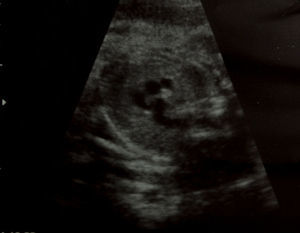
Caso clínicoPresentamos el caso de una gestante de 37 años, en el curso de su primer embarazo, fumadora de 10 cigarrillos al día. No tomaba medicación más allá de los habituales suplementos de ácido fólico y yodo, y no presentaba antecedentes familiares de interés; tampoco su pareja. No conocían casos de cardiopatías en sus respectivas familias, pero si declaró que su hermana había presentado un soplo cardíaco en la infancia. No tenía enfermedades de interés. Las analíticas de rutina, las ecografías, los cribados de cromosomopatías y el cribado de diabetes gestacional fueron normales. Hasta la semana 34, durante la ecografía de tercer trimestre, no se detectó la existencia de un ductus arterioso aneurismático. A nivel de los cortes 3V y 3VT, es decir, en los cortes ecográficos en los que aparecen los grandes vasos que salen del corazón, la vena cava superior, la aorta y el tronco pulmonar (3V), además de la tráquea (3VT), apreciamos un hallazgo insólito. Había un vaso de calibre considerable (similar o superior al de la aorta ascendente), de trayecto serpiginoso y diámetro diferente en sus diversas zonas. Este vaso se originaba en las inmediaciones del lugar donde el tronco arterial pulmonar da sus dos ramas y, de manera serpenteante, ganando tamaño, se dirigía a la aorta (fig. 1–3). En su extremo distal tenía un diámetro aproximado de unos 6mm. Cabe destacar que el resto del estudio del corazón fetal era normal y no se apreciaban indicios de alteraciones morfológicas o hemodinámicas. El arco aórtico se mostraba normal. El flujo en el ductus arterioso y venoso era normal. Asimismo, respecto de la morfología fetal, no se detectaron hallazgos patológicos, como malformaciones arteriovenosas o shunts que pudieran justificar la existencia de un ductus aneurismático.
En la semana 41 y 3 días nació un varón de 3.520g, tras un parto eutócico. La puntuación en la prueba de Apgar del recién nacido fue de 9/10. Presentaba un soplo sistólico 1-2/6, de características funcionales. El estudio electrocardiográfico del paciente reveló un ritmo sinusal normal a 130 latidos/min. No se detectan alteraciones en la adaptación al medio en las primeras horas de vida (salvo un episodio de bradicardia autolimitada durante unos minutos, que registraron las monitorizaciones del recién nacido). Se solicitó estudio al servicio de cardiología, que informó de la existencia de una membrana oval adelgazada, con paso mínimo e intermitente a su través. Se observó una insuficiencia tricuspídea leve, con gradiente de presión ventrículo derecho-aurícula derecha de 23 mmHg; un mínimo ductus arterioso, aunque no se observó flujo de éste en el extremo pulmonar; el corazón era estructuralmente normal y el ductus arterioso persistente era mínimo. Por ello, se desestimó proponer tratamiento, con control por parte del servicio de cardiología pediátrica al año.
DiscusiónEl ADA es una lesión infrecuente, pero potencialmente letal para el individuo. Consiste en una dilatación ductal de forma sacular o fusiforme. Puede ser espontáneo (primario), que es el caso que presentamos, o aparecer de manera posquirúrgica tras ligar un ductus persistente tras el nacimiento (secundario)1.
La incidencia del ADA es desconocida. De hecho puede aparecer a cualquier edad, pero es más común en niños de menos de 2 meses de edad. En 1991, Lund et al1 recopilaban y revisaban 106 casos de ADA primarios publicados en la literatura científica. El hecho es que cada día se reconocen más y mejor los casos, por lo que creemos que la verdadera incidencia está infraestimada pues muchos casos no reconocidos se resuelven espontáneamente.
El mecanismo que origina estas dilataciones aneurismáticas espontáneas es desconocido. Existen varias teorías diferentes, pero ninguna resulta ninguna enteramente satisfactoria1. En 1947 Helen Taussig sugería que el retraso en el cierre del margen aórtico tras el nacimiento sería resultado de la exposición de la debilitada pared del vaso a las presiones sistémicas, lo que conduciría a la formación del aneurisma. De hecho, está constatado que en pacientes neonatales el margen aórtico está abierto en todos los casos, mientras que el lado pulmonar sólo está abierto en un 30% de casos.
Otras teorías hablan de debilitamiento congénito de la pared del vaso. Lund et al1 describen una teoría en la que el flujo incrementado intraútero a través del vaso causaría el aneurisma ductal, basándose en dos casos asociados a shunts arteriovenosos (un angioma hepático con dilatación de cavidades derechas del corazón y un aneurisma de la vena de Galeno). Algunas hipótesis adicionales relacionan el ADA con patologías como las alteraciones del tejido conectivo en los síndromes de Marfán, Ehlers-Danlos, Larsen, etc.
El primer caso de diagnóstico prenatal de esta patología fue publicado por el grupo de Romero et al2 en 1995. Posteriormente, han ido apareciendo otros casos en la literatura científica3,4. Jackson et al5 señalan la importancia de realizar el conocido como corte de los tres vasos, además de los cortes estándar usados en ecocardiografía fetal, si queremos diagnosticar el ADA.
Desde el punto de vista clínico, puede ser asintomático y resolverse espontáneamente. Otras veces el ADA cursa con disnea u otros síntomas respiratorios debido a la afectación del nervio laríngeo recurrente o del frénico6. Es también posible que cause la erosión de la pared de un bronquio o del esófago. En ocasiones, puede ser origen de un soplo auscultatorio. Las dos complicaciones más temidas son los procesos tromboembólicos (debido a la dilatación y tortuosidad del vaso) y la rotura (que suele causar la muerte)1.
Cuando es necesario el tratamiento, la cirugía es la opción preferida1.
Dyamenahalli et al7 presentan una serie de 24 casos, 15 de diagnóstico posnatal (13 casos de niños de menos de 2 meses) y 9 casos de diagnóstico prenatal (todos diagnosticados después de las 33 semanas). De los 24 sujetos, sólo 4 tenían síntomas atribuibles a ADA y 6 tenían síndromes asociados: Marfán, Smith-Lemli-Optiz, trisomía 21, trisomía 13 y un posible síndrome de Ehlers-Danlos. Tres casos sufrieron complicaciones: presencia de un trombo que se extendía hasta la arteria pulmonar, una rotura espontánea y un infarto cerebral asintomático. Seis casos precisaron resección quirúrgica del vaso por la persistencia, el tamaño o la extensión de un trombo; 5 de los 24 casos fallecieron, pero sólo un caso debido directamente al ADA. En 4 casos se pudo estudiar la histología y se encontró evidencia de expresión anormal de la elastina (en dos ocasiones) y reducción de la capa íntima en otros 2 casos.
Acherman et al8 presentan 11 casos de neonatos afectados; 6 presentaron evidencia de distrés fetal, 2 fueron diagnosticados prenatalmente y en 6 de los casos existía evidencia de masa mediastínica en la radiografía de tórax. En 8 pacientes la dilatación aneurismática desapareció espontáneamente en un plazo de 5 a 10 días. Se realizó cirugía en 3 casos, en 1 por persistencia de ADA tras 11 días y en 2 casos por trombosis del ADA.
Jan et al9 presentan una serie amplia exclusivamente en neonatos. Son 48 casos diagnosticados por ecocardiografía, sobre 548 estudios de recién nacidos a término. Todos ellos estaban asintomáticos. En el 70,2% el ADA desapareció entre el día 7 y 35. El 29,8% presentaba evidencia de la formación de un trombo, aunque éste desapareció espontáneamente en todos ellos y el ductus se cerró en el período de un mes. Esta serie presentó una alta incidencia de ADA comparada con todas las anteriores. También presentó una evolución mucho más favorable de los casos que las otras. Los autores postulan que el ADA en el recién nacido sería parte del proceso de cierre espontáneo del ductus.
En el paciente de nuestro caso, el ADA no fue origen de clínica en el período neonatal y evolucionó hacia la resolución. Sin embargo, y debido a la posibilidad de graves consecuencias, sería aconsejable prestar atención a esta alteración vascular. Para ello se recomienda extender la exploración ecocardiográfica fetal a los segmentos 3V y 3VT en la ecografía del tercer trimestre. Posteriormente, estos recién nacidos precisarán seguimiento cardiológico hasta constatar el cierre del aneurisma. Debemos tener también en cuenta que estos fetos pudieran ser portadores de anomalías del tejido conectivo.
Al Servicio de Cardiología Infantil del Complexo Hospitalario Universitario de La Coruña, por el apoyo prestado en el diagnóstico y el seguimiento de las cardiopatías fetales.