El bloqueo cardiaco congénito (BCC) es una entidad poco frecuente que se presenta con una incidencia de 1 entre 11.000-20.000 recién nacidos1,2.
Se presenta un caso de bloqueo aurículo-ventricular completo (BAVC) de causa inmune en el que destaca un buen resultado perinatal al implantar marcapasos al nacimiento, a pesar de la alta morbimortalidad reflejada en la literatura.
Los anticuerpos Anti-Ro (SS-A) están presentes en un 95% del BCC de causa inmune, aunque sólo un 5% de las mujeres con positividad para ellos tienen hijos afectados2.
El diagnóstico se realiza mediante ecografía, al visualizar bradicardia fetal persistente con disociación aurículo-ventricular y en ausencia de otras alteraciones estructurales y de patología infecciosa.
En dos tercios de los casos precisan implantación de marcapasos al nacimiento1.
The congenital complete heart block is a rare condition which is only found in one in 11.000 – 20.000 newborns1,2.
We report one case of congenital heart block with a good perinatal outcome after a pacemaker implant at birth, despite the high morbidity and mortality of this condition reported in the literature.
Anti-Ro (SS-A) antibodies are associated with immune-mediated congenital heart block in 95% of cases, although only 5% of the woman who are likely to have these antibodies give birth to children affected by this disease. The diagnosis is carried out using ultrasonography, by visualizing a bradycardia with atrial-ventricular dissociation and the absence of other congenital structural heart disease and congenital infection1.
In two thirds of cases a post-natal pacemaker implantation is needed1.
Se presenta un caso de bloqueo aurículo-ventricular completo (BAVC) fetal en una paciente asintomática durante toda la gestación, en la que se detectó positividad para anticuerpos anti-Ro.
El BAVC se manifiesta con una bradicardia fetal mantenida, que en ausencia de alteraciones estructurales o infecciosas, sugiere una causa inmune.
No fue preciso realizar tratamiento prenatal, implantándose un marcapasos al nacimiento, con buena evolución posterior.
Caso clínicoPaciente de 31 años, sin antecedentes de interés y dos gestaciones previas a término con recien nacidos sanos. G3P2. Gestación normocontrolada, analíticas rutinarias y serológicas dentro de la normalidad.
Amniocentesis por riesgo alto para síndrome de Down en el screening del I trimestre: 46 XX cromosómicamente normal.
En la ecografía morfológica de la semana 20 se aprecia bradicardia fetal mantenida a 80-90lpm, sin otras alteraciones estructurales evidentes.
Se solicita ecocardiografia fetal a centro de referencia informando de corazón estructuralmente normal, situación hemodinámica estable, y presencia con frecuencia auricular a 150-170lpm y frecuencia ventricular 50-65lpm.
En sucesivos controles se mantienen los parámetros antes citados, asociándose insuficiencia tricuspídea leve-moderada, y sin visualizar signos de hidropesía fetal.
Ante la ausencia de alteraciones estructurales cardiacas y signos de infección fetal se solicita estudio de autoinmunidad materno, resultando positividad para Anti-Ro (SS-A): 52 y ANA: 1/1280 (patrón moteado) y negatividad para Anti-La(SS-B), Anti-RNP, Anti-Sm, Anti-DNA, C3, C4, y anticuerpos anticardiolipina. La paciente se encuentra durante toda la gestación asintomática y niega cualquier síntoma sugestivo de colagenopatía.
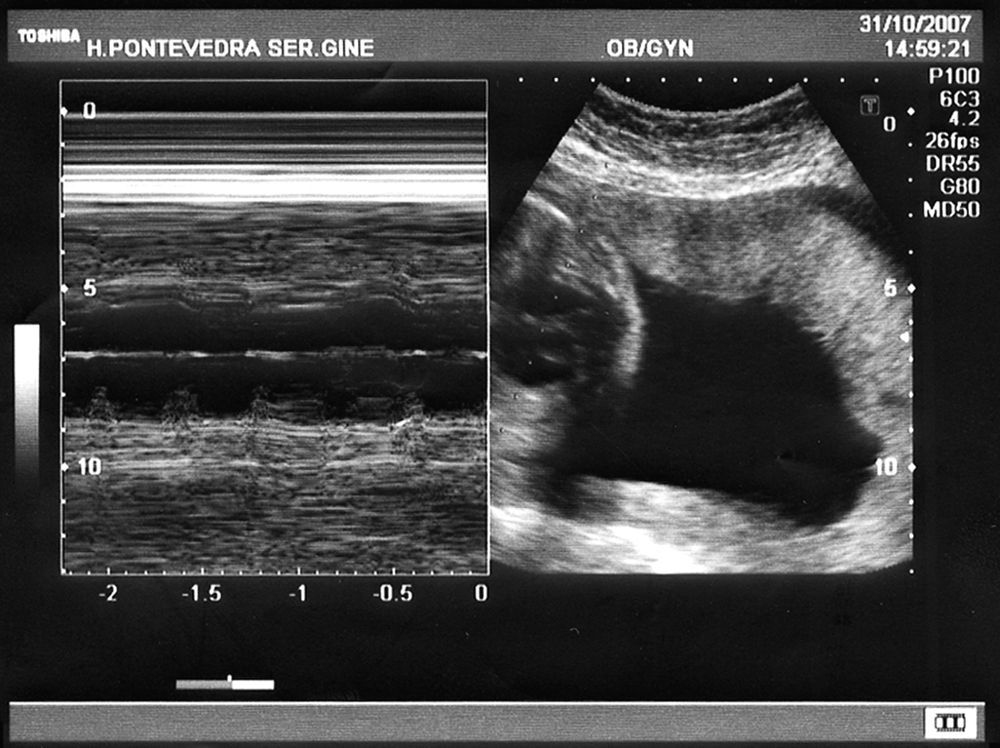
En sucesivos controles se mantiene bradicardia fetal entre 52-55lpm (fig. 1), sin signos de hidrops, ni descompensación hemodinámica, por lo que se decide conjuntamente con el centro de referencia, no instaurar tratamiento prenatal. Con el diagnóstico de BAVC de causa inmune se deriva a la paciente a centro de tercer nivel para posibilidad de tratamiento fetal al nacimiento.
Se finaliza gestación mediante cesárea electiva en la semana 37, naciendo una mujer de Apgar: 9-10 y peso 3550g.
Al 3° día de vida se implanta un marcapasos con buena evolución posterior durante el primer año de vida.
DiscusiónEl BAVC es una entidad poco frecuente, que se manifiesta por una bradicardia fetal mantenida.
En un estudio reciente se ha visto que la edad y la paridad son factores de riesgo adicionales que incrementan el riesgo de bloqueo cardíaco congénito (BCC)3.
Se asocia a cardiopatías estructurales con una incidencia del 162 a 53%1 de los casos según las series publicadas, siendo la más frecuente el isomerismo ventricular izquierdo y menos la comunicación aurículo-ventricular, la transposición de los grandes vasos y la hipoplasia pulmonar1,2.
Igualmente hay que descartar colagenopatías maternas, a veces no diagnosticadas antes de la gestación, como el síndrome de Sjogren, enfermedad mixta del tejido conectivo o vasculitis leucocitoclástica, y sobre todo lupus eritematoso sistémico.
El 50% de las pacientes, como en este caso, están asintomáticas en el momento del diagnóstico y pueden desarrollan posteriormente una colagenopatía3.
Se han descrito casos no asociados ni a autoinmunidad ni a alteraciones estructurales, que se resuelven espontáneamente en todas las pacientes4.
El BAVC se diagnostica por ecografía fetal con modo M (fig. 1) y eco Doppler, complementada con ecocardiografía. La frecuencia ventricular oscila entre 45-80 lpm, asociándose a peor pronóstico cuando desciende de 55 lpm1.
En las pacientes con riesgo de BCC, se aconseja evaluación ecográfica y controles frecuentes debido a que el desarrollo de un bloqueo tercer grado y miocardiopatía en algunos casos se ha descrito en el plazo de una semana de un ecocardiograma normal y sin aparición previa de bloqueo de primer grado5.
Es preciso descartar otras causas de bloqueo tales como infecciones fetales u otras alteraciones estructurales cardiacas, llegando al diagnóstico de BAVC de causa inmune por la presencia de positividad para anticuerpos en la gestante1.
Los anticuerpos Anti-Ro (SS-A) presentes en esta paciente, se asocian en un 95% de los casos con el BCC, reforzándose la hipótesis de que estos anticuerpos tienen función patógena con efectos inflamatorios y antiarritmogénicos en el sistema de conducción cardiaco fetal2,5,23.
El riesgo de que una madre con anticuerpos presente un hijo con bloqueo congénito es del 0,5-2% durante la primera gestación y del 10-17% con el 2° hijo5–7.
Se ha descrito la presencia de signos de bloqueo de primer grado en 1/3 de estas mujeres, revirtiendo espontáneamente en la mayoría de los casos8.
Se han barajado distintas terapéuticas durante la gestación para los fetos con BCC, aunque este es un tema que permanece en discusión9. En esta paciente no se instauró tratamiento por estar asintomática y no asociarse a signos fetales de mal pronóstico.
Se ha planteado tratamiento con corticoides y β-agonistas en la mayoría de los estudios, y aunque no hay unanimidad en las recomendaciones, se ha demostrado beneficioso con un incremento en la supervivencia, en fetos con BAVC de peor pronóstico, como una frecuencia ventricular <55lpm, hidropesía fetal, miocardiopatía, signos de descompensación cardiaca o fallo cardiaco fetal11–15. Ambos tratamientos han demostrado ser útiles en la prevención de la inflamación miocárdica con incremento del gasto y la frecuencia cardiaca y revirtieron el hidropesía en algunos casos obteniendo mejores resultados en los fetos con BCC de causa inmune que en aquellos asociados a cardiopatías congénitas12–18. También se ha demostrado su eficacia en los BCC de 1° y 2° grado para prevenir el paso a AVC14,15,22.
Se ha publicado recientemente que los corticoides a altas dosis administrados prenatalemente, no tienen efectos negativos en el desarrollo neuropsicológico de los niños9,10.
Otra alternativa propuesta al tratamiento es la plasmaféresis para reducir la tasa de anticuerpos maternos, pero son necesarios más estudios17.
En cuanto a la prevención de BCC en madres con positividad para anticuerpos anti-Ro (SS-A), en los últimos artículos publicados no se recomienda tratamiento profiláctico con corticoides fluorados, incluso en aquellos casos que tengan un hijo anterior afecto de BCC o rash cutáneo7,19. En estos casos se recomienda comenzar con un estudio de ecocardiograma y Doppler cada dos semanas al menos desde la semana 16, con el objetivo de detectar anormalidades tempranas como contraciones atriales prematuras, derrame pericárdico o ritmo irregular, que puedan sugerir instaurar tratamiento19–22. Los corticoides no fluorados (prednisona o derivados) son recomendados sólo por indicaciones maternas19,23.
En cuanto al pronóstico el BAVC fetal detectado intraútero se asocia con una alta morbimortalidad, estimada en aproximadamente un 21% antes o después del nacimiento. Se asocia generalmente a frecuencia ventricular <55lpm siendo el marcador más importante de mal pronóstico es la hidropesía fetal y presencia de defectos cardiacos congénitos como isomerismo ventricular izquierdo19–21.
En nuestro caso destaca la sorprendente evolución favorable intrauterina, a pesar de asociar frecuencia ventricular alrededor de los 55lpm no se desarrolló hidropesía ni otros signos de mal pronóstico, por lo que no se instauró tratamiento, consiguiendo buenos resultados perinatales.
Las frecuencias ventriculares <60lpm, se han asociado con requerimiento de implantación de marcapasos al nacimiento y/o miocardiopatía22–24.
La atención al parto de estas gestantes deben ser realizada en un centro de tercer nivel con un equipo médico multidisciplinario y entrenado en la atención a estos recién nacidos y en la implantación de un marcapasos, que es preciso en dos tercios de los casos1,22–24. Se consideran indicaciones para la colocación de un marcapasos permanente síntomas de bradicardia y disfunción ventricular como el ritmo de escape con complejos anchos, la ectopia, la prolongación del intervalo Q-T y la cardiomegalia22–24.
Esta descrita la colocación de un marcapasos intraútero con resultado de muerte fetal por hidropesía1.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.