INTRODUCCIÓN
El carcinoma adenoide quístico (CAQ) de la mama es una entidad anatomopatológica poco frecuente. La primera descripción de la evolución clínica y el aspecto histológico del CAQ se debe a Robin en 1853. En las publicaciones ha aparecido con diferentes términos: cilindroma, adenocarcioma quístico, etc.; la nomenclatura actual considerada más apropiada es acuñada por Ewing como carcinoma adenoide quístico1. El CAQ se puede identificar en distintos órganos como las vías aéreas superiores, glándulas salivales, nasofaringe, próstata, glándulas de Bartholino, el cuello uterino o la glándula mamaria. La frecuencia relativa de este tumor es del 0,07-0,1%2.
Con respecto a este tema, se propone el siguiente caso clínico con sus hallazgos histopatológicos característicos que permiten hacer una diferenciación en el manejo clínico, el tratamiento y la evolución de las neoplasias mamarias más frecuentes: ductal y lobulillar.
CASO CLÍNICO
Paciente de 69 años que presenta nódulo en cuadrante superexterno derecho de 2 cm de morfología ovalada que no retrae la piel. Entre sus antecedentes familiares destacan: padre fallecido por carcinoma de pulmón, madre fallecida por cáncer gástrico, tía paterna afectada por carcinoma mamario.
Entre sus antecedentes personales se encuentran: faquectomía derecha y amigdalectomía, extirpación de quiste sebáceo cervical y liberación de tunel carpiano e intolerancia a antiinflamatorios no esteroideos (AINE). Menarquia a los 12 años, menopausia a los 55, primer parto a los 22 años y lactancia materna. No consumió previamente anticonceptivos orales ni realizó tratamiento hormonal sustitutivo en el climaterio.
Había realizado controles (con exploración física y mamografías periódicas regladas), hasta el momento de inicio de la clínica, compatibles con la normalidad.
Acudió a la Unidad de Mama por hallazgo de un nódulo sospechoso en la mama derecha. En la mamografía bilateral se observa en el cuadrante superoexterno una radiopacidad asimétrica con distorsión arquitectural. En la ecografía mamaria y axilar derecha se evidencia un área hipoecoica de 15 mm de contornos irregulares en la que se realiza punción-aspiración con aguja fina. No presenta adenopatías axilares patológicas.
Con el diagnóstico citológico de carcinoma adenoide quístico (CAQ), se procede a realizar mastectomía conservadora y linfadenectomía axilar derecha de los niveles I y II, y se obtiene una pieza tumoral de 1,5 x 2,5 x 1 cm, sin afección axilar (10 ganglios con linfadenitis reactiva), con bordes libres de neoplasia (a más de 1,5 cm), receptores estrogénicos negativos, receptores de progesterona negativos, P53 negativa, cerbB2 negativo, Bcl-2 positivo, Ki-67: índice proliferativo bajo, de carcinoma adenoide quístico.
Se completa el estudio de extensión con radiografía de tórax, ecografía abdominal, gammagrafía ósea y analítica completa con funciones hepática y renal, hemograma y marcadores tumorales. El diagnóstico definitivo es CAQ pT2N0M0.
Después de la cirugía conservadora, la paciente se trató con radioterapia adyuvante (50 Gy). No recibió tratamiento con quimioterapia complementaria por el buen pronóstico de esta histología tumoral. Tampoco se instaruró hormonoterapia por tener receptores hormonales negativos.
En la actualidad no se evidencian datos de recidiva, y hasta el momento permanece libre de enfermedad (intervalo libre, 2 años).
DISCUSIÓN
El CAQ se puede identificar en vías aéreas superiores, glándulas salivales, nasofaringe, próstata, glándulas de Bartholino, cuello uterino o mama. En todas estas localizaciones su aspecto histológico es similar, pero la evolución clínica, muy variable. En las localizaciones extramamarias el comportamiento es agresivo; sin embargo, en la mama tiene una historia natural favorable, con mejor pronóstico que los carcinomas de histología más frecuente; de ahí la importancia de su correcto diagnóstico3.
La frecuencia de aparición es muy baja2. Afecta más frecuentemente a mujeres entre la quinta y la sexta décadas de la vida, aunque el rango de edad puede ser amplio (31-90 años). Se ha descrito también una decena de casos en el varón. No se ha observado relación entre los antecedentes familiares y el CAQ ni con el estado premenopáusico o posmenopáusico de la mujer, pero puede asociarse a otras afecciones mamarias, como adenofibroma, mastopatía fibroquística y carcinomas ductal y lobulillar infiltrantes4.
Clínicamente, su inicio suele ser como una masa palpable única, bien delimitada, indolora, generalmente localizada en las regiones centrales o subareolares. Es muy rara la afección multicéntrica o contralateral; excepcionalmente puede causar dolor si hay infiltración perineural, y puede ser fluctuante si el componente quístico es importante5.
Mamográficamente, la imagen más común es un nódulo de bordes bien delimitados, densidad homogénea y sin microcalcificaciones. Por ecografía se observa una masa sólida hipoecoica de bordes más o menos irregulares. Raramente se presenta como una lesión lobulada, masa mal delimitada o como una simple densidad asimétrica. Ocasionalmente se han descrito microcalcificaciones6.
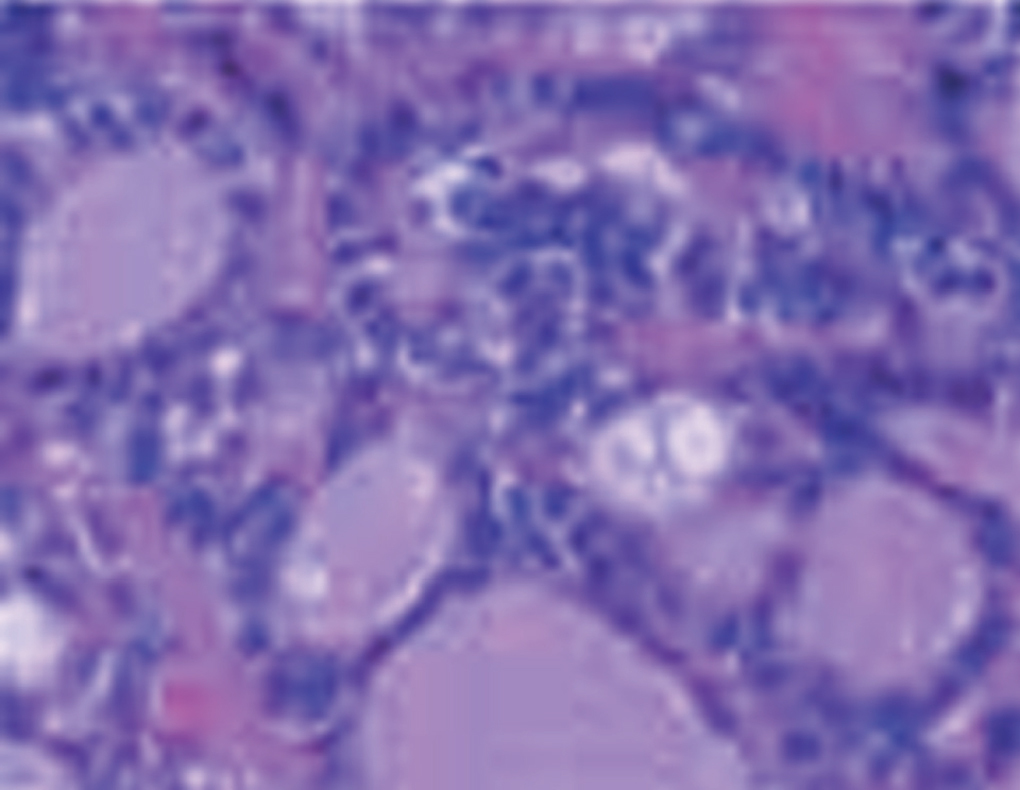
Microscópicamente es una lesión bien delimitada amarillento-grisácea o amarillenta con zonas mucoides grises, casi siempre no encapsulada. Al microscopio óptico se visualizan 2 tipos de células: un componente epitelial, que forma estructuras similares a ductos que contienen mucina PAS positiva, y otro estromal prominente compuesto por células mioepiteliales azul Alcián positivas; en conjunto presenta un aspecto cilindromatoso7 (fig. 1).
Figura 1.Estructura ductal con mucina en su interior.
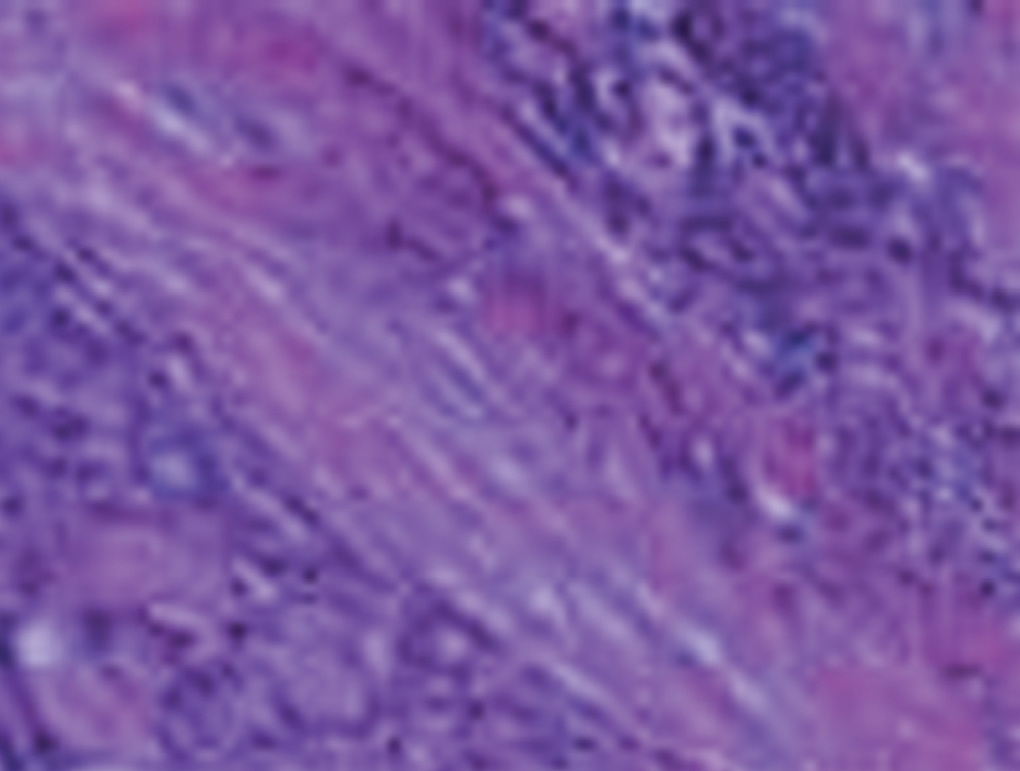
Ro et al describen 3 grados histológicos basándose en el sistema utilizado para el CAQ de glándulas salivales: grado I (tumor totalmente glandular y quístico), II (constituido por menos del 30% de componente sólido) y III (cuando el componente sólido supera el 30%). La microscopia electrónica confirma la doble estirpe celular, las células epiteliales poseen un núcleo regular y un citoplasma rico en glucógeno con numerosas mitocondrias y microvellosidades en su polo apical. Las células mioepiteliales son más grandes, alargadas y con miofibrillas densas en el citoplasma8. Los estudios inmunohistoquímicos con anticuerpos marcados objetivan positividad para proteína S-100, vimentina, actina, miosina, glucoproteínas y colágeno; con una tendencia a la diferenciación mioepitelial y una positividad para la citoqueratina y el antígeno de membrana, a favor de la diferenciación epitelial9 (fig. 2).
Figura 2. Visualización de sus 2 componentes, epitelial y estromal.
Se describe positividad para antígenos de estrógenos y progesterona en el 25% de los casos. La negatividad de los receptores hormonales no está relacionada, a diferencia de otras histologías, con un peor pronóstico ni con una pérdida de la diferenciación celular. Tienen un índice de proliferación bajo y no suelen expresar mutaciones del P5310.
La anatomía patológica nos permite hacer el diagnóstico diferencial con otras entidades: carcinoma ductal con crecimiento cribiforme, carcinoma cribiforme invasivo, mucinoso, papilar, colágeno-esferulosis, adenoma pleomórfico e hiperplasia epitelial.
Su evolución es más favorable que otras neoplasias mamarias (afección axilar muy infrecuente y no predictiva de recidiva local ni de diseminación a distancia). Se ha relacionado el grado histológico con el comportamiento biológico del tumor, y algunos autores lo consideran factor pronóstico. La expresión de receptores hormonales no se considera como determinante de su evolución. Pastolero defiende que la sobreexpresión de P53 implicaría un peor pronóstico, pero no lo confirman otros autores. El factor más importante de recidiva local es el tratamiento quirúrgico inicial realizado (mastectomía radical frente a conservadora o tumorectomía), en relación con la presencia de tumor microscópico en los márgenes de resección. Aunque en este caso se ha realizado una cirugía conservadora y en las publicaciones revisadas parece indicarse el tratamiento quirúrgico radical, la paciente recibió radioterapia adyuvante, 50 Gy, actitud defendida por algunos autores, pues su radiosensibilidad se parece a la del CAQ del ámbito de la otorrinolaringología. Dado el bajo porcentaje de afección axilar y su escaso valor pronóstico, la disección axilar no está recomendada salvo que existiesen adenopatías palpables.
Tampoco hay datos que apoyen la utilidad de una quimioterapia adyuvante (en la paciente únicamente se realiza seguimiento), y sólo habría lugar a la hormonoterapia si los receptores hormonales fuesen positivos. El manejo recomendado de las recidivas locales es el tratamiento quirúrgico radical.
La diseminación a distancia es rara, con un riesgo de metástasis del 8-12%. El 80% de los pacientes con enfermedad diseminada no tiene afección ganglionar previa, lo que indica una diseminación hematógena. Las metástasis son de aparición tardía y se localizan en el pulmón, sobre todo, y también en el hígado, los huesos, el riñón, la pleura y el sistema nervioso central.
En relación con la quimioterapia en la enfermedad a distancia, no hay suficiente evidencia por su escasa casuística, pero parece indicado el empleo de fármacos activos en el CAQ otorrinolaringológico: cisplatino, adriamicina, docetaxel y ciclofosfamida, entre otros. La supervivencia a los 5 años es cercana al 85% incluso tras el diagnóstico de enfermedad a distancia.
CONCLUSIONES
En resumen, el CAQ mamario es una entidad clínica de rara presentación, muy diferente de los carcinomas ductal o lobulillar; con un manejo terapéutico, una evolución y un pronóstico distintos; su histología es lo que nos permite establecerlo, de ahí su gran importancia.
Correspondencia:
Dra. M.E. Pérez López.
Servicio de Oncología Médica.
Complejo Hospitalario de Ourense.
Ramón Puga, 54-56. 32005 Ourense. España.
Correo electrónico: mevaplo@hotmail.com
Fecha de recepción: 9/11/04
Aceptado para su publicación: 4/5/05