Conocer las características histológicas e inmuno-histoquímicas de los carcinomas ductales in situ (CDIS) que pudieran influir en el estado de los márgenes en la primera cirugía, y el tratamiento quirúrgico finalmente realizado en los CDIS.
Material y métodosEstudio retrospectivo de los 485 diagnosticados en los años 2003, 2004 y 2005, en el Servicio de Ginecología del Hospital Universitario 12 de Octubre de Madrid, 54 de los cuales (11,1%) fueron carcinomas ductales in situ (CDIS) y 280 (57,7%) ductales infiltrantes.
ResultadosSolamente un 10% de CDIS fueron palpables. Los CDIS supusieron la cuarta parte de los carcinomas diagnosticados mediante biopsia con arpón. Los bordes estuvieron afectos en la primera cirugía de intención conservadora en el 50% de CDIS y solo en el 34% de carcinomas ductales infiltrantes (CDI), por lo que las segundas y terceras cirugías (por bordes persistentemente afectos) fueron más frecuentes en CDIS que en CDI. En CDIS, los grados histológicos altos se relacionaron con más bordes afectados, más resultados positivos en reescisiones y más mastectomías. La tasa de mastectomía en CDIS (43%) fue mayor que en CDI diagnosticados mediante arpón (27%), y similar a la de CDI considerados globalmente (41%).
ConclusionesEl cribado mamográfico ha permitido un aumento de detección de CDIS, pero en ocasiones es difícil conseguir márgenes libres en ellos. Esto lleva a la aparente paradoja de tener que realizar mastectomía en CDIS, cuando en CDI podemos permitir cirugía conservadora sin empeorar el pronóstico.
To determine the histological or immunohistochemical characteristics of ductal carcinomas in situ (DCIS) that could influence margin status at first surgery and at final surgery.
Material and methodsWe retrospectively studied the 485 breast carcinomas diagnosed in 2003, 2004 and 2005 at the Doce de Octubre Hospital (Madrid), of which 54 (11.1%) were DCIS and 280 (57.7%) were invasive ductal carcinomas (IDC).
ResultsOnly 10% of DCIS were palpable. DCIS represented 25% of all carcinomas diagnosed by mammographic wire-guided biopsy. We found positive margins on first breast-conserving surgery in 50% of DCIS and in 34% of IDC. Consequently, a second or even a third intervention (for persistently involved margins) was more frequent in DCIS than in IDC. In DCIS higher histological grades were associated with more frequent margin involvement and a higher rate of re-excision with positive margins and mastectomy. The mastectomy rate in DCIS (43%) was higher than that in IDC diagnosed by mammographic wire-guided biopsy (27%), and was similar to that in IDC overall (41%).
ConclusionsMammographic screening programs have improved the detection of DCIS, but clear margins are sometimes difficult to achieve in this entity, leading to the paradox that women with palpable IDC are able to undergo breast-conserving surgery without compromising prognosis, whereas a mammographically detected DCIS requires mastectomy.
Broders, en 1932, define el carcinoma ductal in situ (CDIS) como la trasformación maligna de las células del epitelio ductal que permanece confinado al mismo, sin rotura de la membrana basal. La misma definición lleva implícita la no posibilidad de penetración en vasos linfáticos o sanguíneos, careciendo por tanto de potencial de dar metástasis. Por tanto, el CDIS es un fenómeno local y no una enfermedad sistémica, pero ha sido considerado por muchos autores como un verdadero precursor anatómico del cáncer ductal infiltrante.
El CDIS es una entidad totalmente diferente del carcinoma lobulillar in situ (el otro tipo de carcinoma in situ), que actualmente es considerado como un simple marcador de riesgo de presentar un carcinoma invasor con los años (predominantemente ductal infiltrante) en cualquiera de las mamas. Anteriormente y hasta la década de los ochenta, el CDIS era muy rara vez diagnosticado, casi siempre tras nódulo palpable o en forma de enfermedad de Paget de la mama, y se trataba de forma sistemática mediante mastectomía. Una revisión llevada a cabo en 1980 por el American College of Surgeons, encuentra un 2% de CDIS entre 10.000 carcinomas ductales y lobulillares1.
El uso creciente de la mamografía de cribado ha dado como resultado un aumento significativo de la tasa de detección del CDIS. Entre 1973 y 1992 se asistió a un aumento de la incidencia (realmente tasa de detección) de CDIS de un 587%, mientras que en este mismo periodo el carcinoma invasivo solo aumentó en un 34,2%2. El aumento tan espectacular de diagnostico de CDIS gracias a los programas de cribado mamográfico, ha llevado a muchos autores a sugerir que la mamografía en pacientes asintomáticas puede detectar CDIS totalmente indolentes, que con muy baja probabilidad hubiesen llegado a ser clínicamente relevantes a lo largo de la vida de la mujer. En contra de esto va el hecho de que en CDIS detectados mamográficamente existe una proporción relativamente importante de grados histológicos II y III, y la no existencia de diferencias en cuanto a factores de riesgo de CDIS y carcinomas ductales infiltrantes (CDI), como lo demuestran un estudio caso-control3.
Evidencia indirecta de que el CDIS es precursor del CDI lo constituye el hecho de que en los casos en que coexisten ambos componentes en una misma lesión, la expresión de los marcadores tumorales es muy similar en el componente de CDIS y en el de CDI. Asimismo, el perfil de expresión génica en casos de CDIS de bajo grado son similares a los casos de CDI de bajo grado, y estos a su vez diferentes de los perfiles tanto de los CDIS como de los infiltrantes de alto grado. Por ello se ha sugerido que es más probable que el CDIS de bajo grado progrese a un CDI de bajo grado, que a un CDIS de alto grado4.
La cuestión más importante en el manejo del CDIS es su riesgo de progresión a carcinoma infiltrante. Para contestar a este tema, hay pocos datos relevantes, ya que tradicionalmente una vez diagnosticado el CDIS, se realiza tratamiento quirúrgico (hasta la década de los ochenta mediante mastectomía sistemática).
ObjetivosNos propusimos conocer qué características histológicas o inmunohistoquímicas pudieran influir en el estado de los márgenes en la primera cirugía realizada en CDIS, así como el tratamiento quirúrgico finalmente realizado en ellos. Para ello, analizamos los CDIS diagnosticados entre los años 2003 a 2005 en el Hospital Universitario 12 de Octubre de Madrid.
Material y métodosSe realizó estudio retrospectivo de los 485 carcinomas diagnosticados durante los años 2003, 2004 y 2005 en el Servicio de Ginecología del Hospital Universitario 12 de Octubre de Madrid, 54 de los cuales fueron CDIS. El tipo histológico más frecuente entre nuestros carcinomas (57,7%) fue el ductal infiltrante (280/485).
En los casos de lesión no palpable se realizó biopsia con arpón mamográficamente guiada, y en todos ellos se llevó a cabo comprobación radiológica intraoperatoria de inclusión de la lesión en la biopsia. En el periodo del actual estudio, no disponíamos de la posibilidad de realizar core biopsia guiada por esterotaxia de las lesiones mamográficas, por lo que no se conocía la histología de la lesión mamográfica previamente a la realización de la biopsia. El estudio histológico definitivo de las biopsias con arpón se hizo siempre de forma diferida.
El diagnóstico de los carcinomas clínicos (palpables) se llevó a cabo mediante punción con aguja gruesa, biopsia diferida o biopsia intraoperatoria. Durante los años 2003 al 2005 aún no se realizaba en todos los casos BIO de bordes en las cirugías conservadoras sobre mama tras nódulo palpable (que ahora ya si realizamos de forma sistemática).
Los márgenes de la pieza quirúrgica (tanto en biopsias con arpón, como en nódulos palpables) se tintaron con tinta china (con distinto color cada uno de los 6 márgenes), y se los estudió histológicamente en busca de presencia de células malignas en ellos.
Consideramos los márgenes histológicos de la biopsia (tanto en biopsia con arpón, tumorrectomía o cuadrantectomía) como «libres» cuando el margen histológico tintado estuvo a más de 3mm de las células tumorales. Se consideraron los márgenes «escasos» cuando, aunque dichos márgenes estuvieron libres, las células tumorales alcanzaron a sus proximidades, y pusimos el límite en 3mm o menos. Finalmente, se consideraron los márgenes de la biopsia como «afectados», cuando existieron células tumorales en el mismo margen tintado de la pieza quirúrgica.
En los carcinomas que hubieron de ser ampliados, consideramos la ampliación como «negativa», cuando en la pieza histológica de ampliación no se encontró tumor residual, y «positiva», cuando se encontró carcinoma residual (ya fuera éste infiltrante o in situ, independientemente de la infiltración inicial).
Para los carcinomas ductales (tanto infiltrantes, como in situ) se consideró el grado histológico como grado I (bajo grado), grado II (moderado) y grado III (alto grado).
Para el estudio estadístico se utilizó el programa de procesamiento estadístico SPSS para Windows (versión 12). Se aplicó el análisis de la chi al cuadrado para tablas de contingencia de variables cualitativas, o la prueba exacta de Fisher cuando el caso así lo requirió. Los datos de variables continuas se expresan en forma de media±desviación estándar y mediana con rango intercuartílico. Para la comparación de dos medias entre sí, se utilizó la prueba de Mann-Whitney. Se consideraron diferencias estadísticamente significativas los valores de p<0,05.
ResultadosDe los 485 carcinomas diagnosticados durante los años 2003, 2004 y 2005 en el Servicio de Ginecología del Hospital Universitario 12 de Octubre de Madrid, los más frecuentes fueron: 280 ductales infiltrantes (57,7%), 61 lobulillares infiltrantes (12,6%), 54 CDIS (11,1%), 15 cacinomas tubulares (3,1%), 14 lobulillares in situ (2,9%), 11 carcinomas mucinosos (2,3%), 8 carcinomas microinfiltrantes (1,6%). Existió una enfermedad de Paget del pezón asociada a CDIS (1,8% de los CDIS).
Del total de carcinomas, 203 (41,9%) fueron diagnosticados tras lesión mamográfica (no palpables) mediante marcaje con arpón manual. Los 282 (58,1%) carcinomas restantes se diagnosticaron tras nódulo palpable.
A pesar de que los CDIS solo supusieron un 11,1% de todos los carcinomas del periodo de estudio, entre los diagnosticados tras biopsia mamográficamente guiada, los CDIS supusieron un 23,6% de todos los carcinomas diagnosticados mediante este procedimiento (48/203).
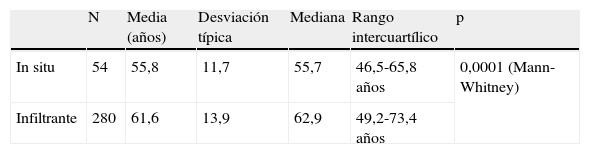
Carcinoma ductal in situ y edadLa mediana de edad de CDIS intervenidos fue de 56,5 años (rango intercuartílico 46,8 a 66,4), teniendo la paciente más joven 35,0 años y 80,8 años la de mayor edad. La media de edad de las pacientes con CDIS fue mayor que la de pacientes con CDI (tabla 1). Asimismo, la media de edad de las pacientes con CDIS diagnosticadas mediante biopsia con arpón (55,4±11,4 años) fue menor que las diagnosticadas de CDIS tras aparición de nódulo clínico (65,3±10,7 años), aunque la diferencia no llegó a la significación estadística (p=0,07).
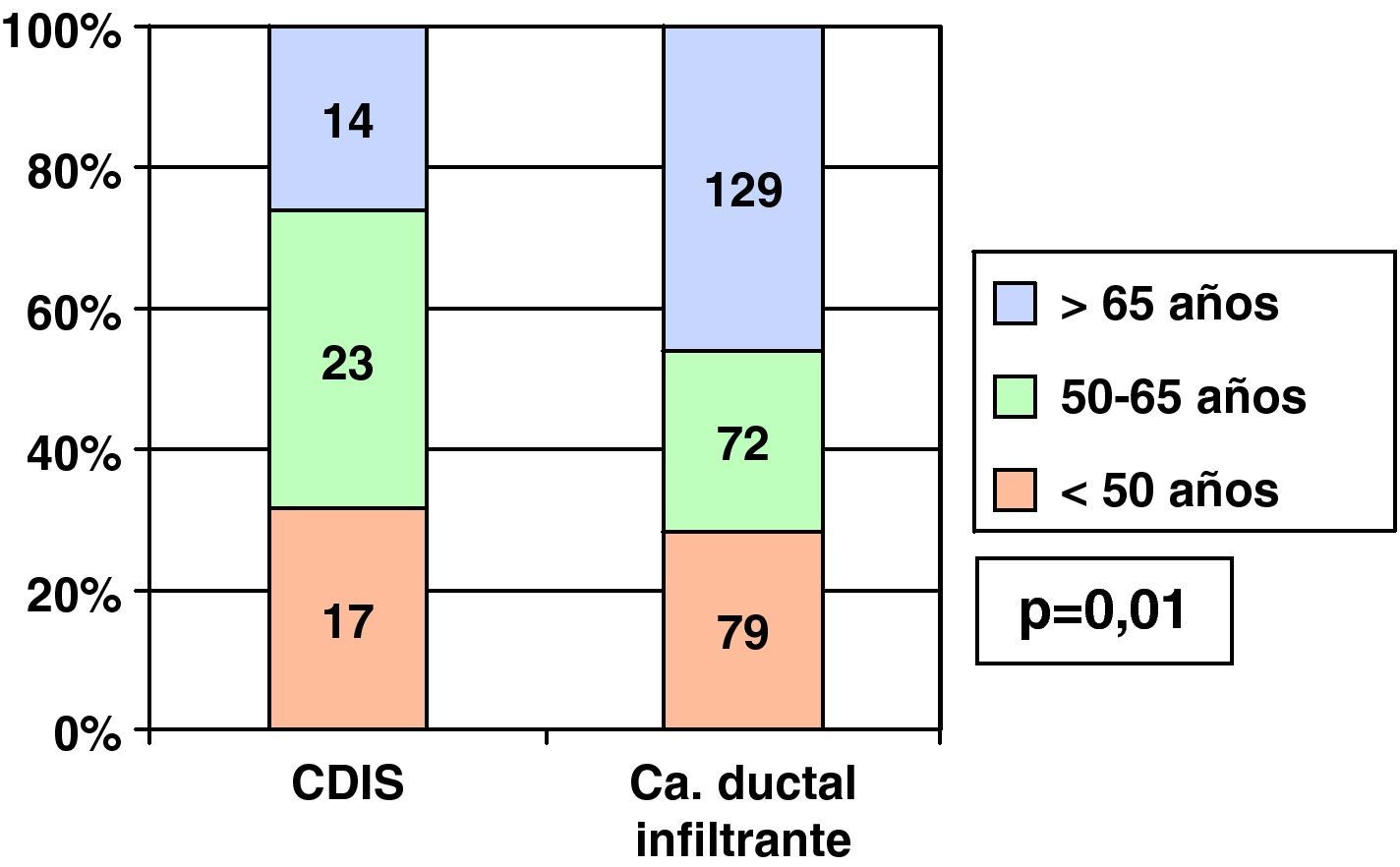
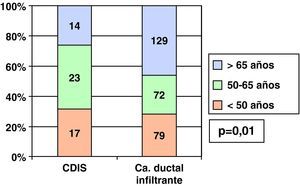
Al dividir a las pacientes en 3 grupos de edad (menores de 50 años, entre 50 y 65 y mayores de 65 años), vimos que en los CDIS el mayor grupo porcentual (42,6%) pertenecía al grupo de edad entre 50 y 65 años (grupo de mujeres en el que se realizó el cribado mamográfico en el periodo de nuestro estudio), mientras que el mayor grupo porcentual entre los CDI correspondía al grupo de más de 65 años (45,9%) (fig. 1).
Presentación clínica y forma de diagnósticoExistieron únicamente 6 CDIS que se presentaron con nódulo palpable (11,1% de CDIS), siendo el resto diagnosticados tras alteración mamográfica (88,9%). La alteración mamográfica más frecuentemente observada en los CDIS fue la de hallazgo de microcalcificaciones (85,4%, 41/48). Patrón masa (nódulo espiculado o densidad asimétrica) se encontró en un 10,4% (5/48) y patrón mixto (patrón masa y patrón cálcico simultáneos) en el 4,2% (2/48).
Carcinoma ductal in situ y tamaño histológicoSeis de los CDIS fueron indimensionables o no constaba tamaño histológico.
La media de tamaño de los restantes CDIS intervenidos en el periodo de estudio fue de 11,1mm (desviación típica de 7,3; mínimo de 2 y máximo de 35), mediana 10mm con rango intercuartílico 7-15mm.
La media de tamaño de los CDIS que fueron no palpables (9,8mm y desviación típica 5,9) fue menor que la de los diagnosticados tras nódulo palpable (15,8mm y desviación típica de 11,1) (p=0,004). Un 22,9% de los CDIS que se diagnosticaron tras biopsia con arpón por no ser palpables (11/48) tuvieron un tamaño histológico de más de 10mm, con un tamaño histológico de 35mm el mayor de ellos. Un 27,8% de los CDIS fueron mayores de 10mm (15/54). Dentro de los CDIS palpables, existieron 2 casos con tamaño histológico final de menos de 10mm.
Carcinoma ductal in situ y bordes de resecciónSe realizaron 2 mastectomías simples como cirugía inicial en CDIS (3,7% de los CDIS), ambas en nódulos clínicos y tras diagnóstico (previo a la cirugía) mediante punción con aguja gruesa de la tumoración palpable (más tarde comentaremos sus características).
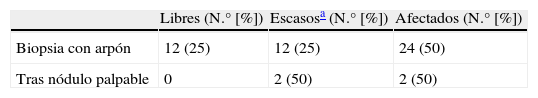
Excluyendo estos dos casos de realización de mastectomía como primer acto quirúrgico en CDIS, cuando la cirugía consistió en biopsia con arpón los bordes estuvieron afectados en la mitad de los casos, igual porcentaje de bordes afectados que en tumorrectomía tras nódulo palpable (tabla 2).
Carcinomas ductales in situ y estado de bordes quirúrgicos
| Libres (N.° [%]) | Escasosa (N.° [%]) | Afectados (N.° [%]) | |
| Biopsia con arpón | 12 (25) | 12 (25) | 24 (50) |
| Tras nódulo palpable | 0 | 2 (50) | 2 (50) |
p=0,39.
Excluidas 2 mastectomías como cirugía inicial (tras nódulo palpable y diagnóstico con aguja gruesa).
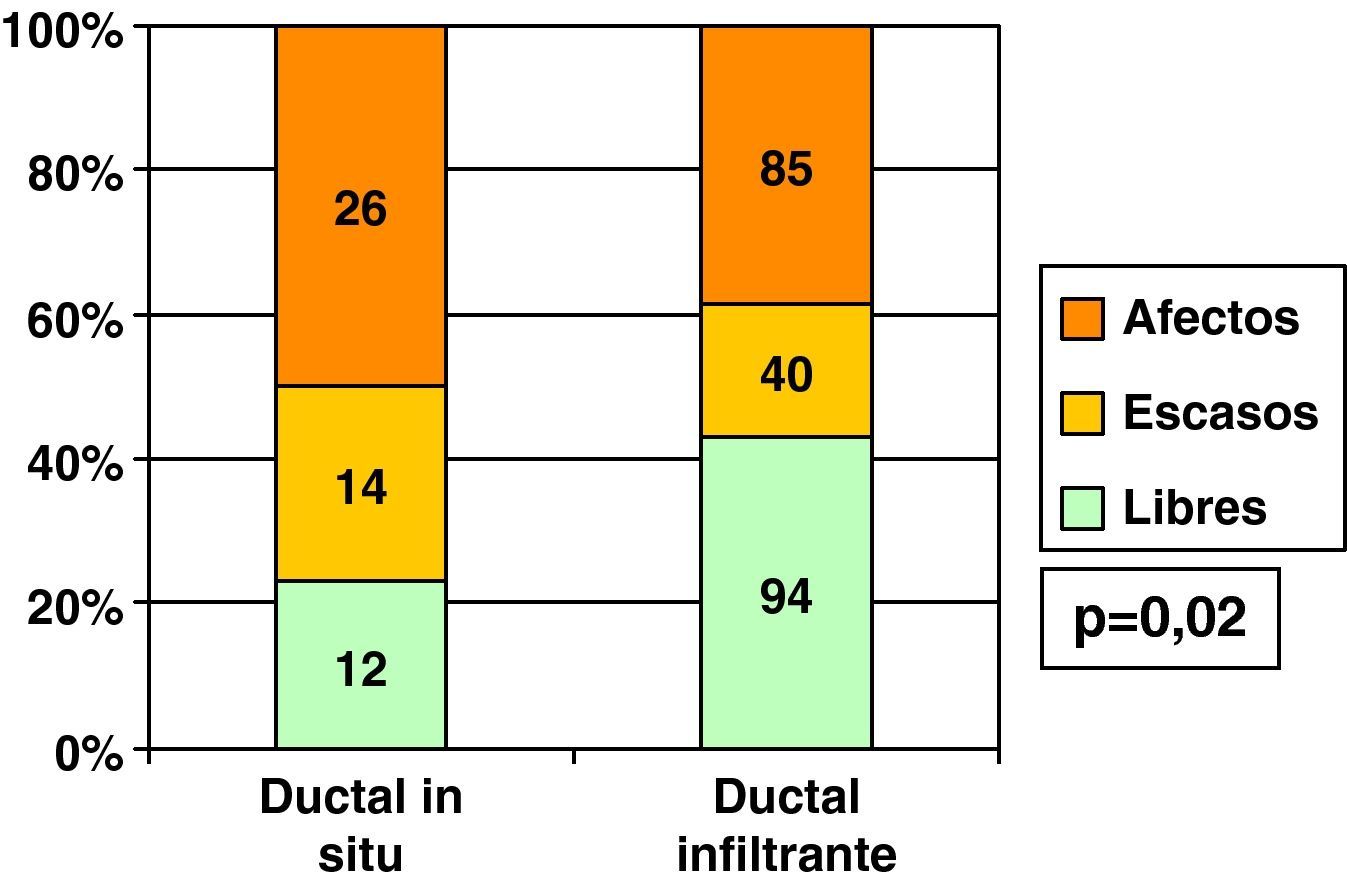
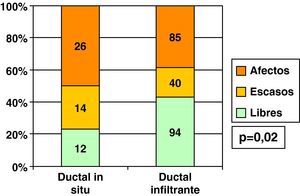
Excluyendo también los casos de realización de mastectomía inicial, es decir, casos de intención de cirugía conservadora inicial, vimos que el porcentaje de bordes libres tras primera cirugía fue menor en CDIS que en CDI, y los bordes escasos y afectados, por el contrario, fueron más frecuentes en los CDIS (fig. 2).
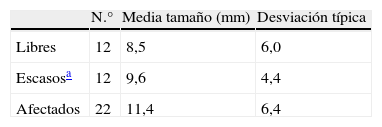
A pesar de que la media de tamaño de los CDIS con bordes libres fue menor que la de bordes escasos y ésta que la de bordes afectos (tabla 3), no hubo diferencias estadísticamente significativas entre ellas. Sin embargo, la media de tamaño de los CDIS en los que se realizó mastectomía de entrada (32,5mm, desviación típica 3,5) fue mayor (p<0,0001) que la del resto de CDIS (10,2mm, desviación típica de 5,9).
Carcinomas ductales in situ: media de tamaño histológico según bordes de resección
| N.° | Media tamaño (mm) | Desviación típica | |
| Libres | 12 | 8,5 | 6,0 |
| Escasosa | 12 | 9,6 | 4,4 |
| Afectados | 22 | 11,4 | 6,4 |
6 CDIS de tamaño indimensionable o no figuraba en histología.
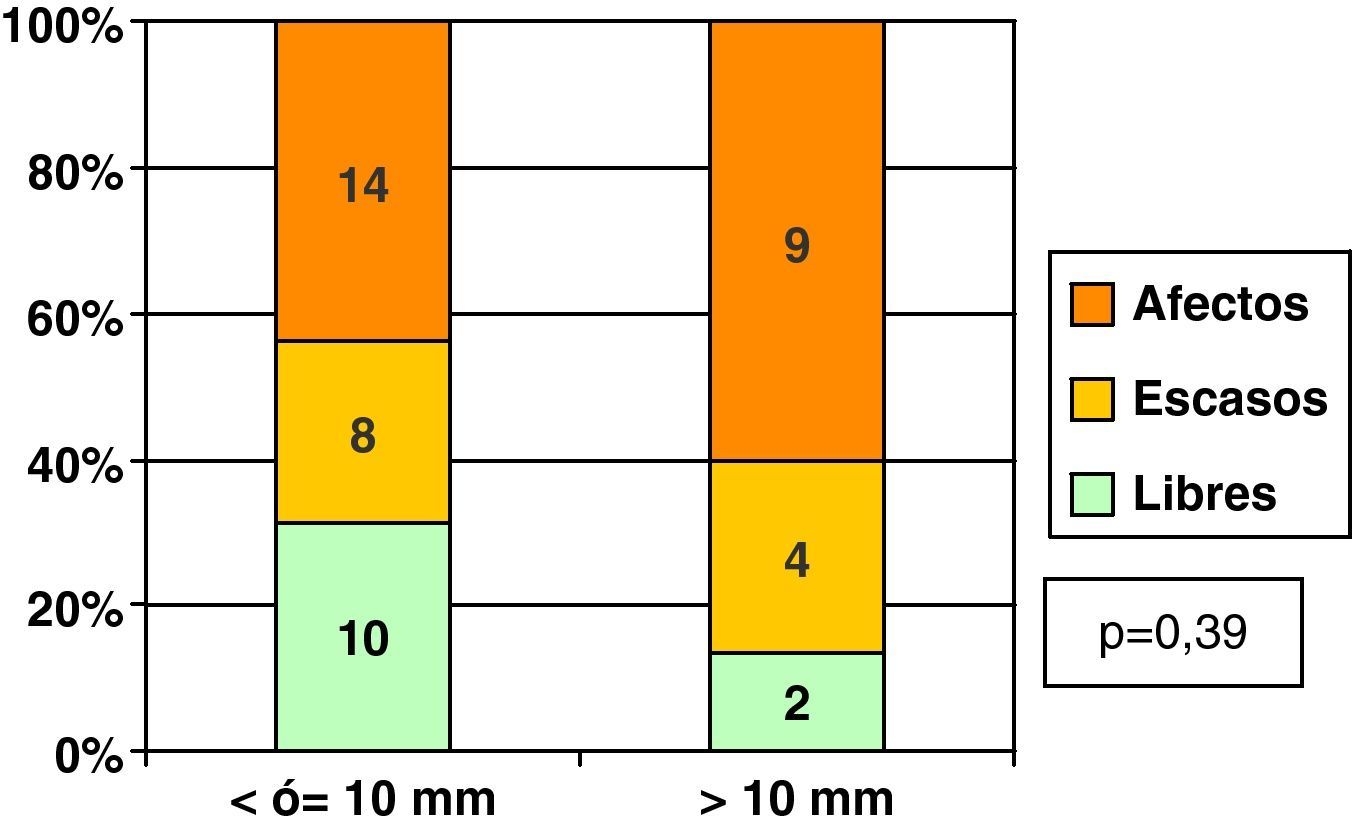
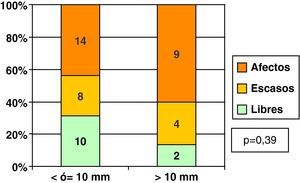
Ya hemos comentado que la mediana de tamaño de los CDIS fue de 10mm. Poniendo el punto de corte en esta medida, y dividiendo a los CDIS en 2 grupos, los de 10mm o menos de tamaño y los de mayor tamaño mayor (fig. 3), a pesar de que los bordes libres fueron mas frecuentes entre los CDIS de tamaño ≤ 10mm, no existieron diferencias estadísticamente significativas entre ambos grupos.
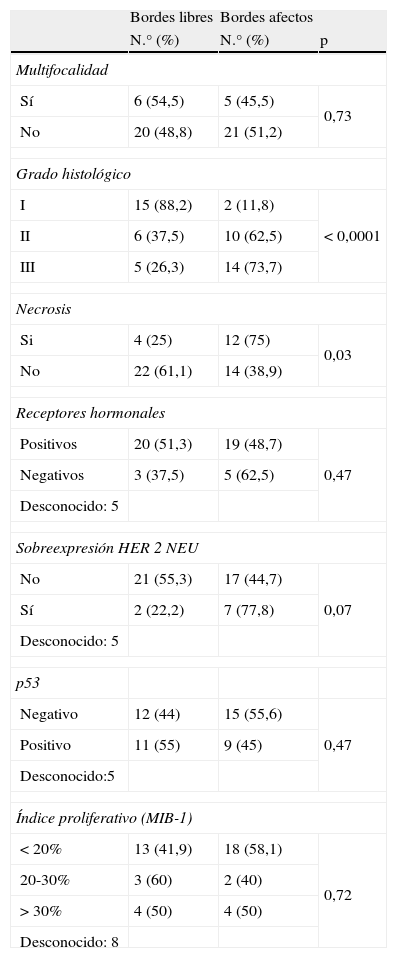
En cuanto a factores pronósticos histológicos e inmuno-histoquímicos de nuestros CDIS (tabla 4), únicamente el grado histológico y la existencia de necrosis tuvieron relación con el estado de los márgenes de resección ellos; los CDIS con sobreexpresión de HER 2 NEU tuvieron mayor porcentaje de bordes afectados, aunque no se llegó a alcanzar la significación estadística (p=0,07).
Carcinomas ductales in situ: factores pronósticos histológicos e inmunohistoquímicos y estado de márgenes
| Bordes libres | Bordes afectos | ||
| N.° (%) | N.° (%) | p | |
| Multifocalidad | |||
| Sí | 6 (54,5) | 5 (45,5) | 0,73 |
| No | 20 (48,8) | 21 (51,2) | |
| Grado histológico | |||
| I | 15 (88,2) | 2 (11,8) | < 0,0001 |
| II | 6 (37,5) | 10 (62,5) | |
| III | 5 (26,3) | 14 (73,7) | |
| Necrosis | |||
| Si | 4 (25) | 12 (75) | 0,03 |
| No | 22 (61,1) | 14 (38,9) | |
| Receptores hormonales | |||
| Positivos | 20 (51,3) | 19 (48,7) | 0,47 |
| Negativos | 3 (37,5) | 5 (62,5) | |
| Desconocido: 5 | |||
| Sobreexpresión HER 2 NEU | |||
| No | 21 (55,3) | 17 (44,7) | 0,07 |
| Sí | 2 (22,2) | 7 (77,8) | |
| Desconocido: 5 | |||
| p53 | |||
| Negativo | 12 (44) | 15 (55,6) | 0,47 |
| Positivo | 11 (55) | 9 (45) | |
| Desconocido:5 | |||
| Índice proliferativo (MIB-1) | |||
| < 20% | 13 (41,9) | 18 (58,1) | 0,72 |
| 20-30% | 3 (60) | 2 (40) | |
| > 30% | 4 (50) | 4 (50) | |
| Desconocido: 8 | |||
Excluidas 2 mastectomías como cirugía inicial.
No encontramos, sin embargo, relación entre bordes quirúrgicos de resección con estado de receptores hormonales, p53, ni al dividir índice proliferativo (MIB-1) en bajo, medio o alto.
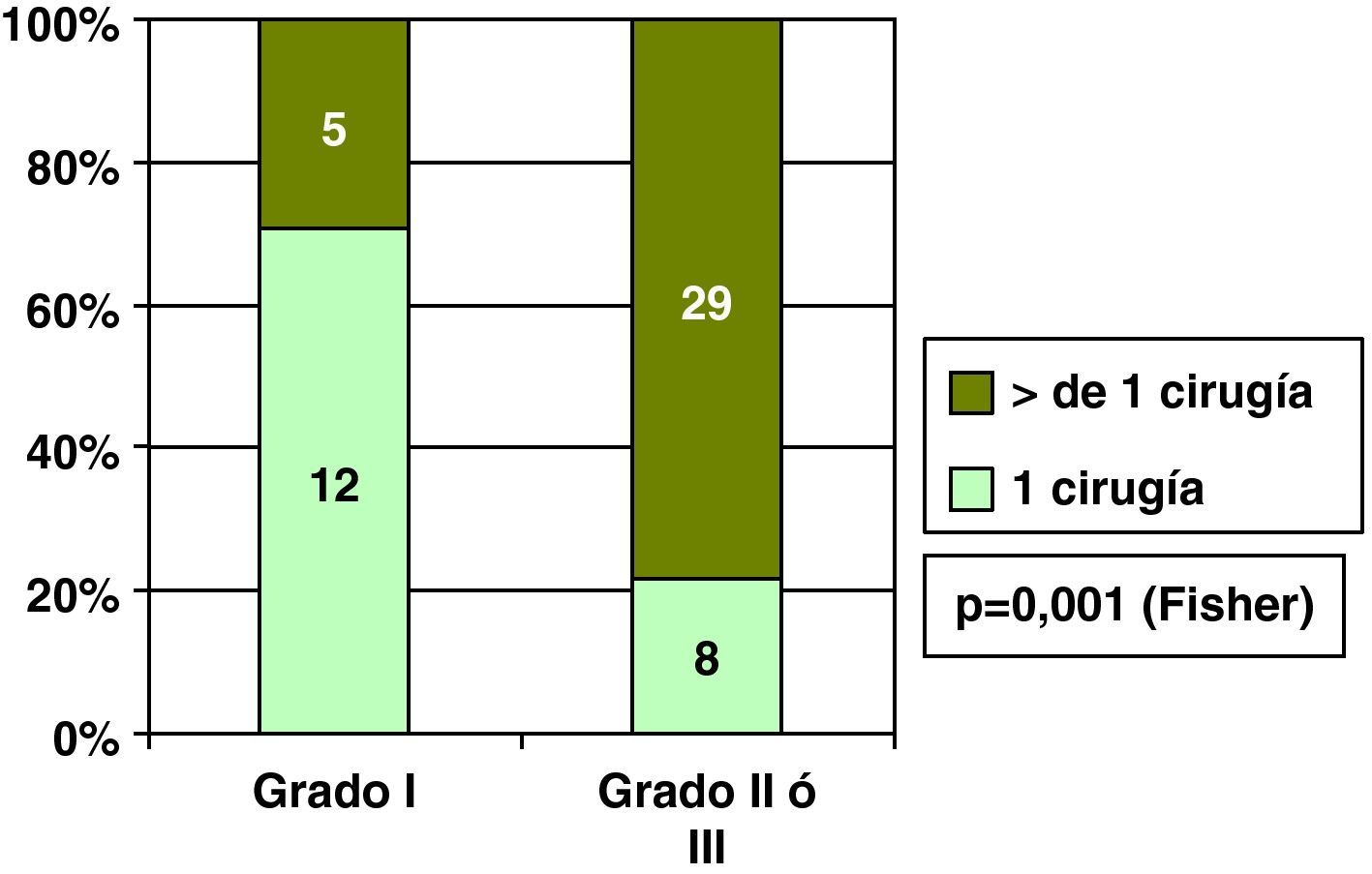
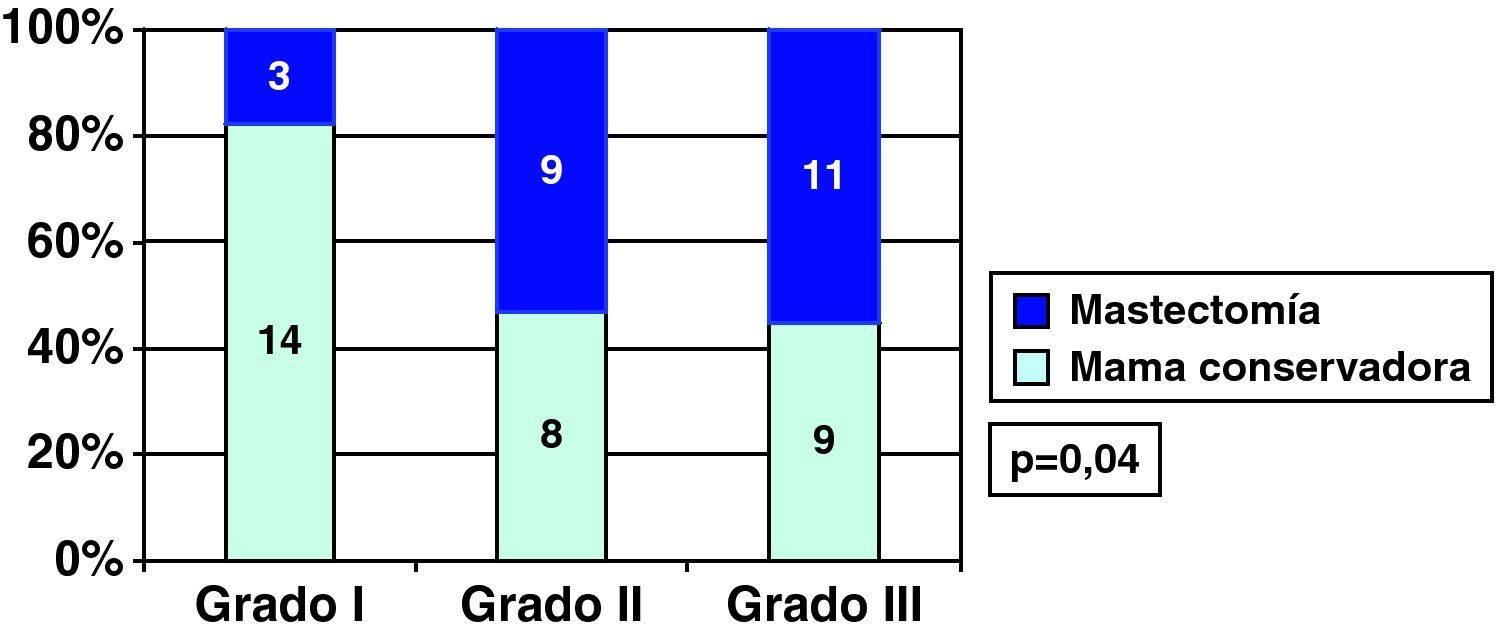
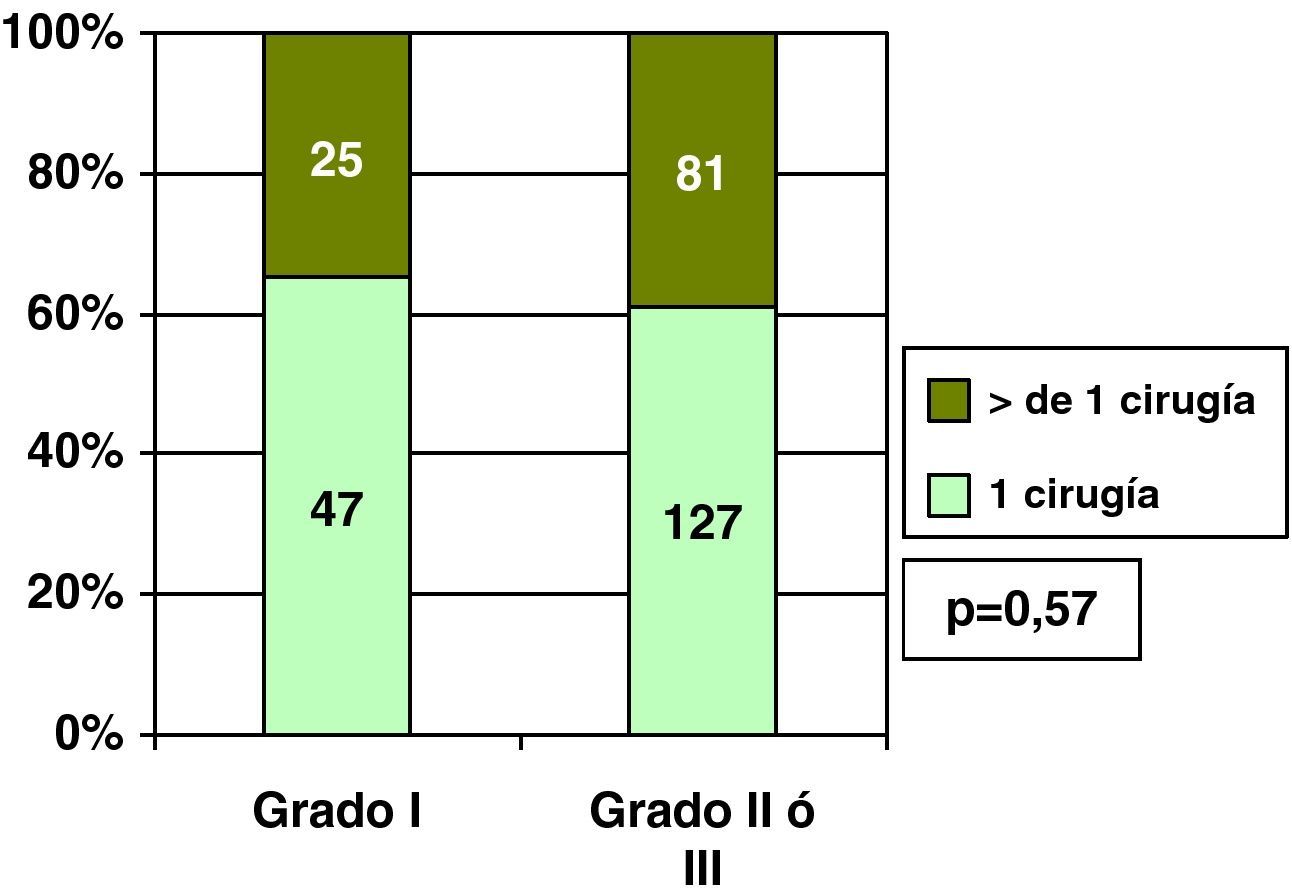
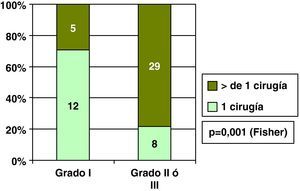
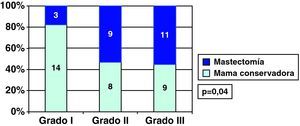
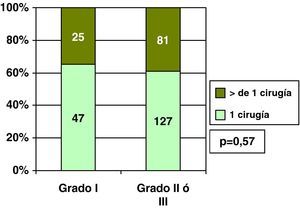
Carcinoma ductal in situ y grado histológicoEncontramos relación entre el grado histológico y única cirugía en los CDIS, y así el 70,6% de los CDIS de grado I precisaron una única cirugía, frente al 21,7% de los CDIS grados II o III (fig. 4). Por esta asociación entre el grado histológico y el número de cirugías necesarias, también hubo relación entre grado histológico y cirugía final sobre la mama en los CDIS, y así el porcentaje de cirugía conservadora fue mayor en los CDIS de grado histológico I que en los grados II y III (fig. 5).
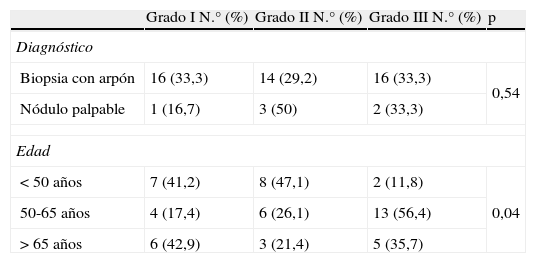
No vimos diferencias en nuestros CDIS entre porcentajes de grados histológicos I, II y III dependiendo de si el diagnostico se realizó mediante biopsia con arpón o tras nódulo palpable (tabla 5). Sin embargo, al dividir a nuestros CDIS según los 3 grupos de edad al diagnóstico, fue en los diagnosticados entre los 50 y 65 años de edad en donde vimos mayor porcentaje de grados III (tabla 6).
Carcinomas ductales in situ: forma de diagnóstico, grupos de edad y grado histológico
| Grado I N.° (%) | Grado II N.° (%) | Grado III N.° (%) | p | |
| Diagnóstico | ||||
| Biopsia con arpón | 16 (33,3) | 14 (29,2) | 16 (33,3) | 0,54 |
| Nódulo palpable | 1 (16,7) | 3 (50) | 2 (33,3) | |
| Edad | ||||
| < 50 años | 7 (41,2) | 8 (47,1) | 2 (11,8) | 0,04 |
| 50-65 años | 4 (17,4) | 6 (26,1) | 13 (56,4) | |
| > 65 años | 6 (42,9) | 3 (21,4) | 5 (35,7) | |
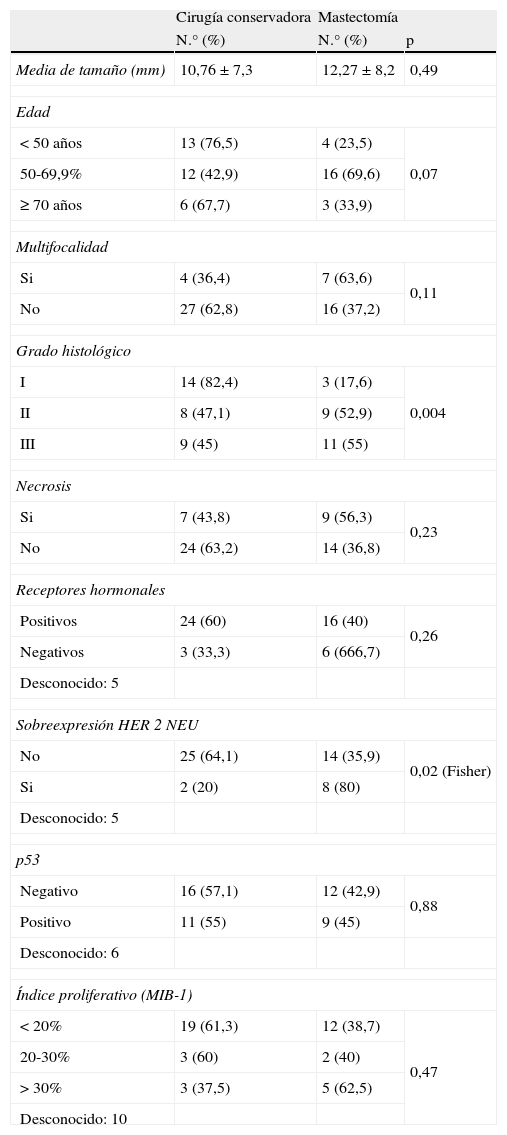
Carcinomas ductales in situ: media de tamaño, grupos de edad, factores pronósticos histológicos e inmuno-histoquímicos y cirugía sobre la mama
| Cirugía conservadora | Mastectomía | ||
| N.° (%) | N.° (%) | p | |
| Media de tamaño (mm) | 10,76±7,3 | 12,27±8,2 | 0,49 |
| Edad | |||
| < 50 años | 13 (76,5) | 4 (23,5) | 0,07 |
| 50-69,9% | 12 (42,9) | 16 (69,6) | |
| ≥ 70 años | 6 (67,7) | 3 (33,9) | |
| Multifocalidad | |||
| Si | 4 (36,4) | 7 (63,6) | 0,11 |
| No | 27 (62,8) | 16 (37,2) | |
| Grado histológico | |||
| I | 14 (82,4) | 3 (17,6) | 0,004 |
| II | 8 (47,1) | 9 (52,9) | |
| III | 9 (45) | 11 (55) | |
| Necrosis | |||
| Si | 7 (43,8) | 9 (56,3) | 0,23 |
| No | 24 (63,2) | 14 (36,8) | |
| Receptores hormonales | |||
| Positivos | 24 (60) | 16 (40) | 0,26 |
| Negativos | 3 (33,3) | 6 (666,7) | |
| Desconocido: 5 | |||
| Sobreexpresión HER 2 NEU | |||
| No | 25 (64,1) | 14 (35,9) | 0,02 (Fisher) |
| Si | 2 (20) | 8 (80) | |
| Desconocido: 5 | |||
| p53 | |||
| Negativo | 16 (57,1) | 12 (42,9) | 0,88 |
| Positivo | 11 (55) | 9 (45) | |
| Desconocido: 6 | |||
| Índice proliferativo (MIB-1) | |||
| < 20% | 19 (61,3) | 12 (38,7) | 0,47 |
| 20-30% | 3 (60) | 2 (40) | |
| > 30% | 3 (37,5) | 5 (62,5) | |
| Desconocido: 10 | |||
No existieron diferencias de grados I, II y III (p=0,31) entre CDIS (17, 17 y 20) y CDI (72, 119 y 89, respectivamente).
De forma similar a lo que había ocurrido en los CDIS, en los CDI fue más frecuente (p=0,01) la cirugía conservadora en el grado histológico I (70,8%; 51/72) que en los grados II o III (54,8%, 114/165), pero no encontramos relación entre grado histológico y única cirugía en ellos, y así el 65,3% de CDI de grado I necesitaron una única cirugía, frente al 61,1% de los grados II o III (fig. 6).
Histología de la ampliación en reescisionesSe realizaron 34 ampliaciones en CDIS por bordes afectados o escasos, de las que 61,8% (21/34) fueron positivas, es decir, tuvieron hallazgo histológico de existencia de CDIS residual. De las ampliaciones por bordes escasos (CDIS a 3mm o menos del margen) 55,6% fueron positivas (5/9), mientras que un 66,7% de las realizadas en bordes afectados (16/24) lo fueron, aunque estos porcentajes no fueron estadísticamente diferentes.
Tuvimos dos casos de bordes afectados que no se ampliaron. El primero de ellos fue una paciente de 56 años con un CDIS grado histológico II, de 3mm, que afectaba únicamente a uno de los bordes, y que la paciente no deseó reescisión. El segundo de los casos se trató de una paciente de 80 años con CDIS grado III, de 9mm con 2 bordes afectados, que no se amplió por riesgo quirúrgico y edad.
Cinco casos de bordes escasos no se ampliaron. Cuatro de ellos tuvieron grado I y todos ellos tenían un único margen afectado y en todos los bordes se encontraban entre 2 y 3mm.
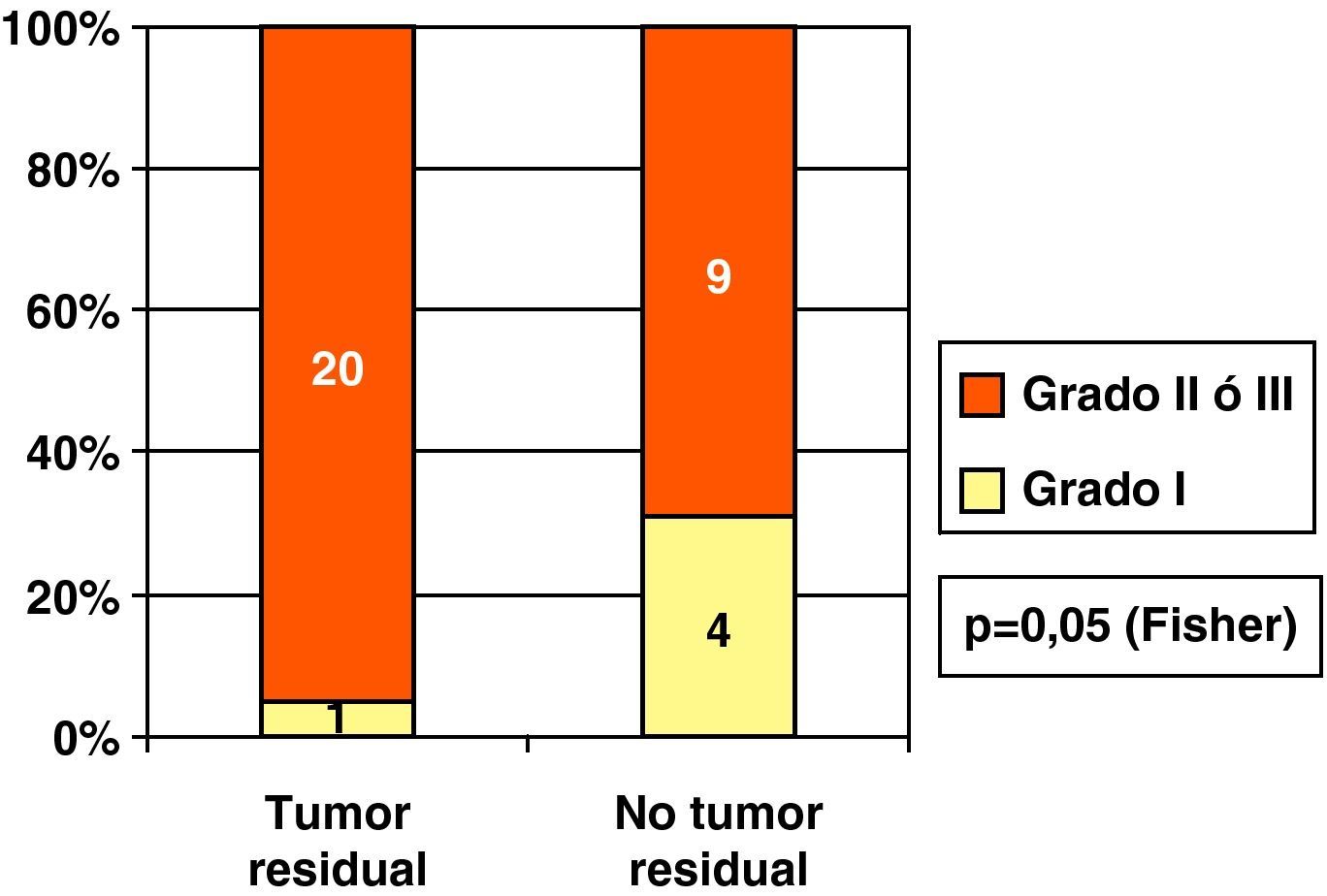
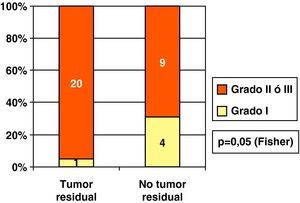
En nuestros CDIS sometidos a ampliación existió mayor porcentaje de tumor residual histológico en los grados II o III que en los de grado I (fig. 7). Sin embargo, no vimos diferencia (p=0,98) en cuanto a reescisiones positivas dependiendo de la existencia de necrosis (61,5%, 8/13) o no (61,9%; 13/21).
Tampoco hubo diferencias (p=0,72) en histologías positivas en ampliaciones dependiendo en la existencia de multifocalidad (66,7%; 6/9) o no (60%; 15/25).
En cuanto a factores pronósticos inmunohistoquímicos, no encontramos tampoco relación (p=0,31) de tumor residual con receptores hormonales positivos (61,5%; 16/26) o negativos (83,3%; 5/6), ni (p=0,98) con la existencia (61,5%; 8/13) o no de necrosis (61,5%; 8/21), ni sobre-expresión (p=0,13) de HER-2/NEU (87,5%; 7/8) o no sobreexpresión (58,3%; 14/24).
Cirugía en carcinoma ductal in situYa hemos comentado como se realizaron 2 mastectomías simples como cirugía inicial en CDIS (3,7% de los CDIS), ambas en nódulos clínicos y tras diagnóstico (previo a la cirugía) mediante punción con aguja gruesa de la tumoración palpable. Sus tamaños histológicos fueron de 30 y 35mm, respectivamente. En ambos casos, y además del nódulo palpable, la existencia de amplias zonas de microcalcificaciones fuera del nódulo aconsejaba la realización de mastectomía tras el diagnóstico histológico prequirúrgico. En ambos, también, se realizó linfadenectomía axilar (ante la posibilidad del hallazgo en histología definitiva de alguna zona de invasión, y puesto que en aquellos momentos aún no teníamos validada la técnica del ganglio centinela). No se encontró afectación ganglionar en ninguno de los dos casos.
Entre CDIS diagnosticados con arpón, en 35,4% (17/48) ésta fue la única intervención necesaria, el 54,2% necesitó 2 intervenciones (26/48) y precisó 3 cirugías el 10,4% (5/48). La mitad de los CDIS palpables solo necesitaron 1 cirugía (3/6), la otra mitad dos (3/6), y en ningún caso se precisaron 3 intervenciones (p=0,62).
Se conservó la mama en el 90% de los CDIS que precisaron una única cirugía. Las pacientes que precisaron una primera ampliación por bordes escasos o afectados en la primera intervención, ésta consistió en nueva tumorrectomía en el 46,4% de los casos. En los 6 casos de CDIS que necesitaron una tercera cirugía por márgenes persistentemente afectados, ésta consistió en mastectomía simple en el 100% de ellos.
La media de edad de las pacientes sometidas a cirugía conservadora de la mama en CDIS (55,4±12,9 años) no fue diferente (p=0,37) de la de las pacientes con CDIS sometidas a mastectomía (58,1±12,9 años). Tampoco encontramos diferencia en cuanto a tamaño histológico del CDIS entre los casos en que finalmente se conservó mama y los sometidos a mastectomía (tabla 6).
Al dividir a las pacientes con CDIS en 3 grupos de edad (menores de 50 años, entre 50 a 69 y 70 o más años), vimos que aunque en las más jóvenes el porcentaje de cirugía conservadora de la mama fue mayor que en los otros 2 grupos (tabla 6), no se llegó a la significación estadística.
En cuanto a factores pronósticos histológicos e inmunohistoquímicos de los CDIS en relación con el tipo final de cirugía (tabla 6), únicamente encontramos mayor número de cirugías conservadoras en los grados histológicos bajos (tabla 6 y fig. 5) y en los que no sobreexpresaron el HER 2 NEU (tabla 6). Por el contrario, no encontramos diferencia en cuanto a porcentajes de mastectomía dependiendo de existencia de multifocalidad, necrosis, estado de receptores hormonales, positividad de p53 o índice proliferativo categorizado (tabla 6).
Al excluir los 14 carcinomas lobulillares in situ (considerados sólo como marcadores de riesgo de presentar CDIS o carcinomas infiltrantes en el futuro), no encontramos diferencias entre el porcentaje de cirugía conservadora sobre mama en los CDIS (57,4%) y los carcinomas infiltrantes (ductales o no) considerados globalmente (54,3%) (tabla 7).
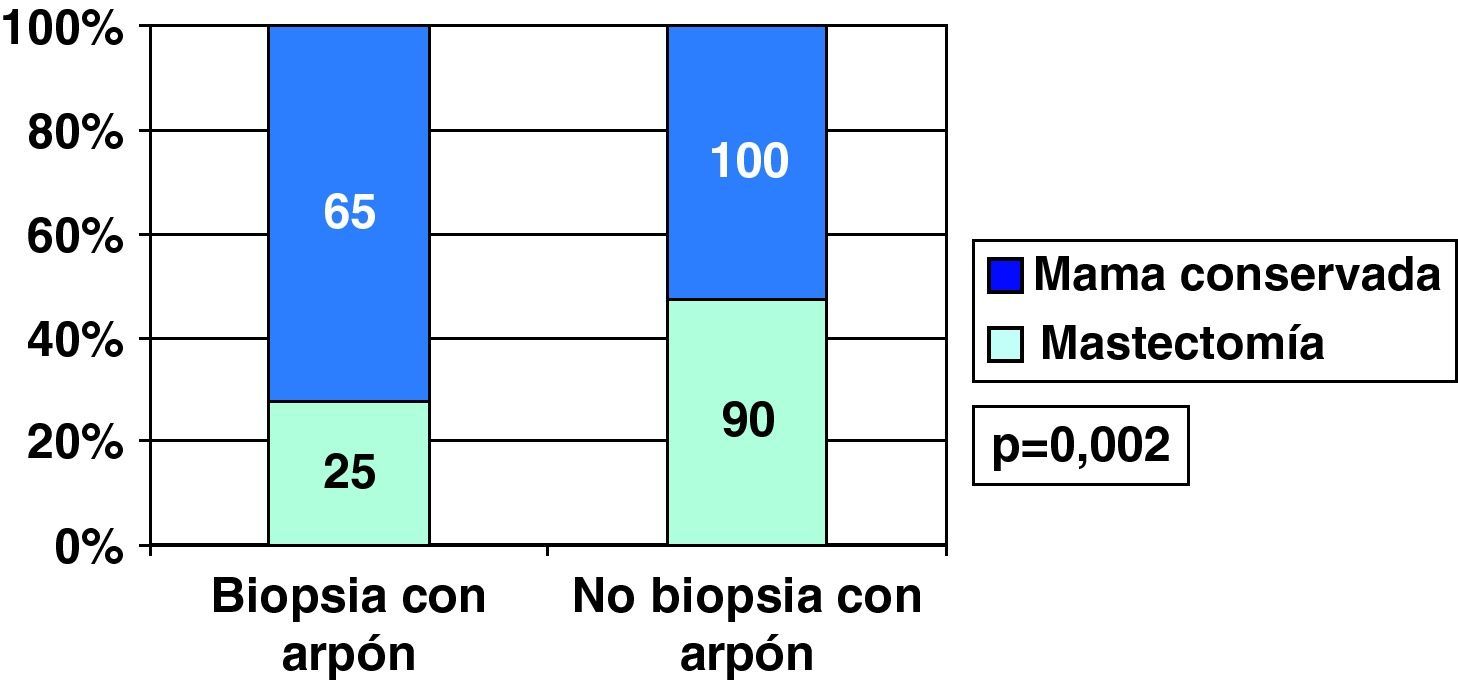
Al considerar únicamente los carcinomas ductales (in situ: 54 e infiltrantes: 280), vimos que la biopsia con arpón (lesión mamográfica) como primera cirugía en CDIS fue de 88,9% (48/54), porcentaje mayor que el 32,1% (90/280) en que se realizó este procedimiento en CDI (p=0,001).
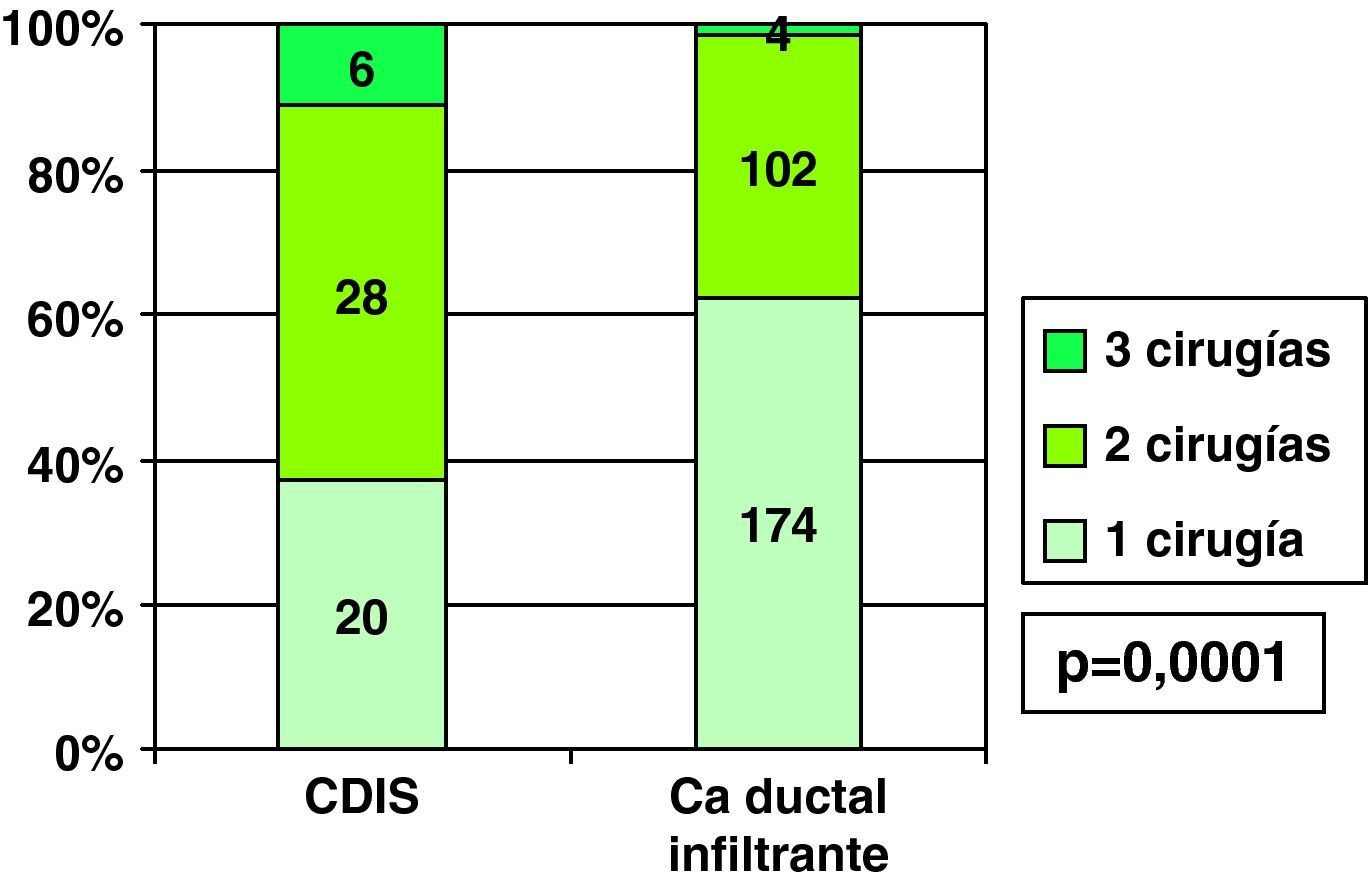
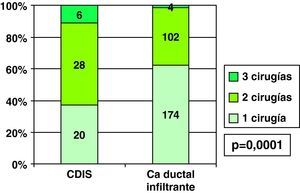
Por el menor porcentaje de bordes de resección libres en la primera cirugía en CDIS que en CDI (fig. 2), los casos en que se realizó una única intervención en CDIS (37%) fue menor que en los casos de CDI (62,1%), siendo en CDIS con mayor frecuencia necesaria una segunda intervención por persistencia de bordes afectados, e incluso frente al 11,1% de necesidad de realizar hasta 3 cirugías (bordes afectados tras primera ampliación) en CDIS, en CDI se precisaron 3 intervenciones solo en 1,4% de ellos (fig. 8). En los 6 casos de necesidad de realizar una tercera cirugía en CDIS, se realizó mastectomía en todos ellos, pero entre los 4 casos de realización de 3 intervenciones en CDI se realizó mastectomía en 3 de ellos (75%, 3 de los 4) y nueva tumorrectomía en el restante, aunque esta diferencia no fue estadísticamente significativa con los CDIS (p=0,19).
El porcentaje de cirugía conservadora de la mama en los CDIS (57,4%) fue similar al de los CDI considerados globalmente (58,9%) (tabla 8).
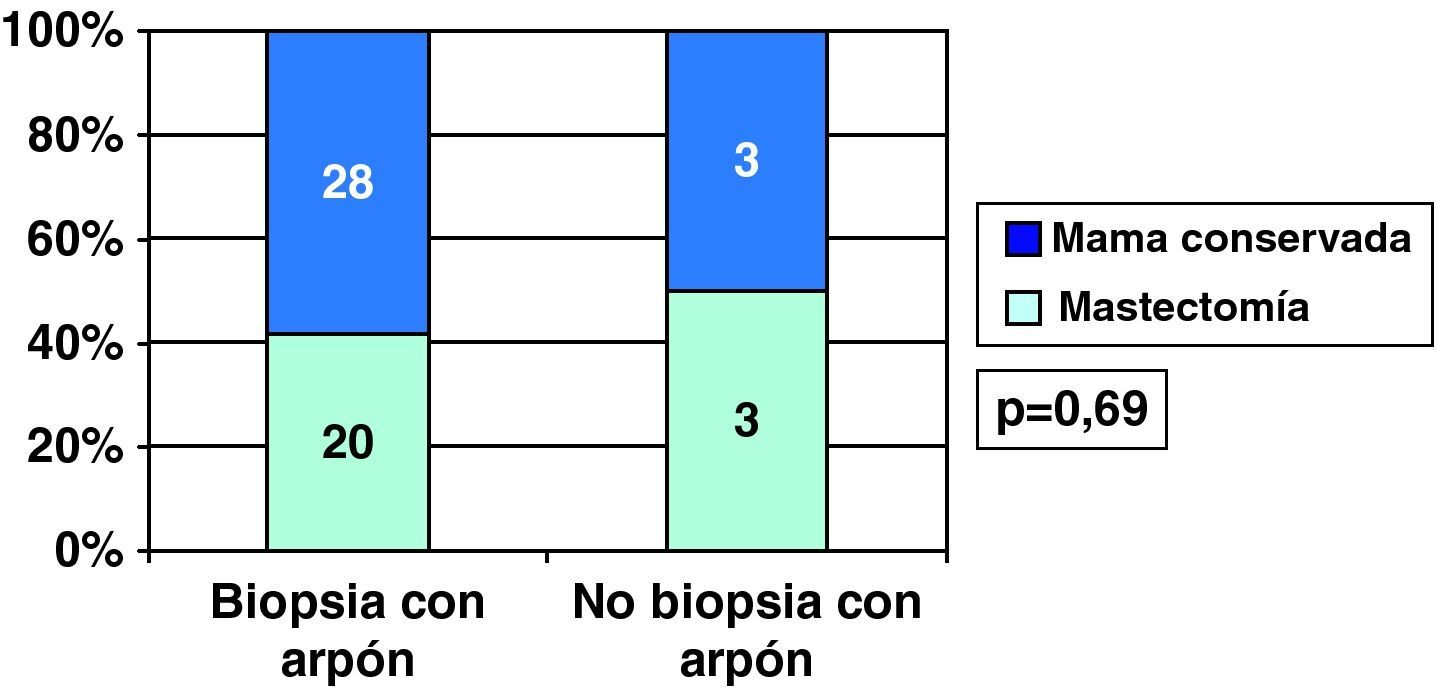
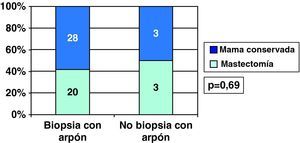
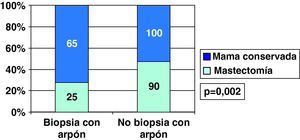
Conservaron mama el 58,3% de CDIS diagnosticados tras arpón y 50% de los CDIS sin arpón previo, por tratarse de nódulos ya palpables (fig. 9). Sin embargo, en los CDI diagnosticados tras arpón se conservó mama más frecuentemente (72,2%) que en los diagnosticados tras nódulo clínico (52,6%) (fig. 10).
Los 2 casos de realización de mastectomía como cirugía inicial en CDIS supusieron un 3,7% de ellos (2/54), mientras que en los CDI se realizó mastectomía como primera cirugía en un 21,8% de los casos (61/280) (p=0,002).
Dividiendo los CDI en los de tamaño ≤ 20mm (pT1), y aquellos de entre 21 y 50mm (pT2), vimos que la tasa de mastectomía, aunque fue mayor en CDIS (58,3%) que en cualquiera de los 2 grupos de CDI, no fue estadísticamente mayor el porcentaje cuando el diagnóstico se realizó mediante biopsia con arpón. En los ductales infiltrantes de 20mm o menos, el porcentaje de mastectomía fue mayor que en tumores de tamaño histológico entre 21 y 50mm debido a que en los más pequeños existieron 8 casos de recidiva de carcinoma ductal previo in situ o infiltrante. Estas pacientes ya habían sido sometidas a una primera cirugía con tumorrectomía y habían recibido radioterapia adyuvante, y durante el seguimiento, y por hallazgo mamográfico, tras el diagnóstico mediante biopsia con arpón y resultado histológico de CDIS, se procedió a realizar mastectomía de rescate (a pesar de su pequeño tamaño).
La tasa de mastectomía tras nódulo palpable en CDIS (50%) fue mayor que la de los pT1 de ductales infiltrantes palpables (36,5%) y similar a la de los pT2 de carcinomas infiltrantes también palpables (47,8%), aunque estas diferencias tampoco fueron significativas.
DiscusiónEl 90% de nuestros CDIS fueron no palpables (porcentaje este similar al de otros autores5), por lo que a pesar de que los CDIS suponen solo un 11% de nuestros carcinomas de mama, son la cuarta parte de los diagnosticados mediante biopsia con arpón.
Por ser casi todos nuestros CDIS no palpables, se diagnosticaron tras alteración mamográfica y casi la mitad de nuestros CDIS pertenecían al grupo de edad en que (durante el periodo de estudio) se realizaba el cribado mamográfico (de 50 a 65 años). Kricker6 encuentra que un 54% de sus CDIS correspondían también a la edad de cribado (porcentaje algo mayor que el nuestro, ya que en el periodo de su estudio y en su medio el cribado comprendía entre los 50 y los 69 años).
La media de edad de nuestros CDIS (56 años) fue similar a la de Chapgar5 (55 años).
Solo un 10% de nuestros CDIS fueron palpables y en un 83% de ellos el diagnóstico se realizó mediante punción con aguja gruesa del nódulo.
La incidencia descrita de afectación axilar en los CDIS va de 0-4%, con porcentajes superiores en la era precribado mamográfico, cuando la mayoría de los CDIS se diagnosticaban tras nódulo palpable. En estos casos, la invasión existía sin duda ninguna, y o bien no se detectó por el patólogo o hubo un error en le toma de la muestra para el estudio histológico. En un estudio de 189 CDIS, la mayoría tras detección mamográfica, ninguno mostró metástasis axilar en la linfadenectomía7. En nuestros casos, se realizaron cuatro linfadenectomías (lo que supone un 7,4% de todos los CDIS), todas ellas tras nódulo palpable y en las que una biopsia con aguja gruesa mostró de forma preoperatoria la existencia de CDIS. Ante la posibilidad de encontrar en la cirugía definitiva la presencia de componente infiltrante, se decidió realizar linfadenectomía (ya que en el periodo de estudio aún no teníamos validada la técnica del ganglio centinela).
La realización de la técnica del ganglio centinela para los carcinomas infiltrantes y la observación de que el uso de la inmunohistoquímica permite la detección de células tumorales en ganglios que han sido negativos con hematoxilina-eosina han reabierto el debate del valor de la realización del muestreo ganglionar en los CDIS. Pendas8, realizando la técnica del ganglio centinela en 87 pacientes, encuentra 3 ganglios positivos mediante inmunohistoquímica. Pero por el momento la significación clínica de estas metástasis detectadas solo mediante inmunohistoquímica permanece incierta y no se admite la realización rutinaria de esta linfadenectomía selectiva en los CDIS.
Los programas de cribado mamográfico han permitido un gran aumento de detección de CDIS, pero a pesar de ello la realización de mastectomías en CDIS no ha disminuido de manera tan ostensible, como lo han hecho en los carcinomas infiltrantes últimamente9,10, haciendo parecer un contrasentido el hecho de que en un número considerable de pacientes con carcinomas infiltrantes, palpables clínicamente, puedan conservar su mama y se realice una mastectomía en CDIS aún no palpables. En nuestras pacientes, mientras que el 90% de los CDIS fueron no palpables, únicamente un 32% de los CDI no lo fueron. Por este diagnóstico «supuestamente precoz» al no ser aun palpables la mayoría de los CDIS, esperaríamos un mayor porcentaje de cirugía conservadora en CDIS que en ductales infiltrantes, que solo son no palpables la tercera parte de ellos.
La cirugía conservadora ha demostrado ser una alternativa segura a la mastectomía en pacientes con carcinoma infiltrante. Por lo tanto, la cirugía conservadora también lo tendría que ser para los CDIS.
Para evitar la recurrencia local y siempre tras cirugía conservadora, se ha de añadir radioterapia en los CDIS. Se han realizado 3 ensayos clínicos para conocer el beneficio de la radioterapia adyuvante tras la cirugía conservadora de mama11–13, que mostraron que la reducción de recurrencia local tras radioterapia adyuvante en CDIS fue menor en CDIS (50-60%) que la observada en carcinomas infiltrantes (70-75%), de lo que se deduce que la cirugía conservadora con radioterapia posterior sería una opción mas segura, en términos de evitar recurrencias locales, para los carcinomas infiltrantes que para los CDIS. Además, en los CDIS existe el riesgo potencial de que, en caso de existir recurrencia local, la mitad de ellas serán infiltrantes, con el subsiguiente riesgo de metástasis a distancia14–17 y posibilidad de muerte tras una lesión que en principio fue solo in situ. Es por ello que una de las causas de mastectomía, y no la menos importante, es el miedo, tanto por parte del médico como de la paciente, que una enfermedad en principio in situ pueda recurrir ya de forma infiltrante, con el consiguiente cambio de pronóstico para la paciente.
La realización de mastectomía en CDIS puede deberse a varias causas: dificultad en la consecución de bordes libres, existencia de factores pronósticos histológicos de alto riesgo de recurrencia local, existencia de CDIS extenso que comprometa el resultado estético adecuado si se realiza cirugía conservadora, la existencia de contraindicación de radioterapia adyuvante como gestación (salvo si el diagnóstico se hace en el tercer trimestre en el que la radioterapia se puede diferir al posparto), enfermedad vascular del colágeno que cause vasculitis de pequeños vasos o cambios en la piel que puedan empeorar con la cirugía conservadora o la radioterapia adyuvante (esclerodermia o lupus eritematoso activo), o historia de radioterapia previa sobre mamas (cirugía conservadora de mama anterior con radioterapia adyuvante, o radioterapia en manto por linfoma de Hodgkin previo).
Para que sea aceptable una cirugía conservadora de mama, se requiere que los bordes quirúrgicos estén libres, y cuando no lo estén, se precisará una ulterior cirugía, ya sea en forma de ampliación o de mastectomía. Pero a veces una reescisión puede comprometer el resultado estético, como ocurre en mamas pequeñas o sucesivas ampliaciones, por lo que habrá que optar por la realización de una mastectomía.
La trascendental importancia del estado de los márgenes quirúrgicos cuando se pretende cirugía conservadora de la mama, se debe a que de ello va a depender directamente el riesgo de recurrencia local, y así el estado de los bordes de resección de los CDIS aparece asociado en todos los estudios con la recurrencia local, aunque la magnitud de esta asociación es variable. La incidencia de recurrencia local es menor cuando se consiguen márgenes de resección libres si se comparan con márgenes positivos o desconocidos, pero el menor margen en milímetros (mm) requerido para evitar recurrencias no se ha establecido (y esto tanto para CDIS como para carcinomas infiltrantes). Nakamura18 en un estudio retrospectivo de 260 CDIS tratados mediante escisión y radioterapia adyuvante (con media de seguimiento de 105 meses) encuentra una incidencia de recurrencia local del 30% para márgenes de menos de 1mm, 17% para márgenes entre 1 y 9mm, y solo del 2% para más de 10mm.
Desafortunadamente, la evaluación de los márgenes puede ser un proceso complicado en algunos casos, por ejemplo en aquellos en los que la tumoración se extirpa en más de un fragmento. También es complicado el saber el margen de seguridad escindido cuando se lleva a cabo una reescisión de la biopsia inicial (por márgenes afectados o escasos).
Si la resección de bordes es importante, lo es más aún en los casos de CDIS con necrosis, ya que en estas células hipóxicas pueden tener menos sensibilidad a la radioterapia adyuvante, por lo que es importantísimo lograr la total escisión del tumor con márgenes libres suficientes antes de iniciar la radioterapia19.
Actualmente, no existe una evaluación estándar intraoperatoria para casos de lesiones no palpables de mama (biopsia con arpón). Lo que ha de existir, en cualquier caso, es una buena comunicación entre cirujano, patólogo y radiólogo, ya que se ha demostrado el valor de la comprobación radiológica intraoperatoria de inclusión de la lesión en la biopsia para disminuir el número de bordes afectados, pero también se ha visto que márgenes aparentemente negativos en la placa de control de la pieza quirúrgica, pueden ser positivos en la pieza histológica hasta en un 44% de los casos20.
Los márgenes de la pieza quirúrgica se han de tintar con tinta china (con distinto color cada uno de los 6 márgenes) para que en caso de afectación de algún margen se pueda localizar en la histología definitiva, pudiéndose ampliar únicamente la zona precisa, en aras a la mayor preservación de tejido sano y mejor resultado estético de la ampliación.
Mientras que en tumores infiltrantes palpables existe la posibilidad de realizar biopsia intraoperatoria de márgenes en muestra congelada, no se admite este procedimiento para carcinomas de menos de 1cm. Por ser en estos casos la muestra pequeña, es poco el tejido de que se dispone y en él hay que realizar tanto estudio histológico como inmunohistoquímico, y además, congelar el tejido para valoración intraoperatoria puede hacer imposible el diagnóstico diferencial entre hiperplasia ductal atípica y CDIS, así como la valoración de la presencia de microinvasión19.
Es precisamente en los CDIS en donde existe especial dificultad en la consecución de bordes quirúrgicos libres. En nuestros CDIS encontramos bordes afectados tras primera cirugía en la mitad de los casos y esto fue así tanto en los casos no palpables (biopsia con arpón mamográficamente guiada) como en los palpables clínicamente, siendo esta cifra mayor que la observada en CDI (39%). Otros autores5,21–23 encuentran cifras totalmente superponibles a las nuestras de bordes afectos en CDIS en la primera cirugía. Keskek23 encuentra, entre todos los tipos histológicos de carcinoma de mama, un mayor número de bordes afectados en CDIS (45%) y lobulillares infiltrantes (40%), encontrando bordes afectados solo en el 20% de los ductales infiltrantes.
Encontramos relación en cuanto al estado de bordes quirúrgicos en la primera cirugía y el grado histológico de nuestros CDIS, y así mientras que solo un 11% de los CDIS grado I tuvieron márgenes afectados, el porcentaje subió a un 62% para los de grado II y a 74% para los de grado III. Similar relación encuentra Chapgar5, que únicamente observa bordes afectados en un 5% de sus grados I frente a un 56 y 39% de grados II y III, respectivamente. Sin embargo Mokbel22 encuentra mayor número de bordes afectados precisamente en los CDIS grados I (83%) frente a solo un 46% tanto para grados II y III. Este autor argumenta su hallazgo diciendo que es precisamente en los grados histológicos superiores en donde existen mayor número de calcificaciones existen, y precisamente este marcador es el que va a guiar en el marcaje mediante arpón de la extirpación de la mayor cantidad de CDIS, mientras que en los grados histológicos I el CDIS más periférico puede carecer de microcalcificaciones, por lo que esto pudiera ser la razón por la que encuentra mayor número de bordes quirúrgicos afectados.
En nuestros CDIS también hubo relación entre el mayor número de márgenes afectados en los que se vio la existencia de necrosis (75%) frente a los que no la tuvieron (39%). Mokbel22, a pesar de que encuentra también más bordes afectados cuando se objetiva necrosis (67%), no encuentra diferencia con los que no la tuvieron (51%).
No tuvimos diferencia en cuanto a porcentaje de bordes afectados dependiendo de si se trató de CDIS no palpables o palpables, hecho que también constató Mokbel22 en sus CDIS.
Chapgar5 encuentra más márgenes afectados en sus CDIS de más de 1cm de tamaño histológico (61%) que en los menores (37%). Para nosotros, y a pesar de que tuvimos cifras muy similares a las de este autor (60% en mayores de 1cm y 44% en menores de este tamaño), la diferencia no resultó estadísticamente significativa.
Precisamos una tercera intervención por bordes persistentemente afectados en un 11% de nuestros CDIS, frente solo a un 1% de casos en que se dio esta circunstancia en ductales infiltrantes. La dificultad en conseguir bordes histológicos libres tras varias cirugías en CDIS la han constatado también Cellini24 y Chapgar5, y el problema que confiere la existencia de CDIS en la consecución de bordes libres lo demuestra Besic25 al encontrar mayor número de bordes libres en los carcinomas invasivos sin componente in situ asociado, que en aquellos otros en los que además de carcinoma infiltrante existe también componente de CDIS.
Por todo lo expuesto, la tasa de reescisiones para consecución de bordes libres en cirugía conservadora de mama en los CDIS es alta.
Como primera ampliación de cirugía por bordes afectados o escasos, realizamos un 47% de cirugía nuevamente conservadora, realizándose en el resto una mastectomía como ampliación. Keskek23 también realiza nueva cirugía conservadora en el 50% de sus ampliaciones por bordes afectados.
Otro de los motivos de la realización de mastectomía en los CDIS puede ser la existencia de factores pronósticos histológicos o inmunohistoquímicos adversos, y así Smith26 en sus CDIS tiene un 35% de factores pronósticos histológicos de alto riesgo de recurrencia local, y hasta un 46% de riesgo moderado. Otros autores5,6,22 encuentran entre sus CDIS mayor número de grados histológicos II o III, que grados I. Nosotros, sin embargo, encontramos los 3 grados histológicos en similar proporción.
Existe la dificultad de planificar la intervención definitiva en el caso de CDIS, aún conociendo el diagnóstico histológico de antemano, ya que frecuentemente las microcalcificaciones mamográficas infraestiman el verdadero tamaño histológico de la lesión, y esto ocurre sobre todo en los CDIS grados I, ya que al ser bien diferenciados, áreas importantes áreas del tumor pueden no contener microcalcificaciones27.
Cellini28 observa que sus tumores de grado alto (grado III) estuvieron asociados con mayor porcentaje de tumor residual en reescisiones por bordes afectados. De forma similar, en nuestros CDIS observamos un mayor porcentaje de ampliaciones con tumor residual en los grados II y III al compararlos con los grados I. Miller29 en un intento de discernir qué casos con márgenes afectados de entre todos sus carcinomas reescindidos tuvieron histologías positivas en la ampliación, encuentra mayor porcentaje de tumor residual en los CDIS y en aquellos carcinomas (infiltrantes o in situ) con sobreexpresión de Her 2/neu. Nosotros, a pesar de que encontramos mayor porcentaje de tumor residual en CDIS con sobreexpresión de HER-2/NEU, no tuvimos diferencias estadísticamente significativas.
El tamaño de los CDIS ha sido evaluado por muchos autores como factor pronóstico de recurrencia local. Pero la determinación de la medida histológica de CDIS es considerablemente más difícil que en los carcinomas infiltrantes, y esto puede deberse a que en ocasiones no existe lesión macroscópica, al contrario de lo que ocurre en carcinomas invasivos, por lo que la medición total requiere seriación de absolutamente toda la pieza quirúrgica extirpada.
El CDIS, a pesar de ser no palpable, puede ser a veces extenso; Keskek23 encuentra en sus CDIS tamaños de hasta 8cm, a pesar de que no fueron palpables muchos de ellos. En estos casos el factor estético puede verse comprometido en caso de cirugía conservadora. Nuestro CDIS de mayor tamaño tuvo 3,5cm y fue palpable clínicamente, y únicamente tuvimos 11 casos de más de 1cm en la primera cirugía. Nuestra media de tamaño de CDIS está en sintonía con la de Chapgar5, aunque mientras el 62% de sus CDIS tuvieron más de 1cm, nosotros solo excedieron esta medida el 21%.
Por todo lo anteriormente expuesto, las cifras de mastectomía en CDIS son aún altas si consideramos que se trata de una proliferación confinada a los conductos y con preservación de la membrana basal, y por lo tanto sin posibilidad de dar metástasis, y que la gran mayoría de los diagnósticos son preclínicos (aún no palpables). A pesar de esto, autores como Morrow30 encuentran contraindicación absoluta para conservación de la mama en el 33% de los CDIS, frente solo a un 10% de pacientes con carcinoma invasivo en estadio I, lo que puede justificar la alta tasa de mastectomía en CDIS en relación con los carcinomas infiltrantes en estadios iniciales. En nuestros casos fue mayor el porcentaje de mastectomía realizada en CDIS que en carcinomas invasivos de menos de 2cm. Asimismo, en nuestros CDIS diagnosticados mediante arpón mamográficamente guiado se realizó más frecuentemente mastectomía (40%) que en carcinomas infiltrantes diagnosticados de esta forma (28%).
Es variable la tasa de cirugía conservadora que refieren los distintos autores para CDIS, pero va de cifras de un 50%9,31, pasando por cifras de un 60% como la de Baxter32 o la nuestra, o de hasta el 70%6,26,33.
Rakovitch33 y Kricker6 analizan sus CDIS y encuentran mayor porcentaje de cirugía conservadora en grado histológico I que en grados histológicos altos. Nosotros, y de forma similar en cuanto a grado histológico, realizamos un 82% de cirugía conservadora de la mama en grados I, frente a un 47 y un 49% en grados II y III, respectivamente, y esto fue el reflejo de la existencia de un significativo menor número de bordes afectados en los grados histológicos I frente a los grados superiores.
Kricker6 refiere en mujeres con diagnóstico de CDIS, una tasa mayor de mastectomía en las menores de 40 años en relación con las de mayor edad. Sin embargo, en nuestras pacientes fue en el grupo de mujeres de menos de 50 años en el que más cirugía conservadora realizamos (76%), ya que si bien en este grupo de pacientes podría considerarse que van a estar sometidas a mayor número de años de riesgo de presentar una recurrencia local, ellas por su edad también, van a ser las que con más frecuencia demanden más cirugía conservadora.
La multifocalidad fue el principal factor de riesgo para Rakovitch33 (riesgo relativo de 3,5 y p=0,001) de realización de mastectomía en sus CDIS, aunque en una publicación posterior, esta misma autora34 encuentra que no existe un aumento de riesgo de recurrencia local en CDIS con multifocalidad a los que se añade radioterapia adyuvante tras la cirugía. En nuestros CDIS, y a pesar de que se realizaron más mastectomías en los casos de existencia de multifocalidad (64%) con relación a los que no tuvieron este hallazgo histológico (37%), la diferencia no fue estadísticamente significativa.
La decisión quirúrgica final en pacientes con CDIS debe estar basada en una combinación de hallazgos de evaluación clínica, mamográfica e histológica. Aunque las opciones de tratamiento disponibles para CDIS son similares a las utilizadas en el manejo de carcinomas infiltrantes, la evidencia en cuanto a seguridad y eficacia de cirugía conservadora en CDIS es menos concluyente, como lo demuestra el hecho de la menor disminución de recurrencia local en CDIS comparado con los carcinomas infiltrantes al añadir radioterapia poscirugía conservadora11–13, y el riesgo potencial de que una enfermedad en principio in situ, en caso de recurrencia local puede ser infiltrante con el consiguiente riesgo de menor supervivencia. Las indicaciones ideales de conservación de mama en CDIS serían las de CDIS con hallazgos mamográficos localizados, sin evidencia de sospecha de multicentricidad radiológica ni microcalcificaciones difusas de aspecto sospechoso y que en la histología definitiva se haya podido conseguir bordes libres con adecuado margen de seguridad y buen resultado estético.
En nuestros casos vimos que la consecución de bordes libres a veces es difícil, precisando en algunos casos hasta una tercera cirugía. En el periodo de estudio a la hora de realización de la biopsia con arpón aún desconocíamos el diagnóstico de CDIS previo a dicha cirugía. Quizás ahora que ya disponemos de posibilidad de realizar core biopsia guiada con esterotaxia de las lesiones mamográficas sospechosas que nos permite conocer el diagnóstico de antemano, podamos ser capaces de obtener más bordes libres al ser más ambiciosos en la primera resección y sin perder de vista nunca, a la hora de la cirugía, que el CDIS se extiende siempre en dirección al pezón. El conocimiento preoperatorio del grado del CDIS será de utilidad sobre todo en los casos de grados histológicos II o III, en donde más bordes afectados hemos encontrado en nuestros casos estudiados y, por tanto, será en ellos donde intentemos ser mas ambiciosos a la hora de la resección, ya que existe consenso general de existencia de mayor porcentaje de márgenes libres cuando se conoce de forma preoperatoria el diagnóstico de carcinoma en la lesión no palpable mediante diagnóstico preoperatorio percutáneo con core biopsia22,35–37.
En cualquier caso, en determinadas situaciones, especialmente aquellas en las que se presupone un riesgo sustancial de recurrencia local, la mastectomía continúa siendo una opción. En la situación ideal y en caso de mastectomía en CDIS, podría acompañarse ésta de reconstrucción inmediata (o en su defecto diferida). Aunque el tamaño histológico no es indicación de mastectomía, la extirpación de tumores grandes está asociada a resultados cosméticos pobres, de tal manera que CDIS grandes que para el logro de aceptables resultados estéticos tengan que ser extirpados con bordes quirúrgicos escasos deberían considerarse candidatos a mastectomía. Esto ocurre sobre todo en los casos de mamas pequeñas y teniendo en cuenta la dificultad ya comentada de estimar el tamaño histológico final ante una imagen mamográfica inicial. Para cada una de las pacientes se ha de considerar la relación riesgo-beneficio de conservación de la mama ante la mastectomía con reconstrucción inmediata, que también puede ser una buena alternativa de tratamiento.
Como conclusión, se puede decir que los programas de cribado mamográfico en la población han contribuido grandemente a disminuir la mortalidad por cáncer de mama y también al diagnóstico creciente de CDIS. Pero precisamente los CDIS a veces constituyen un reto para la cirugía conservadora, ya que es en ocasiones difícil conseguir márgenes libres en ellos, lo que nos puede llevar a la aparente paradoja de tener que realizar una mastectomía, cuando en casos de carcinomas infiltrantes podemos permitir cirugía conservadora sin empeorar el pronóstico de estas pacientes. En cualquier caso, se han de discutir cuidadosamente con la paciente las ventajas y desventajas de cada tipo de cirugía, para que ella sea también partícipe en la toma de decisión final de su cirugía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.