Las neoplasias de ovario suelen presentarse en estadios avanzados. La citorreducción primaria completa continúa teniendo una importancia clara en el pronóstico de las pacientes. Hemos asistido a una progresiva mejoría en el resultado de los tratamientos, desde la aparición de los taxanos, así como de la importancia de la vía intraperitoneal. Sin embargo, esta última no acaba de imponerse como práctica clínica habitual dadas las dificultades que presenta. Tras el final de la quimioterapia adyuvante, la mayoría de las pacientes presentará una recaída. La identificación de las pacientes con mayor riesgo puede permitir el establecimiento de una pauta terapéutica que mejore las perspectivas de este subgrupo de pacientes.
La enfermedad residual tras citorreducción primaria y quimioterapia adyuvante tiene una importancia pronóstica y su manejo no responde a pautas estandarizadas.
Ovarian cancer is often diagnosed in the advanced stages. Primary cytoreduction still retains its central prognostic value. We have witnessed a general in treatment results since the appearance of the taxanes and the development of the intraperitoneal therapies. However, the latter has not been incorporated into routine clinical practice, given the difficulties it poses. After adjuvant chemotherapy the majority of our patients will recur. If we could identify high risk patients, we could study and develop better strategies for these patients.
The residual disease after the completion of cytorreductive surgery and adjuvant chemotherapy has prognostic importance and its management is not well established.
La mayoría de las pacientes con tumores ováricos se presentan con enfermedad avanzada, son sensibles a tratamientos quimioterápicos y finalmente presentan recurrencias, generalmente con un pobre pronóstico.
Por tanto, debemos buscar y diseñar mejores estrategias terapéuticas.
Tras los resultados de 2 ensayos en fase III publicados durante la pasada década, se concluyó que la quimioterapia de combinación con cisplatino (CDDP)-paclitaxel era superior a la combinación CDDP-ciclofosfamida en pacientes con neoplasias ováricas avanzadas, por lo que la primera se ha adaptado como «patrón de oro» en el tratamiento del cáncer de ovario1-3.
Posteriormente, 3 ensayos mostraron similar eficacia pero con menor toxicidad, con la combinación carboplatino (CBDCA)-taxol, y se adoptó como estándar en 2004 en la Gynecologic Intergroup Ovarian Cancer Consensus Conference4-7.
Sin embargo, las pacientes continúan recayendo tras presentar una buena respuesta clínica y patológica.
Ante este panorama, es fundamental la identificación de las pacientes más susceptibles de recaer, con peor pronóstico y en las que deben focalizarse esfuerzos para mejorar sus perspectivas.
Una de las estrategias utilizadas fue diseñar una combinación triple con un tercer fármaco agregado a la combinación de platino-taxol, que no consiguió los éxitos deseados8-10.
Otras aproximaciones han intentado quimioterapia de continuación con la utilización de los mismos fármacos o con quimioterápicos sin resistencia cruzada.
El uso de la vía peritoneal para la administración de fármacos ha mostrado una mejoría de la supervivencia, pero a costa de una mayor toxicidad y complicaciones, que la convierten en una vía complicada, lo que dificulta continuar con el programa terapéutico propuesto.
La definición de enfermedad microscópica residual y la experiencia reportada con diferentes aproximaciones y tratamientos convierten este campo en interesante y prometedor a la hora de promover nuevas aproximaciones.
ENFERMEDAD MICROSCÓPICA RESIDUALExiste un grupo importante de pacientes con neoplasia de ovario en las que, tras cirugía citorreductora y tratamiento quimioterápico adyuvante, no podemos poner de evidencia enfermedad residual mediante el empleo de métodos clínicos, pero en las que la enfermedad posteriormente reaparecerá.
El método más habitual para mostrar la presencia de enfermedad residual fue la laparotomía-laparoscopia, conocida como second look (SL).
IMPACTO DEL LA CITORREDUCCIÓN SECUNDARIAEl estudio de McCreath et al11 se planteó como un estudio retrospectivo en 262 pacientes con SL positiva y con remisión clínica completa. El primer objetivo fue la supervivencia global. Las pacientes habían recibido tratamientos diversos, como CDDP intraperitoneal, con o sin un segundo fármaco por vía intravenosa; se obtuvo una supervivencia global de 262 pacientes, con una edad media de 54 años.
Los tratamientos aplicados fueron otros fármacos intraperitoneales o quimioterapia intravenosa únicamente. Dos de los factores analizados tuvieron significado pronóstico: la enfermedad residual tras la cirugía primaria y la enfermedad microscópica residual a la SL microscópica.
Los tratamientos de segunda línea aplicados no tuvieron impacto.
En el estudio de Dowdy et al12 se analizó a 150 pacientes, 145 con seguimientos completos. La supervivencia media fue de 18 meses y en el análisis univariante resultaron significativos la presencia de enfermedad residual tras la primera intervención, la presencia de enfermedad en la SL y el grado tumoral.
Las pacientes con enfermedad microscópica ≤ 1 cm que quedaron con enfermedad microscópica con la citorreducción secundaria tuvieron mejor supervivencia tras la SL (p = 0,003) (SM: 3,3, 2,5 y 1,4 años).
Las pacientes con enfermedad macroscópica o ≥ 1 cm no presentaron diferencias significativas: 1,3 y 1 año, respectivamente.
Obeimar et al13 publicaron otro análisis retrospectivo de 179 pacientes, en estadio FIGO II, con cirugía subóptima, o III-IV adecuadamente citorreducidos y con respuesta clínica completa (cCR). En pacientes con enfermedad macroscópica, se continuó con citorreducción. Las pacientes con SL positiva recibieron quimioterapia como tratamiento de segunda línea. La supervivencia desde la SL se consideró el objetivo primario del estudio.
En 78 pacientes no se evidenció enfermedad residual. Las pacientes con sin enfermedad (NE), enfermedad microscópica (Em) y enfermedad macroscópica (EM) tuvieron supervivencias de 66,6, 57,2 y 19 meses, respectivamente, y con diferencias significativas.
La presencia de una enfermedad macroscópica residual se comportó como un factor pronóstico adverso.
Gaducci et al14 publicaron un análisis retrospectivo de 81 pacientes, 31 de ellos con pCR, 7 con enfermedad microscópica, 22 con enfermedad macroscópica, 21 con enfermedad residual; 22 de los 43 pacientes con EM siguieron en citorreducción, 11 completa, y 11 con reducción a tamaño menor de 2 cm.
Los pacientes con reducción a Em tuvieron mejor supervivencia que el resto (EM): 49 frente a 19,6 (p = 0,002). Los pacientes con EM < 2 cm tras la SL tuvieron mejor supervivencia que aquellos con residuo macroscópico (24 frente a 10 ms; p = 0,0001). Se evidenció recurrencia en todos los casos, independientemente de la enfermedad encontrada en el momento de la SL.
Nicoletto et al15 presentaron un estudio prospectivo con la hipótesis de que las pacientes con cCR pueden beneficiarse de la SL en 102 pacientes con cCR aleatorizadas en 2 brazos; en 48 pacientes se realizó seguimiento únicamente y en 46 pacientes una SL.
De las pacientes con SL, 35 no presentaron persistencia de enfermedad y 11 fueron positivas.
Las 11 pacientes recibieron quimioterapia de segunda línea. La SL no impactó en la supervivencia (SL frente a no SL), que fue del 65 y el 78%, respectivamente (p > 0,005).
Como conclusión, podemos considerar que la presencia de enfermedad tras citorreducción y quimioterapia adyuvante es un factor pronóstico adverso y que la resección completa tras la SL positiva tiene impacto en la supervivencia, pero esto no ocurre con la SL diagnóstica.
Se necesitan tratamientos para aquellas pacientes con enfermedad residual con urgencia.
ESTRATEGIAS TERAPÉUTICAS CON FÁRMACOS TRAS LADETECCIÓN DE ENFERMEDAD MICROSCÓPICA RESIDUALTratamientos con quimioterapiaQuimioterapia sistémica en pacientes con enfermedad residual tras la finalización de la adyuvanciaBolis et al16 realizaron un estudio abierto, sin controles, con topotecán en monoterapia, que incluyó a pacientes con Em residual tras tratamiento con CBDCA-taxol y SL con enfermedad residual < 2 cm. Las pacientes presentaron estadios III-IV al diagnóstico.
Todas las pacientes documentaron una respuesta a la quimioterapia > 50% con respecto a la enfermedad documentada tras la citorreducción primaria.
Se incluyó a un total de 38 pacientes. Se realizó una third look con laparoscopia o laparotomía en pacientes sin progresión después de 1 mes de la finalización de la quimioterapia.
Se documentó una respuesta completa en 10 casos (28,5%; intervalo de confianza [IC] del 95%, 15,6-59,5). La respuesta fue parcial en 1 (2,5%) paciente; se demostró progresión en 11 (31,4%) pacientes y enfermedad estable en 13 pacientes.
La duración media de la respuesta fue de 8 meses (5-20). La supervivencia global a 1 año fue del 82,8%. No se comunicaron toxicidades relevantes.
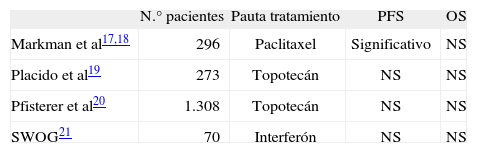
Quimioterapia de mantenimientoEl estudio más representativo fue el publicado por el grupo de Markman et al17,18 del SWOG/ GOG. En este estudio se aleatorizó a un total de 296 pacientes con respuesta clínica completa (datos de ASCO 2006). Las pacientes recibieron 3 ciclos o 12 ciclos de paclitaxel a 175 mg/m2 cada 4 semanas. Tras el fin de la quimioterapia, las pacientes fueron observadas hasta la progresión. El análisis se realizó en función de la intención de tratamiento.
El estudio fue cerrado prematuramente por el comité de control cuando se alcanzaron diferencias significativas en el intervalo librede progresión (22 frente a 14 meses [p = 0,01]), que no fue significativo para la supervivencia global (53 frente a 46 meses; p = 0,27).
Otros trabajos han estudiado la quimioterapia de continuación con fármacos sin resistencia cruzada, como es el caso del trabajo publicado por De Placido et al19,20.
El objetivo de este ensayo fue estudiar el efecto de la quimioterapia de mantenimiento con topotecán en 4 ciclos en pacientes con respuesta clínica completa. Se incluyó a 273 pacientes; 137 pacientes recibieron tratamiento con topotecán y 136 pasaron a observación. Un 65% de las pacientes presentaron estadio III al diagnóstico y un 10%, estadio IV. Tras la citorreducción primaria, un 46% no tenía enfermedad residual y un 20% se consideró óptimamente citorreducidas.
Después de quimioterapia con CBDCA-paclitaxel, un 87% presentó una respuesta clínica completa y un 13% una respuesta parcial.
No se encontraron diferencias en ambos grupos en cuanto al intervalo libre de progresión y a la supervivencia global. Se permitió incluir a pacientes con cirugía completa e incompleta.
El grupo de Pfisterer et al20 estudió a un grupo de 1.308 pacientes con carcinoma de ovario en estadio IIb-IV tras la finalización de quimioterapia con platino-paclitaxel, seguida de 4 ciclos de topotecán (TC-Top) (658 pacientes) o seguimiento (650 pacientes), en un esquema trisemanal. El objetivo primario fue la supervivencia global y los objetivos secundarios fueron el intervalo libre de progresión, la respuesta, la toxicidad y la calidad de vida.
El intervalo libre de progresión fue de 18,2 meses en el grupo con TC-TOp y de 18,5 meses en el grupo control (hazard ratio = 1,01; IC del 95%; 0,86-1,18).
La supervivencia media a los 3 años fue del 57%, el 58,5% con TC y el 55,7% con TC-Top. Por supuesto, el brazo que siguió tratamiento con topotecán presentó mayor tasa de efectos adversos.
Recientemente, el SWOG21 ha publicado un nuevo trabajo con el uso de interferón semanal a dosis de 50 × 10 MU × 6 semanas, por vía intraperitoneal, frente a observación. Este ensayo se cerró prematuramente por la falta de reclutamiento, con 74 pacientes incluidas; 70 pacientes fueron evaluables para el intervalo libre a la progresión y la supervivencia global. No se han documentado diferencias significativas en cuanto al intervalo libre a la progresión (p = 0,56). La supervivencia global en el grupo no tratado fue de 87 meses y no se ha alcanzado en el grupo que recibió tratamiento.
El tratamiento con interferón fue bien tolerado y no se reportaron defunciones relacionadas con el tratamiento ni eventos adversos de grado 4. De este ensayo no pueden derivarse conclusiones prácticas. Sin embargo, es interesante para el uso de bioterapia en este campo (tabla 1).
Resultados con quimioterapia de mantenimiento tras finalizar la quimioterapia sistémica
| N.° pacientes | Pauta tratamiento | PFS | OS | |
| Markman et al17,18 | 296 | Paclitaxel | Significativo | NS |
| Placido et al19 | 273 | Topotecán | NS | NS |
| Pfisterer et al20 | 1.308 | Topotecán | NS | NS |
| SWOG21 | 70 | Interferón | NS | NS |
NS: no significativo; OS: supervivencia global; PFS: supervivencia libre de progresión.
En el estudio de Bakarat et al22 se administraron 3 ciclos de quimioterapia intraperitoneal con CDDP (100 mg/m2)-VP 16 (200 mg/m2) como consolidación en pacientes con SL negativa. Se trató a un total de 40 pacientes. Se compararon con 46 pacientes contemporáneas que siguieron únicamente controles.
Fueron finalmente elegibles 36 pacientes, con una edad media de 52 años. Estaban en estadio II 3 pacientes, en estadio III 31 mujeres y en estadio IV 2 pacientes. El grado histológico fue: GI 2 pacientes, GII 7 y GIII 25 pacientes, y no se registró en 2 casos. En cuanto a la enfermedad residual tras la citorreducción primaria, 13 pacientes no la presenta ron y se demostró enfermedad residual microscópica en 36 pacientes. Se realizó un seguimiento medio de 36 meses en ambos grupos; el 39% de las pacientes con quimioterapia intraperitoneal habían recaído, comparado con 54% en el grupo de control. El intervalo libre de enfermedad fue de 28,5 meses en el grupo control y no se alcanzó en el grupo tratado; este intervalo fue significativo a favor del grupo tratado (p = 0,003).
El análisis multivariante mostró que el único factor pronóstico fue el tratamiento aplicado.
En el estudio aleatorizado en fase II publicado por Muggia y Liu23, pacientes con enfermedad residual tras citorreducción primaria y quimioterapia sistémica recibieron quimioterapia intraperitoneal por enfermedad residual o tras segunda citorreducción a la enfermedad mínima durante la SL. Se reclutó a pacientes dentro de los primeros 30 días tras la SL o citorreducción. Las pacientes se estratificaron según la máxima enfermedad residual, microscópica: 0,5 cm y 0,5-1 cm; por el momento de su aleatorización con respecto a la SL: 14 días y 14-30 días, y por el valor del CA 125: < 35 o > 35.
El brazo de tratamiento fue de mitoxantrona 10 mg/ m2 cada 2 semanas o 9 FUDR 3 g/m2/día durante 3 días, cada 3 semanas por 6 ciclos. Se implantaron reservorios para tratamiento intraperitoneal. Los fármacos se diluyeron en 1,5-2 l de suero fisiológico. Se incluyó a 83 pacientes entre diciembre de 1998 y enero de 1994; se excluyó a 6 pacientes patológicas, 9 quirúrgicas y 29 pacientes no evaluables. El FUDR se consideró el fármaco de elección para continuar estudios debido a una tasa de no progresión al año del 15% y una supervivencia media de 38 meses (tabla 2).
Resultados con diferentes vías y fármacos
| Quimioterapia sistémica | |
| Bolis et al16 | |
| Fármaco utilizado | Topotecán i.v. |
| Tasa de respuesta | 100% con > 50% |
| Third look | 100% de las pacientes |
| Respuesta completa | 1 (2,5% de las pacientes) |
| Supervivencia al año | 82,8% de las pacientes |
| Quimioterapia de mantenimiento | |
| Markmann et al17,18 | |
| Tratamiento | Taxol de mantenimiento |
| N.° de pacientes | 277 pacientes; 262 evaluables |
| Resultado | Supervivencia globlal no significativa |
| Intervalo libre de progresión significativo | |
| Quimioterapia intraperitoneal | |
| Bakarat et al22 | |
| N.° pacientes con pCR | 40 |
| Tipo de quimioterapia | CDDP-VP 16 |
| Estadios | II-III-IV |
| Comparado con | 46 controles contemporáneos |
| Seguimiento | 36 meses |
| Recaída | 39% pacientes tratadas |
| 54% no tratadas | |
| DFS | 28,5 meses en grupo no tratado |
| No alcanzada en grupo tratado | |
| Muggia et al23 | |
| Tipo de quimioterapia | Mitoxantrona frente a FUDR |
| PFS al año | 18% |
| Supervivencia media | 38 meses |
PFS: supervivencia libre de progresión.
El carcinoma de ovario puede considerarse una enfermedad radiosensible; sin embargo, la administración de la radioterapia a las pacientes con carcinoma de ovario y carcinomatosis peritoneal entraña dificultades dosimétricas y tiene consecuencias a largo plazo por toxicidad, además de dificultar la administración de una dosis potencialmente efectiva.
RadioinmunoterapiaLa radioinmunoterapia como aproximación permitiría, mediante el uso de un anticuerpo ligado a un agente radiactivo, la localización y la administración de una dosis de radioterapia letal a cualquier célula que exprese en su membrana el antígeno al que estaría dirigido el anticuerpo.
El grupo de Oei et al24 analizó la administración del anticuerpo monoclonal HMFG1 (90-muHMFG1) en el patrón de recurrencia. Se incluyó a un total de 447 pacientes, con un seguimiento medio de 3,5 años. Se apreciaron recaídas en 104 de las 224 de las pacientes tratadas y en 98 de las 223 mujeres del brazo control. Las pacientes tratadas presentaron más recaídas extraperitoneales (p < 0,05) y menos intraperitoneales (p < 0,001). El impacto del tratamiento sólo se apreció en las pacientes que presentaron enfermedad residual tras la cirugía primaria. No se apreciaron diferencias significativas en cuanto a la supervivencia global.
El trabajo de Meredith et al25 es un estudio de fase 1 de combinación de interferón subcutáneo, paclitaxel intraperitoneal y radioinmunoterapia intraperitoneal con lutecio 177 (177LU-CC49). Se trató a pacientes con recurrencias confinadas a la cavidad abdominal tras la primera línea de quimioterapia. El paclitaxel se administró como radiosensibilizante y con intención antitumoral. Se trató a 34 pacientes con los 3 agentes, con buena tolerancia; la toxicidad más reseñable fue la hematológica; 4 de 17 pacientes con enfermedad medible experimentaron una respuesta parcial, y 4 de 27 pacientes con enfermedad no medible presentaron intervalos libres a la progresión de más de 18, 21, 21 y 37 meses, respectivamente.
El último trabajo que comentaremos es el de Crippa et al26, en el que 16 pacientes con SL positiva y enfermedad definida como < 0,5 cm recibieron radioinmunoterapia intraperitoneal con 131I MOv18, entre 30 y 40 días tras la SL. Se realizó una third look 90 días después de la administración intraperitoneal; 5 pacientes presentaron una respuesta completa, en 6 pacientes se confirmó enfermedad estable y en 5 mujeres, progresión. Tras 34 meses de seguimiento, 1 paciente continuaba libre de enfermedad y 4 habían recaído, con un intervalo libre de enfermedad medio de 10,5 meses.
Se han publicado otros trabajos (Molthoff CF, Maraveyas A, Jacobs AJ, etc.) con resultados dispares.
RadioterapiaEl uso de radioterapia abdominal completa puede ilustrarse a partir del trabajo de Dowdy et al27, en el que se aleatorizó a un total de 171 pacientes tras SL positiva con Em (SL), seguida de cirugía citorreductora en el caso de EM (SLC). La dosis media administrada fue de 25,5 Gy, con un boost pélvico en 120 pacientes y en ganglios paraórticos en 21 pacientes. La dosis planificada se administró a 123 pacientes. Hubo una muerte relacionada con el tratamiento.
Un 41% de las pacientes no habían presentado progresión a los 5 años en el grupo de SL, y a 11 meses en el grupo de EM.
El 15% de las pacientes presentaron toxicidad de intestino delgado. De este trabajo se desprende que la radioterapia abdominal puede tener sentido en el subgrupo de pacientes con Em residual.
Se han publicado otros trabajos en los años setenta y ochenta; sin embargo, la radioterapia no se ha revelado como una estrategia terapéutica de cara al tratamiento del cáncer de ovario. Es posible que con la aparición de las nuevas técnicas de radiación (IMRT) pueda reconsiderarse el uso de esta modalidad terapéutica en monoterapia o combinada con quimioterapia radiosensibilizante.
RadiofármacosUno de los radiofármacos que se ha utilizado en el tratamiento de las neoplasias de cavidades ha sido el P32. En relación con él debemos mencionar el trabajo de Vergote et al28, que estudiaron retrospectivamente a 313 pacientes. La supervivencia a los 5 años fue del 81% en el grupo tratado con P32 adyuvante y del 79% en el grupo tratado en el momento de la SL. El P32 provocó complicaciones intestinales en un 7% de las pacientes, 9 de las cuales tuvieron que ser intervenidas.
Uso del valor de CA 125 al final de la quimioterapia. El nadir como factor pronósticoRecientemente, se han publicado trabajos sobre la importancia del nadir del CA 125 y el riesgo de recaída.
En el trabajo publicado en ASCO 2006 por Tanabe et al29, se estudió de manera retrospectiva el nadir del CA 125 en 84 pacientes con carcinoma de ovario en estadios III-IV. Según este trabajo, las pacientes con un nadir de CA 125 > 10 presentaron peor supervivencia libre de progresión y supervivencia global, con un riesgo relativo para la supervivencia libre de progresión y supervivencia global significativamente peor (tablas 3 y 4).
Datos de supervivencia libre de enfermedad y global en el trabajo de Tanabe et al29 según nadir de CA 125 al final de la quimioterapia
| Media de: | PFS | OS |
| Nadir CA 125 | 19 meses | 36,5 meses |
| HR PFS | HR OS | |
| ≥ 10 U/ml | 0,39 (IC del 95%, 0,21-0,71) | 0,28 (IC del 95%, 0,11-0,72) |
HR: hazard ratio; OS: supervivencia global; PFS: supervivencia libre de progresión.
Características de las pacientes y nivel de nadir correlacionado con la supervivencia en el trabajo de Tanabe et al29
| N.° pacientes | 84 |
| Estadio | III: 59 |
| IV: 25 | |
| Histología | Seroso: 71 |
| No seroso: 13 | |
| Diámetro tumor tras cirugía | < 2 cm: 72 pacientes |
| > 2 cm: 12 pacientes | |
| CA 125 antes de la cirugía | Media: 535 |
| Rango: 13-28190 | |
| Nadir CA 125 | < 10: 54 pacientes |
| > 10: 30 pacientes |
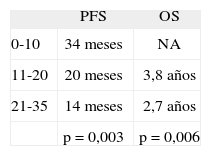
El trabajo de Nadal et al30, publicado también en ASCO 2006, estudia, de manera también retrospectiva, el nadir del CA 125 en 114 pacientes en estadios Ic-IV, tratadas de manera similar con CDDP o CBDCA y taxanos. En este trabajo no se apreciaron diferencias en cuanto al estadio FIGO y el nadir del CA 125. Se establecieron 3 cortes para el nadir de CA 25: ≤ 10, 11-20 y 21-35 U/ml. El PFS, de acuerdo con los 3 grupos, fue de 34, 20 y 14 meses, respectivamente. La supervivencia media para el grupo con nadir ≤ 10 no estaba establecida en el momento de la publicación del abstract. La supervivencia global fue de 3,8 y 2,7 años, respectivamente, para los grupos segundo y tercero (tablas 5 y 6).
Características de las pacientes en el trabajo de Nadal et al30
| N.° pacientes | 114 |
| Estadios | IC-IV |
| Histología | 56% seroso |
| 12% endometrioide | |
| 16% pobremente diferenciado | |
| Quimioterapia | Platino-taxanol |
El tercer estudio que debemos valorar en este apartado es el publicado por Markman et al, ya comentado previamente, con el uso de paclitaxel de mantenimiento en pacientes con carcinoma de ovario y respuesta clínica completa. Este estudio fue positivo para el intervalo libre de progresión, pero no en cuanto a la supervivencia global. En este estudio, el nivel de CA 125 fue también estadísticamente significativo con un corte ≤ 10 o > 10 como valor pronóstico (prueba de Cox p = 0,03).
CONCLUSIONESEl estudio de la enfermedad residual en pacientes con carcinoma de ovario, tras citorreducción primaria y quimioterapia adyuvante, es importante a la hora de establecer el pronóstico de las pacientes y para considerar una estrategia terapéutica.
La calidad de la citorreducción primaria se confirma como uno de los factores clave en cuanto a la calidad terapéutica de los programas en cáncer de ovario.
El uso de la SL puede tener una utilidad en el caso de pacientes con EM que puedan ser citorreducidas nuevamente. No disponemos de propuestas terapéuticas claras en el caso de las pacientes que no presenten una pCR y los trabajos publicados han aportado resultados contradictorios. Los nuevos fármacos, como permetrexed, adriamicina liposomal y bortezomib, pueden estudiarse en este contexto en monoterapia o en combinación con anticuerpos o agentes biológicos.
El uso del nadir del CA 125 puede considerarse como una herramienta sencilla de aprovechar y con potencial aplicación clínica para la selección de las pacientes con mejor pronóstico y para poder plantear el tratamiento en las pacientes que lo presentan peor.
El uso de nuevos fármacos sin resistencia cruzada en este subgrupo de pacientes puede aportar en el futuro una mejora de sus perspectivas.