1. INTRODUCCIÓN
Aunque la cardiopatía no es muy frecuente entre las mujeres gestantes (0,4-2%), continúa siendo una causa importante de mortalidad materna. Esto se debe a los cambios hemodinámicos que ocurren durante el embarazo, que son bien tolerados por la mujer sana, pero que pueden descompensar el corazón de una mujer cardiópata y provocar un grado variable de morbimortalidad. En un estudio sobre muerte materna en el Reino Unido (1997-1999), la enfermedad cardíaca igualó a la tromboembolia como causa principal. El 30% de las defunciones de causa cardíaca eran por cardiopatía congénita, el 15% por cardiopatía isquémica y el resto por otras cardiopatías adquiridas1.
Desde las pasadas décadas se viene observando un cambio en el tipo de cardiopatía materna, con un gradual incremento de las madres con una cardiopatía congénita y una disminución de las portadoras de una cardiopatía reumática, reflejo de una brusca disminución en la incidencia de fiebre reumática y un tratamiento médico y quirúrgico mucho mejor de las cardiopatías congénitas, que permite a muchas niñas no sólo llegar a la edad reproductiva, sino hacerlo en unas condiciones que permiten el embarazo.
Por todo lo anterior, es evidente que para atender a una mujer con cardiopatía, que desea o tiene un embarazo, se requiere un enfoque multidisciplinario. Será necesario conocer las modificaciones cardiovasculares en el embarazo, la traducción que estos cambios tienen en la sintomatología y las exploraciones clínicas, cuándo contraindicar un embarazo o cuándo terminarlo y de qué manera, cómo controlarlo, qué fármacos se pueden utilizar o no, etc.
2. MODIFICACIONES CARDIOVASCULARES EN EL EMBARAZO
Se deben a los cambios hormonales, la circulación uteroplacentaria y al incremento del tamaño uterino (tabla 1). Estos cambios se inician en una fase precoz del embarazo y adquieren su mayor expresión en el tercer trimestre. En el segundo mes se inicia un progresivo aumento del volumen plasmático, que al final del embarazo puede llegar a ser hasta de un 50% respecto al pregestacional. Este aumento es mayor en embarazos múltiples (20-30% más que en únicos).
El gasto cardíaco es directamente proporcional al volumen plasmático y a la frecuencia cardíaca, y por ello aumenta progresivamente hasta en un 40-50% hacia el segundo trimestre y luego se mantiene en ese nivel hasta el final. Este aumento del gasto cardíaco se debe principalmente al mayor volumen plasmático, dado que la frecuencia cardíaca sólo aumenta un 10-15%. Durante el parto, cada contracción uterina supone una «autotransfusión» de 300-500 ml de sangre que retorna a la circulación sistémica. El gasto cardíaco aumenta aproximadamente un 34% en cada contracción y un 12% entre contracciones.
Durante el embarazo descienden las resistencias vasculares periféricas. Esto implica una disminución de la presión arterial sistémica, más evidente en el segundo trimestre y menos llamativa al final de la gestación. Las presiones pulmonares no varían significativamente.
También existe un estado de hipercoagulabilidad, con aumento de los factores de coagulación II, VII, VIII, IX y X, mayores concentraciones de fibrinógeno sérico, mayor turnover plaquetario y una actividad fibrinolítica plasmática disminuida. Esta situación favorecerá los fenómenos trombóticos tanto durante el embarazo como en el puerperio2.
3. EXPLORACIÓN CARDÍACA EN EL EMBARAZO
Los cambios que ocurren durante el embarazo en la fisiología cardiovascular provocan síntomas y signos que son normales, pero que simulan los ocurridos en pacientes con afección cardíaca.
La disnea acompañada de fatiga es muy frecuente. Aparece hasta en el 75% de las gestantes durante el tercer trimestre. También puede haber ortopnea por la presión ejercida por el útero a término sobre el diafragma. Se debe pensar que ambas pueden ser patológicas si son progresivas, si resultan en una limitación importante de la actividad o si ocurren en reposo.
La sensación de mareo o incluso síncope (lipotimia) es frecuente debido a la disminución de la presión arterial. A veces ocurre en decúbito supino por la presión ejercida por el útero sobre la cava, lo que disminuye la precarga. Son frecuentes las palpitaciones al final del embarazo. Pueden ser signo de afección si se asocian con arritmia o si la frecuencia supera los 160 latidos/min. El edema es común, sobre todo al final del embarazo y más en épocas de calor. Se debe a la dilatación venosa y a la disminución de la presión oncótica.
Habrá que pensar en afección cardíaca si se ve alguno de los siguientes3:
Síntomas: síncope, disnea u ortopnea progresivas, angina de esfuerzo.
Signos: acropaquias, hemoptisis, ingurgitación yugular persistente, cianosis, soplo sistólico > III/IV, soplo diastólico, cardiomegalia, arritmia sostenida, desdoblamiento fijo del segundo ruido e hipertensión pulmonar.
El electrocardiograma suele reflejar la horizontalización del corazón, con un eje eléctrico desviado a la izquierda; puede mostrar alteraciones inespecíficas de la repolarización ventricular, extrasístoles auriculares o ventriculares de densidad variable y en algunas gestantes se advierten distintos grados de bloqueo auricular tipo Wenckebach. En la radiografía de tórax es común observar un aumento del índice cardiotorácico por el incremento de los volúmenes ventriculares. Con ecocardiografía es común observar pequeños derrames pericárdicos en el tercer trimestre, así como un pequeño aumento en las dimensiones de las 4 cámaras cardíacas y una dilatación progresiva de las válvulas pulmonar, tricúspide y mitral con regurgitación funcional leve.
4. CONSEJO PRECONCEPCIONAL
La situación ideal a la hora de enfrentarse a una mujer cardiópata que desea embarazo es la planificación antes del embarazo. El consejo preconcepcional debe tomar en consideración estos 6 aspectos:
Definir la lesión cardíaca: su naturaleza, función ventricular, presión pulmonar, severidad de las lesiones obstructivas, persistencia o no de shunts y presencia o no de hipoxemia.
Definir el estado funcional materno (tabla 2): suele dar un pronóstico bastante acertado, tanto para la madre como para su hijo. La mayoría de las gestantes cardiópatas tiene una buena clase funcional (I-II de la New York Heart Association [NYHA]) y afrontan el embarazo con buenas garantías.
Cirugía correctora o paliativa: si se realiza suele mejorar el pronóstico para la madre y el niño, sobre todo en casos de cirugía correctora de cardiopatías cianóticas u obstrucciones sintomáticas.
Presencia de factores de riesgo adicionales: historia de arritmia o insuficiencia cardíaca, uso de fármacos con potencial teratogénico.
La esperanza de vida materna y su capacidad de cuidar al futuro hijo: necesidad de más cirugías, riesgo de muerte súbita, capacidad funcional.
El riesgo de recurrencia de cardiopatía en el futuro hijo en padres portadores de una cardiopatía congénita.
Tras valorar estos aspectos, el consejo preconcepcional debe ser capaz de dar un pronóstico de riesgo para la madre y el feto (tablas 3 y 4), contraindicar la gestación cuando haya riesgo materno y/o fetal alto y planificar el momento y el tratamiento más adecuados para iniciar y continuar el embarazo.
4.1. Influencia de la gestación sobre la cardiopatía
La mortalidad materna es aún importante en ciertas enfermedades. Entre las cardiopatías adquiridas asociadas a mortalidad alta destacan las siguientes:
Estenosis aórtica descompensada (17%).
Valvulopatías en clase funcional III-IV o en fibrilación auricular (5%).
Miocardiopatía dilatada perinatal (15-60%).
Infarto de miocardio (37%).
La mortalidad relacionada con el embarazo en pacientes con bioprótesis valvulares es del 1% y cuando son prótesis mecánicas o que requieren anticoagulación, del 2-4%.
Las cardiopatías congénitas asociadas a riesgo más elevado son:
Hipertensión pulmonar y el síndrome de Eisenmenger (25-53%).
Coartación de aorta (9%).
Síndrome de Marfan (50%).
Además, en general, se puede considerar que la cardiopatía empeora un grado de la clasificación funcional de la NYHA durante la gestación.
4.2. Influencia de la cardiopatía sobre la gestación
Las gestaciones en madres cardiópatas se asocian a mayor incidencia de parto prematuro, retraso del crecimiento intrauterino, pérdida del bienestar fetal y la mortalidad perinatal es 10 veces superior a la general. En las cardiopatías congénitas hay que valorar además el riesgo de transmisión (tabla 5).
En general, la cardiopatía empeora con el tiempo. Por ello las mujeres con enfermedad cardíaca que deseen tener niños deberán hacerlo lo antes posible.
4.3. Situaciones que desaconsejan el embarazo
En los siguientes casos debe desaconsejarse el embarazo o, en caso de producirse, puede recomendarse su interrupción:
Pacientes en grado funcional III y IV con compromiso severo de la función cardíaca, cuando no hay posibilidades de realizar tratamiento de las lesiones cardíacas, incluido el tratamiento intervencionista o quirúrgico.
Hipertensión pulmonar de cualquier origen, que conlleva una mortalidad materna y fetal superior al 50%.
Lesiones obstructivas izquierdas severas, tanto sintomáticas como asintomáticas, con datos de disfunción sistólica, como la estenosis aórtica severa y la coartación aórtica con hipertensión no tratable.
Síndrome de Marfan con dilatación de la raíz aórtica > 4-5 cm o inferior a esta cifra, si existe historia familiar de rotura aórtica, por el importante riesgo de disección o rotura aórtica durante el embarazo.
Cardiopatías congénitas con cianosis y grado funcional III y IV determinan una elevada incidencia de aborto espontáneo y debe valorarse el riesgo asociado de herencia de la cardiopatía congénita.
Cardiopatías complejas cianóticas, corregidas o no: debe realizarse riguroso consejo obstétrico y valorar la posibilidad del aborto terapéutico.
Portadoras de válvulas cardíacas artificiales que precisan anticoagulación y otros cuidados que aumentan el riesgo materno-fetal.
Pacientes con antecedentes de miocardiopatía asociada al embarazo, que tienen un elevado riesgo de recidiva con consecuencias impredecibles de la evolución de la función ventricular.
En el caso de realizarse una interrupción del embarazo, se tendrá en cuenta:
Que el riesgo se incrementa conforme aumenta la edad gestacional, por lo que se intentará hacer lo antes posible (en el primer trimestre).
El legrado con anestesia local parece ser el método de elección.
El uso de antiprogestágenos por vía oral y prostaglandinas por vía vaginal puede estar contraindicado por sus efectos hemodinámicos impredecibles (vasodilatación sistémica con hipotensión, aumento de la cianosis) y el riesgo de hemorragia o de retención de restos con riesgo de infección.
4.4. Anticoncepción en la mujer con cardiopatía4
Es un instrumento fundamental para evitar embarazos no planificados o hacer obligatoria una terminación de éste. Ningún anticonceptivo es el ideal para una mujer con cardiopatía y se debe tener en cuenta los siguientes aspectos:
Los métodos «naturales» y los de barrera no son recomendables por su alta tasa de fallos.
Los anticonceptivos orales combinados están contraindicados si hay riesgo de tromboembolia, por el riesgo trombótico de los estrógenos.
Los anticonceptivos con progestágenos solos no aumentan el riesgo trombótico y tienen pocos efectos secundarios (metrorragias irregulares), pero su eficacia es menor que la de los combinados. Se puede plantear el uso de progestágenos depot por vía intramuscular, sobre todo en adolescentes con dudas sobre si mantendrán el tratamiento diario con medicación oral.
Los dispositivos intrauterinos liberadores de progestágenos son un avance importante, pues tienen una alta eficacia, no aumentan el riesgo de trombosis y reducen el sangrado menstrual.
Los métodos de esterilización definitiva se deben plantear en mujeres con un riesgo elevado en caso de embarazo o cuando la pareja ha completado sus deseos de tener hijos.
5. MANEJO DE LA ENFERMEDAD VALVULAR EN EL EMBARAZO
5.1 Consideraciones generales
Las siguientes valvulopatías se asocian a un riesgo alto de complicaciones materno-fetales durante el embarazo2,7:
Estenosis aórtica severa, con o sin síntomas.
Estenosis mitral en clase funcional III-IV.
Regurgitación aórtica o mitral en clase funcional III-IV.
Valvulopatía mitral o aórtica asociada a hipertensión pulmonar severa (> 75% de la presión sistémica).
Valvulopatía mitral o aórtica asociada a disfunción del ventrículo izquierdo (fracción de eyección < 40%).
Prótesis valvulares mecánicas que requieren anticoagulación.
Insuficiencia aórtica en el síndrome de Marfan.
Son de riesgo bajo de complicaciones (según su situación funcional, permiten el desarrollo normal del embarazo y el parto a término), las siguientes:
Estenosis aórtica con gradientes inferiores a 50 mmHg y buena función ventricular izquierda (fracción de eyección > 50%).
Regurgitación mitral o aórtica en clase funcional I-II, con buena función del ventrículo izquierdo.
Prolapso valvular mitral con o sin insuficiencia mitral ligera-moderada, con función sistólica del ventrículo izquierdo normal.
Estenosis mitral con área valvular mitral > 1,5 cm2, gradiente medio < 5 mmHg, sin hipertensión pulmonar severa.
Estenosis valvular pulmonar ligera o moderada.
Siempre que sea posible, las lesiones valvulares severas o sintomáticas deberían corregirse antes de la concepción. El seguimiento debe ser más estricto a partir del segundo trimestre. Por otra parte, el manejo de estas pacientes puede llevarse a cabo con éxito en la mayor parte de los casos con tratamiento conservador, orientado a optimizar el volumen intravascular y las condiciones de pre y poscarga. Se debe recomendar medidas sencillas, como el reposo en cama, evitar el decúbito supino y seguir una dieta sin sal.
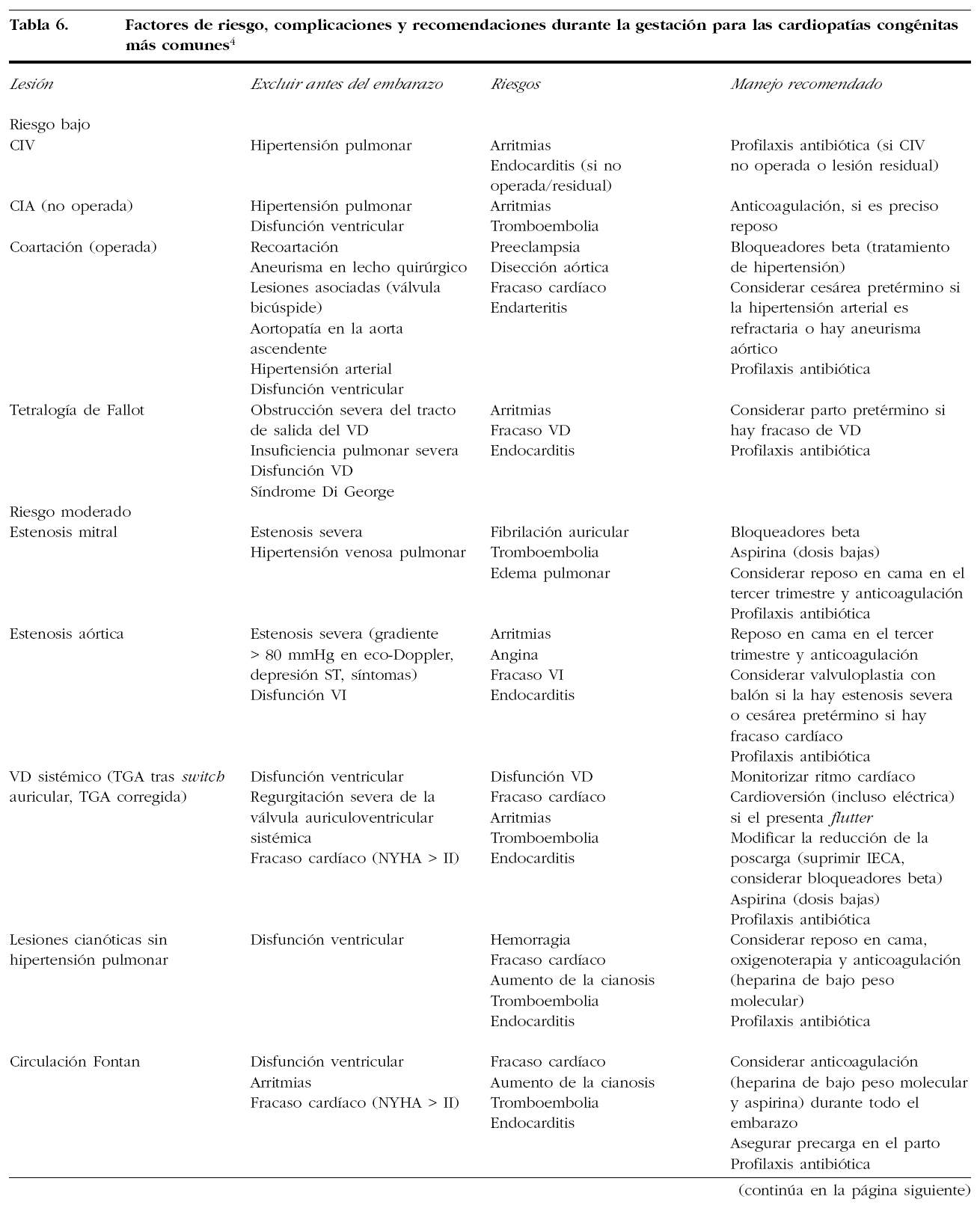
5.2. Entidades específicas (tabla 6)
5.2.1. Estenosis mitral
Es la valvulopatía más común en la mujer gestante y casi siempre es de origen reumático. Las pacientes con estenosis mitral severa sintomática deben considerarse candidatas a valvuloplastia mitral percutánea o comisurotomía mitral quirúrgica antes del embarazo. No obstante, el tratamiento médico adecuado, con énfasis en el control de la frecuencia cardíaca, permite completar el embarazo sin necesidad de corrección valvular en la mayoría de los casos. La valvuloplastia mitral percutánea, la reparación quirúrgica o el reemplazo valvular durante el embarazo sólo deben considerarse en los casos de estenosis mitral severa (área valvular mitral < 1 cm2) refractaria a tratamiento médico. Debe evitarse realizar cualquiera de los procedimientos durante el primer trimestre de la gestación. La valvuloplastia mitral con exposición limitada a fluoroscopia (1-2 min de escopia con delantal plomado abdominopélvico) presenta pocas complicaciones materno-fetales. Aunque la cirugía de reparación o reemplazo valvular no se ha asociado a alto riesgo materno-fetal, la comisurotomía mitral cerrada se considera la técnica de elección en los centros con experiencia.
La estenosis ligera-moderada puede manejarse con diuréticos y bloqueadores beta. Los diuréticos se emplean para mejorar los síntomas de congestión pulmonar y venosa pero evitando la depleción excesiva de volumen que puede conducir a hipoperfusión uteroplacentaria. Los bloqueadores beta cardioselectivos (metoprolol, atenolol) tienen como objetivo prevenir o tratar las taquiarritmias optimizando el llenado diastólico. También la digoxina puede emplearse para el tratamiento de las taquiarritmias.
Las mujeres con estenosis mitral pueden tener un parto vaginal. Cuando están sintomáticas, se recomienda realizar una monitorización hemodinámica durante éste. Una vez producido el alumbramiento, se produce un incremento súbito del retorno venoso, por lo que esa monitorización deberá mantenerse hasta varias horas después del parto. La analgesia epidural es la forma adecuada de analgesia en estas pacientes.
5.2.2. Estenosis aórtica
Debería evitarse el embarazo antes de la corrección de la valvulopatía en pacientes con estenosis severa o sintomática. Cuando es severa, incluso en mujeres que están libres de síntomas antes del embarazo, existe un riesgo elevado de aparición de angina, insuficiencia cardíaca izquierda, edema de pulmón y muerte súbita, así como de pérdidas fetales. La valoración del estado adecuado para la gestación debería realizarse antes de intentar el embarazo mediante ecocardiografía y prueba de esfuerzo. Las pacientes sin datos de fallo ventricular y con buena capacidad de esfuerzo pueden tolerar la sobrecarga del embarazo. Durante el embarazo, la presencia de síncope o fracaso ventricular izquierdo es indicación de valvuloplastia aórtica percutánea o de cirugía antes del parto, aunque ambos procedimientos conllevan considerable riesgo maternofetal.
5.2.3. Insuficiencia aórtica
Se suele tolerar bien e incluso mejora durante el embarazo. En pacientes sintomáticas, los diuréticos y la hidralazina son el tratamiento de elección.
5.2.4. Insuficiencia mitral
El prolapso mitral es la causa más frecuente de regurgitación en mujeres jóvenes durante la gestación. El tratamiento médico de las pacientes sintomáticas incluye diuréticos (en los pocos casos que desarrollan congestión pulmonar) y vasodilatadores (hidralacina) cuando se acompaña de hipertensión sistémica. Las sobrecargas de volumen son bien toleradas, tanto en ésta como en la insuficiencia aórtica, por lo que no suelen aparecer problemas durante el embarazo.
5.2.5. Valvulopatía tricúspidea
Se suele tolerar bien. Ha de tenerse precaución con los diuréticos en lesiones graves para evitar una hipoperfusión por excesiva reducción de la precarga.
5.2.6. Prótesis valvulares
Estas pacientes plantean varios problemas durante el embarazo:
Problemas hemodinámicos secundarios a los cambios fisiológicos del embarazo. La tolerancia depende de la normofunción de la prótesis, la capacidad funcional de la paciente antes del embarazo y la presencia de disfunción ventricular e hipertensión pulmonar.
Deterioro estructural intrínseco acelerado de las prótesis biológicas, que obliga a reintervenir durante el embarazo o poco después hasta en el 47% de las pacientes. Este riesgo debe valorarse en contraposición con los riesgos del embarazo en las mujeres con prótesis mecánicas y anticoagulación.
Estado de hipercoagulabilidad que aumenta la probabilidad de complicaciones tromboembólicas pulmonares o sistémicas, incluso con anticoagulación correcta (sobre todo en prótesis mecánicas).
Riesgo fetal secundario al tratamiento anticoagulante: embriopatía por terapia con dicumarínicos entre la sexta y la duodécima semana de gestación y riesgo de hemorragia cerebral fetal si se usan cerca del parto. Por ello, la elección del tratamiento anticoagulante debe sopesar el mayor riesgo tromboembólico con heparina, frente al riesgo de embriopatía con dicumarínicos. La opción más recomendada es utilizar heparina no fraccionada o heparina de bajo peso molecular a dosis terapéuticas ajustadas hasta la semana decimoprimera. Luego se puede seguir con heparina o cambiar a dicumarínicos y a partir de la 32.a-33.a semana y hasta el parto sólo utilizar heparina. Tras el parto se pueden usar los dicumarínicos de nuevo, al no estar contraindicados con la lactancia materna8.
6. CARDIOPATÍAS CONGÉNITAS EN EL EMBARAZO2,9
6.1. Consideraciones generales
En las pacientes con una cirugía paliativa por una cardiopatía congénita se debe valorar su reserva cardíaca, función ventricular, hipertensión pulmonar, estenosis pulmonar o de conductos, defectos de conducción y arritmias. La mayoría de las mujeres con cardiopatías congénitas con shunt izquierda-derecha asintomáticos, estenosis pulmonar moderada, transposición corregida o enfermedad de Ebstein sin cianosis toleran el embarazo sin problemas.
En las cardiopatías con cianosis, los riesgos materno-fetales son elevados: aumentan la cianosis, el riesgo tromboembólico y la mortalidad materna, con un alto índice de abortos espontáneos, partos prematuros, retraso del crecimiento intrauterino y recién nacidos muertos. La hipertensión pulmonar acarrea el mayor número de muertes maternas y fetales, por lo que en estos casos debe aconsejarse la interrupción del embarazo. Factores de mal pronóstico son la saturación de oxígeno (O2) < 85%, un hematocrito > 60% o el síncope de repetición.
Las siguientes cardiopatías congénitas se asocian a un alto riesgo de complicaciones maternofetales durante el embarazo:
Hipertensión pulmonar.
Obstrucción severa en la salida del ventrículo izquierdo, que impide al corazón acomodarse al aumento del gasto cardíaco que tiene lugar durante la gestación, apareciendo signos de fracaso cardíaco.
Cardiopatía cianógena.
Enfermedad de Marfan con dilatación de la raíz aórtica mayor de 4 cm.
Cualquier paciente con un estado funcional III o IV de la NYHA durante el embarazo es de alto riesgo, independientemente de su afección de base, pues tiene una escasa o nula reserva cardiovascular.
6.2. Manejo de gestantes con riesgo alto
El embarazo está contraindicado. Si se produce, debe recomendarse su interrupción dado el riesgo materno (mortalidad 8-35%, morbilidad 50%).
Se debe reducir la actividad física o incluso permanecer en cama si hay síntomas. Se utilizará oxigenoterapia si hay hipoxemia evidente. Se debe hospitalizar a la paciente desde el final del segundo trimestre y se hará tromboprofilaxis con heparina de bajo peso molecular, sobre todo en pacientes con cianosis.
En la estenosis aórtica severa (gradiente > 50 mmHg), es importante monitorizar la presión sistémica y realizar un electrocardiograma para vigilar la aparición de sobrecarga ventricular izquierda. Si es necesario se puede hacer valvuloplastia si la válvula no es rígida y no hay regurgitación. Este procedimiento se debe realizar en el segundo trimestre, una vez pasada la embriogénesis. La radiación recibida por la madre es baja (0,05-0,2 rads). Si es necesaria una cirugía, se debe intentar esperar a que el feto sea viable, hacer una cesárea para extraerlo y operar después.
Si hay una cardiopatía cianótica severa es muy importante monitorizar la saturación de O2. El hematócrito y la hemoglobina no son buenos indicadores debido a la hemodilución del embarazo. Si hay hipoxemia severa (saturación O2 < 85%) y se rechaza la terminación del embarazo, se debe plantear implantar algún shunt para mejorar la oxigenación.
6.3. Manejo de gestantes de riesgo bajo
Las pacientes con shunts pequeños o moderados sin hipertensión pulmonar o con regurgitación valvular moderada se benefician de la disminución de las resistencias vasculares en el embarazo. Las que tienen una obstrucción moderada en la salida del ventrículo izquierdo también suelen tolerar bien el embarazo. Las obstrucciones severas de salida del ventrículo derecho (estenosis pulmonar) suelen ser bien toleradas y pocas veces necesitan grandes intervenciones en el embarazo.
Muchas pacientes con cirugía en la infancia y no portadoras de válvulas protésicas suelen tolerar bien el embarazo, pero es importante asegurarse, mediante una ecocardiografía, de la presencia o no de lesiones residuales.
Dado el riesgo de recurrencia de la cardiopatía en la descendencia, está indicada la realización de una ecocardiografía fetal.
6.4. Entidades específicas
6.4.1. Estenosis valvular pulmonar
Suele ser bien tolerada durante el embarazo, a pesar de la sobrecarga de volumen añadida a un ventrículo derecho ya sobrecargado.
Si la estenosis es severa, el embarazo puede precipitar un fallo cardíaco derecho, arritmias auriculares o regurgitación tricuspídea, hubiese o no síntomas antes del embarazo. Las mujeres con obstrucción severa deben plantearse la corrección antes del embarazo. Si hay insuficiencia cardíaca derecha durante el embarazo, se puede hacer valvulotomía con balón.
6.4.2. Tetralogía de Fallot
En gestantes no operadas, el embarazo es de riesgo alto para la madre y el feto, y se relaciona con el grado de cianosis (riesgo alto con saturación de oxígeno < 85%). Los cambios del embarazo aumentan el shunt derecha-izquierda y la cianosis. En el parto es importante monitorizar la presión arterial sistémica y la gasometría, y evitar la vasodilatación sistémica.
En gestantes operadas, el riesgo durante el embarazo depende de la situación hemodinámica. En pacientes con buena corrección, el riesgo es bajo. Si hay una obstrucción significativa en la salida del ventrículo derecho, regurgitación pulmonar severa con o sin regurgitación tricúspidea y/o disfunción ventricular derecha, el aumento de volumen del embarazo puede provocar fallo cardíaco derecho y arritmias. Todas las pacientes deben recibir consejo preconcepcional para buscar un síndrome de microdeleción 22q11, pues en su ausencia el riesgo de defecto en el feto es bajo (4%).
6.4.3. Coartación de la aorta
En la gestante no operada, el tratamiento de la hipertensión es difícil, pero un tratamiento agresivo puede resultar en hipotensión en el territorio distal. El crecimiento fetal suele ser normal (al contrario que en la hipertensión esencial o la preeclampsia), aunque en ocasiones puede haber retardo del crecimiento por reducción del flujo placentario. La rotura de la aorta es la principal causa de defunción materna y también se ha descrito en el embarazo, la rotura del aneurisma del círculo de Willis. El aumento de volumen plasmático y del gasto cardíaco del embarazo aumenta el riesgo de disección o rotura de aorta, por lo que se debe tratar con un bloqueador beta.
Se debe restringir la actividad física para evitar la hipertensión. La corrección quirúrgica sólo estará indicada en el embarazo si no se controla la hipertensión sistólica o hay fallo cardíaco. La angioplastia con balón está contraindicada por el riesgo de rotura o disección y no hay experiencia con stent. Siempre es recomendable su reparación antes del embarazo, aunque no se sabe hasta qué punto esos riesgos desaparecen tras la corrección.
6.4.4. Transposición de grandes arterias
Presentan discordancia ven triculoarterial y es infrecuente la supervivencia en adultos, pero no imposible.
En las gestantes operadas con técnicas de neocanalización o switch auricular (técnicas de Senning o Mustard), los principales problemas se relacionan con la vulnerabilidad del ventrículo derecho a la sobrecarga de volumen, ya que está sometido a circulación sistémica y al riesgo elevado de bloqueo auriculoventricular. En una serie de 23 mujeres operadas con técnica de Mustard, 9 tuvieron 15 embarazos sin clínica, ni antes ni después del parto. Hubo 12 nacidos vivos con peso adecuado y 3 pérdidas fetales, sin ninguna cardiopatía congénita. De las pacientes intervenidas mediante la técnica de Jatene (switch arterial) existe todavía poca información, aunque es de esperar que los resultados sean satisfactorios.
6.4.5. Comunicación interauricular
Suele ser bien tolerada, incluso los cortocircuitos grandes. Presenta riesgo de arritmias supraventriculares y embolismo paradójico. Debe reducirse en lo posible los efectos de la estasis venosa en los miembros inferiores y los asociados a hemorragia severa que pueden aumentar el cortocircuito derecha-izquierda. Se debe valorar la presión pulmonar.
Poscirugía. En las reparaciones a edades avanzadas, se elimina el riesgo de embolismo paradójico con secuelas insignificantes, excepto las arritmias.
6.4.6. Comunicación interventricular
Se suelen tolerar bien salvo si son grandes o hay hipertensión pulmonar. Debe evitarse la hipotensión severa por hemorragia posparto pues puede invertirse el cortocircuito. En estos casos se utilizará volumen y vasopresores.
Poscirugía. El cierre en la infancia previene las complicaciones; el embarazo es normal si también lo son la presión pulmonar y la función ventricular. Excepcionalmente, la enfermedad vascular pulmonar puede progresar durante el embarazo después del cierre de una comunicación restrictiva.
6.4.7. Ductus
Es raro verlo en el embarazo, pues su corrección suele ser precoz. Presenta riesgo de endocarditis y de insuficiencia cardíaca si es grande.
Poscirugía. Se consideran normales, pero pueden quedar secuelas de resistencias pulmonares altas o recuperación parcial del volumen ventricular.
6.4.8. Atresia tricúspidea
La válvula auriculoventricular derecha no está perforada, por lo que el flujo venoso llega al ventrículo izquierdo atravesando el septo interauricular. Hay supervivencias esporádicas hasta la 2.a-5.a décadas e incluso embarazos con éxito.
Poscirugía. La operación de Fontán para ventrículo único y atresia tricuspídea con estenosis pulmonar crea una circulación entre las cavas o la aurícula derecha y el tronco pulmonar, evitando el ventrículo derecho. El gasto cardíaco puede aumentar con el esfuerzo de una forma casi normal, lo cual implica que en ritmo sinusal estable y con buena función ventricular sistémica se puede asumir la sobrecarga del embarazo de manera adecuada. En una serie de 126 mujeres operadas con diversas técnicas de Fontán y varios tipos de ventrículo único y atresia tricuspídea, se registraron 38 embarazos, con un 45% de nacidos vivos, todos ellos de bajo peso medio. El embarazo fue bien tolerado en la mayoría de las madres, con escasas complicaciones, que incluían flutter auricular e insuficiencia cardíaca pero sin mortalidad, por lo que en mujeres estables podría ser positivamente considerado. Por el contrario, las pacientes con circulación Fontán, aurícula derecha grande y signos de congestión venosa deben ser vigiladas estrechamente y precisan anticoagulación.
6.4.9. Síndrome de Eisenmenger
La mortalidad materna descrita inicialmente era superior al 50%; en la actualidad es algo más favorable (30-40%), pero el elevado riesgo de muerte súbita y la elevada incidencia de tromboembolias hacen que el embarazo deba desaconsejarse y deba proponerse una interrupción del embarazo. Ello se debe a que durante la gestación, al disminuir las presiones sistémicas y elevarse la sobrecarga ventricular derecha, aumenta el shunt derecha-izquierda, con lo que se acentúa la cianosis y se reduce el flujo pulmonar. Se asocia también a mal pronóstico fetal y apenas un 25% de los embarazos llegan a término. Presenta una elevada tasa de prematuridad, retraso del crecimiento intrauterino y muerte perinatal.
En el supuesto de que la gestación continúe, la frecuencia elevada de parto prematuro hace recomendable la hospitalización temprana. También se aconseja tratamiento anticoagulante en las 8-10 semanas últimas y en las 4 semanas posparto, dado que la mayor parte de las defunciones tiene lugar en el período periparto. El parto puede ser espontáneo con monitorización gasométrica y hemodinámica, y acortamiento del expulsivo, aunque también hay cesáreas sin complicaciones con anestesia epidural.
6.4.10. Enfermedad de Ebstein
La supervivencia espontánea hasta la edad de la concepción es elevada. Su pronóstico a largo plazo depende de la severidad de la insuficiencia tricuspídea, de la disfunción ventricular derecha y de la cianosis por shunt derecha-izquierda interauricular. Hay casos de evolución satisfactoria, pero pueden presentarse complicaciones, más frecuentes en cianóticos, de insuficiencia cardíaca derecha, endocarditis, embolismo paradójico e hipoxia fetal. La cianosis puede manifestarse también por primera vez debido al aumento de la presión de llenado ventricular derecha. Las arritmias supraventriculares paroxísticas ocurren en un tercio de las pacientes no embarazadas y su incidencia aumenta en el embarazo, lo que las hace potencialmente peligrosas por la asociación de este síndrome a vías accesorias tipo Wolf-Parkinson-White. El riesgo fetal es significativo, con pérdida fetal, bajo peso incluso sin cianosis materna y elevado riesgo de cardiopatía congénita. En una revisión de 111 embarazos en 44 mujeres, hubo un 76% de nacidos vivos, el 89% con parto vaginal y sin complicaciones maternas graves, pero con una elevada incidencia de prematuridad (27%) y menor bajo peso medio en las madres cianóticas. La incidencia de cardiopatía congénita de los descendientes fue del 4%, y fue de tipo Ebstein en el 0,6% (26%).
Poscirugía. En la situación más favorable se realiza una reconstrucción valvular con resección de la parte auricularizada e interrupción de las vías accesorias, con lo que se reduce significativamente el riesgo materno.
6.4.11. Síndrome de Marfan y otras enfermedades hereditarias que afectan a la aorta (incluidos el síndrome de Ehlers-Danlos y otros aneurismas aórticos torácicos familiares)
El síndrome de Marfan es una enfermedad hereditaria del tejido conectivo, transmitida con carácter autosómico dominante, que se reconoce por alteraciones oculares, esqueléticas o cardiovasculares. Las complicaciones más graves asociadas al embarazo son la disección y rotura aórtica, que suelen originarse en la aorta ascendente y que son más comunes en el tercer trimestre o en el posparto inmediato. La dilatación de la raíz aórtica > 4 cm identifica al grupo de mayor riesgo, tengan o no regurgitación aórtica.
Recomendaciones. Durante la gestación se deben realizar ecocardiogramas seriados, ya que una raíz aórtica normal antes del embarazo no excluye totalmente el riesgo de disección. Cualquier mujer que se plantee el embarazo debería realizarse un ecocardiograma para medir las dimensiones de la raíz aórtica. Un diámetro > 4-5 cm o una dilatación progresiva en el seguimiento se asocian a elevado riesgo de complicaciones fatales, por lo que se recomienda la cirugía electiva (sustitución de la aorta ascendente por prótesis valvulada y reimplantación coronaria) antes de la gestación, aunque debe recomendarse evitar el embarazo en estos casos o la interrupción terapéutica de éste. Durante la gestación se restringe la actividad física y se recomienda el tratamiento con bloqueadores beta, que lentifica la dilatación progresiva de la raíz aórtica y reduce la incidencia de complicaciones cardiovasculares. Durante el parto, se debe asegurar una analgesia adecuada que evite incrementos súbitos de la presión arterial y acortar el período expulsivo. La cesárea es recomendable y con anestesia general si la raíz aórtica es de alrededor de 4,5 cm.
7. MIOCARDIOPATÍAS
7.1. Miocardiopatía hipertrófica
La mayoría de las pacientes tolera bien el embarazo, ya que el aumento del volumen circulante compensa el descenso de las resistencias periféricas, pero es frecuente el desarrollo o empeoramiento de los síntomas cardíacos. El pronóstico fetal no parece verse afectado por la miocardiopatía hipertrófica materna. Sin embargo, el riesgo de heredar trastornos alcanza hasta el 50% en casos familiares y algo menos en los casos esporádicos.
El tratamiento para la gestante con miocardiopatía hipertrófica depende de los síntomas y de la obstrucción del tracto de salida del ventrículo izquierdo. Si ésta no existe y la paciente está asintomática, no se precisa tratamiento. Las indicaciones para el tratamiento farmacológico incluyen síntomas y presencia de arritmias, que pueden ser mortales. Los síntomas asociados a la elevación de las presiones de llenado del ventrículo izquierdo deben tratarse con bloqueadores beta y, excepcionalmente, son necesarios los diuréticos. Aunque los antagonistas del calcio parecen ser útiles en las mujeres no embarazadas, en la gestación no se ha establecido el efecto de estos fármacos sobre el feto. Están contraindicados los betamiméticos, pues agravan la obstrucción del tracto de salida del ventrículo izquierdo.
El embarazo no parece incrementar el riesgo de muerte súbita, aunque ésta es más frecuente durante los años de la procreación. En ausencia de historia familiar de muerte súbita, el riesgo de ésta en las pacientes asintomáticas es bajo y la gestación puede completarse con éxito.
El parto vaginal es seguro en mujeres con miocardiopatía hipertrófica. En las que tienen síntomas u obstrucción significativa, se debe acortar la duración del expulsivo. El uso de prostaglandinas para aumentar las contracciones uterinas puede ser desfavorable debido a su efecto vasodilatador, mientras que la oxitocina parece tolerarse bien. De manera semejante, se evitará la anestesia espinal y epidural en miocardiopatía obstructiva debido a su efecto vasodilatador y se vigilará también la pérdida sanguínea excesiva, que debe reemplazarse de inmediato con líquidos por vía intravenosa o sangre. Dado que en la miocardiopatía hipertrófica aumenta el riesgo de endocarditis infecciosa, especialmente la forma obstructiva, está indicada la profilaxis antibiótica en el parto.
7.2. Miocardiopatía periparto
El diagnóstico de esta entidad se establece según los siguientes criterios:
Inicio del fallo cardíaco en el último mes del embarazo o en los cinco primeros meses posparto.
Ausencia de cardiopatía conocida en el último mes del embarazo.
Ausencia de causas identificables de fallo cardíaco.
Disfunción ventricular izquierda demostrada por ecocardiografía (disminución de la fracción de acortamiento o de la fracción de eyección).
Esta forma de miocardiopatía dilatada tiene los signos y síntomas de insuficiencia cardíaca debido a disfunción sistólica del ventrículo izquierdo. Los síntomas suelen aparecer en los primeros días después del parto. La sintomatología es de insuficiencia cardíaca congestiva, con dolor precordial, palpitaciones y, en ocasiones, embolia periférica o pulmonar. En ocasiones, el cuadro debuta de forma fulminante. El electrocardiograma, la radiografía de tórax, el eco-Doppler y los cambios hemodinámicos son indistinguibles de los asociados a otras formas de miocardiopatía dilatada.
La miocardiopatía periparto es más frecuente en mujeres con embarazo gemelar, multíparas, mayores de 30 años y en la raza negra. Aunque se desconoce su etiología, el carácter especial de este síndrome se sospecha por su presentación a una edad más o menos joven en comparación con otras formas de miocardiopatía dilatada, la recuperación del tamaño y de la función cardíaca en un gran número de pacientes y su relación con el embarazo.
La evolución clínica es variable. Cerca del 50% de las enfermas tiene recuperación completa o casi completa de la función cardíaca y del estado clínico en los 6 meses que siguen al parto. En el resto hay deterioro clínico continuo que conduce a defunción temprana o a disfunción ventricular izquierda progresiva, con insuficiencia cardíaca crónica y morbimortalidad elevadas.
La insuficiencia cardíaca aguda se trata con oxígeno, diuréticos, apoyo inotrópico con digital y fármacos vasodilatadores. El uso de hidralacina para reducir la poscarga es seguro durante el embarazo. La experiencia con los nitratos orgánicos es limitada, aunque la hipotensión secundaria a una dosis excesiva se asocia a bradicardia fetal. Se ha utilizado satisfactoriamente el nitroprusiato durante el embarazo, aunque los experimentos en animales han demostrado riesgos de toxicidad fetal. Los inhibidores de la enzima de conversión de la angiotensina no se recomiendan antes del parto. Debido a la mayor incidencia de tromboembolia en esta miocardiopatía, se recomienda la terapia anticoagulante. La elevada mortalidad de las pacientes que no se recuperan pronto las hace candidatas a trasplante cardíaco.
Los embarazos posteriores en mujeres con miocardiopatía periparto se asocian a menudo con recaídas y riesgo elevado de mortalidad materna. Aunque la probabilidad de estas recaídas es mayor en pacientes con crecimiento persistente del corazón o función anormal, también se ha visto en mujeres en las que la función ventricular izquierda se restableció tras el primer episodio.
Por ello, se deben desalentar futuros embarazos en pacientes con miocardiopatía periparto que tienen disfunción cardíaca persistente y las mujeres que recuperaron la función cardíaca después del primer episodio también serán informadas del mayor riesgo que suponen esas nuevas gestaciones.
8. ARTERIOPATÍA CORONARIA
La enfermedad coronaria es infrecuente en las mujeres en edad fértil y la aparición de infarto de miocardio en el periparto se puede considerar casi anecdótica (1/10.000 gestaciones). Se ha observado que la combinación de tabaquismo importante y el uso concomitante de anticonceptivos son potentes predictores de infarto de miocardio en mujeres jóvenes. El infarto de miocardio periparto a menudo se asocia a arterias coronarias normales y puede deberse a una reducción local en la perfusión coronaria debido a espasmo o trombosis. El espasmo se ha asociado también con la hipertensión inducida por el embarazo y la utilización de ergotínicos, oxitocina y prostaglandinas para evitar la hemorragia uterina. La disección de las arterias coronarias durante el embarazo o inmediatamente tras el parto es otra causa relativamente común de infarto de miocardio periparto. Otras causas son las conectivopatías, enfermedad de Kawasaki, la anemia falciforme, el feocromocitoma y el consumo de cocaína.
El diagnóstico de infarto de miocardio muchas veces se retrasa durante el embarazo o posparto debido al bajo índice de sospecha. La aproximación diagnóstica y terapéutica está influida, a veces en exceso, por las consideraciones sobre el daño que algunas técnicas pueden causar en el feto. El diagnóstico debe basarse en el electrocardiograma y en los cambios enzimáticos (principalmente, troponina I). Si la situación clínica no implica gravedad, el tratamiento médico será el habitual. Los fármacos más aconsejables en el infarto agudo de miocardio, por su efecto beneficioso y por la seguridad de su uso durante el embarazo, son los bloqueadores beta. También se pueden usar los antagonistas del calcio. Se debe evitar el uso de fibrinolíticos, pero se pueden usar si la situación lo requiere. La aspirina a dosis bajas es también segura y no ha demostrado efectos deletéreos sobre el feto.
La coronariografía es esencial para el diagnóstico y para conocer la anatomía del infarto y se debe hacer sin demora, si la situación lo aconseja, para instaurar el tratamiento más adecuado: angioplastia, stent, fibrinólisis local o cirugía urgente. En los casos de disección coronaria, la implantación de un stent puede ser el tratamiento de elección y si es muy extensa, puede ser necesaria la cirugía urgente. En estos casos, la coronariografía ofrece más información sobre la etiología y las opciones terapéuticas que las técnicas no invasivas y, por ello, no hay que sobrevalorar el riesgo de la radiación sobre el feto en detrimento de la supervivencia de la madre y, por tanto, de ambos.
9. TRASPLANTE CARDÍACO
Hay casos descritos de embarazos en mujeres trasplantadas. Se ha observado un aumento del riesgo de complicaciones maternas durante el embarazo, sin un aumento de la mortalidad. El índice de abortos espontáneos es alto, pero no se han observado malformaciones atribuibles a la inmunodepresión. La mortalidad materna se eleva en los años siguientes al nacimiento. Esta circunstancia debe advertirse por su repercusión sobre la crianza de los hijos.
10. ARRITMIAS
El embarazo crea un estado «proarrítmico», incluso en pacientes sin historia previa de arritmias ni cardiopatía orgánica, a pesar de lo cual las arritmias graves son infrecuentes. Debe intentarse identificar factores potencialmente causantes o agravantes de arritmias y que sean corregibles, como alteraciones electrolíticas, hipertiroidismo y algunas drogas (alcohol, cafeína, tabaco).
En el caso de que las arritmias sean sintomáticas, con repercusión hemodinámica o supongan un riesgo para la vida, se valorará la utilización de los fármacos antiarrítmicos más seguros. Estos fármacos atraviesan la placenta y la hemodinámica del embarazo hace necesario monitorizar sus valores para asegurar su eficacia y evitar toxicidad. La digoxina y los bloqueadores beta con efecto selectivo ß-1 son seguros y tienen las indicaciones habituales. La adenosina por vía intravenosa para la reversión de la taquicardia por reentrada intranodal no afecta al feto. Es posible también la cardioversión eléctrica sin que se hayan descrito complicaciones. En caso de necesitar un antiarrítmico de clase 1C, la amiodarona es preferible al sotalol: atraviesa en menos cantidad la placenta (la concentración fetal es el 20% de la materna), no tiene efectos teratógenos, deprime menos la función miocárdica, pero puede producir hipotiroidismo fetal (el 9% tras su uso continuado). El estudio electrofisiológico y la ablación con catéter deberán posponerse hasta después del parto o, al menos, minimizar el uso del control fluoroscópico.
Los trastornos de la conducción sintomáticos, debidos a bloqueo cardíaco congénito u otras causas, se tratarán con la implantación de marcapasos, que se puede hacer en cualquier momento del embarazo guiado por ecografía.
11. FIEBRE REUMÁTICA AGUDA
Aunque la incidencia de fiebre reumática aguda ha descendido claramente en los países occidentales, en muchas partes del mundo continúa teniendo gran prevalencia y se puede asociar con una morbimortalidad elevada durante el embarazo, durante el cual puede recurrir y tener consecuencias fatales.
Los antibióticos están indicados como profilaxis contra la infección estreptocócica y prevención de las recurrencias de la fiebre reumática aguda durante el embarazo en pacientes con historia previa de la enfermedad. Las pautas antibióticas recomendadas son las mismas que para las mujeres no grávidas, con penicilina o eritromicina a dosis de prevención primaria o secundaria. La sulfadiacina no se recomienda durante el tercer trimestre debido a la posibilidad de que cause ictericia neonatal.
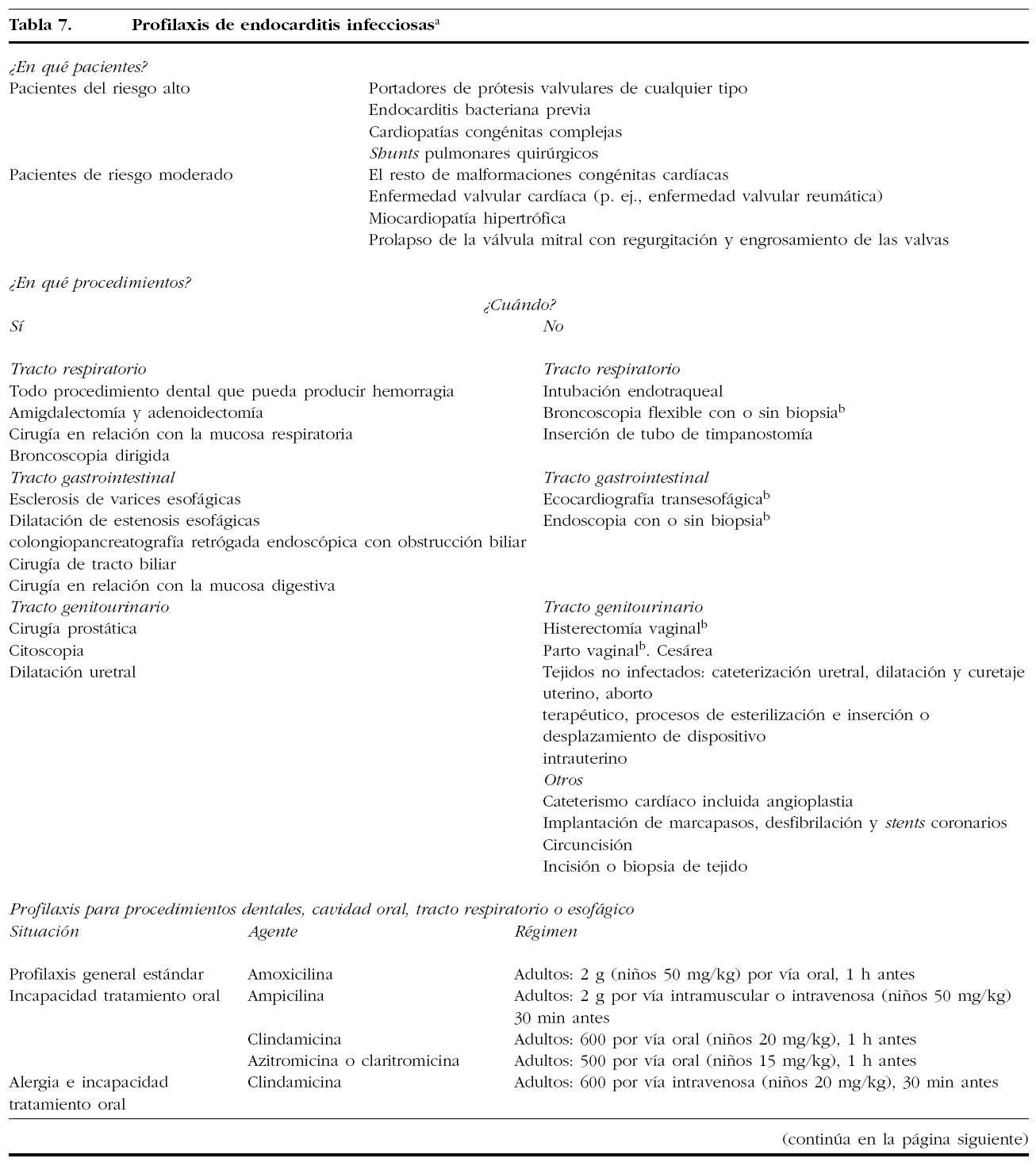
12. ENDOCARDITIS INFECCIOSA
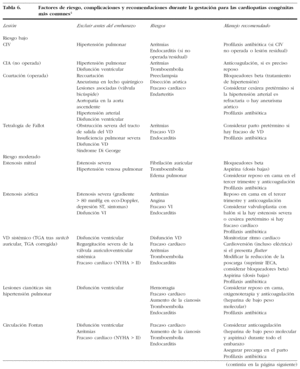
El diagnóstico y el tratamiento son iguales que en las pacientes no embarazadas. Si se usa gentamicina es conveniente monitorizar su dosis para minimizar el riesgo de daño al oído fetal. La profilaxis antibiótica sigue las pautas marcadas por la American Heart Association en 1997 (tabla 7).
13. CIRUGÍA CARDÍACA DURANTE EL EMBARAZO
Se asocia a distrés fetal, retraso del crecimiento intrauterino o muerte (15%), debido a la disminución del flujo uteroplacentario durante el bypass cardiopulmonar, aunque no se ha descrito aumento del riesgo materno. Se recomienda retrasar la cirugía hasta que se considere viable el feto y realizarla en el mismo acto quirúrgico que la cesárea electiva. Sólo se indica cirugía en pacientes refractarias al tratamiento médico, sobre todo si hay síndrome de bajo gasto. En estos casos debe mantenerse un flujo alto > 2,5 l/m/m2 y una presión arterial media > 70 mmHg. El feto debe monitorizarse y, si aparece bradicardia, aumentar el flujo sanguíneo. La hipotermia parece no afectar al feto, pero puede aumentar la actividad uterina con riesgo de parto pretérmino.
Para las lesiones susceptibles siempre se prefiere la reparación valvular al reemplazo. Cuando no es posible la reparación, la elección del tipo de prótesis es problemática: en posición aórtica pueden emplearse homoinjertos o autoinjertos pulmonares. Debe reconsiderarse la práctica de implantar prótesis biológicas a pacientes jóvenes que desean tener descendencia, ya que la anticoagulación puede hacerse necesaria por otras razones (fibrilación auricular, tromboflebitis, historia de tromboembolia). Además, debe asumirse el riesgo de un segundo recambio valvular en el futuro y a corto plazo por el deterioro protésico acelerado relacionado con el embarazo.
14. TRATAMIENTOS ANTICOAGULANTES EN EL EMBARAZO
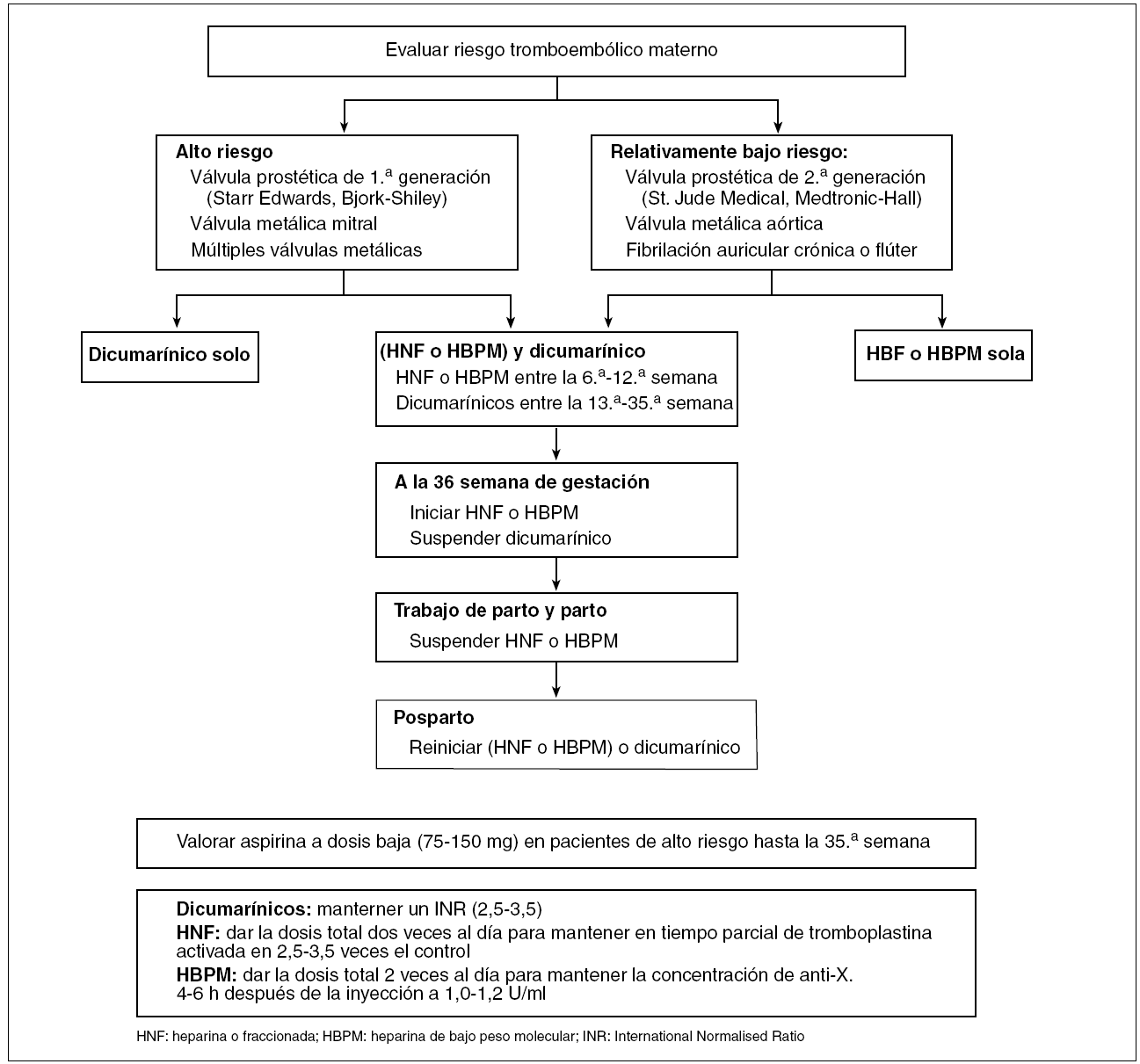
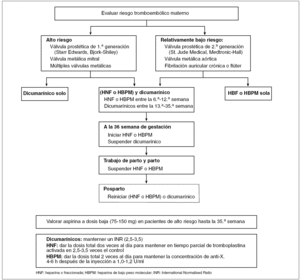
Durante el embarazo, la tasa de complicaciones tromboembólicas se sextuplica y durante el puerperio multiplica por once. La presencia de cardiopatía embolígena o de otras enfermedades susceptibles de trombosis durante el embarazo requiere importantes decisiones sobre el tipo de terapia anticoagulante. Sin embargo, dada la falta de información relevante sobre su eficacia y seguridad, existe controversia en la elección de las 3 pautas posibles: heparina sola, dicumarínicos solos o su combinación (fig. 1). La heparina es más segura para el feto, pero parece ser menos efectiva que los dicumarínicos en la tromboprofilaxis en mujeres portadoras de válvulas protésicas. Hay potenciales riesgos para la madre y el feto con ambos fármacos, por lo que el régimen definitivo debe definirse después de informar a la mujer y su familia de las implicaciones de cada uno.
Figura 1. Esquema de anticoagulación en gestantes con válvulas cardíacas protésicas4,8.
Heparina no fraccionada y heparinas de bajo peso molecular. Debido a su peso molecular elevado, la heparina no fraccionada no atraviesa la placenta y no se asocia a elevación de la morbilidad fetal. En la madre puede ocasionar osteoporosis, trombocitopenia, hematomas o abscesos estériles, así como elevación del riesgo de trombosis protésica, incluso en administración por vía subcutánea e intravenosa a dosis adecuadas.
Las heparinas de bajo peso molecular son una alternativa a la heparina no fraccionada. Su excelente biodisponibilidad, sin atravesar tampoco la placenta, las hace muy atractivas; han demostrado su utilidad en la prevención de la trombosis venosa, pero no se ha publicado su utilidad en la embarazada con valvulopatía. Con estas heparinas, la trombocitopenia por trombosis inducida por las heparinas no fraccionadas (1/2.000 pacientes) parece ser menos frecuente, pero el riesgo de osteoporosis es desconocido.
Dicumarínicos. La warfarina atraviesa la placenta por su bajo peso molecular. La embriopatía dicumarínica (4-10% de recién nacidos) afecta sobre todo al desarrollo de los huesos (hipoplasia nasal y condrodisplasia punctata) entre la sexta y la duodécima semanas de gestación. Durante el segundo y tercer trimestres, se relaciona con anomalías del sistema nervioso central (atrofia del nervio óptico, microcefalia, retraso mental, espasticidad e hipotonía). El acenocumarol (Sintrom®) parece ser menos teratogénico, pero también se han descrito estas alteraciones.
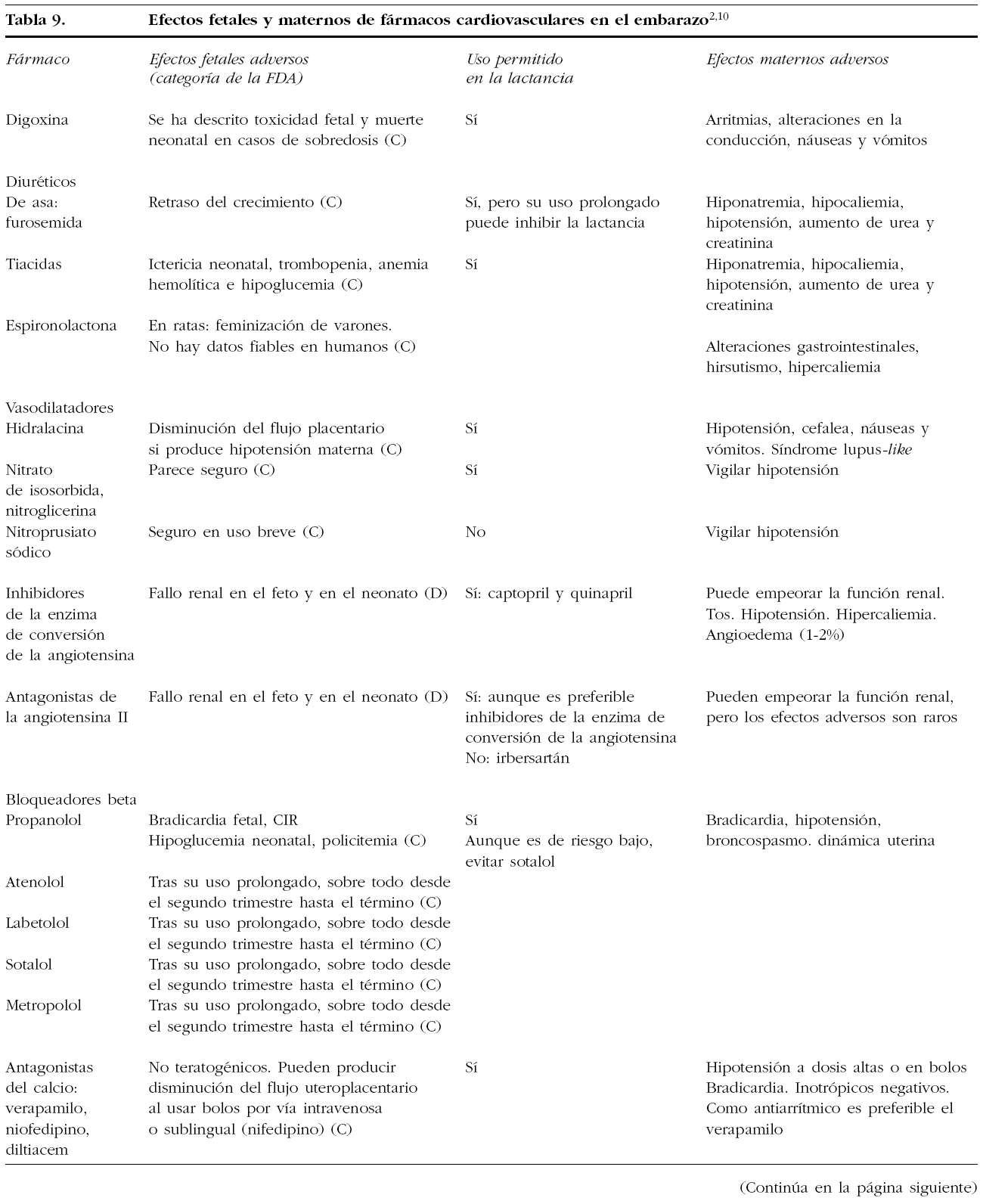
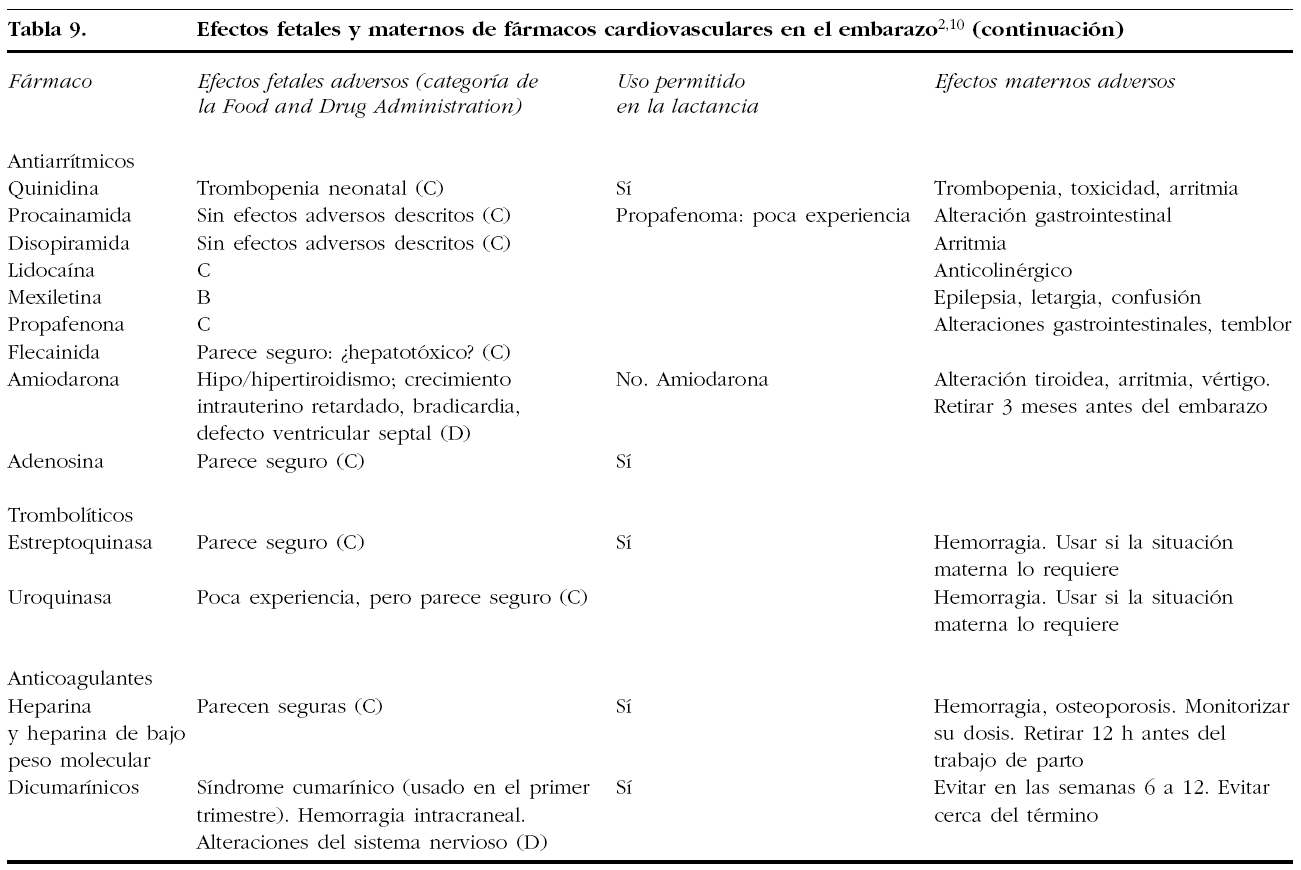
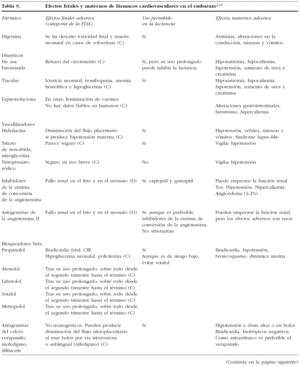
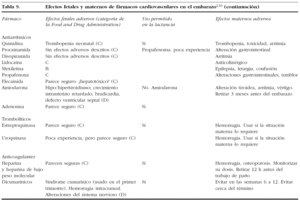
15. FÁRMACOS CARDIOVASCULARES EN EL EMBARAZO
Muchos de los fármacos cardiovasculares atraviesan la placenta y pueden tener efectos sobre el feto. También pueden pasar a la leche materna y producir un efecto en el recién nacido. Si bien muchos fármacos son relativamente seguros, los beneficios y riesgos han de sopesarse bien. En las tablas 8 y 9 se expone un resumen sobre la seguridad y los posibles riesgos de su uso en el embarazo y la lactancia.
16. MANEJO MULTIDISCIPLINARIO DE PACIENTES CARDÍACAS DE RIESGO ALTO4,11
Es imprescindible el trabajo conjunto del obstetra, el cardiólogo, el anestesista y el pediatra. Ante cada caso particular, el equipo debe reunirse lo antes posible para tomar las decisiones oportunas en cuanto al manejo de cada paciente.
Trabajo de parto, parto y puerperio
En general, se recomienda el parto vaginal, pues comparado con la cesárea provoca cambios menos bruscos de volumen, menor pérdida hemorrágica y menos complicaciones de coagulación e infecciosas. Pero también conviene evitar un período expulsivo prolongado. Las indicaciones cardíacas para hacer una cesárea son: disección aórtica, síndrome de Marfan con raíz aórtica dilatada y fallo al cambiar de warfarina a heparina al menos 2 semanas antes del parto.
Cuando sea necesario se puede inducir el parto de forma programada, mejor si hay madurez fetal. La maduración pulmonar fetal puede ser inducida con corticoides, como en el resto de las gestantes.
En muchos partos es suficiente la monitorización materna con un electrocardiograma continuo y pulsioximetría. No hay consenso en el uso de monitorización hemodinámica intensiva durante el parto. Se puede usar monitorización intraarterial (con o sin monitorización de la arteria pulmonar) en los casos en que haya dudas sobre los efectos de una caída brusca de la presión arterial sistémica (estenosis aórtica, hipertensión pulmonar o disfunción importante de la función ventricular sistémica). Se valorará colocar un catéter en la arteria pulmonar si no se puede obtener la información de otra forma y valorando bien los riesgos, que son altos en el caso de hipertensión pulmonar.
La anticoagulación con heparina se debe suspender al menos 12 h antes de la inducción del parto o revertirla con protamina si se desencadena el parto espontáneo. A las 6-12 h después del parto, se puede reiniciar la anticoagulación, bien con heparina o con warfarina. Ambas son compatibles con la lactancia materna.
La profilaxis de la endocarditis bacteriana se debe iniciar cuando empiece la fase activa del parto. Las recomendaciones actuales de la American Heart Association dicen que, salvo en pacientes de alto riesgo, no es necesaria la profilaxis antibiótica en la cesárea ni en el parto vaginal si no hay infección. No obstante, muchos centros la indican, pues no se sabe cuándo aparecerá la infección.
La analgesia epidural es de elección, precedida de una adecuada precarga de volumen. Esta sobrecarga hemodinámica deberá tenerse en cuenta en pacientes con riesgo de fracaso cardíaco. La epidural con fentanilo es especialmente ventajosa en mujeres con shunts cianógenos ya que no disminuye la resistencia vascular periférica. En presencia de shunts, se deben colocar filtros de aire y partículas en todos los puntos intravenosos.
Durante la dilatación, la gestante debe estar en decúbito lateral izquierdo. Muchas veces será conveniente acortar el período expulsivo (parto instrumental) para evitar el sobreesfuerzo materno.
El posparto inmediato también puede ser peligroso. La contracción uterina tras la expulsión fetal y de la placenta provoca una transfusión de sangre extra al volumen intravascular y puede causar una sobrecarga. También hay que tener en cuenta la pérdida de volumen de la hemorragia del parto. La oxitocina y la ergometrina pueden tener importante efectos hemodinámicos. La primera puede inducir vasodilatación e hipotensión y la segunda, hipertensión. La oxitocina se debe usar siempre en infusión continua y evitar bolos intravenosos. El objetivo es siempre evitar fluctuaciones bruscas de volumen y presión arterial. En pacientes de riesgo, puede ser necesario continuar la vigilancia hemodinámica hasta 72 h posparto (incluso hasta 7 días en pacientes con síndrome de Eisenmenger y 10 días en pacientes con hipertensión pulmonar).