INTRODUCCION
El citomegalovirus (CMV) es la causa más frecuente de infección congénita, ya que causa el 60% de los casos. La incidencia de infección congénita por CMV varía entre el 0,15 y el 2% de los embarazos a término1. El cuadro de la infección congénita por CMV varía desde la infección asintomática hasta el síndrome congénito, con microcefalia, ictericia, hepatosplenomegalia, petequias, etc. La frecuencia de recién nacidos sintomáticos es del 5-10%, que tienen una tasa de mortalidad del 10%; de los que sobreviven, más del 80% presentará secuelas neurológicas graves. Entre los neonatos con infección congénita asintomática al nacimiento (90%), un 5-15% acabará presentando secuelas de distinta gravedad con el tiempo, como pérdida auditiva neurosensorial, déficit mental y defectos neuromusculares2.
La inmunidad preconcepcional de la madre ejerce un efecto protector para el embarazo. La incidencia de la transmisión vertical es más baja, ya que se produce en el 35-40% de las primoinfecciones maternas y en el 0,2-1,5% de las recurrencias1. Hasta ahora generalmente se aceptaba que la infección congénita causada por una primoinfección materna es más grave que la debida a una infección recurrente; sin embargo, esta idea se está poniendo en duda, ya que se han descrito casos de cuadros graves de CMV congénito tras una infección materna recurrente3,4.
Presentamos un caso de infección congénita por CMV con lesiones fetales graves tras una infección recurrente materna, asintomática.
CASO CLINICO
Paciente secundigesta de 29 años de edad, sin antecedentes medicoquirúrgicos de interés. Embarazo de evolución normal hasta la semana 14, en la que ingresa por sospecha de rotura prematura de membranas (RPM). Durante el ingreso la paciente permanece apirética, no se produce una RPM y la ecografía es rigurosamente normal, con un volumen de líquido amniótico también normal, por lo que se da de alta.
La paciente continúa con un embarazo normal, hasta la ecografía de la semana 20, en la que se pone de manifiesto un feto con peso en el percentil 10-25, una tumoración líquida en la fosa craneal posterior, de 1,1 × 0,7 cm, en contacto con el IV ventrículo, asas intestinales hiperrefringentes y oligohidramnios leve. Se realiza un juicio diagnóstico de posible variante de Dandy-Walker, con intestino hiperrefringente y oligohidramnios leve. Se realiza una amniocentesis y una cordocentesis para el estudio del cariotipo, y se deriva a la paciente a un centro de referencia.
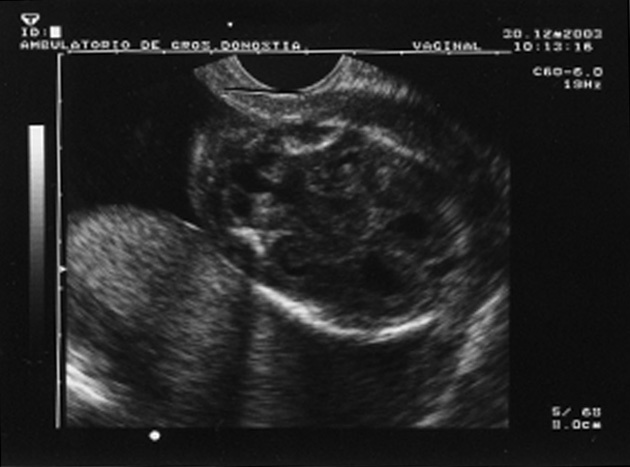
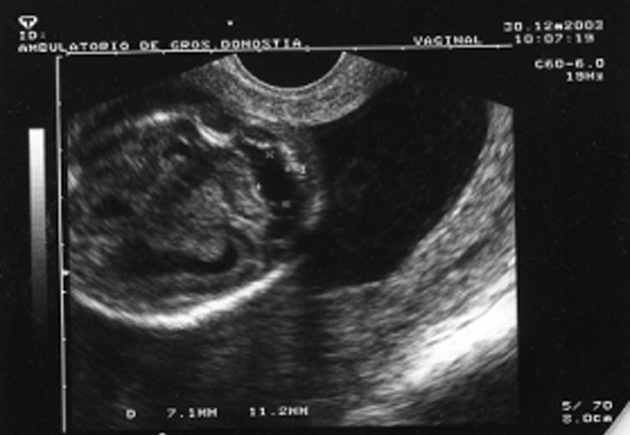
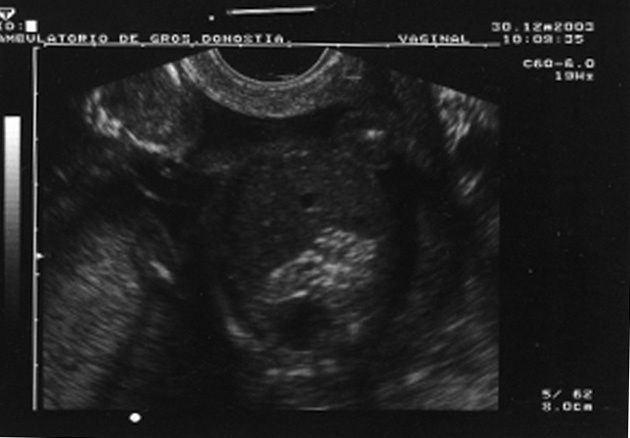
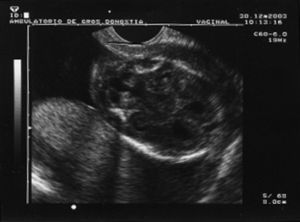
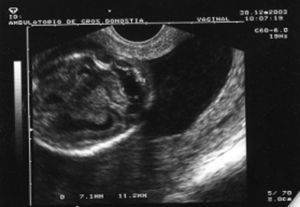
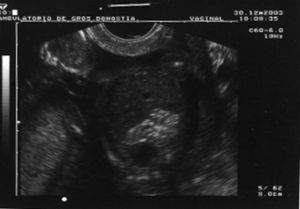
Al cabo de una semana se repite la ecografía, con los siguientes hallazgos: frecuencia cardíaca fetal (FCF) positiva; feto en posición cefálica; sexo masculino. peso fetal en percentil 10-25; aumento generalizado del espacio subaracnoideo, con aspecto de parénquima encefálico de pequeño tamaño y con escasas circunvoluciones; se observa comunicación entre las astas anteriores de los ventrículos laterales; cerebelo de morfología anómala con ausencia parcial de vérmix cerebeloso y cisterna magna límite; notable hiperecogenicidad intestinal; líquido amniótico normal. El diagnóstico fue: variante de Dandy-Walker + aumento de espacio subaracnoideo + holoprosencefalia lobar + hiperrefringencia intestinal (figs. 1 y 2).
Figura 1.Variante de Dandy-Walker: quiste en fosa posterior, agenesia parcial de vermis cerebeloso, IV ventrículo normal o mínimamente agrandado.
Figura 2. Hiperrefringencia intestinal.
Ante estos hallazgos ecográficos, la pareja fue informada sobre el mal pronóstico fetal, con riesgo de deficiencia intelectual grave, y alto riesgo de malformaciones asociadas, cerebrales y de otros órganos. Ante este pronóstico, la paciente decide realizar una interrupción legal del embarazo (ILE).
El estudio necrópsico demuestra los siguientes datos:
-- Microcefalia con dilatación de ventrículos laterales y adelgazamiento corticosubcortical (3 mm).
-- Mala definición de estructuras de la línea media, sin delimitarse macroscópicamente el cuerpo calloso.
-- Hemorragia parenquimatosa en el hemisferio cerebeloso izquierdo.
-- Órganos de cavidades torácica y abdominal en normoposición.
-- Infección diseminada por CMV, con inclusiones citomegálicas en tiroides, pulmones, hígado, páncreas, riñones, glándulas suprarrenales, testículo y encéfalo.
-- Encéfalo con inflamación aguda en diferentes estadios evolutivos, que afectan al parénquima periependimario, los núcleos grises de la base, los plexos coroideos y el cerebelo (fig. 2).
En el estudio radiológico se detectó una agenesia del cuerpo calloso y un vermis sin hallazgos patológicos.
El cariotipo es 46 XY, de un varón cromosómicamente normal. Las cifras de alfafetoproteína fueron de 11.570 U/ml.
Ante el informe necrópsico, se revisa la serología para CMV de la paciente, hallando los siguientes datos:
-- Suero de febrero de 2003, previo a la gestación: CMV IgG positivo, CMV IgM negativo.
-- Suero de marzo de 2004, posterior a la gestación: CMV IgG positivo, CMV IgM negativo.
Ante dichos hallazgos, se realiza un juicio diagnóstico de feto polimalformado por CMV congénito, secundario a una infección materna recurrente.
La paciente ha tenido posteriormente un embarazo de evolución normal, con un parto eutócico en la semana 39 y un recién nacido completamente sano.
DISCUSION
El CMV es un virus muy extendido en la población general. Su prevalencia varía entre el 40 y el 100%, en función de varios factores, como el nivel socioeconómico, la edad, la situación geográfica, etc. La seropositividad en las gestantes de nuestro medio alcanza aproximadamente el 86%5.
El CMV pertenece al grupo de los herpesvirus (virus herpes simple tipos 1 y 2, virus varicela zoster, virus de Epstein-Barr y CMV), por lo que, como todos ellos, puede producir infecciones líticas y sintomáticas, latencias y reactivaciones. La infección se produce por contacto íntimo con fluidos biológicos que contienen el virus: lágrimas, saliva, orina, secreciones cervicovaginales, calostro-leche materna, sangre y semen. La infección fetal se produce por vía transplacentaria durante el embarazo, a través de las secreciones vaginales durante el parto, así como mediante la transmisión por leche materna durante la lactancia6. Sabiendo que las secreciones cervicovaginales maternas son una fuente de infección tanto para el feto durante el parto como para la población general, se podría plantear la hipótesis de una posible vía de infección fetal ascendente desde el canal cervicovaginal infectado hacia el contenido intraamniótico en caso de RPM. En nuestro caso, la paciente ingresó la semana 14 por sospecha de RPM. Dicha rotura no llegó a producirse, y por otro lado, no disponemos de cultivos cervicovaginales de esa etapa del embarazo ni podemos concretar el momento en que ocurrió la recurrencia del CMV, ya que fue asintomática. Por tanto, no tenemos datos para corroborar dicha hipótesis, pero nos parece que puede constituir otro aspecto susceptible de investigación en el futuro.
La infección congénita puede ser el resultado de una primoinfección materna (adquisición del virus por primera vez durante el embarazo), o de una recurrencia (seropositividad materna [presencia de anticuerpos IgG] previa a la gestación). Debido a que el nivel socioeconómico y la edad influyen en la prevalencia de seropositividad para CMV (ésta es mayor en las personas con un nivel socioeconómico bajo y en la población joven), actualmente algunos estudios indican que en Estados Unidos la recurrencia de CMV materno es responsable de más casos de infección congénita que la primoinfección, particularmente en los estratos socioeconómicos más bajos1.
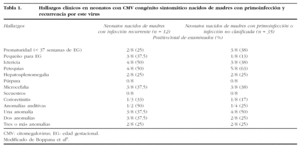
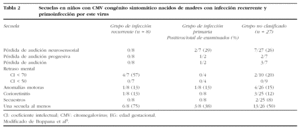
Se dispone de múltiples datos que apoyan el papel protector de la inmunidad materna, en cuanto a la disminución de la tasa de transmisión y la gravedad del cuadro y sus secuelas7. La tasa de transmisión vertical asociada a la infección materna primaria es del 35-40%, mientras que la asociada a una recurrencia es del 0,2-1,5%. En general, se acepta que la infección congénita sintomática ocurre principalmente tras una primoinfección materna. A este respecto, se han publicado cierto número de casos de recién nacidos con CMV congénito sintomático nacidos de madres con inmunidad frente al CMV3,4,8-10. En un estudio retrospectivo, Boppana et al9 comparan los recién nacidos con CMV congénito sintomático debido a una primoinfección con la recurrencia materna. La gravedad y la frecuencia de anomalías clínicas y de laboratorio fueron similares en ambos grupos (tabla 1). Se realizó un seguimiento de la evolución de estos niños, observando que la incidencia de secuelas fue similar en ambos grupos (tabla 2). Nuestro caso constituye otra muestra de que la infección materna recurrente puede generar casos de infección congénita de máxima gravedad.
El cuadro causado por el CMV es muy variado, y la mayoría de las veces es una infección asintomática y latente en adultos sanos. Sin embargo, en individuos inmunodeprimidos y en fetos humanos en desarrollo, el cuadro clínico puede llegar a ser muy grave y diseminado. El 50% de los recién nacidos que presentan síntomas al nacimiento tienen el síndrome de inclusiones citomegálicas, que consiste en exantema petequial, hepatosplenomegalia, ictericia y afección multiorgánica (microcefalia, calcificaciones encefálicas y secuestros, corioretinitis, alteraciones motoras, distrés respiratorio y bajo peso para edad gestacional). Esta presentación es fulminante, con una mortalidad del 10% en días o semanas11,12. Ésta es la presentación clínica más grave del CMV congénito. En nuestro caso hubo un síndrome de inclusiones citomegálicas, secundario a una recurrencia materna de CMV durante la gestación. Esto demuestra que el CMV materno recurrente es capaz de ocasionar el cuadro más grave de CMV congénito. La evidencia de que nuestro caso fue consecuencia del CMV nos la dan las inclusiones citomegálicas halladas en múltiples órganos. Las inclusiones citomegálicas son cuerpos de inclusión intranucleares, denominados en «ojo de lechuza», que constituyen la evidencia histológica de la replicación viral. La evidencia de que nuestro caso se debió a una reactivación materna de CMV lo da la serología, con positividad de la IgG previa y posterior a la gestación.
En el caso que presentamos se realizó un diagnóstico ecográfico de feto polimalformado. El diagnóstico fue exclusivamente ecográfico, basándose en los siguientes hallazgos:
-- Variante de Dandy-Walker: quiste en la fosa posterior y defecto parcial del vermis cerebeloso. En este caso no se visualizó el aumento de los ventrículos laterales por ecografía, que luego sí fue observado en la necropsia.
-- Holoprosencefalia lobar: el hallazgo que sugirió la holoprosencefalia lobar fue la comunicación entre las astas anteriores de los ventrículos laterales. El aspecto del parénquima encefálico de pequeño tamaño, con escasas circunvoluciones, y el aumento del espacio subaracnoideo apoyaban dicho diagnóstico.
Posteriormente, en la necropsia se observó una mala definición de las estructuras de la línea media, sin delimitarse el cuerpo calloso.
-- Hiperrefringencia intestinal.
Ante este diagnóstico, e informados sobre el prónostico fetal, la decisión de la paciente fue realizar una ILE. En ese momento todavía no se disponía del resultado del cariotipo fetal.
Ante el hallazgo de un feto polimalformado de estas características, en un intento de aproximación al diagnóstico etiológico se puede seguir el siguiente protocolo:
1. Estudio de cariotipo fetal, debido a que estos síndromes frecuentemente se asocian con anomalías cromosómicas.
2. Estudio de infecciones congénitas:
-- Serologías maternas de toxoplasma, sífilis, rubéola, CMV, Coxsackie.
-- Amniocentesis para detección de ADN del agente infeccioso por reacción en cadena de la polimerasa (PCR) en líquido amniótico y/o cordocentesis para estudio serológico fetal.
Ante la sospecha de infección congénita por CMV, pueden realizarse las siguientes pruebas diagnósticas:
-- Ecografía. Se consideran marcadores ecográficos sugestivos de CMV congénito los siguientes: ventriculomegalia, microcefalia, intestino hiperrefringente, hepatosplenomegalia, ascitis, calcificaciones intracraneales y retraso del crecimiento fetal. Estos marcadores son sugestivos, pero en ningún caso diagnósticos, y además, una ecografía absolutamente normal no descarta la posibilidad de anomalías neonatales, ya que a veces éstas no son visualizables mediante ecografía y, en otras ocasiones, las lesiones se desarrollarán en épocas más tardías.
-- Detección de ADN de CMV en líquido amniótico mediante PCR. Es diagnóstica de feto infectado, con una sensiblidad del 70-100%. Es el método preferido, teniendo en cuenta que el momento de la gestación en el que se realiza la amniocentesis es un factor determinante en dicho parámetro. La carga viral detectada en el líquido amniótico puede ayudar a distinguir entre fetos infectados, pero asintomáticos de los fetos con una alta probabilidad de presentar serias secuelas, ya que parece que cargas virales altas se relacionan con fetos clínicamente afectados2,5,8.
-- Serología en suero de cordón umbilical. Un resultado positivo debe ser confirmados por cultivo viral en orina, saliva o tejido del recién nacido infectado en la primera semana de vida.
-- Estudio de la infección en la madre mediante los siguientes métodos:
* Serología: aporta una aproximación diagnóstica, no un diagnóstico definitivo.
* Cultivo del virus: los resultados tardan 1-6 semanas.
* El estudio de antígenos específicos del virus mediante anticuerpos monoclonales: resultado disponible en 2 o 3 días.
En conclusión, la infección materna recurrente por CMV es capaz de causar infecciones congénitas de la misma gravedad que la primoinfección, y es capaz, como ésta, de producir el cuadro más grave: el síndrome de inclusiones citomegálicas.
Correspondencia:
Dra. L. Barinaga-Rementeria.
San Miguel, 10, 1.o.
31880 Leitza. Nafarroa. España.
Correo electrónico: barinagalorea@yahoo.es
Fecha de recepción: 27/12/2005. Aceptado para su publicación: 5/4/2006.