INTRODUCCION
El tumor trofoblástio epitelioide (TTE) es una neoplasia derivada del trofoblasto intermedio de tipo coriónico, presente en el corion leve1. Histológicamente, se caracteriza por una proliferación de células trofoblásticas mononucleares, dispuestas en nidos, cordones y masas de células con núcleos pleomórficos y citoplasmas eosinófilos o claros, circundados por una membrana citoplasmática bien delimitada. El tumor muestra un bajo pero claro potencial maligno: aunque la mayoría de los casos presenta un curso benigno, el 15-25% de los ETT desarrolla metástasis o recidivas, las cuales se asocian a un mal pronóstico2. El TTE se presenta habitualmente durante la edad reproductiva (rango, 15-48 años), y la mayoría de ellos es posterior a un embarazo normal, un aborto o, más raramente, una mola hidatidiforme completa1.
Sólo algunos casos aislados de TTE se han descrito en mujeres posmenopáusicas3-6. Nuestro caso representa un nuevo TTE en una mujer de 63 años de edad, cuyo último antecedente obstétrico fue un embarazo a término a los 33 años. El caso representa el intervalo más largo entre el último antecedente obstétrico y la detección del tumor reportado en la literatura médica.
CASO CLINICO
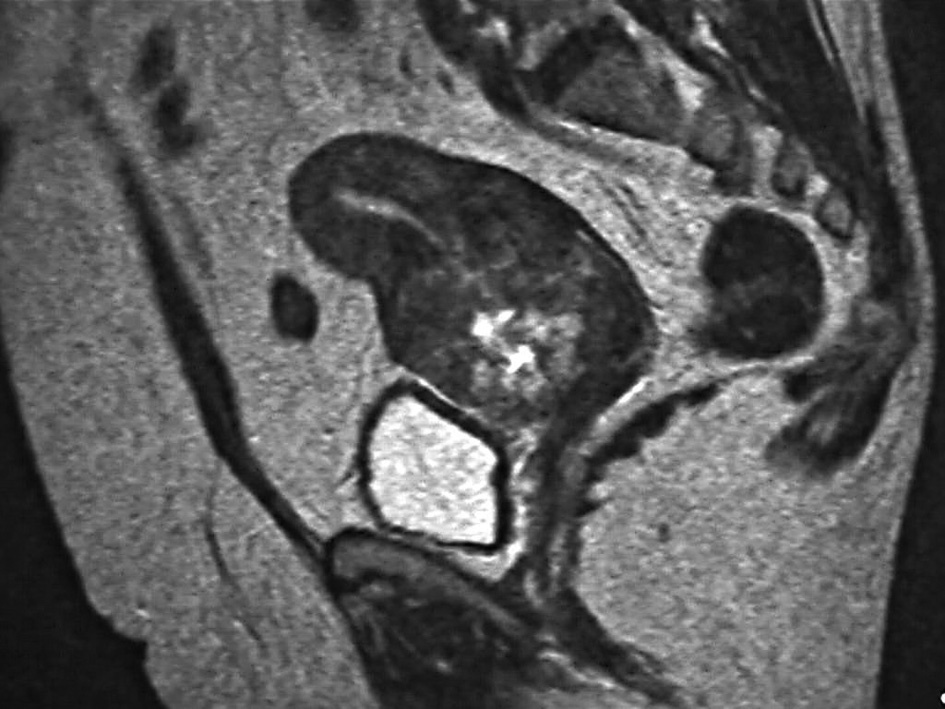
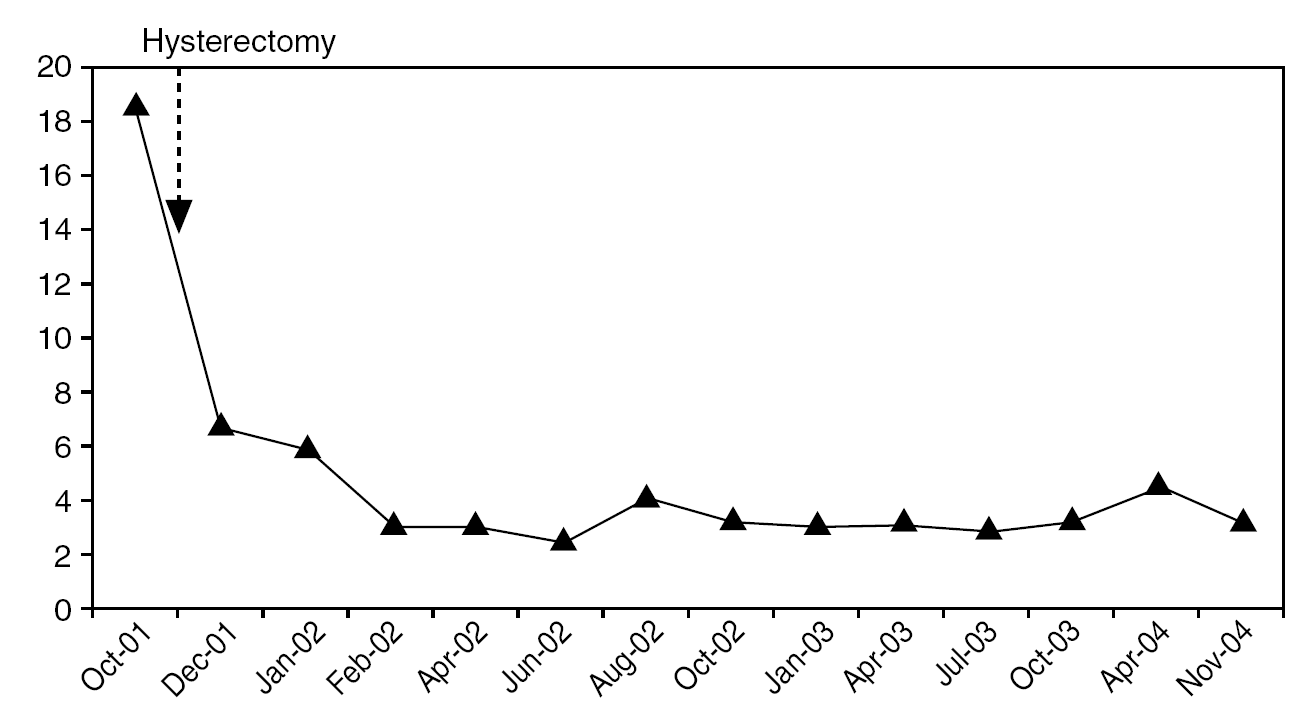
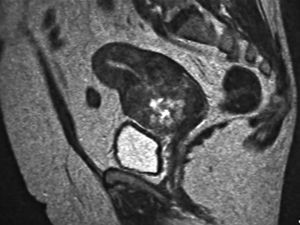
Paciente de 63 años de edad, que consulta por un sangrado vaginal moderado de 9 meses de evolución. En los antecedentes obstétricos destacan 3 gestaciones con 2 partos normales a los 26 y 30 años. La paciente presentó la menopausia a los 45 años. La ecografía transvaginal demostró un endometrio engrosado, de 7,3 mm. La histeroscopia reveló una cavidad endometrial normal, con un endometrio atrófico y una formación polipoide. En el endocérvix se observó un tejido friable compatible con neoplasia endocervical. La tomografía computarizada y la resonancia magnética mostraron un tumor de 6 cm de localización cervical, con signos sospechosos de invasión parametrial proximal (fig. 1). Se realizó una biopsia endometrial que puso de manifiesto una proliferación de probable origen trofoblástico. Se realizó una prueba para la detección del virus del papiloma humano (VPH) mediante Hybrid Capture 2, que resultó negativa. Los valores séricos de la fracción de gonadotropina coriónica humana (β-hCG) fueron de 18,7 U/l. Tras completar el estudio, se decidió realizar una histerectomía radical (Wertheim-Meigs). Después de la histerectomía, los valores séricos de β-hCG retornaron a cifras normales (fig. 2). La paciente se encuentra al final de su cuarto año después de la cirugía sin evidencia de enfermedad, aunque en la última revisión se detectó un adenocarcinoma rectal.
Figura 1. Resonancia magnética. Gran lesión tumoral localizada en el cérvix y el istmo uterino.
Figura 2.Valores séricos de la fracción β de gonadotropina coriónica humana (β-hCG). Se detectó un leve incremento de estos valores, que disminuyeron después de la cirugía.
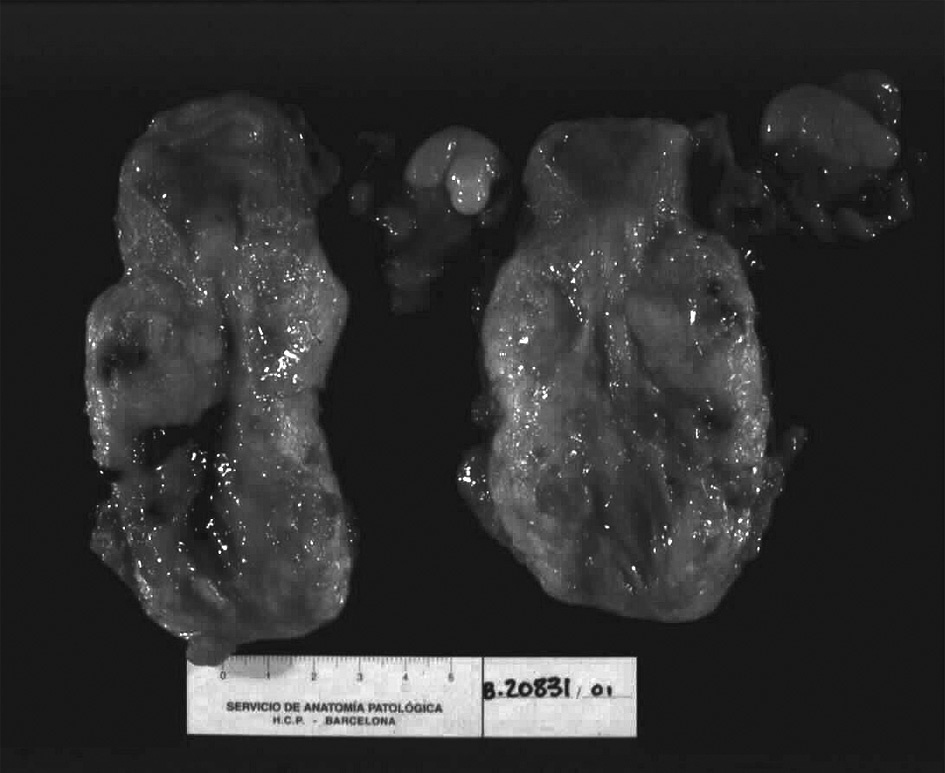
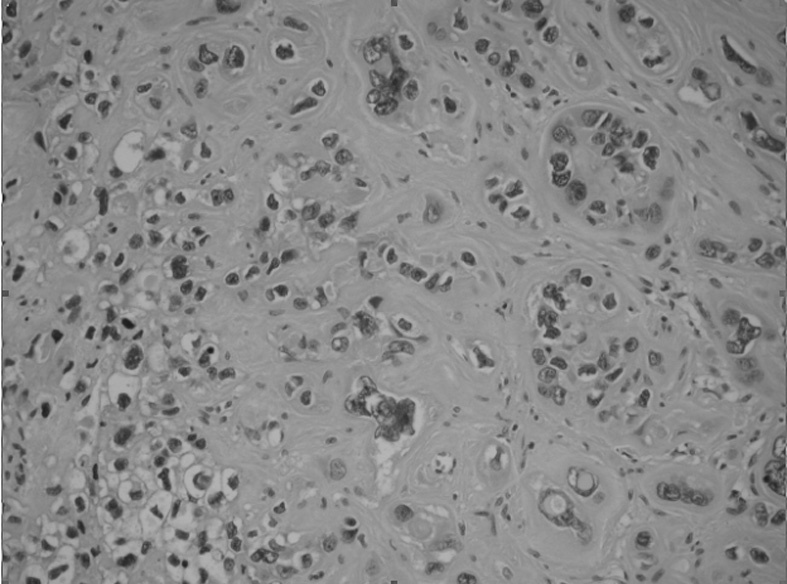
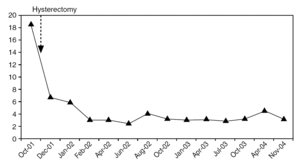
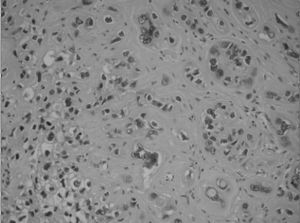
La pieza de histerectomía demostró una masa bien circunscrita de 6 × 3 × 2 cm, localizada en la pared endocervical que se extendía al istmo uterino (fig. 3). La superficie al corte mostraba una lesión sólida, de márgenes bien definidos y expansivos. Microscópicamente, las secciones mostraron una proliferación de células trofoblásticas grandes, con moderado pleomorfismo, núcleos vesiculares y citoplasmas eosinófilos o claros, con membranas celulares bien definidas. Las células se disponían en forma de trabéculas y cordones que infiltraban el tejido fibromuscular de la pared endocervical (fig. 4). La zona central del tumor mostraba pequeños focos de necrosis. La actividad mitótica fue inferior a 2 figuras mitóticas por 10 campos de gran aumento. No se evidenció enfermedad extrauterina.
Figura 3.Pieza de histerectomía en la que se observa una lesión bien circunscrita, que expande la pared endocervical y se extiende al istmo uterino.
Figura 4. Células trofoblásticas grandes pleomórficas, con núcleos vesiculosos y citoplasmas claros o eosinófilos (HE,×200).
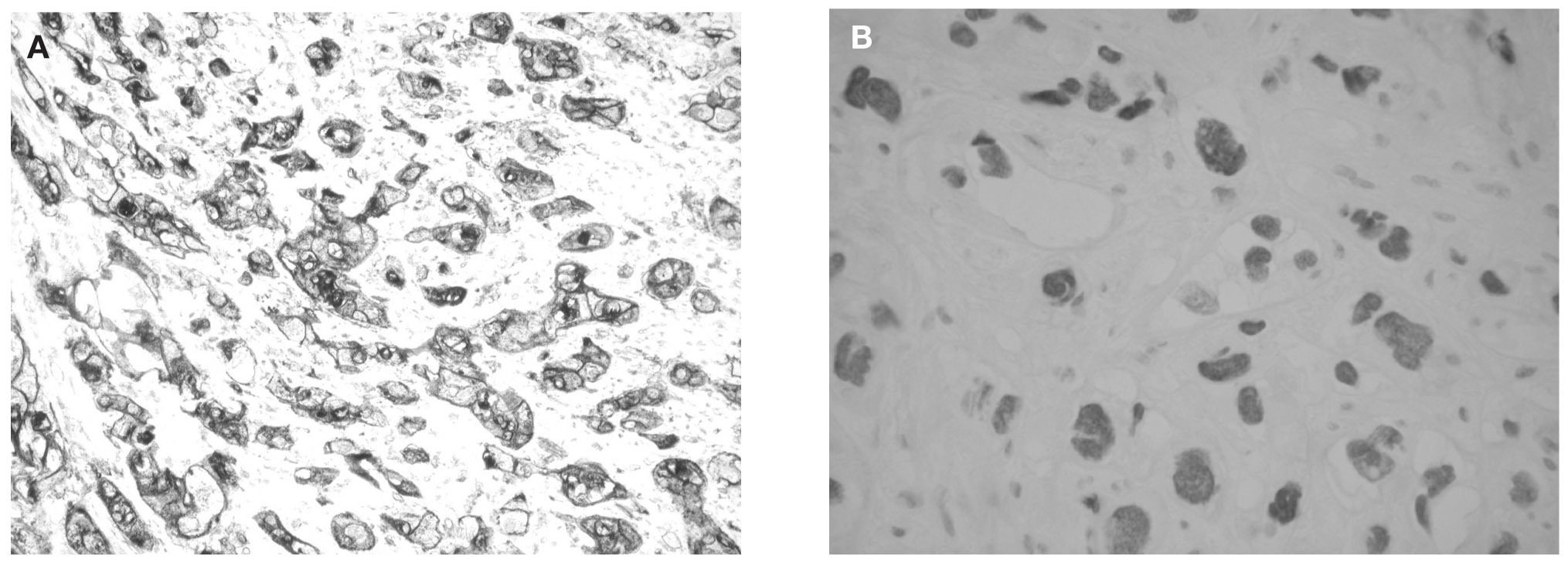
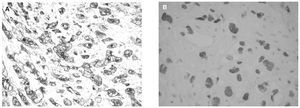
Los estudios inmunohistoquímicos mostraron que las células tumoral eran intensa y difusamente positivas para citoqueratina 7 (Dako), CAM 5,2 (Beckton-Dickinson, San Jose, CA, Estados Unidos), CD 10 (Novocastra, Newcastle upon Tyne, Reino Unido), *-inhibina (Serotec, Oxford, Reino Unido) y p63 (Dako), esta última con tinción nuclear (fig. 5). Algunas células tumorales aisladas fueron positivas para lactógeno placentario humano (hPL, Dako). En cambio, las células trofoblásticas fueron negativas para β-hCG (Eurodiagnostic, Países Bajos) y fostatasa alcalina placentaria (PLAP, Novocastra). El índice proliferativo, valorado con Ki-67 (Immunotech, Marseille, Francia) fue del 20%.
Figura 5.A) Intensa positividad citoplasmática para α-inhibina (α-inhibina, Envision, hematoxilina, ×400). B) Positividad nuclear para p63.
Estas características fueron consistentes con el diagnóstico de TTE. La evaluación de la pieza de histerectomía mostró focos de endometriosis localizadas en la serosa uterina. Los ovarios mostraron signos de atrofia y las trompas de Falopio no presentaban particularidades. Se disecaron 4 ganglios pélvicos, todos libres de tumor.
DISCUSIÓN
El TTE es la variante más recientemente descrita de tumor trofoblástico gestacional, y representa la transformación neoplásica del trofoblasto intermedio de tipo coriónico4. El sangrado vaginal anormal es el signo clínico con el que se presenta más frecuentemente. Sin embargo, algunos casos aislados se han presentado por la clínica relacionada con las metástasis pulmonares5. Es importante remarcar que más del 50% se origina en el cérvix uterino o en el segmento inferior del útero. Su patrón de crecimiento es nodular, con bordes expansivos. El tumor muestra frecuentemente un material hialino fibrilar y una necrosis geográfica extensiva; ambos hallazgos pueden simular histológicamente la queratina4,5.
La principal peculiaridad de nuestro caso es su presentación en la posmenopausia, muchos años después del último antecedente obstétrico. Es interesante tener en cuenta que el TTE es un tumor diagnosticado habitualmente durante la edad reproductiva, entre los 15 y los 48 años, con una media de 36,1 años, pero unos pocos casos se han presentado varios años después de la menopausia7. Recientemente, se ha descrito un caso de una paciente de 66 años de edad que desarrolló un TTE 17 años después de un antecedente de mola hidatidiforme completa1. A pesar de su origen trofoblástico, el TTE presenta habitualmente mínimas elevaciones de la β-hCG. A pesar de ello, la β-hCG sérica es de gran utilidad en el seguimiento de los TTE, como ilustra nuestro caso.
Debido a su presentación cervical la principal consideración diagnóstica en nuestra paciente fue, como en muchos de los casos publicados, un carcinoma escamoso de cérvix. La distinción entre ambas lesiones es crucial, ya que la cirugía no es la principal opción terapéutica en el carcinoma escamoso del cérvix4. La inmunohistoquímica es de particular contribución en el diagnóstico. Sin embargo, las células del TTE son negativas, o sólo focalmente positivas, para los marcadores trofoblásticos clásicos, como β-hCG o hPL, por lo que sólo otros marcadores, como α-inhibina o CD108, que son positivos en todos los tumores trofoblásticos, permiten confirmar la naturaleza trofoblástica de la lesión. La detección del virus del papiloma humano (VPH) mediante técnicas moleculares también ayuda a realizar el diagnóstico diferencial, debido a que el virus está presente constantemente en la patogenia de los carcinomas de células escamosas y es negativo en los tumores trofoblásticos. Además, en el TTE el índice de expresión del Ki-67 es relativamente bajo (10-15%), mientras que en los carcinomas de células escamosas la expresión del Ki-67 es elevado (> 50%)9.
Una vez establecida la naturaleza trofoblástica de la célula tumoral, debe relizarse la diferenciación con otras lesiones o neoplasias trofoblásticas, como el coriocarcinoma y el tumor trofoblástico del sitio placentario (TTSP)10. Al igual que el TTE, estos tumores también pueden presentarse ocasionalmente en mujeres posmenopáusicas3. El coriocarcinoma se distingue del TTE por la presencia característica de cito, sincitio y trofoblasto intermedio, y los altos valores séricos de β-hCG, que también se detecta mediante inmunohistoquímica. La distinción entre estas 2 entidades es importante, debido a que el tratamiento quimioterápico es usualmente efectivo en el coriocarcinoma y no en el TTE. El TTSP presenta un patrón de crecimiento difusamente infiltrativo, el cual contrasta con el nodular y expansivo del TTE3. La inmunohistoquímica es también determinante en el diagnóstico diferencial, puesto que el TTE es fuertemente positivo para p63 y negativo para hPL, mientras que en el TTSP se observa el patrón inverso6. El pronóstico del TTSP es semejante al del TTE11. Finalmente, aunque podría plantearse el diagnóstico diferencial con las lesiones benignas del trofoblasto intermedio, como el nódulo del sitio placentario y el sitio placentario exagerado, debe recordarse que estas lesiones son siempre hallazgos incidentales y no forman una masa tumoral.
El TTE muestra un potencial maligno: la mayoría de los casos presenta un curso benigno pero el 15-25% de ellos desarrollan metástasis o recidivas, lo cual se asocia a un mal pronóstico2. Los factores asociados con una alta mortalidad son: TTE que precede a un embarazo a término, un alto índice mitótico y la edad avanzada de las pacientes. Se desconoce si el índice elevado es un factor pronóstico significativo en el TTE, como lo es en el TTSP. El tratamiento debe ser quirúrgico, puesto que el TTE no responde a los tratamientos quimioterápicos.
En conclusión, el TTE es una lesión trofoblástica infrecuente que no debe ser excluida del diagnóstico diferencial en pacientes posmenopáusicas con sangrado uterino anormal. Se trata de un tumor de diagnóstico difícil, dada su frecuente localización cervical y sus características histológicas, que remedan un carcinoma escamoso poco diferenciado. Sin embargo, es importante considerar esta posibilidad, dado que el tumor tiene un pronóstico definido y un tratamiento particular.
Correspondencia:
Dr. J. Ordi.
Departamento de Patología. Hospital Clínic.
Casanova, 143. 08036 Barcelona. España.
Correo electrónico: jordi@clinic.ub.es
Fecha de recepción: 13/12/2005. Aceptado para su publicación: 26/4/2006.