INTRODUCCIÓN
La comprobación de la presencia de proteinuria es importante para el manejo de las pacientes con hipertensión crónica o inducida por el embarazo. El diagnóstico de preeclampsia se establece en presencia de hipertensión y proteinuria más allá de las 20 semanas de gestación1. Las pacientes con hipertensión tienen menos de 300 mg de proteínas en orina de 24 h, las que presentan preeclampsia leve tienen entre 300 y 5.000 mg en orina de 24 h y las pacientes con preeclampsia grave superan esta última cifra2. Los procedimientos para determinar la proteinuria con tiras reactivas en una muestra de orina al azar tienen tanto falsos positivos como negativos, por lo que la recogida de orina de 24 h se considera el estándar para la determinación de proteinuria. Sin embargo, este procedimiento no sólo es farragoso, sino que es necesariamente lento, y conlleva la posibilidad de retrasar el diagnóstico. La determinación del cociente proteínas/creatinina en una muestra al azar permite ganar tiempo, ya que la correlación con la proteinuria en 24 h es buena, aunque persisten algunas dudas sobre el punto de corte más adecuado para conseguir un equilibrio óptimo entre falsos negativos y falsos positivos.
En nuestro trabajo hemos recogido orina de 24 h en pacientes en las que previamente se había realizado una determinación al azar del cociente proteínas/creatinina para comprobar la correlación de los resultados de ambos procedimientos y buscar el punto de corte más adecuado en términos de sensibilidad y especificidad3,4. También hemos intentado establecer el punto de corte que modifica más la probabilidad postest de presentar preeclampsia.
MATERIAL Y MÉTODOS
Se reclutaron para el estudio todas las embarazadas de más de 20 semanas de gestación que ingresaron en el Hospital Son Dureta entre el 1 de enero y el 31 de mayo de 2002, cuya indicación para el ingreso eran unas cifras de presión arterial ≥ 140/90 mmHg en 2 determinaciones separadas por 30 min de reposo. Inmediatamente después de decidir el ingreso se recogió una muestra de orina, en la que se determinó el cociente de proteínas/creatinina y se realizó un sedimento, anotándose la hora del día en la que se hizo la determinación.
Se excluyeron las pacientes con disfunción renal, parto al cabo de menos de 24 h después del ingreso, no realización de sedimento al ingreso, no recogida de orina de 24 h por normalización de la presión arterial en planta y también las pacientes en las que el cociente se había determinado en la primera micción de la mañana.
Para valorar la relación entre el cociente proteínas/creatinina y la cifra de proteínas en orina de 24 h, hemos calculado el coeficiente de correlación de Pearson, así como su error estándar de acuerdo con la fórmula:
donde r es el coeficiente de correlación y sr el error estándar5. Hemos calculado la sensibilidad (verdaderos positivos/verdaderos positivos + falsos negativos), especificidad (verdaderos negativos/verdaderos negativos + falsos positivos) para distintos puntos de corte. Por último, también con distintos puntos de corte, hemos calculado la probabilidad pretest y postest, tanto para el resultado positivo como para el negativo para distintos puntos de corte6. La probabilidad pretest la hemos considerado como la prevalencia de enfermas observada en nuestra muestra y la probabilidad postest la hemos calculado de acuerdo con la siguiente fórmula para el resultado positivo:
Para el resultado negativo de la prueba, la probabilidad postest de estar delante de una paciente sana se calcula de acuerdo con esta otra fórmula:
RESULTADOS
De las 59 pacientes que cumplían los criterios de inclusión hemos eliminado 24 por distintas razones: incumplimiento del protocolo, normalización de la presión arterial con el reposo, parto antes de 24 h, etc. De las 35 restantes, 7 tenían un sedimento urinario alterado y también las hemos excluido del análisis. La media de edad fue de 32 años (rango, 19-44). La edad gestacional media fue de 34 semanas (rango, 25-40). En 7 de los casos había un diagnóstico previo de hipertensión arterial crónica, 4 de los cuales además tenían diabetes gestacional. Otra paciente presentaba una diabetes gestacional aislada, que precisó tratamiento con insulina. De las pacientes incluidas, 3 tenían un embarazo gemelar. Dieciocho de las gestantes eran nulíparas.
El valor medio del cociente proteínas/creatinina en las 28 pacientes que finalmente fueron incluidas fue de 1, con una mediana de 0,17 y un rango de 0 a 15,75. En cuanto a las proteínas en orina de 24 h, la media fue de 500 mg/l con una mediana de 160 mg/l y un rango de 0 a 6.850 mg/l. El coeficiente de correlación entre ambas variables fue de 0,9254 con un error estándar de 0,0743, lo que indica que el coeficiente es significativo con un valor de p < 0,0001.
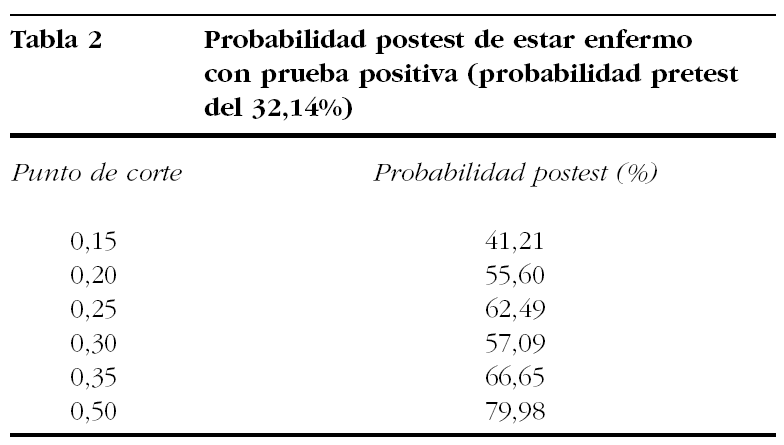
De las 28 pacientes estudiadas, 9 tenían cifras de proteínas en orina de 24 h superiores a 300 mg, con lo que la prevalencia de enfermedad era del 32,14%. En la tabla 1 se recogen los datos correspondientes a sensibilidad y especificidad para distintos puntos de corte. Con éstos es posible calcular, aplicando las fórmulas mencionadas antes, la información recogida en las tablas 2 y 3. En ellas encontramos las probabilidades postest de que una determinada paciente esté enferma (si la prueba es positiva: cociente mayor o igual al punto de corte) o de que esté sana (si la prueba es negativa: cociente menor al punto de corte).
DISCUSIÓN
La correlación que hemos observado entre el cociente proteínas/creatinina y la determinación de proteinuria en orina de 24 h es muy estrecha, con valores significativos del coeficiente de correlación de Pearson. Esto permite afirmar que podemos sustituir una prueba por otra con la ventaja de ser mucho menos farragosa la obtención de la información y de que además está disponible de forma casi inmediata. En la bibliografía hay otros trabajos que llegan a la misma conclusión4,7-9, pero también hay autores que consideran esto poco apropiado, basándose en que las embarazadas presentarían una gran variabilidad durante el día en la excreción de proteínas10. Las críticas a este último trabajo se basan en que las pacientes estudiadas fueron incluidas a partir de una determinación de proteinuria con una tira reactiva, lo que implicaría un sesgo de selección7. Nuestros resultados apoyan la sustitución de la determinación de proteínas en orina de 24 h si consideramos sólo la correlación, pero las dudas surgen al valorar los distintos puntos de corte entre normalidad y patología que podemos adoptar.
Se acepta que una cifra de 300 mg de proteínas en orina de 24 h es un valor anormal y esta cifra forma parte de la definición de preeclampsia. En realidad, esta cifra es arbitraria, pero su uso tan extendido la convierte en un parámetro de referencia11. Nuestro hallazgo de un coeficiente de correlación significativo indica que a medida que crecen los valores de una de nuestras 2 variables, los valores de la otra lo hacen también. Este análisis se basa en que ambas variables son continuas o cuantitativas. Cuando queremos encontrar una cifra del cociente de proteínas/creatinina que separe a las mujeres con proteinurias de 24 h superiores e inferiores a 300 mg estamos utilizando variables discontinuas: normalidad y anormalidad. Esto implica un cambio que dificulta la interpretación de los datos.
En la tabla 1 hemos recogido distintos valores de sensibilidad y especificidad para distintos puntos de corte y, como sabíamos de antemano, observamos que al mover el punto de corte, si mejora la sensibilidad empeora la especificidad, y viceversa. La mejor aproximación al problema (elegir el punto de corte más satisfactorio) se ha realizado antes, calculando el área bajo una curva ROC (receiver operator characteristic)4. Estos autores llegaron a la conclusión de que el mejor punto de corte era el de 0,19, con una sensibilidad del 90% y una especificidad del 70%. Hay otros autores que apoyan valores próximos, como el de 0,2, pero sin dar cifras de sensibilidad y especificidad8. Nuestros resultados no reproducen en absoluto estos hallazgos, ya que tenemos cifras más bajas, tanto de sensibilidad como de especificidad. Es posible que las diferencias se deban a que el trabajo era retrospectivo, a que su muestra era más grande o a criterios de inclusión más selectivos4. También pueden encontrarse en la bibliografía cifras más altas de cociente proteínas/creatinina para el punto de corte, que se asociarían a cifras de sensibilidad y especificidad también mejores que las que hemos hallado nosotros7. A veces algún trabajo obtiene cifras muy buenas de correlación con sensibilidad y especificidad altas, pero olvida mencionar el punto de corte elegido, aunque es posible calcularlo a partir de la información publicada9. De todas formas, creemos que la aplicación a la práctica es más fácil con nuestros datos, ya que el objetivo sería reducir el número de ingresos para estudio en una situación frecuente, así como hacer posible la toma de decisiones casi inmediata en los casos de preeclampsia. El cálculo de probabilidades postest y la comparación con las probabilidades pretest es la mejor forma de evaluar la utilidad de una prueba diagnóstica. Así, si tenemos una determinada probabilidad de encontrarnos con diagnóstico concreto, una prueba que aumente un poco la probabilidad de acertar tiene poco interés. En cambio, si la prueba dobla las probabilidades de acertar, el interés de ésta es evidente. Esperar al hematocrito en una paciente pálida, con pulso filiforme, metrorragia escasa, dolor abdominal, amenorrea de 2 meses y que refiere una prueba de embarazo positiva, va a ser poco útil. Sin embargo, en ausencia de palidez, con pulso y presión arterial normales, el hematocrito puede ser muy útil. Con estos ejemplos intentamos explicar que las circunstancias en las que pedimos una exploración complementaria modifican su valor. A la vista de nuestros resultados, modificaríamos nuestra conducta frente a las pacientes con 2 tomas anormales de presión arterial separadas por un breve período de la siguiente forma:
Si el cociente proteínas/creatinina es inferior a 0,15, hay un 90% de probabilidades de que la paciente esté sana y nos limitaríamos a su control ambulatorio sin ingresarla para recoger orina de 24 h.
Si el cociente de proteínas/creatinina es superior a 0,5, hay un 80% de probabilidades de que la paciente esté enferma y obraríamos en consecuencia, sin demorar las decisiones por la recogida de orina de 24 h.
Si las cifras obtenidas son intermedias, entre 0,15 y 0,5, ingresaríamos a la paciente para estudio.
De haber aplicado esta conducta a nuestras pacientes hubiésemos evitado el 40% de los ingresos. Las 2 pacientes que no hubieran ingresado y presentaron proteinurias elevadas no hubiesen tenido mayores problemas, ya que después de la recogida de orina de 24 h, que fue positiva, la prueba se repitió al cabo de unos días y las cifras de proteínas en orina de 24 h fueron indetectables. El parto se produjo entre 7 y 10 semanas después del ingreso para estudio. Otro 30% de las recogidas de orina de 24 h hubiesen sido innecesarias si se hubiera establecido el diagnóstico de preeclampsia a partir de una cifra de cociente de proteínas/creatinina ≥ 0,5. La única paciente que después de un cociente elevado presentó una cifra de proteínas inferior a 300 mg en orina de 24 h fue sometida de todas formas a inducción del parto por su problema de hipertensión.