INTRODUCCIÓN
La coexistencia de un tumor epitelial maligno y otro benigno de estirpe germinal en el mismo ovario es rara.
La mayoría de los tumores malignos de ovario (80-90%) son epiteliales. Suelen presentarse en pacientes nulíparas (66-70%) entre la quinta y la séptima décadas de la vida.
Los carcinomas de células claras (mesonefroides) representan un 5-10% de estos tumores1. Son bilaterales en un 4-5% de los casos y, aunque el tipo histológico no desempeña un papel importante en el pronóstico del cáncer de ovario, este tipo de tumor parece tener peor pronóstico que otros tumores epiteliales.
Histológicamente, el adenocarcinoma de células claras es un tumor del epitelio superficial del ovario que recuerda a los tumores de células claras del endometrio. Se asocian frecuentemente a endometriosis pélvica y un 25% proviene de la transformación maligna de un endometrioma2. Macroscópicamente suelen ser quistes multiloculares, con paredes gruesas, proyecciones amarillentas, presencia de necrosis y hemorragia y aspecto «esponjoso"». Microscópicamente se caracterizan por células grandes columnares o, a veces, poliédricas, de citoplasma claro, separadas por septos fibrovasculares finos y de característica disposición en tachuela. Los núcleos son vesiculosos, a menudo con nucléolos prominentes, y las mitosis son frecuentes, tendiendo a ser menos numerosas que en otros carcinomas epiteliales primarios. El citoplasma está a veces distendido por contener abundante glucógeno, aunque también por variables cantidades de grasa3.
En general, es de alto grado de malignidad, aunque existen variantes borderline y benignos. La mayoría son diagnosticados en estadio I de la FIGO4.
El teratoma quístico maduro es el tumor más frecuente entre los tumores germinales ováricos. Es más común en mujeres en edad reproductiva. Son bilaterales en un 8-15% de los casos y suelen medir entre 5 y 10 cm. Se componen de tejidos diferenciados de las 3 capas germinales y predominan los elementos ectodérmicos.
Macroscópicamente se trata de tumores de tamaño variable, redondos u ovales, con superficie lisa y blanco-grisácea brillante. Al corte se visualizan cavidades rellenas de material graso parecido al sebo y pelo, rodeadas de cápsulas firmes de distinto grosor. De la pared quística al interior suele proyectarse una protuberancia sólida de donde suele proceder el pelo y el hueso o diente, cuando aparecen. Microscópicamente la capa externa se compone de estroma ovárico que puede estar hialinizado. La cavidad del quiste suele ser de epitelio escamoso queratinizado y contiene a menudo glándulas sebáceas o sudoríparas. El área alrededor de la protuberancia puede contener gran variedad de tejidos derivados de las 3 capas germinales.
Los teratomas maduros en su forma pura son siempre benignos, aunque ocasionalmente uno de los elementos que lo compone podría malignizar5. Esta transformación es infrecuente (1-3%) y, cuando ocurre, suele ser en mujeres posmenopáusicas con teratomas unilaterales. La transformación maligna del epitelio escamoso de origen ectodérmico, con la formación del carcinoma de células escamosas, es lo habitual. Pero cualquiera de los tejidos presentes puede malignizar; se han descrito melanomas, tumores carcinoides, tiroideos, leiomiosarcomas, adenocarcinomas intestinales, etc.
La presencia de más de un elemento maligno indica que se trata de un teratoma inmaduro y no de un teratoma maduro con malignización posterior.
CASO CLÍNICO
Paciente de 56 años, menopáusica desde los 55 años, derivada para valorar un posible quiste anexial derecho detectado por ecografía de control, sin sintomatología acompañante. Como antecedentes de interés destaca la realización de una colecistectomía perlaparoscópica 6 meses antes.
En la exploración se encontró una tumoración abdominal de consistencia blanda. La ecografía transvaginal confirmó la presencia de una tumoración anexial derecha muy heterogénea, de unos 14 cm de diámetro, sólido-quística, con papilas y un tabique grueso en su interior, y ascitis leve.
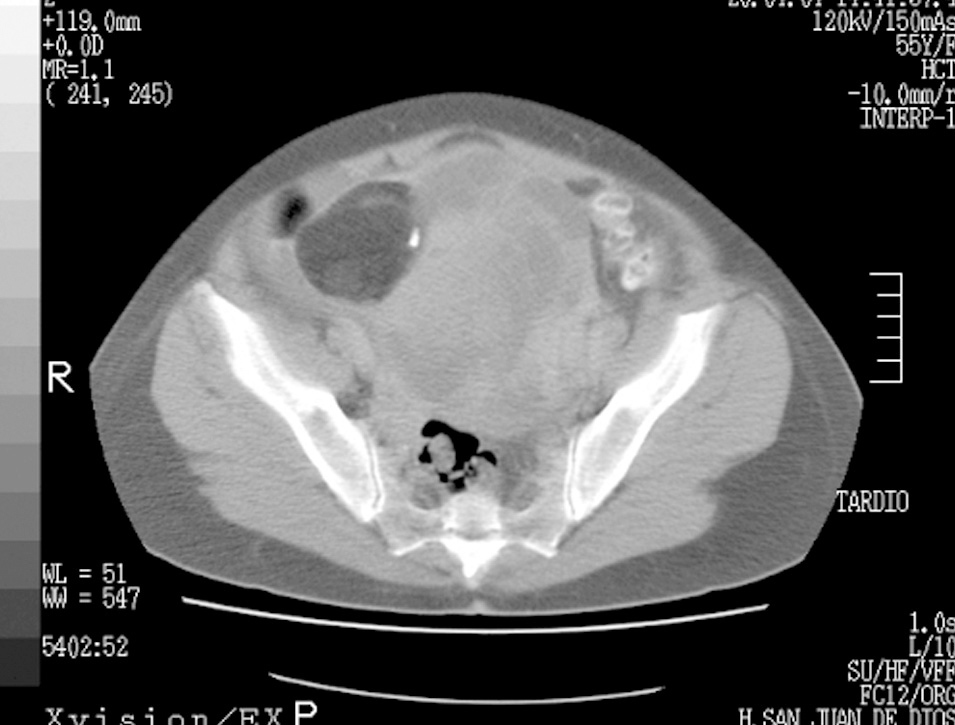
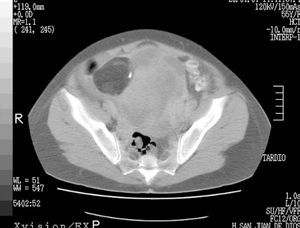
Los marcadores tumorales CA 125 y CA 19.9 presentaban valores séricos elevados, de 216 Kuarb/ml y 42,89 U/ml, respectivamente. La β-HCG, la alfafetoproteína y el antígeno carcinoembrionario (CEA) eran normales. Se completó el estudio con una tomografía computarizada (TC) abdominopélvica que confirmó el hallazgo ecográfico (fig. 1). Se realizó la cirugía estándar del cáncer de ovario con biopsia intraoperatoria.
Figura 1. Tomografía computarizada abdominopélvica. Obsérvese el componente teratomatoso del tumor.
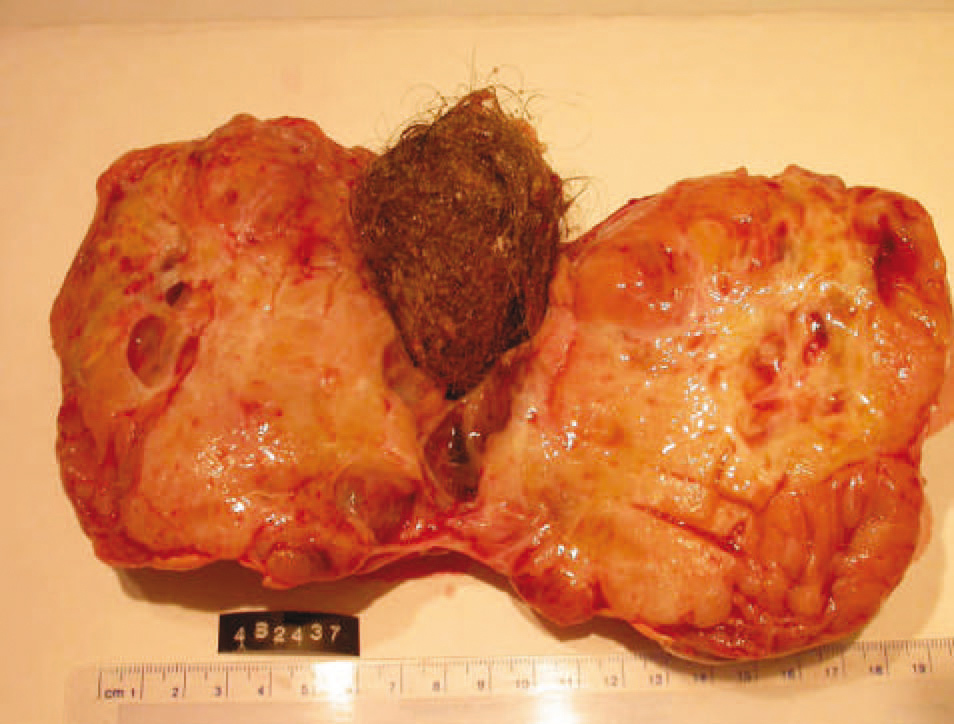
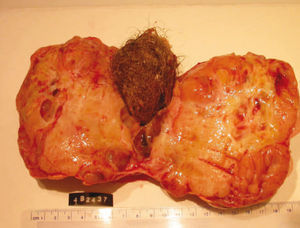
El informe anatomopatológico describió una tumoración quística de 1.028 g y 16 × 16 × 9 cm. Macroscópicamente se trataba de una masa polilobulada, aparentemente encapsulada. A la apertura aparecían 2 patrones morfológicos. En la periferia había una formación ovoide subcapsular de contenido pilosebáceo de 5 × 3,5 cm, alrededor de la que se disponía tejido carnoso, rosado y amarillento, mamelonado, con múltiples formaciones quísticas de contenido seroso filante y áreas de necrosis mal delimitadas (fig. 2).
Figura 2.Aspecto macroscópico de la tumoración. Obsérvese el componente teratomatoso en el centro (flecha) y el adenocarcinoma mesonefroide en la periferia (flecha).
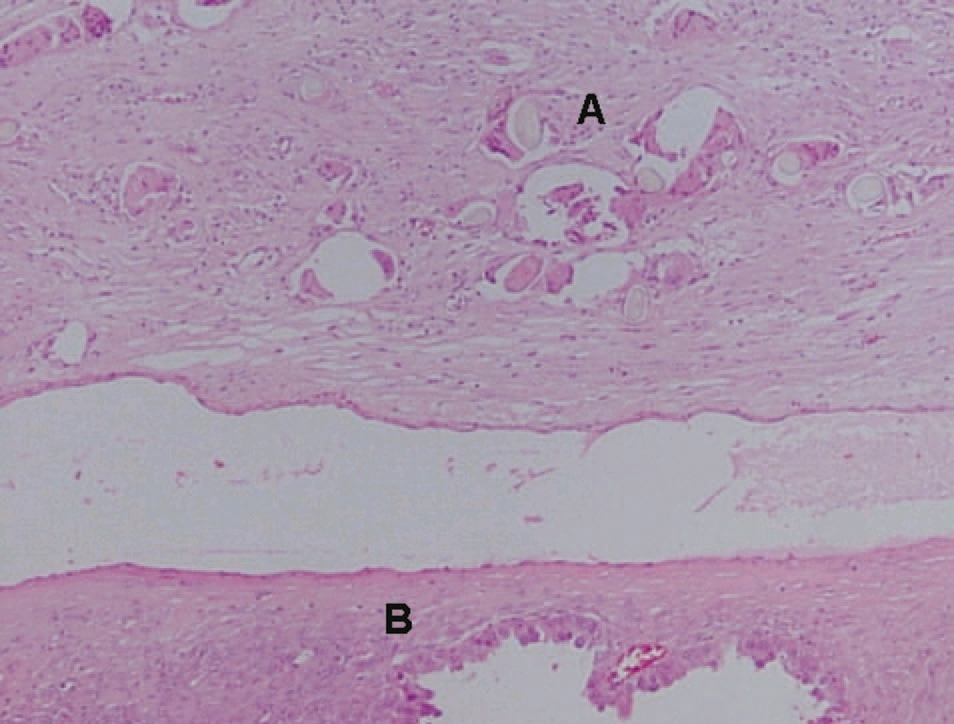
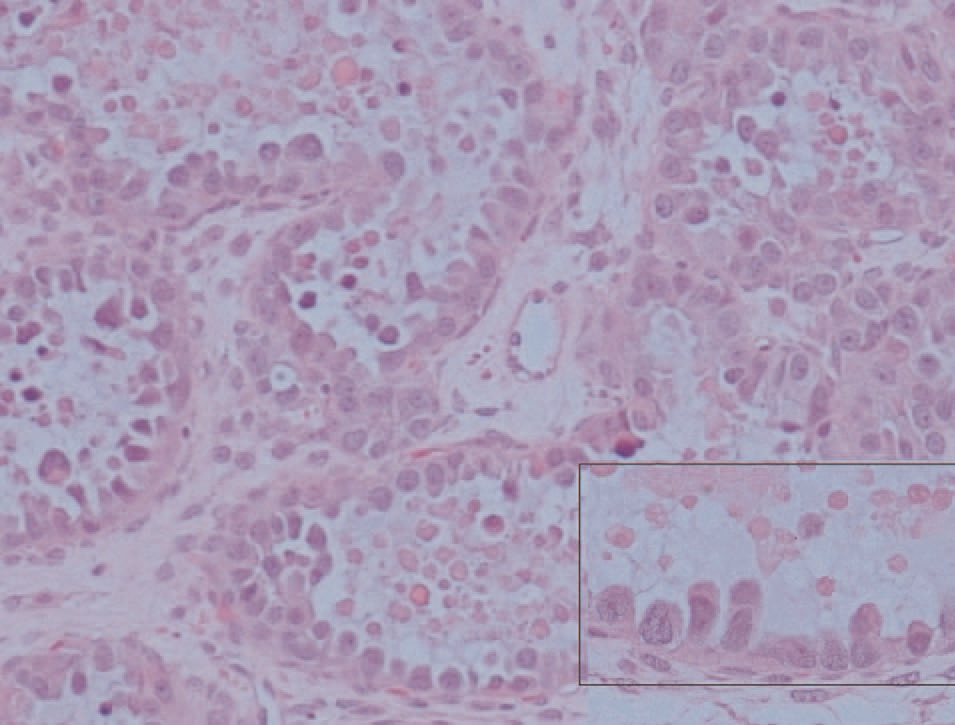
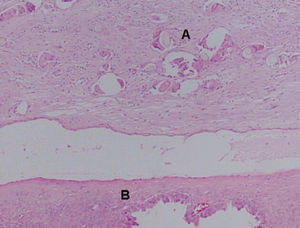
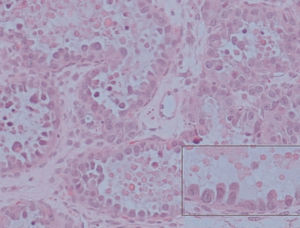
El estudio microscópico mostró, en la pared de la formación quística repleta de pelos, epitelio maduro de tipo escamoso queratinizado, con anejos cutáneos y fenómenos periféricos de reacción granulomatosa estromal a cuerpo extraño. No se identificaron otros tipos de tejidos maduros ni inmaduros, por lo que esta zona constituye un teratoma quístico maduro (fig. 3). El tejido carnoso que conformaba el resto de la tumoración presentaba histológicamente un crecimiento neoplásico de patrón tubuloquístico constituido por estructuras glandulares tapizadas por hileras de células cilíndricas o poligonales, intensamente atípicas, de citoplasma acidófilo, con frecuentes formas mitóticas que sólo ocasionalmente tenían citoplasma óptimamente vacío, y que adoptaban una típica disposición en «tachuela», característica de las neoplasias ováricas mesonefroides (fig. 4). En la luz de estas neoglándulas existían secreciones globulares eosinófilas PAS positivas. El estroma interglandular era escaso y sin atipias. No se observó endometriosis ni focos de carcinoma endometrioide. La cápsula tumoral estaba claramente infiltrada por esta neoplasia.
Figura 3. Microfotografía donde se observan tallos pilosos cortados perpendicularmente y rodeados de células gigantes multinucleadas de cuerpo extraño (A) y adenocarcinoma mesonefroide subyacente (B).Figura 4. Neoglándulas con epitelio monoseriado y secreción globular eosinófila. En el recuadro se observa con detalle la disposición «en tachuela» de las células neoplásicas con gran atipia citológica.
El anejo contralateral, el útero, la trompa derecha, los 12 ganglios linfáticos, el apéndice ileocecal y el epiplón no evidenciaban malignidad. El líquido ascítico presentaba células tumorales, por lo que clasificó en estadio IIc de la FIGO6.
CONCLUSIONES
Exponemos el caso de una paciente posmenopáusica con una tumoración ovárica que sugiere malignidad desde el diagnóstico inicial y que se presenta clínicamente de manera asintomática y como hallazgo casual, como la mayoría de los cánceres de ovario. El tamaño, su rápido crecimiento y la presencia de ascitis orientan en un principio hacia un carcinoma epitelial, lo que apoya la elevación de los marcadores tumorales CA 19.9 y CA 125. Sin embargo, aunque las pruebas de imagen también sugieren malignidad, describen la masa como de características teratomatosas.
Tras recibir el informe anatomopatológico es la coexistencia de estos 2 tumores de estirpe tan distinta en un mismo ovario lo que convierte el caso en excepcional. Puede tratarse de una simple coincidencia, pero se nos plantean otras posibles hipótesis.
Los teratomas, dado su origen pluripotencial, pueden malignizar y transformarse en otras estirpes tumorales en un 1-2% de los casos, casi siempre en pacientes posmenopáusicas, generalmente en carcinoma escamoso, aunque con menor frecuencia se han descrito otras variedades tumorales, tales como sarcomas, melanomas, adenocarcinomas intestinales, etc. Sin embargo, no encontramos relación histológica alguna entre el teratoma y el adenocarcinoma de células claras.
En cambio, la transformación en adenocarcinoma de células claras es relativamente frecuente a partir de lesiones endometriósicas; se ha descrito hasta en un 25% de los casos.
El correcto diagnóstico histológico del caso se lleva a cabo una vez realizado un estudio inmunohistoquímico del patrón de adenocarcinoma para reforzar el diagnóstico diferencial con neoplasias epiteliales metastásicas (estómago y riñón) y otras neoplasias germinales malignas (carcinoma embrionario, tumor del seno endodérmico). Evidencia positividad de las células neoplásicas para citoqueratina 7, CEA y CD15, y es negativa para citoqueratina 20 y vimentina. El carcinoma de células renales es negativo para citoqueratina 7 y positivo para vimentina y citoqueratina 20, mientras que el adenocarcinoma gástrico es negativo para CD15. En el caso del tumor del seno endodérmico, las características histológicas de este caso son suficientes para la diferenciación.
Más del 80% de las células neoplásicas evidencian el marcador de proliferación nuclear Ki 67 (MIB-1), en concordancia con el alto grado de malignidad histológica observado.
El tratamiento de los carcinomas epiteliales de ovario, entre los que se incluye el subtipo de células claras, es inicialmente quirúrgico, aunque a diferencia de las otras variantes este tumor se caracteriza por su elevada resistencia a la quimioterapia habitual con cisplatino.
INFORMACIÓN
V CURSO IAN DONALD INTER-UNIVERSITY SCHOOL.
«NUEVOS DESARROLLOS EN ECOGRAFÍA OBSTÉTRICO-GINECOLÓGICA»
Directores: José M.ª Carrera, A. Kurjak
Fecha: 20 a 22 de septiembre de 2007
Lugar de celebración: Auditorio AXA Winterthur. Sala 1. Déu i Mata, 111. Puerta Giratoria. 08029 Barcelona
34 SYMPOSIUM INTERNACIONAL «AVANCES Y CONTROVERSIAS EN GINECOLOGÍA ONCOLÓGICA»
Presidente: S. Dexeus
Directores: R. Fabregas, R. Labastida
Fecha: 28, 29 y 30 de noviembre de 2007
Lugar de celebración: Auditorio Winterthur. Avda. Diagonal, 547. 08009 Barcelona
III JORNADA DE ENFERMERÍA EN GINECOLOGÍA
Directora: Montserrat García
Fecha: 29 de noviembre de 2007
Lugar de celebración: Auditorio Winterthur. Avda. Diagonal, 547. 08009 Barcelona
INFORMACIÓN GENERAL:
Fundació Santiago Dexeus Font
Sra. Isabel Rodríguez
Coordinadora de Cursos de Formación
Gran Vía Carles III, 71-75
08017 Barcelona
Tel.: 34 932 27 47 09
Fax: 34 934 17 02 98
Correo electrónico: cursos@dexeus.com
Web: www.dexeus.com
Correspondencia:
Dra. H. Millán Cantero.
Departamento de Ginecología. Hospital San Juan de Dios del Aljarafe.
Avda. San Juan de Dios, s/n Bormujos. Sevilla. España.
Correo electrónico: hmillán@aljarafebetica.sanjuandedios-oh
Fecha de recepción: 24/11/2005.
Aceptado para su publicación: 14/3/2007.