INTRODUCCIÓN
El tamoxifeno (TMX) es un SERM (modulador selectivo del receptor de estrógeno) de primera generación, agente antiestrógeno no esteroideo con efecto estrogénico leve sobre la vagina y el endometrio. El término SERM hace referencia a que una molécula estrogénica determinada, gracias a la existencia de 2 isoformas del receptor estrogénico y a un intricado mecanismo íntimo de acción, puede tener un efecto agonista en un tejido u órgano concreto mientras actúa como antagonista en otra área tisular distinta. Asimismo, el TMX posee efecto agonista sobre el hueso y los vasos arteriales.
Se usa ampliamente en el tratamiento hormonal adyuvante del cáncer de mama, su empleo se cifra en más de 10 millones de mujeres/año de uso como agente antineoplásico sumamente útil, aunque actualmente está siendo desplazado por los inhibidores de la aromatasa. La FDA (Food and Drug Administration) lo ha aprobado en las siguientes indicaciones:
Tratamiento adyuvante del cáncer de mama.
Cáncer de mama metastásico.
Reducir la incidencia del cáncer de mama en mujeres de alto riesgo.
A dosis de 20 mg/día puede estar asociado con proliferación endometrial, hiperplasia, formación de pólipos y carcinoma invasivo.
Una serie de estudios han encontrado un riesgo relativo incrementado para desarrollar cáncer de endometrio de 2 a 3 veces más elevado, para una determinada edad1-3.
El nivel de riesgo es dependiente de la dosis y, para algunos autores, también del tiempo4. Los adenocarcinomas que aparecen con 20 mg no difieren de los de la población general en cuanto a estadio, grado, tipo histológico y biología2,5, pero con 40 mg los tumores son más agresivos6. Según el NSABP (National Surgical Adjuvant Breast and Bowel Project), la sobrevida a los 5 años en el cáncer de mama, libre de enfermedad, es un 38% más alta en el grupo TMX que en el placebo2. La aparición de cáncer de endometrio con 20 mg de TMX es de 1,6/1.000 y con placebo de 0,2/1.000 pacientes/año.
Se estudia la asociación del tratamiento con TMX y el cáncer de endometrio porque los datos apoyan el papel preventivo del TMX en las mujeres con riesgo de desarrollar cáncer de mama. El ensayo preventivo (P1) del NSABP, sugiere que tanto el cáncer invasivo como el no invasivo se reduce marcadamente con el tratamiento profiláctico con TMX. Y el riesgo relativo de desarrollar cáncer de endometrio es de 2,53 comparado con las mujeres que reciben placebo7.
El gold-standard para el diagnóstico de patología endometrial es establecer un diagnóstico anatomopatológico mediante biopsia con sonda de Novak o Cornier o bien mediante biopsia dirigida por histeroscopia.
Otros métodos de diagnóstico serían la histeroscopia, la ecografía y la histerosonografía.
Se han publicado numerosos protocolos sobre el manejo y seguimiento de las pacientes tratadas con TMX con el objeto de realizar un control y diagnóstico precoz de patología endometrial maligna.
Existe gran controversia sobre el seguimiento ideal a seguir. Muchos de los protocolos publicados someten a la mujer a pruebas molestas e invasivas, no siempre justificadas a la luz de la evidencia científica actual.
Este trabajo tiene la finalidad de aportar nuestra experiencia en el tema y nuestra conducta de prevención de patología endometrial maligna en la mujer en tratamiento con TMX.
PACIENTES Y MÉTODOS
En este artículo se muestra una descripción de la actividad de nuestra consulta de ginecología del hospital Nuestra Sra. de Aranzazu de San Sebastián, en pacientes con cáncer de mama y en tratamiento hormonal adyuvante.
Entre 1996 y 1999 se han practicado 247 histeroscopias a 188 pacientes con cáncer de mama tratadas con 20 mg/día de TMX. En 43 mujeres se repitió 2 veces la histeroscopia, en 5 se repitió 3 veces y en 1 se repitió más de 3 veces.
Las histeroscopias se practicaron hasta el año 1999 con un histeroscopio Hamou 1 de Storz (Tutinglen. Alemania) con distensión de gas, controlada con histeroflátor de Storz o con un histeroscopio Olympus de 5,5 mm, de flujo continuo, con suero fisiológico como medio distensor. Desde el año 1999, se empleó únicamente el histeroscopio de flujo continuo.
Se muestran los diagnósticos formulados por histeroscopia y se correlacionan con los obtenidos tras biopsia obtenida con Novak, Cornier, dirigida por histeroscopia con flujo continuo, polipectomía histeroscópica con tijeras o bien con resector, según cada caso.
Las histeroscopias que no se pudieron realizar en consulta, principalmente por dolor, se realizaron en quirófano con anestesia general.
La proliferación endometrial que provoca el TMX tiene unas caraterísticas. El endometrio normal en la paciente que consume TMX en la menopausia es atrófico con quistes, que no es más que una atrofia quística exagerada, aunque los quistes también se ven en canal endocervical. Se define el pólipo como una tumoración sesil o pediculada dentro de la cavidad uterina con características similares del endometrio circundante. El mioma es una tumoración redondeada con vascularización aumentada y con las características de un mioma uterino. La hiperplasia endometrial es todo crecimiento anormal del endometrio que se acompañe de diversos grados y combinaciones de desorden arquitectural, estratificación y atipia epitelial. Para la descripción de la hiperplasia y del cáncer nos basamos en las descripciones histeroscópicas de Labastida8.
RESULTADOS
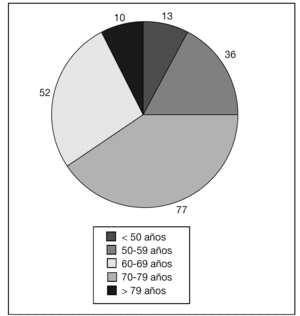
La mayoría de las pacientes eran posmenopáusicas, la distribución por edades del estudio se refleja en la tabla 1 y en la figura 1.
Figura 1. Distribución por edades.
La indicación de la histeroscopia fue mayoritariamente por control de cavidad endometrial en mujer en tratamiento con TMX (111 mujeres, 44,9%) o por línea endometrial (LE) engrosada en la ecografía (91 mujeres, 36,8%). Un 7,2% (18 pacientes) de las histeroscopias se hicieron por metrorragias, indicación que se consideró importante y que se quiere resaltar (tabla 2). A otro grupo de mujeres se les realizó una histeroscopia por control de patología endometrial previa diagnosticada por histeroscopia.
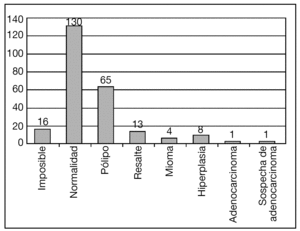
El diagnóstico histeroscópico fue el que se realizó endoscópicamente, es decir, exclusivamente el que se emitió con la visión endoscópica sin conocer el resultado de la biopsia que se tomaba (tabla 3 y fig. 2). Éste fue de normalidad en 139 (56,2%) casos, de pólipo en 65 (23,3%), se diagnosticó 1 adenocarcinoma, 1 sospecha de adencocarcinoma y 8 hiperplasias. El endometrio normal comprende la atrofia y la atrofia quística.
Figura 2. Diagnóstico histeroscópico.
Se realizaron un total de 132 biopsias. No en todas las mujeres se obtuvo endometrio para biopsia, debido a que en los endometrios atróficos no era posible obtenerla. La forma de realizar la toma de biopsia fue diferente según cada caso particular (tabla 4). El diagnóstico anatomopatológico fue insuficiente en 46 casos. Este resultado tiene la misma explicación que ya se ha comentado; se trata de endometrios atróficos donde no es posible obtener muestra histológica o, al intentar extraerla, se obtiene una mínima cantidad de tejido que no hace posible realizar un estudio histológico. En 3 casos dieron un resultado histológico de endometrio activo, en 19 de atrofia, en 48 de pólipo, en 7 de hiperplasia simple, en 1 de hiperplasia compleja, en 3 de hiperplasia con atipias, en 3 nos encontramos con cánceres y en 2 el diagnóstico fue de otro. En la tabla 5 se muestra la correlación de los resultados anatomopatológicos con los diagnósticos histeroscópicos. Destaca la escasa correlación en el diagnóstico histeroscópico de hiperplasias.
Los diagnósticos histológicos de los 65 pólipos visualizados por histeroscopia se presentan en la tabla 6.
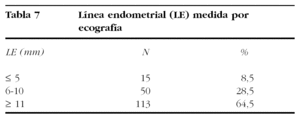
Sólo en 43 casos, el diagnóstico histológico fue también de pólipo. Este suceso se explica porque el concepto histológico de pólipo implica la existencia de un eje vascular conectivo, mientras que histeroscópicamente se diagnostica como pólipo endometrial a toda tumoración sesil o pediculada dentro de la cavidad uterina con características similares del endometrio circundante. La LE medida por ecografía vaginal estaba disponible en 175 pacientes; en 13 pacientes no se dispone de este dato. La mayoría de estas pacientes presentaba una LE engrosada (tabla 7).
DISCUSIÓN
Un elevado número de pacientes posmenopáusicas en tratamiento con TMX presenta un incremento de la LE, lo que hace difícil el control de patología endometrial por ecografía. De hecho, la media del grosor de la LE se sitúa por encima de 11 mm en la mayoría de trabajos publicados, y no existe una correlación lineal entre el grosor endometrial y la duración del tratamiento con TMX9, aunque no todos los autores están de acuerdo. Love et al4 refieren una correlación positiva entre la duración del tratamiento con TMX y el grosor endometrial. Se han publicado artículos que hablan del incremento de riesgo de presentar patología en mujeres posmenopáusicas en tratamiento con TMX que tienen un aumento de la LE medida por ecografía vaginal10. Para algunos autores9 han de realizarse pruebas invasivas cuando la LE es mayor de 8 mm, incluso en mujeres asintomáticas. Estos mismos autores aconsejan realizar de 1 a 3 ecografías vaginales anuales y durante años, una vez concluido el tratamiento. Para Fong et al11, una cifra de 6 mm es el límite máximo para descartar anomalías endometriales, por encima de ésta recomiendan realizar una histerosonografía para aumentar la especificidad. La ecografía tiene un pobre valor predictivo positivo, pero un alto valor predictivo negativo para detectar enfermedad endometrial en mujeres posmenopáusicas asintomáticas12.
Se ha publicado una gran cantidad de falsos positivos4 de la ecografía vaginal para descartar patología endometrial en mujeres en tratamiento con TMX. Algunos autores13 creen que la ecografía puede no ser recomendable como método de cribado en estas pacientes, incluso en las pacientes en las que se repiten varios episodios de metrorragia ya vigilados, porque este suceso, una vez descartada la patología endometrial, es debida, posiblemente, a atrofia quística.
La conducta a seguir en estas pacientes no está clara. Giorda et al14 recomiendan realizar una histeroscopia al principio del tratamiento y repetirla a los 24 meses si es normal; Vosse et al15 recomiendan una ecografía al comenzar el tratamiento con TMX y, si es normal, repetir la ecografía anualmente a partir del tercer año de tratamiento; otros autores16 proponen realizar biopsia endometrial siempre que la LE sea mayor de 9 mm o si el tratamiento es superior a 2 años.
Se han publicado numerosos protocolos para el cribado de adenocarcinoma de endometrio en mujeres en tratamiento basándose en ecografía, y más recientemente se ha añadido la posibilidad de hacer una histerosonografía y pruebas invasivas, como la histeroscopia, con la posibilidad de obtener biopsias dirigidas. La ecografía no ha demostrado ser eficaz como prueba de cribado y no se ha evaluado todo el gasto económico y en sufrimiento para la paciente a la que genera su gran cantidad de falsos positivos.
Si no está admitido el cribado poblacional para el diagnóstico precoz del adenocarcinoma de endometrio en mujeres menopáusicas con endometrio normal, ¿es posible diagnosticar precozmente, en fase asintomática, el adenocarcinoma de endometrio en mujeres en tratamiento con TMX, que por este motivo ya tienen un endometrio normalmente anómalo?
Además, se sabe que la hiperplasia no necesariamente tiene que preceder o acompañar al cáncer de endometrio en mujeres asintomáticas posmenopáusicas. Algunos de estos cánceres, o quizá la mayoría, no son precedidos por hiperplasia sino que se originan en el endometrio de novo17,18.
Las recomendaciones del American College of Gynaecologists and Obstetricians (ACOG) son19:
Control de la paciente una vez al año como mínimo.
Advertir de los síntomas de la hiperplasia y/o del adenocarcinoma: metrorragia, spotting, manchado y leucorrea.
Ante la sintomatología descrita anteriormente: revisión médica.
No se recomienda emplear métodos de cribado porque no son efectivos y conllevan métodos más invasivos y costosos.
El TMX debería estar limitado a 5 años, por encima de ese tiempo los beneficios no se han documentado bien.
Si aparece una hiperplasia atípica, el TMX se debe suspender, y si debe de continuar, hay que realizar una histerectomía.
Posteriormente, el ACOG publicó unas recomendaciones adicionales20:
Nuevos datos sugieren que es posible identificar a las pacientes con cáncer de mama que tomando TMX pueden tener alto y bajo riesgo de desarrollar hiperplasia atípica, en función de la presencia o ausencia de pólipos endometriales benignos antes de comenzar el tratamiento con TMX.
En las que se han resecado pólipos endometriales antes de comenzar el tratamiento con TMX el riesgo es 18 veces mayor (el 11,7 frente al 0,7%) que las que no tenían lesión.
En nuestro servicio se ha adoptado la siguiente conducta en la paciente posmenopáusica (tabla 8): se le advierte que tiene un riesgo incrementado de 2 a 3 veces de presentar un adenocarcinoma de endometrio y que acuda a su ginecólogo si tiene spotting, metrorragia... Se le realiza una ecografía con sonda vaginal y biopsia con cánula de Cornier antes de comenzar el tratamiento con TMX, si es normal, se adoptará una actitud expectante con controles clínicos anuales; si existe alguna patología, se realizará una histeroscopia. En caso de tratarse de mujeres que habían desarrollado pólipos antes de haber iniciado el tratamiento con TMX, se les recomienda control histeroscópico anual. Si durante la vigilancia existe spotting, manchado o metrorragia de cualquier tipo, se realiza una histeroscopia. No se realizan histeroscopias a mujeres asintomáticas.
CONCLUSIONES
A la luz de lo publicado en la bibliografía actual, persisten notables diferencias en la conducta a seguir en el control y prevención de patología endometrial maligna y premaligna en pacientes en tratamiento con TMX.
En nuestra experiencia, y acorde con otros autores, no es necesario realizar pruebas invasivas para su control, debido a que no es coste-efectivo y, principalmente, al sufrimiento y angustia que genera a la paciente. Tampoco encontramos efectiva la ecografía como método de cribado en mujeres asintomáticas, por su elevado número de falsos positivos, pero sí un seguimiento clínico estricto e histeroscopia con biopsia dirigida en caso de presentarse clínica (metrorragia, spotting, manchado o leucorrea). Asimismo, y de acuerdo con las recomendaciones de la ACOG, es recomendable realizar una ecografía antes de iniciar el tratamiento e histeroscopia en caso de sospechar patología endometrial. Asimismo es recomendable realizar un control histeroscópico anual en pacientes catalogadas como de alto riesgo, que se definen como las pacientes que tienen pólipos endometriales antes de iniciar el tratamiento y, por tanto, presentan un riesgo más elevado de desarrollar patología endometrial maligna y premaligna.
Es necesario un estudio aleatorizado de mujeres monitorizadas con ecografía como método de vigilancia e histeroscopia en el caso de sospecha de patología, frente a mujeres con seguimiento clínico e histeroscopia si presentan clínica, que incluya un número suficiente de pacientes para arrojar conclusiones estadísticamente significativas.