La diabetes insípida (DI) es una rara complicación endocrinológica de la gestación. Clásicamente se describen 2 tipos de DI (central y nefrogénica). Sin embargo, en la gestación se ha descrito un tipo específico denominado DI transitoria o DI gestacional. Esta entidad aparece sobre todo en el tercer trimestre del embarazo y se resuelve espontáneamente entre la primera y cuarta semana del posparto. La fisiopatología de la DI gestacional tiene un origen placentario, siendo los niveles excesivos de vasopresinasa placentaria los que dan lugar a un catabolismo excesivo de vasopresina y secundariamente al síndrome de polidipsia-poliuria en la gestante. Ante la sospecha clínica es preceptivo el despistaje de DI subclínicas pregestacionales (centrales o nefrogénicas) o transitorias de la gestación. El diagnóstico es sencillo y el tratamiento con acetato de desmopresina disminuye significativamente los riesgos maternofetales de esta patología. Asimismo, es necesario descartar otras patologías frecuentemente asociadas (preeclampsia, síndrome HELLP, disfunción hepática) y mantener un estricto control fetal por el riesgo de retraso de crecimiento intrauterino secundario a disfunción placentaria.
Diabetes insipidus (DI) is a rare endocrine complication of pregnancy. Traditionally, DI has been considered to be either central or nephrogenic. However, in pregnancy, a specific type has been described: transient DI or gestational DI. This entity occurs mainly in the third trimester of pregnancy and resolves spontaneously between the first and fourth week after delivery. The physiopathology of gestational DI has a placental origin, with excessive levels of placental vasopressinase leading to excessive catabolism of vasopressin and secondarily to polydipsia-polyuria syndrome in the pregnant woman. Screening for subclinical pregestational DI (central or nephrogenic) or transient gestation is mandatory whenever this entity is suspected clinically. Diagnosis is simple and treatment with desmopressin acetate significantly decreases the maternal and fetal risks of this disease. It is also necessary to exclude other frequently associated disorders (preeclampsia, HELLP syndrome, liver dysfunction) and to carry out close fetal monitoring, because of the risk of intrauterine growth retardation secondary to placental dysfunction.
La primera comunicación del síndrome polidipsia-poliuria en la gestación se realizó en 19421. Es una complicación poco frecuente y a menudo infradiagnosticada. Se estima una incidencia de un caso por 30.000 embarazos2. Se define como un cuadro clínico de polidipsia y poliuria hipotónica que puede conducir a deshidratación con hipernatremia y alteraciones neurológicas secundarias.
Fisiología del metabolismo del aguaLa vasopresina (VSP), también llamada hormona antidiurética, es fundamental en la homeostasis hídrica. Se sintetiza en los cuerpos neuronales de los núcleos supraópticos y paraventriculares del hipotálamo, y se transporta vía axónica en forma de prohormona, unida a la neurofisina ii hasta la neurohipófisis. Desde aquí se libera «libre» a la circulación general. La VSP es secretada por exocitosis. El principal estímulo para la secreción es la elevación de la osmolaridad plasmática, que estimula osmorreceptores hipotalámicos. Pequeños incrementos (1%) de la osmolaridad plasmática estimulan la secreción de VSP. Otros estímulos para la liberación hormonal son los cambios de volumen plasmático (mediante receptores distensión de la aurícula izquierda) y receptores (V1) de presión o barométricos localizados en la pared vascular del seno carotídeo y cayado aórtico, pero con un umbral de respuesta más alto que los osmorreceptores. El centro de la sed situado en el área hipotalámica lateral responde a incrementos mayores de osmolaridad plasmática (5-10%) estimulando la ingesta hídrica.
El órgano diana de la VSP es el riñón. La hormona se une al receptor V2 del túbulo colector, activándose la adenilciclasa, que estimula una proteincinasa intracelular para fijar las vesículas citoplasmáticas a la membrana luminar. Estas vesículas contienen la proteína «acuaporina 2» (canales del agua), que originan el paso de agua libre al interior de las células ductales, lo que permite la concentración de la orina2,3.
Cambios fisiológicos del metabolismo hídrico en la gestaciónEn la gestante hay una situación de hiperhidratación, la osmolaridad plasmática disminuye 8-10mOsm/kg y hay una hiponatremia leve (el Na+ sérico disminuye 3-5mmol/L). Asimismo, hay cambios en la osmorregulación. El umbral osmótico plasmático que estimula la secreción de VSP y el centro de la sed está también disminuido. En la gestación normal está aumentada la secreción hipofisaria de VSP; sin embargo el nivel plasmático se mantiene igual que en la no gestante. El motivo es un mecanismo de equilibrio; ya que, por un lado, aumenta la secreción, pero paralelamente hay un aumento del catabolismo por acción de la enzima «vasopresinasa placentaria» y un incremento de la resistencia renal a la VSP por la PGE22,4. La vasopresinasa (sintetizada en la placenta) aumenta gradualmente desde la 8.a semana de gestación, alcanzando máximo nivel en el tercer trimestre. Disminuye un 25% en el 1.er día posparto, siendo indetectable entre la 2.a-4.a semana puerperal.
Subtipos de diabetes insípida en gestantes- 1.
Diabetes insípida central (DIC) preexistente conocida o subclínica con comienzo en gestación. Está bien documentado en la literatura el desarrollo normal del embarazo y parto en pacientes diagnosticadas y tratadas preconcepcionalmente de DIC, si bien requieren un control estricto y posible ajuste de la dosis en el tratamiento. Por otro lado, existe un subgrupo de pacientes con DIC parcial-subclínica que no han precisado tratamiento ni han presentado síntomas clínicos antes de la gestación; sin embargo, pueden comenzar con un síndrome de polidipsia-poliuria en el embarazo, ya que la vasopresinasa placentaria puede alterar una reserva ya disminuida de VSP. El inicio de la clínica puede acontecer en cualquier trimestre de la gestación y ser recurrente en gestaciones posteriores. El tratamiento de elección es el acetato de desmopresina, que es un análogo de la VSP que no se degrada por la vasopresinasa. La etiología de la DIC es variada (tumores hipotálamo-hipofisarios, procesos infiltrativos, traumatismos, neurocirugía, formas familiares e idiopáticas). Estos procesos originan una disminución total o parcial de la secreción central de VSP2.
- 2.
La diabetes insípida nefrogénica. En este subtipo hay una secreción central normal de VSP, pero una resistencia renal a su acción. Hay formas hereditarias por diversas mutaciones génicas que afectan a los receptores V2, enfermedades renales congénitas como la poliquistosis renal, y por último, formas secundarias a tratamientos con litio, hipokalemia e hipercalcemias crónicas. Se han comunicado raros casos de diabetes insípida nefrogénica en gestantes con resistencia parcial a la VSP. El síndrome se presenta en cualquier trimestre de la gestación y puede ser recurrente. Al haber una resistencia de los receptores a la acción de la VSP tampoco responden al acetato de desmopresina2.
- 3.
Diabetes insípida transitoria o gestacional (DIG). La placenta normalmente secreta pequeñas cantidades de vasopresinasa (cistinaminopeptidasa producida por el trofoblasto) cuyas concentraciones máximas se alcanzan al término de la gestación. Los factores que predisponen a algunas mujeres a concentraciones suficientemente altas de esta enzima para producir DIG son desconocidos. La presentación repentina y la desaparición rápida de los síntomas tras el parto sugieren el diagnóstico de DIG. En este subtipo de diabetes insípida (DI) la secreción central de VSP y su acción renal es normal, pero está incrementada su degradación por un exceso de vasopresinasa. Las concentraciones plasmáticas de esta enzima son proporcionales al volumen placentario, lo que explica que el síndrome clínico comience en el 3.er trimestre5,6, siendo más frecuente en gestaciones múltiples7 y se resuelva en el posparto. Se ha planteado la hipótesis de que una disfunción hepática8 explique el aumento en los niveles de vasopresinasa por disminución del metabolismo hepático. En este sentido, se ha asociado este síndrome con disfunciones hepáticas por hígado graso agudo9, preeclampsia o eclampsia10 y síndrome HELLP11,12. Otra hipótesis13 que relaciona la DIG con la preeclampsia muestra que los productos de la degradación de VSP mantienen su actividad presora, pero pierden su actividad antidiurética.
El diagnóstico de la DI en una gestante, no diagnosticada previamente, debe sospecharse por el cuadro clínico de polidipsia, poliuria y nicturia. Ante la sospecha es obligatorio realizar un control de ingesta/diuresis en 24h, y determinar la osmolaridad en plasma y orina, así como la natremia. Es preciso tener en cuenta la hiponatremia leve fisiológica de la gestación, así como la disminución fisiológica de la osmolaridad plasmática. En la gestante se consideran patológicos niveles de sodio sérico≥140mEq/L y de osmolaridad plasmática>280mOsm/L. La osmolaridad en orina en la DI es menor que la osmolaridad plasmática y generalmente es<300mOsm/kg. La determinación de VSP por radioinmunoanálisis tiene poca utilidad en la gestante, ya que los niveles pueden ser indetectables por la acción de la vasopresinasa o falsamente elevados al cuantificarse fragmentos de VSP inactivos. El test de restricción hídrica no debe realizarse en la gestante por el riesgo de deshidratación e hipernatremia con adversas repercusiones maternofetales. Sin embargo, al diagnóstico de DIG puede confirmarse tras la observación del incremento de la osmolaridad urinaria tras la administración de acetato de desmopresina (resistente a la degradación de la vasopresinasa)14–16.
Caso clínicoPrimigesta de 38 años. Gestación gemelar bicorial/biamniótica mediante inseminación artificial conyugal. Antecedentes familiares de diabetes mellitus tipo 2 (ambos progenitores y un hermano). Antecedentes médicos personales (crisis epiléptica a los 9 años, en tratamiento con acido valproico hasta los 16 años, colon irritable, intolerancia a la lactosa). Antecedentes quirúrgicos (apendicectomizada). No hábitos tóxicos. Curso de embarazo normal hasta tercer trimestre de gestación, controlada en la unidad de alto riesgo obstétrico. Ingreso hospitalario en la semana 27+4 por amenaza de parto prematuro, instaurándose tratamiento con un primer ciclo tocolítico de atosiban por vía intravenosa y maduración fetal completa con betametasona. Los controles analíticos al ingreso (hemograma, bioquímica completa, sistemático de orina y urocultivo) fueron normales, así como el control ecográfico y el registro cardiotocográfico de ambos fetos. Una semana más tarde presenta nueva crisis de dinámica con acortamiento cervical, precisando un segundo ciclo tocolítico y dosis de recuerdo con betametasona. Tras la finalización de la terapia tocolítica se realiza un control analítico completo con los siguientes hallazgos:
- -
1.o Alteración del perfil hepatobiliar: hipertransaminemia con elevación de alanina-aminotransferasa (273U/L), aspartato-aminotransferasa (282U/L), gamma-glutamiltransferasa (54U/L) y fosfatasa alcalina (141U/L).
- -
2.o Lactato deshidrogenasa elevada (737U/L) sin criterios analíticos de hemólisis (hemoglobina normal estable, sin reticulocitos ni esquistocitos en sangre periférica).
- -
3.o Plaquetas y coagulación normal.
- -
4.o Ionograma sérico normal, perfil renal normal. Iones en orina y osmolaridad urinaria normal (779mOsm/kg), proteínas en orina negativas.
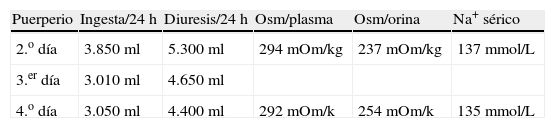
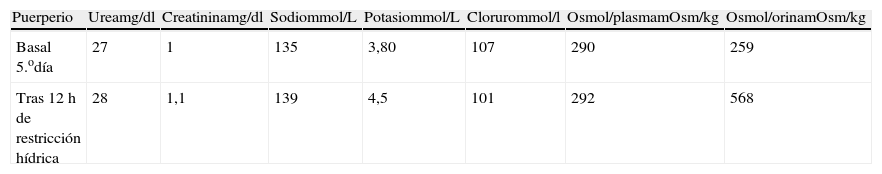
La gestante en todo momento permaneció asintomática (sin ictericia, ni prurito o dolor abdominal). No hipertensión ni proteinuria. Se solicitó interconsulta al Servicio de Aparato Digestivo para estudio de posible hepatopatía subyacente. En dicho estudio se descartaron hepatitis víricas, autoinmunes y déficit de alfa 1 antitripsina. La ecografía abdominal descartó obstrucción de vías biliares y signos de hepatopatía. La paciente permaneció asintomática y persistió la alteración del perfil hepático, manteniendo coagulación normal. Durante el ingreso se realizaron controles seriados de bienestar fetal mediante registro cardiotocográfico externo y controles ecográficos seriados. En la semana 30 de gestación refiere de forma progresiva aumento de sed y nicturia. Se realiza balance de ingesta/diuresis, comprobándose poliuria de 5.490ml en 24h con ingesta de 4.100ml/24h. Ante estos hallazgos se sospecha la posibilidad de DI. La gestación finaliza en la semana 31 mediante cesárea urgente por riesgo de pérdida de bienestar fetal (diagnóstico ecográfico de retraso de crecimiento intrauterino con oligoamnios y doppler patológico, sobre todo en el primer gemelo, que presenta bradicardia mantenida en el registro cardiotocográfico externo). La intervención se realiza sin incidencias. Ambos recién nacidos vivos, de pesos (1.016 y 1.238g), test de Apgar 9/10 en ambos y pH de cordón 7,20 y 7,32 respectivamente. Tras 24h de puerperio se procede al control diario del balance hídrico y determinación de osmolaridad en plasma y orina (tabla 1). La baja osmolaridad de la orina, la poliuria y la polidipsia orientan al diagnóstico de diabetes insípida, probablemente transitoria de la gestación ya que la paciente refiere disminución progresiva de la sed y de la nicturia. Se solicitó valoración al Servicio de Endocrinología que indicó la realización del test de deshidratación (tabla 2). El test comprobó la capacidad de la paciente para concentrar la orina (con osmolaridad urinaria>500mOsm/kg tras 12h de restricción hídrica). En el 8.o día de puerperio la paciente estaba totalmente asintomática, con desaparición completa de la polidipsia, poliuria, y nicturia). Antes del alta hospitalaria se comprobó una mejoría significativa del perfil hepático. A los 3 meses del parto ha sido dada de alta por el servicio de endocrinología por permanecer asintomática con nivel de VSP normal y normalización completa del perfil hepatobiliar. Por tanto, se puede concluir que en el caso que presentamos la gestante desarrolló una DIG, secundaria a la disfunción hepática que presentó en la semana 30 de gestación tras la finalización del 2.o ciclo tocolítico.
La DIG se describe en la literatura como síndrome polidipsia-poliuria de aparición en el 3.er trimestre de la gestación5,6. En nuestra paciente, el cuadro se inició en la semana 30 de gestación. El embarazo gemelar representa una particular predisposición a la DIG por el aumento de la masa placentaria. Asimismo, la gestación múltiple representa un factor de riesgo para la disfunción hepática, la preeclampsia o el síndrome HELLP. En la literatura se describen casos de DIG en gestaciones múltiples7 y/o en asociación con estas patologías gestacionales10–12,17. En nuestro caso, la gestante no presentó preeclampsia (se mantuvo normotensa en todo momento y con proteínas en orina negativas), tampoco presentó criterios analíticos de HELLP (plaquetas normales y sin criterios analíticos de hemólisis). Se descartó una polidipsia psicógena y la diabetes mellitus como origen de la polidipsia-poliuria y se realizó un estudio completo de posibles hepatopatías subyacentes por la alteración del perfil hepatobiliar, siendo completamente negativo.
Se ha descrito la asociación de la DIG con hígado graso agudo9, que es una complicación característica del 3.er trimestre, con clínica de dolor en epigastrio, náuseas, vómitos, ictericia y coagulopatía en el 70% de las gestantes. Nuestra paciente no presentó este tipo de sintomatología y la coagulación fue normal en todo momento. No obstante, nuestra paciente inició el cuadro clínico de DI tras una disfunción hepática constatada por una alteración analítica significativa del perfil hepático, con hipertransaminemia. Barbey et al.8 describen el desarrollo de «novo» de polidipsia-poliuria en una gestante con elevación aislada de enzimas hepáticas. Otros autores constatan una poliuria proporcional al grado de elevación de estas enzimas12.
La relación entre la preeclampsia y la DIG sin alteración hepática es atribuida por algunos autores a una propiedad hipertensiva del extremo C terminal del producto de degradación de la VSP por la vasopresinasa18. Sin embrago, esta explicación no parece ser suficiente ya que no ha podido evidenciarse un incremento en la actividad específica de los receptores17.
La confirmación diagnóstica de la DIG en el caso que presentamos se realizó tras el parto. La finalización de la gestación por el diagnóstico de retraso de crecimiento intrauterino, oligoamnios y doppler patológico motivó la remisión del síndrome polidipsia-poliuria en el puerperio. En la tabla 1 se evidencia en los 3 primeros días puerperales una osmolaridad urinaria muy disminuida e inferior a la del plasma; sin embargo, el sodio plasmático estuvo en rango normal. No se objetivó hipernatremia en ningún momento, manteniendo niveles de Na+<140mEq/L.
Clínicamente la gestante presentó un descenso progresivo de la sed, nicturia y poliuria. En la tabla 1 puede objetivarse un descenso progresivo de la ingesta hídrica y de la diuresis. El test de deshidratación se realizó en el 5.o día del puerperio y nos permitió comprobar la resolución del cuadro. En la tabla 2 se evidencia en el 5.o día puerperal que tras una restricción hídrica de 12h la osmolaridad urinaria fue normal (568mOsm/kg), indicando la capacidad del riñón para concentrar la orina.
Nuestra gestante no presentó deshidratación ni hipernatremia porque tuvo acceso libre a la ingesta hídrica y porque la finalización de la gestación permitió la recuperación de los niveles de VSP por el descenso de la vasopresinasa placentaria. La gestación finalizó por riesgo de pérdida de bienestar fetal, pero, de no existir esta complicación obstétrica, la gestación hubiera seguido su curso, y probablemente el síndrome habría evolucionado con deshidratación e hipernatremia a pesar del acceso libre al agua, si no se hubiera instaurado el tratamiento específico para esta patología. Durante el embarazo, la confirmación diagnóstica no se hubiera realizado con el test de restricción hídrica sino valorando la respuesta de la osmolaridad en orina tras la administración de acetato de desmopresina, por el riesgo maternofetal de la restricción hídrica durante la gestación.
El acetato de desmopresina es un análogo de la VSP que no se degrada por la vasopresinasa placentaria, y que se utiliza no solo como test diagnóstico en la gestación, sino como tratamiento. La DIG no responde a la administración de VSP exógena porque sería rápidamente degradada por la enzima placentaria. El acetato de desmopresina es considerado como fármaco de categoría B en la gestación, actúa de forma selectiva sobre los receptores V2 del túbulo colector, no tiene efecto hipertensor ni estimula la dinámica uterina. Se administra preferentemente vía intranasal por su comodidad de uso y buena absorción. No existe una dosis óptima recomendada, pero un aumento progresivo permite encontrar la dosis mínima eficaz para controlar la nicturia y la poliuria, con una ingesta hídrica de unos 1.000ml/día. En general, se utilizan dosis entre 10 a 20mcg por vía nasal cada 8 a 12h, ajustando la dosis según respuesta. También se puede administrar por otras vías (oral, intravenosa, intramuscular o subcutánea) pero con distintas dosis por presentar diferentes grados de absorción. Ray19 comprueba la seguridad maternofetal del uso de acetato de desmopresina en una amplia serie de gestantes con DI. El tratamiento con acetato de desmopresina es, por tanto, seguro, pero requiere una monitorización rigurosa del Na+ sérico y de la osmolaridad para evitar hiponatremias.
En pacientes con DIC pregestacional conocida, es probable que se necesite una dosis mayor de la habitual, y hay que tenerlo presente para evitar descompensaciones. Gutiérrez y Careaga20 comunican el caso de una paciente en tratamiento pregestacional con acetato de desmopresina intranasal por DIC, embarazo no controlado y tras la supresión del tratamiento acudió a urgencias en el 3.er por un cuadro de DI, dinámica uterina, retraso de crecimiento intrauterino y oligoamnios. Sin embargo, la DI nefrogénica, no responde a la administración de VSP ni al acetato de desmopresina, por lo que se pueden utilizar con extremo cuidado diuréticos como la hidroclorotiazida a dosis<50mg/día (vía oral), con extrema vigilancia por el riesgo de hipovolemia e hipokalemia.
En las gestantes con sospecha de DI es preceptivo realizar un estricto control de bienestar fetal ya que es frecuente el retraso de crecimiento intrauterino y el oligoamnios, sobre todo en pacientes con patologías asociadas (preeclampsia, síndrome HELLP) y en aquellas no diagnosticadas y por tanto no tratadas de DI. Estos resultados fetales adversos están documentados en la literatura21,22. Sin embargo, con diagnóstico y tratamiento adecuado los resultados maternofetales son óptimos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.