Presentamos el caso de una gestante de 8 semanas de amenorrea con implantación del saco gestacional sobre la cicatriz de una cesárea anterior que tras fracaso de tratamiento médico con metotrexato (MTX) se realizó tratamiento quirúrgico mediante laparotomía. Se realiza una revisión y puesta al día sobre la incidencia, los métodos diagnósticos y las diferentes opciones terapéuticas disponibles en la literatura médica a día de hoy.
We present the case of a pregnant woman with an 8-week history of amenorrhea and insertion of a gestational sac over a previous cesarean section scar. Methotrexate treatment was unsuccessful and laparotomy was performed. We provide a literature review and update on the incidence, diagnostic methods and current treatment options of this entity.
El embarazo sobre la cicatriz de una cesárea (CSP) ocurre cuando el blastocisto se implanta sobre la misma y es considerada hoy en día como una complicación tardía de este procedimiento obstétrico cuya frecuencia va en aumento1. Los criterios diagnósticos incluyen: trofoblasto localizado entre la vejiga y la pared uterina anterior, ausencia de partes fetales en la cavidad uterina y, en un corte ecográfico sagital, discontinuidad en el miometrio. El CSP puede causar morbilidad importante en la madre como una hemorragia que pueda poner en peligro la vida de la paciente o una rotura uterina con todas las complicaciones que esto conlleva. Aunque esta complicación obstétrica es todavía rara, con una incidencia de 1:1.800-1:2.216 embarazos2,3, su diagnóstico va en aumento; algunos autores manifiestan que este aumento se ha dado sobre todo en esta última década debido a un crecimiento en la tasa de cesáreas realizadas y un diagnóstico ecográfico más precoz y preciso2,4. Por su baja incidencia no disponemos de ensayos clínicos que nos ayuden a determinar la mejor actitud terapéutica, no habiendo a día de hoy consenso sobre el tratamiento más adecuado. Algunos autores aconsejan el uso de MTX intrasacular con o sin tratamiento sistémico coadyuvante5, otros optan por cirugía transvaginal o transabdominal que incluye resección del tejido gestacional y fibrótico y reparación del útero3,6.
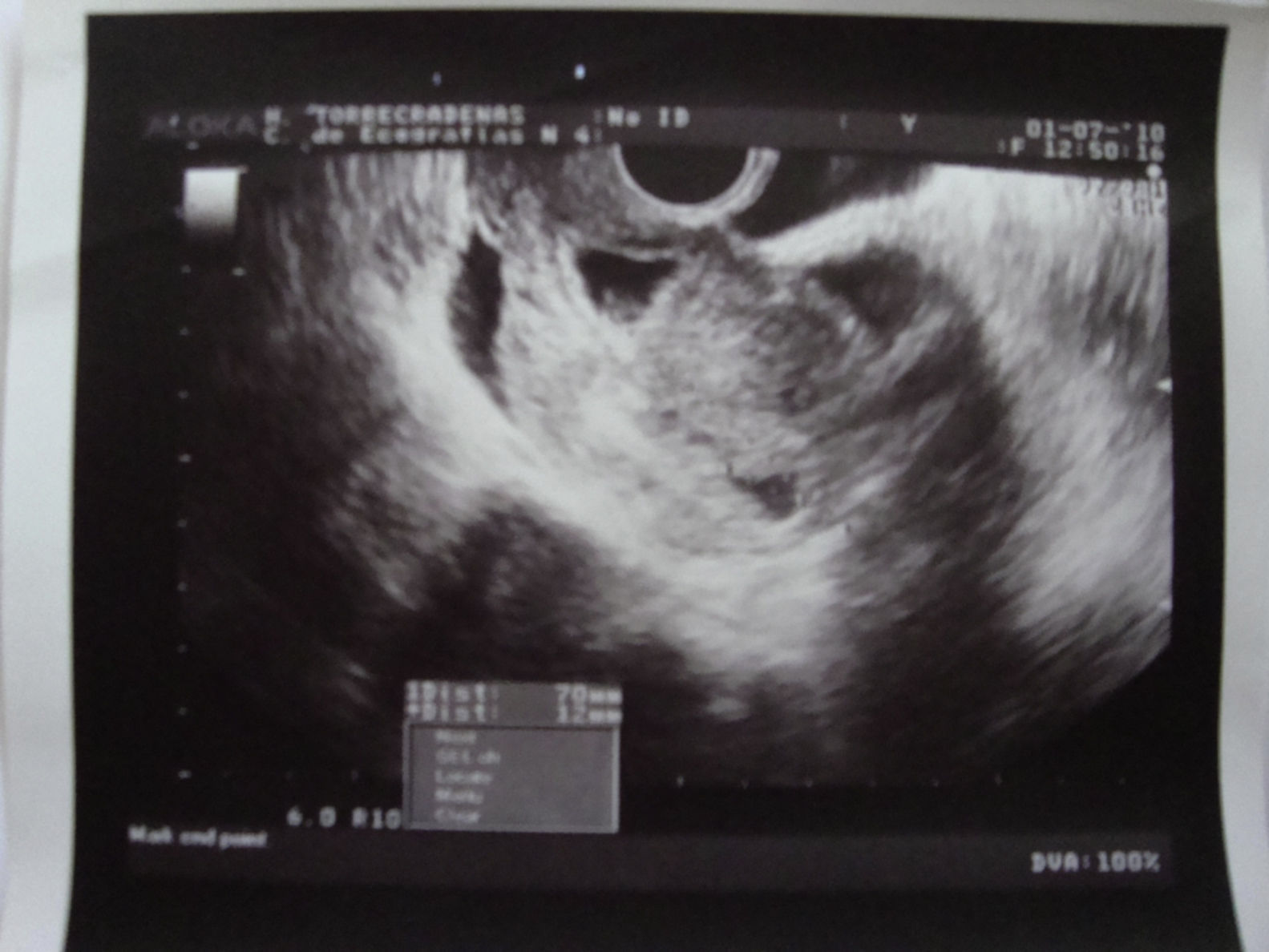
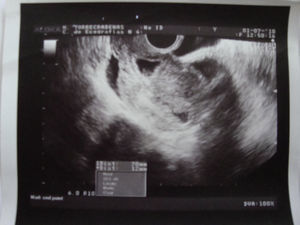
Descripción del casoPresentamos el caso de una paciente de 23 años que fue atendida en urgencias de tocoginecología de nuestro hospital por metrorragia del primer trimestre. En sus antecedentes obstétricos encontramos 2 embarazos anteriores: uno finalizó mediante legrado por aborto diferido y otro que terminó mediante cesárea por no progresión de parto en 2005 cuyo puerperio transcurrió con normalidad; no presentaba otro antecedente de interés. La paciente refería un tiempo de amenorrea de 6 semanas. En la exploración realizada en urgencias se observa metrorragia escasa que provenía de cérvix y útero ligeramente aumentado de tamaño, siendo el resto del examen normal. Se solicita una ecografía de control (fig. 1) la cual muestra un útero en retroversión con línea endometrial engrosada e imagen en fondo uterino compatible con hematómetra. A nivel de la cicatriz de la cesárea anterior se observa un saco gestacional con vesícula vitelina visible y botón embrionario con actividad cardiaca positiva de 3,0mm acorde a las semanas de amenorrea, ambos anexos compatibles con la normalidad. Se vuelve a citar a la paciente en una semana para control de la evolución del embarazo ante la probabilidad de un aborto espontáneo. El control ecográfico a la semana muestra un embrión con actividad cardiaca positiva de 6,8mm acorde a unas 7 semanas de amenorrea. Tras explicar a la paciente el riesgo de rotura uterina espontánea durante la gestación y las posibilidades terapéuticas, decide ingresar para tratamiento médico con MTX. Al ingreso la paciente presentaba un examen clínico sin alteraciones, hemograma y bioquímica dentro de los parámetros normales. Se administraron 53mg de MTX intramuscular según la superficie corporal de la paciente y se solicitó nueva determinación de B-HCG y control ecográfico a los 5 días. En este nuevo control la paciente presenta dolor abdominal y se evidencia persistencia de latido cardiaco en el embrión que ya medía 11,8mm por lo que ante el malestar físico y psicológico de la paciente se opta por el tratamiento quirúrgico.
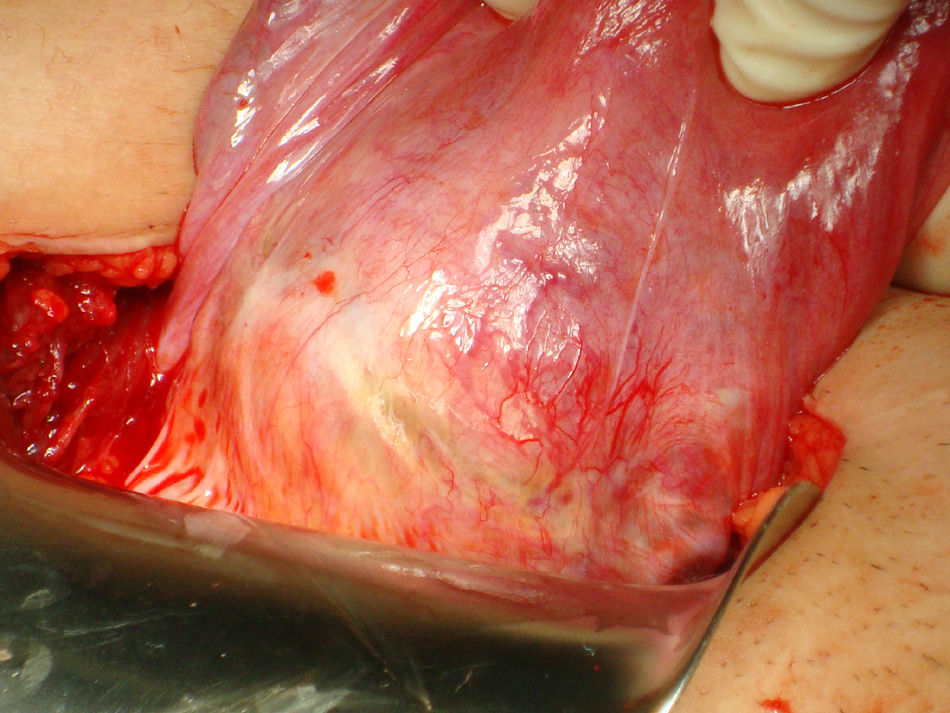
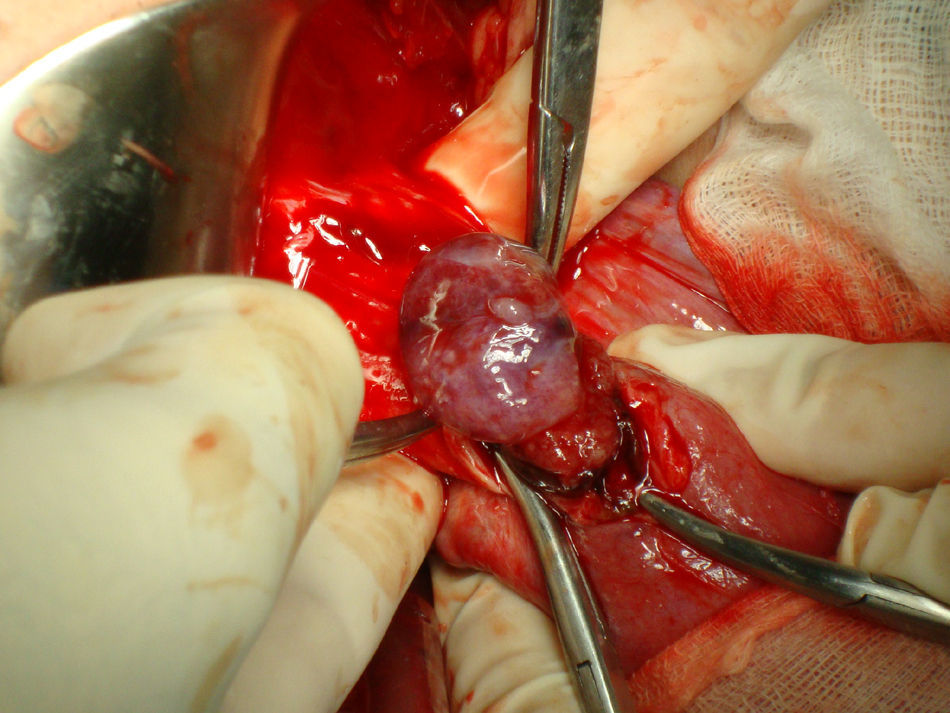
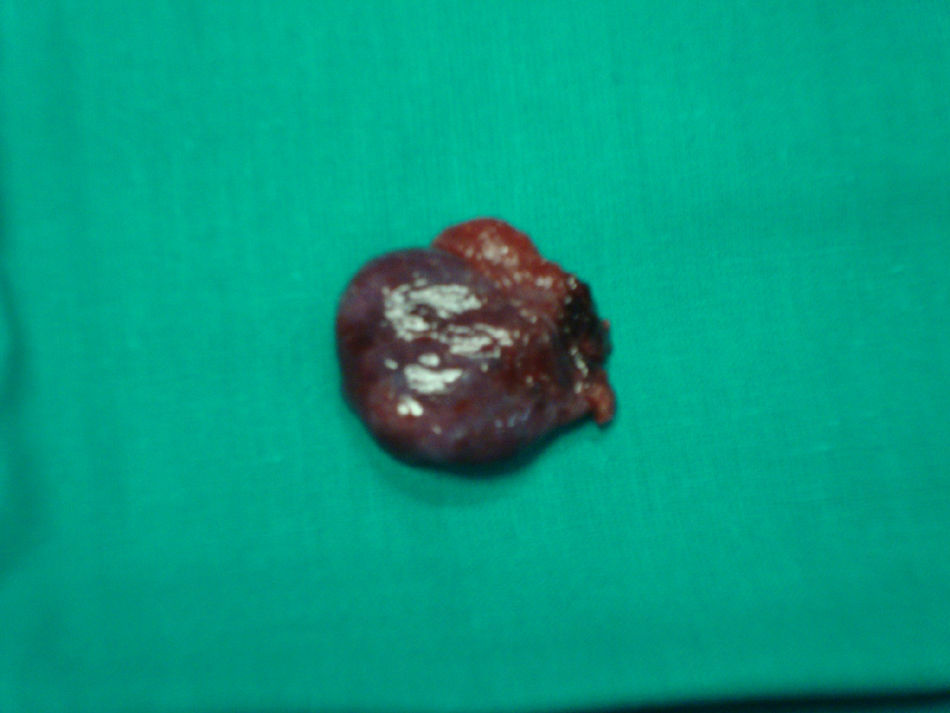
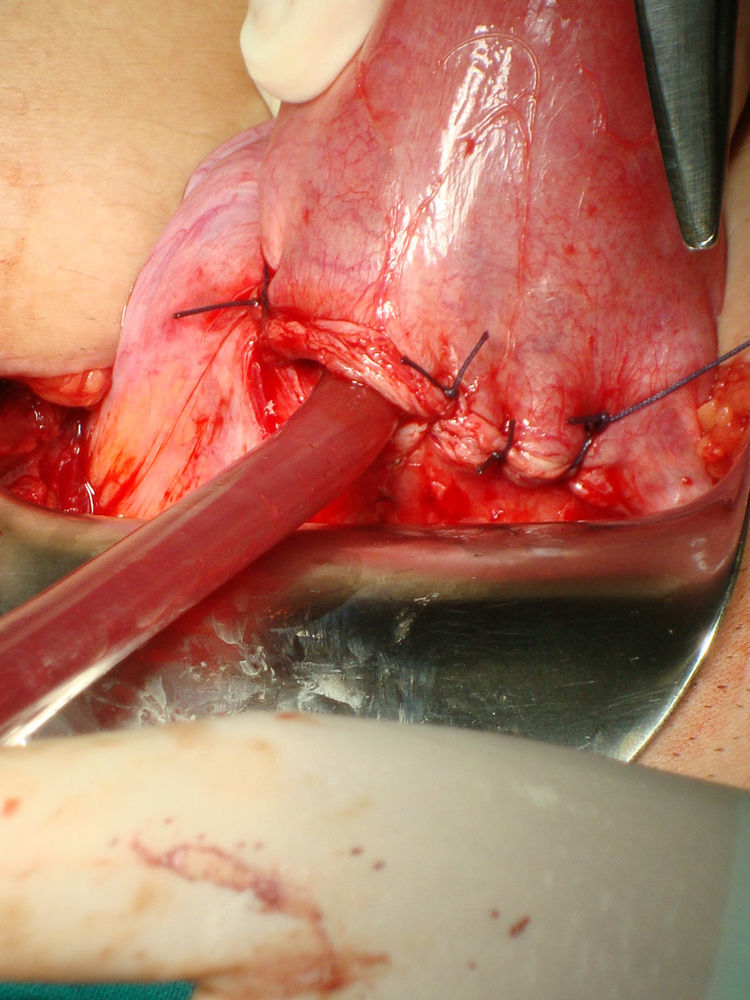
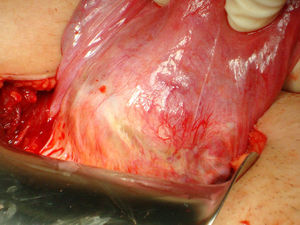
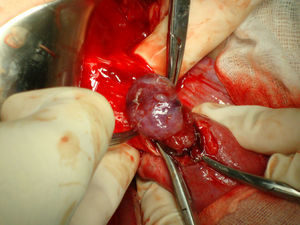
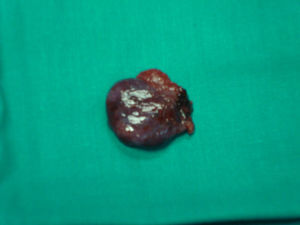
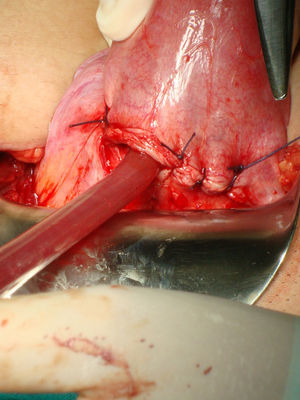
Bajo anestesia general se realiza incisión de Pfannestiel de unos 10cm aproximadamente, se abre la pared abdominal hasta llegar a cavidad, se despega la vejiga y se expone cicatriz anterior con tumoración de unos 4cm correspondiente a embarazo (figs. 2 y 3). Se incide sobre la cicatriz de histerorrafia anterior a una profundidad de 1mm aproximadamente hasta visualizar el saco gestacional que se extrae mediante expresión (fig. 4), posteriormente se procede a legrado digital y aspiración de decidua (fig. 5). El cierre de la histerorrafia se hace en doble capa, la primera con puntos sueltos y la segunda capa con puntos continuos. Se evidencia bajo tono uterino con ligero sangrado por lo que se decide tras realizar masaje uterino dejar el drenaje intracavitario y administrar 400mg de misoprostol intrarrectal. La cirugía y el post-operatorio se desarrollaron sin incidencias, dándole el alta hospitalaria al tercer día.
El CSP es un tipo raro de embarazo ectópico cuyo diagnóstico se realiza generalmente entre las 5+0 y las 12+4 semanas de amenorrea2. Muy pocos de los casos registrados en la literatura médica sobrepasan el primer trimestre3,7, y si lo hacen, están relacionados con un importante riesgo de rotura uterina y hemorragia masiva que puede ser indicación de histerectomía con la consiguiente pérdida de la capacidad genésica por parte de la paciente. También existe el riesgo de invasión de la vejiga por el trofoblasto que está en crecimiento8,9, así como el de acretismo placentario, que es de 3 a 5 veces más frecuente en el CSP.
La causa y la patogenia no están aún bien comprendidas, pero se postula la hipótesis de que podría deberse a tractos microtubulares que se forman durante la agresión de la pared del útero8,10, ya sea tras una cesárea o tras cualquier otra cirugía uterina11. Esto condicionaría la instauración del trofoblasto dentro del espesor del miometrio, rodeado por este y por tejido cicatricial. Este fenómeno explicaría que el comportamiento del CSP sea más agresivo que el de la placenta previa accreta ya que la invasión miometrial se realizaría más precozmente2. Vial et al12, propusieron 2 tipos de CSP. El primero una implantación del trofoblasto en la cicatriz pero de crecimiento intrauterino ístmico-cervical o hacia la cavidad del útero, y el segundo con una implantación más profunda y de crecimiento hacia vejiga y cavidad abdominal con un riesgo elevado de rotura uterina. Es aún incierto si el número de cesáreas anteriores se relaciona con un mayor riesgo para desarrollar un CSP, sin embargo, en una revisión sistemática hecha en 2006 por Rotas et al13, encontraron una incidencia del 52% de casos de CSP tras una cesárea, 36% tras 2 y 12% después de 3 o más.
El caso típico es el de una paciente de unas 5-6 semanas de amenorrea con antecedente de cirugía uterina previa, que viene por un sangrado vaginal, escaso en ausencia de dolor (clínica presente en el 39% de los casos). Si el sangrado es excesivo y el dolor es severo es probable que estemos frente a una inminente rotura uterina. En el 37% de los casos es un hallazgo incidental en un control ecográfico de rutina13. El examen físico no suele tener alteraciones salvo que el útero esté en proceso de romperse, entonces habrá una hipersensibilidad en la cicatriz uterina4.
La ecografía es hoy en día el método de elección para hacer un diagnóstico con un buen nivel de fiabilidad, siempre y cuando se tengan en cuenta los siguientes criterios8,10: saco gestacional con o sin embrión con o sin actividad cardiaca localizado en la pared anterior del segmento uterino, cavidad uterina y canal cervical vacío sin contacto con el saco y, en un corte sagital ecográfico, ausencia o discontinuidad en el miometrio entre la vejiga y el saco gestacional. Sumado a esto no deben observarse masas anexiales ni líquido libre en Douglas a menos que el CSP se haya roto12. El Doppler color ofrece una ayuda adicional al mostrar un flujo vascular peritrofoblástico distintivo de forma circular que nos permite delimitar el saco gestacional y la localización de la placenta en relación con la cicatriz y la proximidad con la vejiga3. El Doppler pulsado nos mostrará características de un embarazo precoz normal con una velocidad pico elevada (> 20cm/s) y una impedancia baja con un índice de pulsatibilidad < 114.
Debido a su baja incidencia no existe consenso con respecto a su tratamiento y, aunque existen casos reportados de CSP que han finalizado con el nacimiento de un recién nacido vivo, la mayoría de autores concuerdan en que debido al elevado riesgo que acarrea continuar con el embarazo se debería finalizar dentro del primer trimestre4, y la mejor manera de hacerlo aún sigue en discusión. Esta decisión debe basarse en los conocimientos actualizados, la clínica de la paciente, la edad gestacional, la viabilidad del feto, el grado de invasión miometrial y también la experiencia de cada centro hospitalario.
Se han descrito15,16 tratamientos conservadores con la administración sistémica de MTX (50mg/m2) con buenos resultados siempre y cuando se cumplan ciertos requisitos como: paciente sin dolor y hemodinámicamente estable, con un CSP menor de 8 semanas de gestación no roto, espesor miometrial < 2mm entre el CSP y la vejiga17 y una B-HCG < 5.000 mUI/ml15,16. Debido a la corta vida del MTX (10h) muchas veces es necesario repetir la dosis. Es por esto que algunos autores optan por la inyección intrasacular de MTX10,18 o alguna sustancia embriocida19–21. El tratamiento médico sistémico o local, simple o combinado, no está exento de complicaciones a veces importantes, como el sangrado, que en algunos casos requieren la aspiración quirúgica del saco gestacional. Existen diferentes secuencias de combinaciones descritas pudiendo estar la aspiración al principio, al medio o al final del tratamiento con MTX2,16,22–24.
Una revisión de la literatura médica hecha por Arslan et al25 muestra que el legrado como tratamiento del CSP debe ser desaconsejado ya que 8 de cada 9 pacientes terminan en fracaso de tratamiento o sufren complicaciones.
Ching-Jung et al26 publicaron el caso de una mujer tratada mediante succión y curetaje bajo visualización directa por histeroscopia, aunque el resultado fue exitoso, hace hincapié en la importancia de la experiencia del cirujano y el alto nivel de coordinación ojo-mano para la coagulación meticulosa de los vasos a nivel de la implantación de la masa ectópica y prever así un sangrado masivo26. La tasa de éxito de esta modalidad es alentadora (8/8=100%) aunque el números de casos es pequeño y aún es pronto para saber si la histeroscopia quirúrgica se puede realizar en presencia de sangrado abundante o inestabilidad hemodinámica de la paciente4.
La cirugía laparoscópica ha sido utilizada con éxito por una serie de autores6–28, utilizando la vasopresina intralesional para minimizar el sangrado29. La dirección del crecimiento del CSP hacia cavidad uterina o hacia la vejiga y la cavidad abdominal nos podría ayudar a determinar si finalizar el embarazo mediante histeroscopia o laparoscopia respectivamente12,28.
Con respecto a la laparotomía se puede decir que es aún considerada como el método de elección por algunos autores8,12. Esta cirugía que no precisa de una elevada técnica y está presente en todos los hospitales, tiene como ventajas la extirpación total del CSP y la reparación simultánea de la cicatriz seguida de una rápida disminución de la B-HCG en 1-2 semanas hasta niveles normales. Esta técnica no solo extirpa el trofoblasto en su totalidad sino también los tractos microtubulares, disminuyendo el riesgo de recurrencia. Como desventajas está la amplia herida quirúrgica con respecto a las otras alternativas terapéuticas, la mayor estancia hospitalaria, el mayor tiempo de recuperación y el aumento del riesgo de desarrollar placenta previa accreta en un embarazo posterior8.
En aquellas mujeres que no desean interrumpir el embarazo y existe evidencia ecográfica de crecimiento del CSP hacia la cavidad uterina, se podría considerar un tratamiento expectante con controles de imagen regulares y explicando a la paciente claramente el elevado riesgo que conlleva4. Desconocemos aún el mínimo grosor de miometrio anterior al CSP que pueda garantizarnos continuar la gestación sin riesgo de rotura uterina. En casos publicados con actitud expectante7,30, el embarazo llegó a término con histerectomía y transfusión sanguínea. Jucovik et al3 describieron en una serie de 18 casos el fracaso de esta actitud en 2 de cada 3 mujeres. Por todo lo anterior, parece prudente planificar una cesárea electiva en la semana 28-30 con maduración pulmonar completa 24 a 48h previas a la cirugía4.
En conclusión, la incidencia de CSP va en aumento, sin tener una clara asociación con el número de partos con cesárea previa. Al no existir una actitud terapéutica definida, se debe individualizar en cada caso según las características de la paciente y de común acuerdo con ella tras una adecuada información.