Presentamos nuevos ejercicios de entrenamiento endoscópico ginecológico en modelo animal (rata Wistar) para formación de los residentes en esta disciplina quirúrgica. Las intervenciones y los ejercicios de adiestramiento se efectuarán en una rata Wistar viva y anestesiada, introducida en un entrenador pélvico endoscópico ginecológico. A través del mismo se realizarán en la rata las prácticas de disección, coagulación, corte, movilización de estructuras de cavidad abdominal, histerectomía subtotal con anexectomía bilateral, extracción de pieza en bolsa y anudado para cerrar la herida abdominal. Con 12h de trabajo un residente de obstetricia y ginecología en su tercer año conseguiría el dominio de los movimientos necesarios para realizarlos en humanos.
We describe a new animal model for training resident physicians in gynecological endoscopy. The surgery and training exercises are performed in live, anesthetized, Wistar rats in a pelvitrainer for gynecological endoscopy. The pelvitrainer is used to practice dissection, cutting, electrocoagulation, mobilization of structures in the abdominal cavity, subtotal hysterectomy with double anexectomy, extraction of the surgical specimen in a bag, and knotting to close the surgical wound. Twelve hours of training are sufficient for third-year resident surgeons to master the movements required to perform these techniques in humans.
Durante años, las unidades de cirugía experimental, ubicadas tanto en facultades de medicina como de veterinaria, han impartido cursos para el aprendizaje y consolidación de nuevas técnicas quirúrgicas, entre ellas las endoscópicas.
Como ginecólogos, nos parece de interés presentar la técnica necesaria para realizar ejercicios endoscópicos ginecológicos en la rata Wistar. Nos servirá para iniciarnos en la práctica de una cirugía que precisa, como todas, un entrenamiento previo, en este caso en modelos animales vivos.
Ya hemos presentado trabajos realizados en otros modelos animales, coneja neozeolandesa, cerda large white1, que precisarían de un nivel técnico-tecnológico superior. Utilizando la comparación de los niveles de ecografía, la rata serviría como destreza para adquirir un nivel I, la coneja el nivel II y la cerda el nivel III. Así, la práctica se iría complicando, en dependencia del animal utilizado. De esta manera, también el coste económico del aprendizaje se adecuaría al nivel, cuestión obvia, porque para estudios iniciales no sería rentable el comienzo con animales como la coneja y la cerda.
Por otro lado, y para cerrar esta serie de trabajos en innovación técnica y metodológica que hemos presentado, queríamos en cierto modo dar un pequeño homenaje a la rata Wistar, que nos ha servido a muchos especialistas, y de las más diversas especialidades, no sólo a desarrollar nuestras habilidades quirúrgicas en sus diferentes facetas, sino también a iniciarnos en investigación básica2–4. A través de los cursos de laparoscopia impartidos nos damos cuenta del interés que despierta el trabajar con rata Wistar en aquellos con ilusión por aprender.
MaterialMaterial animalRata hembra albina de la variedad Wistar. Es un animal de laboratorio muy utilizado para la experimentación biomédica. Mamífero, tiene un ciclo reproductor poliéstrico continuo de 4-5 días. Alcanza la pubertad a los 70-80 días de de vida, con un peso de 200 a 250g, y mantiene una capacidad de concebir unos 18-20 meses. La duración de la gestación es de 21-22 días, con camadas de 7-14 crías por parto5.
Material quirúrgicoAnestesiaInyección intramuscular de 1ml de la mezcla compuesta por:
- –
Clorhidrato de ketamina+excipiente: 250mg (5ml).
- –
Diacepam+excipiente: 20mg (4ml).
- –
Atropina 1mg+excipiente: 1mg (1ml).
- –
Total de la mezcla: 10ml.
- –
2 trocares (opcionales) de 10mm y otros 2 de 5mm.
- –
Material de endoscopia Karl Storz: óptica de 0° 10mm, fuente de luz de Xenon 300, pinzas laparoscópicas de disección, corte, prensión, electrocoagulador monopolar, con potencias de corte de 40 w y de coagulación de 30 w, macroportaagujas de Koh -contraporta y pinza baja nudos modelo Clermont Ferrand.
- –
Entrenador pélvico Karlz Storz, que dispone además de videocámara y pantalla de visión en monitor adjunto: Tele Pack Unidad de Control. Telecam cabezal de cámara. Trainer laparoscópico (26384). Controladora de cámara HD. Cabezal de cámara HD.
- –
Suturas de vicryl 3/0-4/0 y seda 3/0.
- –
Fundas de las utilizadas en ecografía para las exploraciones ecográficas vaginales, que nos servirían de bolsas extractoras.
La experiencia se lleva a cabo en el Servicio de Biomedicina y Biomateriales de la Universidad de Zaragoza, siguiendo la normativa vigente directiva 86/609, RD 1201/205 de 10 de octubre, sobre protección de animales utilizados para experimentación y otros fines científicos. Los profesores están capacitados por la Dirección General de Alimentación para dirigir o diseñar procedimientos en centros de experimentación animal (Orden 22-12-2003).
Cumpliendo las normativas descritas anteriormente, pasamos ahora a describir las diferentes técnicas realizadas sobre el animal experimental.
Preparación del campo operatorioRasurado del abdomen del animal.
Colocación de la rata Wistar en una tabla de metacrilato, sujetando las extremidades y la cola con tiras de esparadrapo para su inmovilización.
Asepsia de la piel con povidona yodada y delimitación del campo quirúrgico con tallas apropiadas de microcirugía.
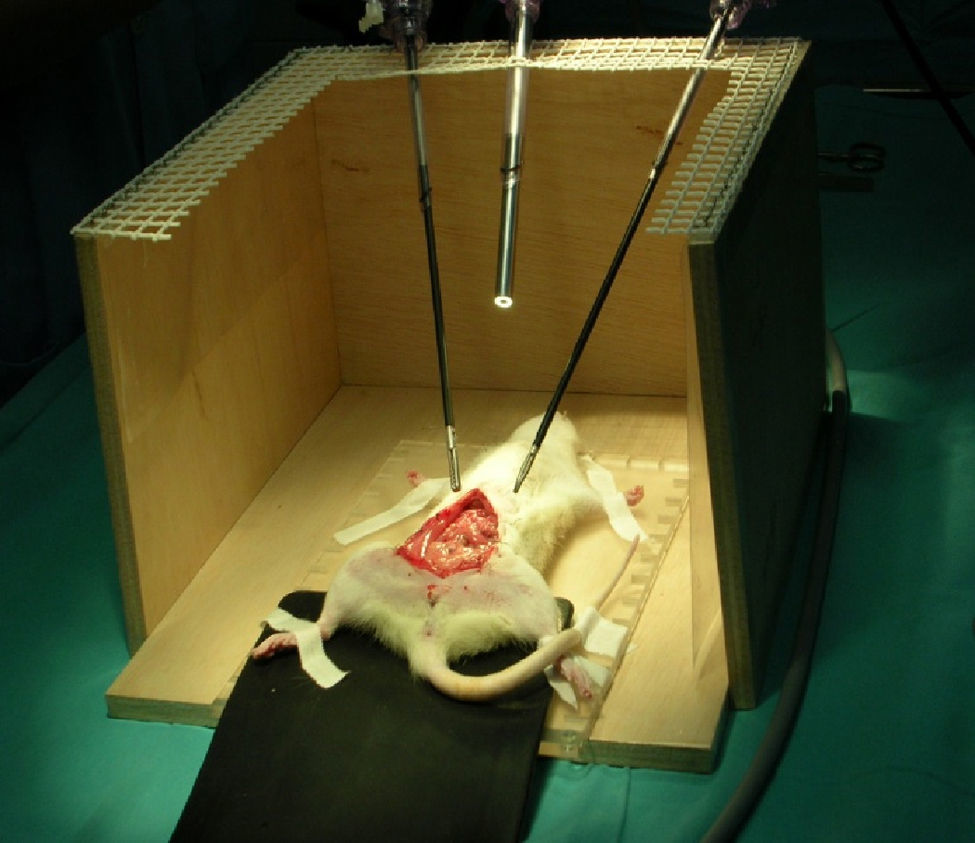
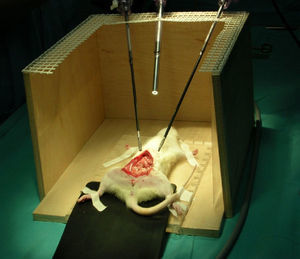
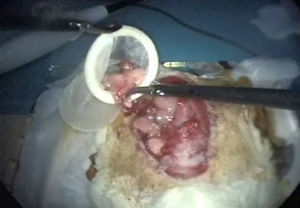
Introducción del animal en el entrenador pélvico situando la cabeza en la parte anterior, es decir próxima al cirujano y ayudante (figs. 1 y 2).
Ejercicios prácticosEl cirujano llevará dos pinzas de laparoscopia (disector y tijera), mientras que el ayudante portará la videocámara y otra pinza (endoclinch).
Sección-disecciónCogiendo un lado de la piel el cirujano y el otro el ayudante, se procede a la maniobra de sección-disección desde el ombligo hasta 1cm por encima de uretra.
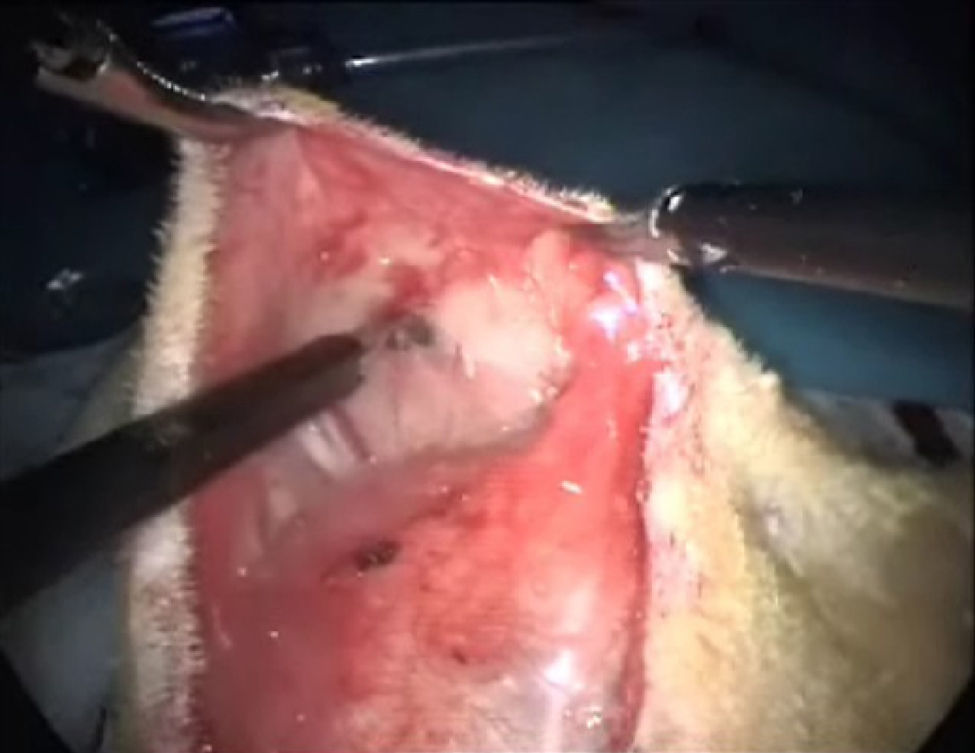
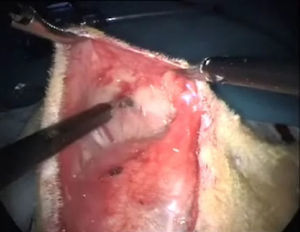
Se continúa lateralmente la disección, hasta completar la separación entre la piel y el plano muscular abdominal de la rata, empezando con maniobras de tracción de un lado entre el cirujano y el ayudante, siguiendo el mismo gesto quirúrgico que cuando se procede a la quistectomía ovárica en humana (fig. 3). Cuando tenemos el espacio suficiente para empezar la tracción-contratracción, uno prendiendo de la piel y el otro del músculo, se facilita la disección. Posteriormente, se completa la laparotomía media infraumbilical y se continúa con los siguientes ejercicios de entrenamiento laparoscópico.
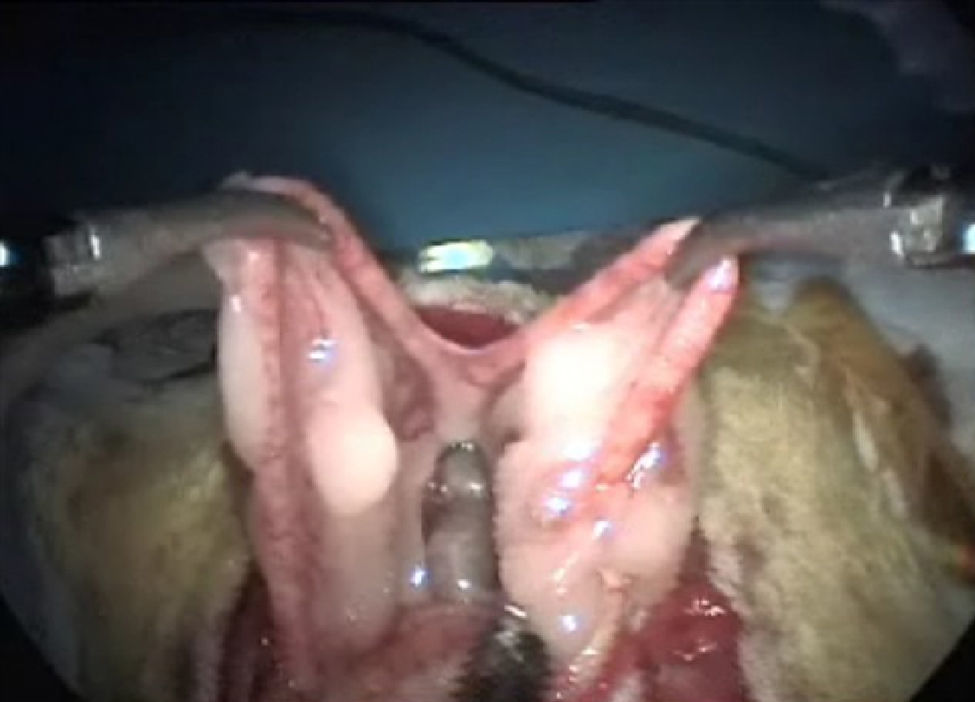
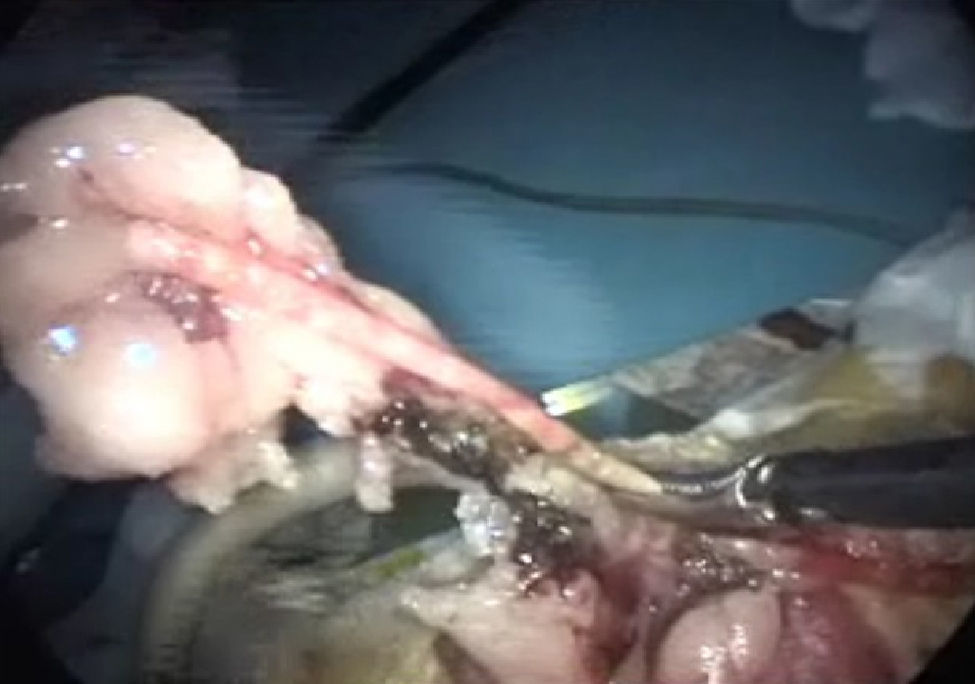
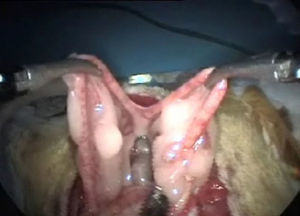
Exposición de úterosRecordamos que en el aparato genital interno de la rata visualizamos: dos bolsas ováricas, dos oviductos, dos cuernos, un cuerpo y dos cuellos uterinos. Su localización es sencilla si traccionamos con suavidad de la grasa mesometrial (fig. 4). La vascularización del aparato genital se realiza fundamentalmente por la arteria ovárica, que nace de la aorta y por la arteria uterina que es continuación de la vesical superior6.
Movilización intestinalNos acostumbraremos a su movilización, extremando las precauciones para que las tracciones no desgarren los mesos vasculares o el propio intestino.
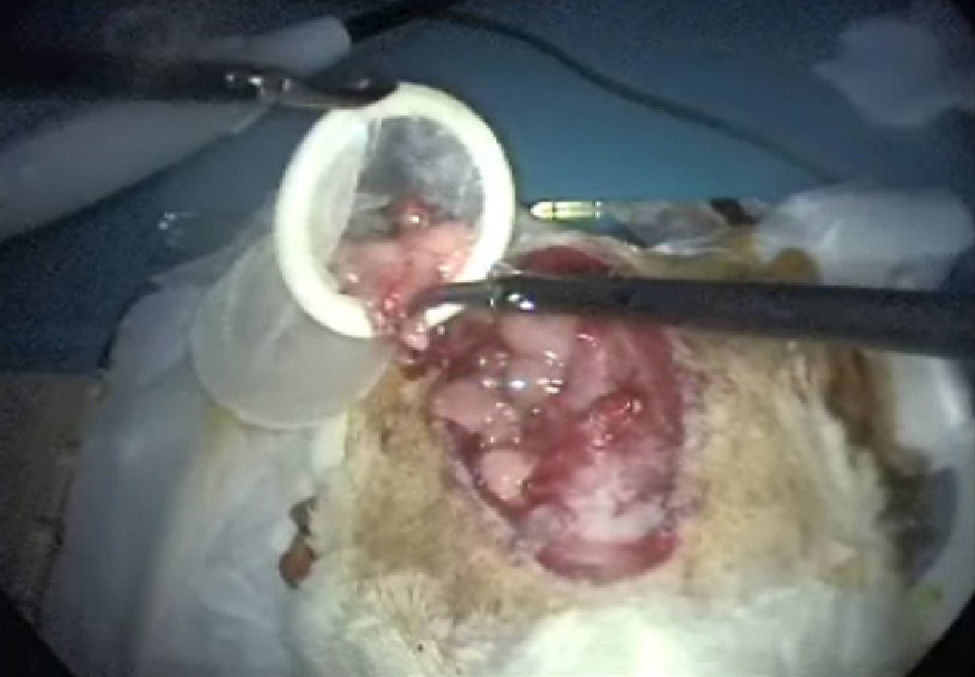
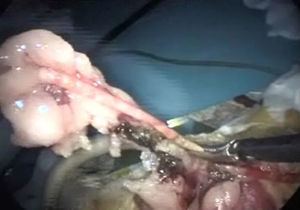
Histerectomía subtotal con anexectomía bilateralUtilizando corriente monopolar7, se irán electrocoagulando los vasos ováricos, la arcada mesometrial (fig. 5) y los vasos uterinos que, de arriba hacia abajo, nos vayamos encontrando, para, una vez seccionados los mesos, sin peligro de hemorragia, poder extraer los cuernos uterinos y los anejos, una vez que se coloquen en la bolsa extractora (fig. 6).
Para evitar lesionar los uréteres en la zona de la arcada mesometrial, se tracciona levemente de los cuernos uterinos, que así se alejan de la zona de electrocoagulación y sección con tijera monopolar, que son el objetivo de esta parte de la práctica.
Se dejan los cuellos uterinos —la rata Wistar tiene dos— para evitar la lesión de la vejiga en esa zona, por la utilización de la corriente monopolar, trabajando en ese espacio de tamaño tan reducido.
Los cuellos se cierran en su parte superior con un punto de vicryl 4/0.
Finalmente se comprueba la hemostasia.
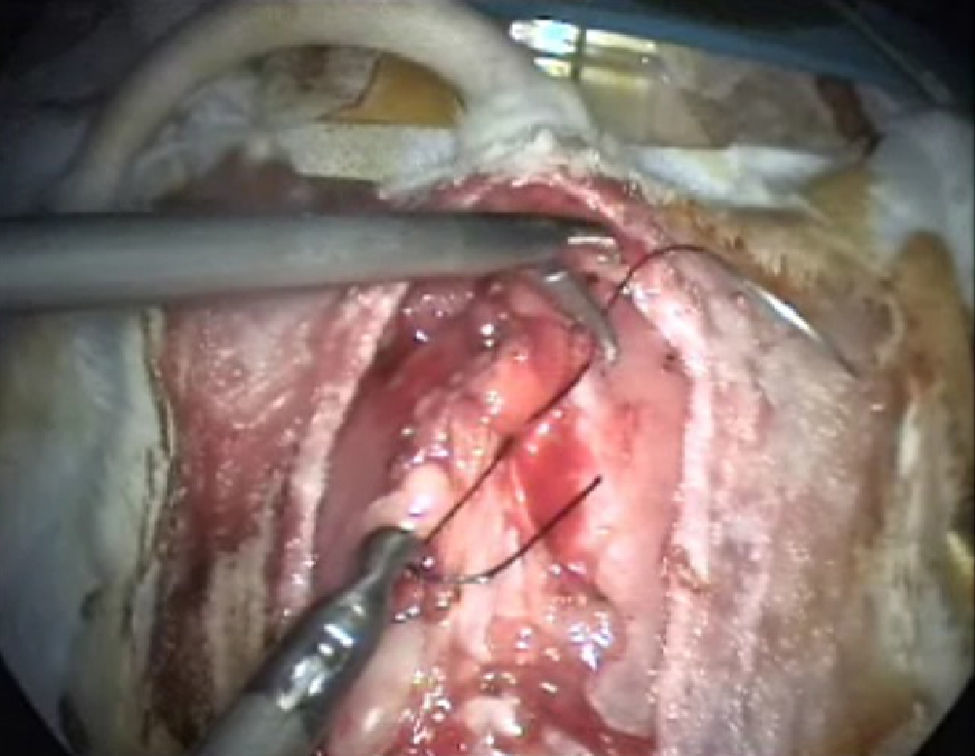
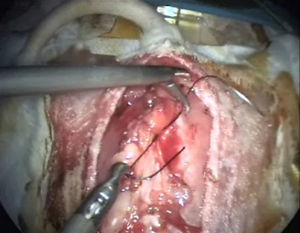
Cierre de laparotomíaEjercicio de sutura endocavitaria y de realización de nudos con seda o vicryl de 3/0. Se practicará nudo doble; el primero seguido de dos simples, el segundo al lado contrario para asegurar el nudo. Así dominaremos la técnica de la sutura y del anudado intracorpóreo (fig. 7). También podremos hacer el anudado extracorpóreo y bajarlo con la pinza baja-nudos.
Finalizada la práctica se procede a la eutanasia del animal anestesiado en la cámara de CO2.
Aplicando el método descrito anteriormente se esperan conseguir los siguientes resultados.
ResultadosAprendizaje de primeros pasos para cirugía laparoscópica:
- –
Sección-disección, tracción-contratracción.
- –
Hemostasia con electrocoagulación monopolar.
- –
Manejo de estructuras abdominales con pincería laparoscópica.
- –
Histerectomía subtotal con anexectomía bilateral.
- –
Extracción de piezas en bolsas.
- –
Suturas intracorpóreas, nudos intracorpóreos y extracorpóreos.
Después de 3 días en sesiones de 4h diarias, consideramos que el alumno (un residente de tercer año de obstetricia y ginecología, con un nivel quirúrgico ya adquirido en ese tiempo) estará en condiciones de dominar las técnicas descritas.
Para su evaluación debe pasar un examen práctico, que es supervisado por un ginecólogo experto en laparoscopia y cirugía mínimamente invasiva y además, en nuestra Comunidad de Aragón, tener la categoría profesional C, que le homologa para el ejercicio profesional en los centros de experimentación animal.
En unos 90min, el cirujano (examinando) deberá demostrar al ayudante (examinador) que es capaz de realizar una histerectomía subtotal a una rata introducida en un entrenador pélvico, extraer los úteros en un bolsa y cerrar la laparotomía mediante sutura discontinua utilizando al menos 5 puntos intracorpóreos en plano músculo-fascial y otros 5 extracorpóreos en piel.
DiscusiónLa cirugía laparoscópica está avanzando de manera espectacular gracias al progreso de la tecnología y a la adaptación de los profesionales a estos nuevos retos, buscando siempre el mayor beneficio para los pacientes.
La enseñanza de la cirugía actual, y más si cabe la cirugía laparoscópica, ha de seguir unos pasos. Entendemos que el primer enfrentamiento a este tipo de cirugía no debe ser una intervención en una mujer. Tiene que pasar por una serie de retos anteriores, como el trabajo con materiales inertes con visión laparoscópica en entrenadores pélvicos, para coordinar la visión magnificada con el movimiento manual en ese nuevo campo quirúrgico, y seguir luego con ejercicios virtuales8–10 de métodos computerizados que simulan intervenciones ginecológicas, o bien la utilización de animales vivos, uno de ellos la rata Wistar, introducida en un entrenador pélvico11–16.
Trabajando con rata Wistar en la enseñanza de microcirugía ginecológica, dentro de programas de investigación en estos animales, pensamos que, al igual que con el microscopio operatorio, la laparoscopia también aumenta el campo quirúrgico e igualmente cuando se opera, tanto con el microscopio operatorio como con las técnicas laparoscópicas, los cirujanos no se ven las manos, al contrario que en la cirugía abierta tradicional.
Fue entonces cuando ideamos la manera de emplear la rata Wistar, que hasta entonces nos servía como modelo de enseñanza de microcirugía, como modelo también para empezar el aprendizaje de la cirugía laparoscópica. Para ello, tras varios ensayos con el animal introducido en un entrenador pélvico endoscópico, que fue primero fabricado de manera artesanal (fig. 1), llegamos a la conclusión de que se adaptaba para la enseñanza de adiestramiento endoscópico planteada y nos serviría no solo para el manejo de la pincería bajo aumento, sino también para practicar las técnicas descritas inicialmente en él los apartados «Material» y «Métodos» que es la base de cualquier cirugía (tracción-contratracción, sección-disección, electrocoagulación, suturas, etc.); dando a conocer la utilización de este animal como modelo de aprendizaje, antes de llegar a otro de mayor coste económico y manejo más complicado como la coneja o la cerda.
En este capítulo, en el Servicio de la Unidad Mixta de Investigación, el coste completo de una práctica de 4h en un quirófano de cirugía experimental en cerda alcanzaría los 500 euros, el de una coneja 200 euros, mientras que el de una rata serían 50 euros.
No solo estamos hablando de técnicas ginecológicas básicas, como anexectomías e histerectomías, con un nivel de complejidad similar a una esterilización tubárica en una mujer, porque otros autores incluso la utilizan como modelo para explorar otras vías quirúrgicas más complejas, como es el acceso retroperitoneal, además de la siempre mencionada investigación biomédica con técnicas microquirúrgicas17,18. De ahí la versatilidad de este animal y por eso nuestro «homenaje» mencionado en la introducción.
El adiestramiento en todo momento estará controlado por especialistas en ginecología endoscópica y homologados para el ejercicio profesional en los centros de experimentación animal y otros fines científicos. Así se procederá de manera que, aunque estemos operando un animal, pensemos en una paciente humana, ya que, a veces, tratándose de un animal tendemos a no realizar los gestos quirúrgicos siempre de manera ortodoxa y se automatizarán entonces movimientos incorrectos.
Después de haber completado este camino, iniciado con la rata Wistar, estaríamos en condiciones de empezar en un quirófano19, primero ayudando y luego ya operando bajo tutela, la patología ginecológica que pudiera resolverse mediante laparoscopia quirúrgica. No podemos entender que sea de otra manera. Así se evitarán parte de las complicaciones iniciales, que retardan o impiden el desarrollo de una técnica quirúrgica, y se adquirirá la capacidad de poder resolverlas, si se presentasen en el curso de una intervención20, sin necesidad de reconvertir a una laparatomía.