Conocer cómo se trata la amenaza de parto pretérmino (APP) en los hospitales españoles.
Material y métodoCon el patrocinio de la Sociedad Española de Ginecología y Obstetricia, se realizó una encuesta por Internet sobre aspectos básicos del tratamiento de la APP en 41 hospitales españoles, 37 públicos y 4 privados.
ResultadosTodos los hospitales realizan tocólisis en la APP antes de las 34 semanas. El tocolítico más empleado es el atosiban (73,7%), seguido de los betamiméticos (21,9%) y el nifedipino (4,9%). En las APP de más de 24 semanas sólo el 7,3% de los hospitales realizan tocólisis. El 100% de los hospitales administra corticoides para acelerar la madurez pulmonar. El 92,7% utiliza betametasona y el 7,3% restante, dexametasona. El 90% de los hospitales no realiza corticoterapia de repetición. En los embarazos múltiples todos emplean la misma dosis que en las APP con feto único.
ConclusionesEl tocolítico más utilizado en los hospitales españoles es el atosiban y el corticoide preferido, la betametasona.
To determine how threatened preterm labor is treated in Spanish hospitals.
Material and methodUnder the aegis of the Spanish Society of Obstetrics and Gynecology, an Internet questionnaire on basic aspects of the treatment of threatened preterm labor was sent to 41 Spanish hospitals (37 public and four private hospitals).
ResultsAll hospitals use tocolysis in threatened preterm labor before 34th weeks. The most widely used tocolytic agent is atosiban (73,7%), followed by betamimetics (21.9%) and nifedipine (4.9%). Only 7.3% of the hospitals use tocolytics in threatened preterm labor after 34 weeks. All the hospitals use corticosteroids to accelerate lung maturation: 92.7% use betamethasone and 7.3% prefer dexamethasone. In 90% of the hospitals, steroid therapy is not repeated. In multiple pregnancies, the same steroid dose as that used in single pregnancies is administrated in all centers.
ConclusionsThe most widely used tocolytic agent in Spanish hospitals is atosiban and the preferred corticosteroid is betamethasone.
El parto pretérmino es el que tiene lugar antes de las 37 semanas. Es un síndrome y como tal se debe a varias causas. Constituye un grave problema que la medicina perinatal aún no ha resuelto. Se estima que en el mundo nacen aproximadamente 13 millones de niños antes de término y en Europa más de 400.0001. La mortalidad de estos embarazos constituye el 65% del total de la mortalidad perinatal2 y la morbilidad, en los nacidos entre la semana 22 y 26 que sobreviven, es del 50%3. El problema del parto pretérmino se agrava por que es frecuente en todo el mundo y, además, en algunos países, tiende a aumentar4–7.
La prevención primara del parto pretérmino es prácticamente imposible y la secundaria, a pesar de los grandes esfuerzos que se han realizado y siguen realizándose, ha dado resultados muy mediocres8–10. En la práctica, la prevención se reduce al tratamiento de la amenaza del parto pretérmino (APP).
La primera dificultad del tratamiento de la APP es hacer el diagnóstico; en muchas ocasiones, el clínico sobrevalora los síntomas tratando casos que son falsas APP. Entre nosotros, Alonso11, utilizando un índice parecido al de Baungarten, investigó el resultado del tratamiento de la APP en 747 casos. Llamaba la atención que, cuanto mayor era el riesgo de parto pretérmino, peor era el resultado del tratamiento. Esto se debe a que, con toda seguridad, algunos de los casos con una prueba muy baja en realidad no eran APP11.
El diagnóstico de la APP se basa en la existencia de contracciones y de modificaciones en el cuello. La rotura prematura de la bolsa, dada su íntima relación con el parto pretérmino, debe valorarse a la hora de hacer el diagnóstico de APP, pero tiene unas connotaciones especiales, por lo que conviene tratarla de forma independiente.
ContraccionesDeben tener una duración de al menos 30s y una frecuencia superior a 4 cada 30min.
Modificaciones del cuelloSe admite que hay modificaciones relacionadas con la APP cuando existe un borramiento del 50% y una dilatación de 1 a 3cm. La valoración ecográfica del cuello no es imprescindible pero sí recomendable. Una longitud < 25mm y la dilatación del orificio cervical interno, con o sin insinuación de la bolsa, pueden considerarse modificaciones del cuello relacionadas con la APP. Antes de comenzar el tratamiento, son imprescindibles el registro cardiotocográfico y una ecografía.
En este trabajo se exponen los resultados de la encuesta realizada por la Sociedad Española de Ginecología y Obstetricia (SEGO) en los hospitales españoles.
MATERIAL Y MÉTODOA través de correo electrónico se envió una encuesta a 43 hospitales españoles, 39 públicos y 4 privados. La encuesta constaba de 19 preguntas relacionadas con aspectos básicos sobre el tratamiento de la APP. No respondieron 2 hospitales públicos. Los 41 hospitales que han intervenido en la encuesta, y con cuyas respuestas se ha elaborado este trabajo, son:
1. Hospital 12 de Octubre, Madrid (José Manuel Hernández García); 2. Hospital Arquitecto Marcide, El Ferrol, A Coruña (Francisco Javier Martínez Mendaña); 3. Hospital Carlos Haya, Málaga (Mario Abehsera); 4. Hospital Central de Asturias, Oviedo (Secundino Villaverde); 5. Hospital Clínico de Salamanca, Salamanca (Luis Peña Sola y Ana Vit); 6. Hospital Clínico de San Carlos, Madrid (Miguel Ángel Herraiz); 7. Hospital Clínico de Valencia, Valencia (Antonio Cano); 8. Hospital Clínico Universitario, Zaragoza (Ernesto Fabre); 9. Hospital Universitario de San Juan, Alicante (Pedro Acien); 10. Hospital de Cruces, Bilbao (Juan Carlos Melchor); 11. Hospital de Elche, Alicante (Alicia Núñez); 12. Hospital de Fuenlabrada, Madrid (Pilar Miranda); 13. Hospital Universitario de Guadalajara, Guadalajara (Juan Carlos Monte y Juan Álvarez de los Heros); 14. Hospital General de Móstoles, Madrid (Emilia de Dios); 15. Hospital Río Carrión, Palencia (Pablo Álvarez); 16. Hospital de Puerto Real, Cádiz (Rafael Comino); 17. Hospital de Madrid-Norte San Chinarro, Madrid (Eduardo Cabrillo); 18. Hospital de San Pablo, Barcelona (Juan Parra); 19. Hospital Clínico Universitario de Santiago de Compostela (Rafael Uceda); 20. Hospital de Torrelodones, Madrid (Guillermo Gómez Montoya); 21. Hospital de Valdecilla, Santander (José Ramón de Miguel); 22. Hospital Virgen de la Concha, Zamora (José Luis Castaño Almendral); 23. Hospital Virgen del Rocío, Sevilla (José Luis Dueñas); 24. Fundación de Alcorcón, Madrid (Antonio López Salvá); 25. Hospital General de Segovia, Segovia (Ricardo Santamaría); 26. Hospital General Universitario de Alicante, Alicante (Juan Carlos Martínez Escoriza); 27. Hospital Gregorio Marañón, Madrid (Ángel Aguarón); 28. Instituto Dexeus, Barcelona (Bernat Serra); 29. Hospital La Fe, Valencia (Alfredo Perales); 30. Hospital La Paz, Madrid (Antonio González); 31. Hospital Montepríncipe, Madrid (María Luisa Cano); 32. Hospital Princesa Sofía, Córdoba (Santiago Carrasco); 33. Hospital Ruber Internacional, Madrid (Juan José Vidal Peláez); 34. Hospital San Juan de Dios, Barcelona (José María Lailla); 35. Hospital Santa Cristina, Madrid (Fernando Izquierdo y José Manuel Bajo); 36. Hospital Universitario de Canarias, Tenerife (Juan Troyano y Dra. Álvarez.); 37. Hospital Universitario Materno-Infantil de Gran Canaria, Las Palmas de Gran Canaria (José Ángel García Hernández); 38. Hospital Vall d'Ebron, Barcelona (Luis Cabero Roura); 39. Hospital Virgen de Valmes, Sevilla (Rogelio Garrido); 40. Hospital Virgen de la Salud, Toledo (María Luisa Cañete y Ángel Salcedo); 41. Hospital Virgen del Camino, Pamplona (Miguel Ezcurdia Gurpegui).
RESULTADOSEn relación con el número de partos que asistieron en el año 2005, los hospitales se agrupan como se indica en la tabla 1.
Agrupación de los hospitales según el número de partos asistidos en el año 2005
| Tipo de hospital según el n.ode partos asistidos | N.o de hospitales | % de hospitales |
| < 1.500 | 7 | 17,1 |
| 1.500-2.000 | 4 | 9,7 |
| 2.001-2.500 | 9 | 22,0 |
| 2.501-3.000 | 2 | 4,9 |
| 3.001-3.500 | 4 | 9,7 |
| 3.501-4.000 | 3 | 7,3 |
| < 4.000 | 12 | 29,3 |
| Total | 41 | 100,0 |
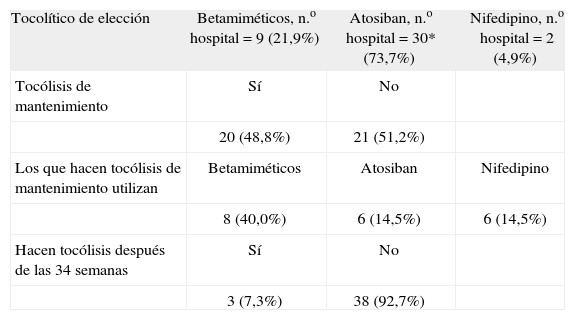
Las respuestas en relación con el tocolítico de elección, número de hospitales que hacen tocólisis de mantenimiento y porcentaje de hospitales que realizan tocólisis después de la semana 34 se exponen en la tabla 2.
Tocólisis en los hospitales, año 2005
| Tocolítico de elección | Betamiméticos, n.o hospital = 9 (21,9%) | Atosiban, n.o hospital = 30* (73,7%) | Nifedipino, n.o hospital = 2 (4,9%) |
| Tocólisis de mantenimiento | Sí | No | |
| 20 (48,8%) | 21 (51,2%) | ||
| Los que hacen tocólisis de mantenimiento utilizan | Betamiméticos | Atosiban | Nifedipino |
| 8 (40,0%) | 6 (14,5%) | 6 (14,5%) | |
| Hacen tocólisis después de las 34 semanas | Sí | No | |
| 3 (7,3%) | 38 (92,7%) |
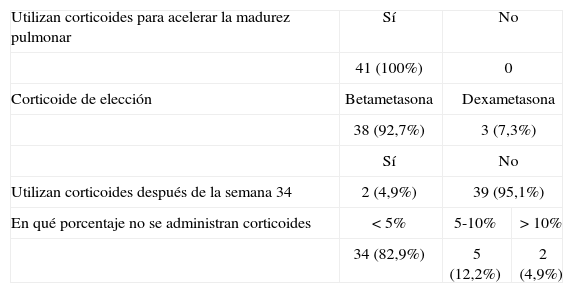
Los resultados relacionados con la administración de corticoides para acelerar la madurez pulmonar del feto se muestran en las tablas 3.1 y 3.2. Los 3 hospitales que dijeron administrar corticoide después de la semana 34 puntualizaron que lo hacían en casos concretos, como el de madres diabéticas, y en algunos casos de sospecha de macrosomía fetal o isoinmunización Rh. Con la dosis de repetición sucede algo similar. Los cuatro hospitales que respondieron que daban corticoides cada cierto tiempo como dosis de recuerdo, lo hacían en casos concretos de APP de pocas semanas, sobre todo si eran gestaciones múltiples.
Corticoterapia en los hospitales españoles, año 2005
| Utilizan corticoides para acelerar la madurez pulmonar | Sí | No | |
| 41 (100%) | 0 | ||
| Corticoide de elección | Betametasona | Dexametasona | |
| 38 (92,7%) | 3 (7,3%) | ||
| Sí | No | ||
| Utilizan corticoides después de la semana 34 | 2 (4,9%) | 39 (95,1%) | |
| En qué porcentaje no se administran corticoides | < 5% | 5-10% | > 10% |
| 34 (82,9%) | 5 (12,2%) | 2 (4,9%) | |
Corticoterapia en los hospitales españoles, año 2005
| Cuando se prevé que no habrá tiempo para hacer el tratamiento completo, se da la primera dosis | Sí | No | |
| 41 (100%) | 0 | ||
| Casos en los que el tratamiento no se hace completo | < 55 | %-10% | > 10% |
| 19 (46,3%) | 14 (34,2%) | 8 (19,5%) | |
| Administran dosis de corticoides de repetición | Sí | No | |
| 4 (9,8%) | 37 (90,2%) | ||
| En los embarazos múltiples dan la misma dosis | Sí | No | |
| 41 (100%) | 0 | ||
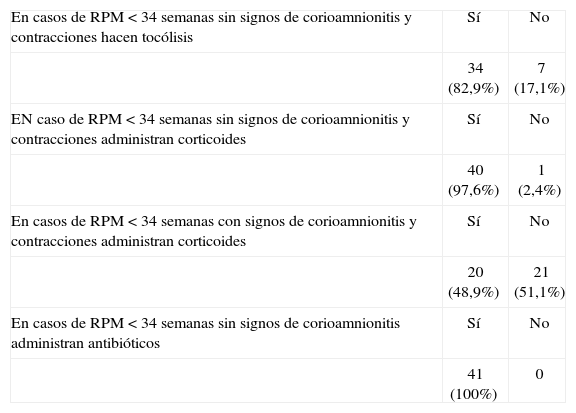
Las respuestas relacionadas con el tratamiento de la APP en los casos de rotura prematura de membranas se muestran en la tabla 4.
Tratamiento de la APP en la rotura de bolsa en los hospitales españoles, año 2005
| En casos de RPM < 34 semanas sin signos de corioamnionitis y contracciones hacen tocólisis | Sí | No |
| 34 (82,9%) | 7 (17,1%) | |
| EN caso de RPM < 34 semanas sin signos de corioamnionitis y contracciones administran corticoides | Sí | No |
| 40 (97,6%) | 1 (2,4%) | |
| En casos de RPM < 34 semanas con signos de corioamnionitis y contracciones administran corticoides | Sí | No |
| 20 (48,9%) | 21 (51,1%) | |
| En casos de RPM < 34 semanas sin signos de corioamnionitis administran antibióticos | Sí | No |
| 41 (100%) | 0 |
Este grupo de 41 hospitales, 37 públicos y 4 privados, es una muestra bastante representativa de los hospitales españoles, sobre todo de los hospitales públicos. También es representativa en cuanto a la distribución geográfica y el número de partos, por lo que se puede deducir que representa de forma ajustada la forma de tratar, en los hospitales españoles, la APP durante el año 2005.
El tratamiento de la APP mediante hidratación se basa en que ésta inhibe la liberación de oxitocina; 34 (82,9%) hospitales la hacen, aunque posiblemente la respuesta de muchos de ellos se refería a tener a la paciente correctamente hidratada pero no a la hiperhidratación necesaria para lograr la inhibición de liberación de oxitocina. Es evidente que todos los hospitales administran fluidos a sus embarazadas para conseguir una hidratación normal. La tendencia es a utilizar cada vez menos la hiperhidratación por la falta de evidencia en cuanto a su eficacia y, sobre todo, por el miedo a favorecer el edema pulmonar, sobre todo cuando a la vez se hace tocólisis con betamiméticos. En el caso de los embarazos múltiples debe contraindicarse.
Después de 50 años de realizar tocólisis, se ha llegado a 3 conclusiones aceptadas casi universalmente: a) la tocólisis no ha logrado disminuir las tasas de prematuridad; b) la tocólisis sirve, fundamentalmente, para demorar el parto el tiempo necesario para el tratamiento con corticoides y, si se considera conveniente, trasladar a la madre a un centro adecuado para tratar al recién nacido, y c) la prolongación de la gestación, aunque sea por muy pocos días, disminuye la mortalidad y morbilidad perinatal.
Hasta hace pocos años, en España, al igual que en la mayoría de los países europeos, los tocolíticos más utilizados eran los betamiméticos, pero existen otros, como los inhibidores de la síntesis de las prostaglandinas, el sulfato de magnesio y, últimamente, los inhibidores de los canales del calcio (nifedipino) y los antagonistas de la oxitocina (atosiban). De las publicaciones de los últimos años puede deducirse que todos los tocolíticos tienen una acción inhibidora de las contracciones uterinas muy parecida y lo que los diferencia son los efectos secundarios12,13.
El 73,7% de nuestros hospitales utiliza atosiban como tocolítico de elección. Además hay 3 hospitales más que lo utilizan sólo cuando están contraindicados los betamiméticos. El segundo más utilizado son los betamiméticos, con el 21,9%, seguido por el nifedipino, con el 2,9%. De los tres, los betamiméticos son los que más efectos secundarios tienen pero, a pesar de ello, los utiliza un importante porcentaje de hospitales. Posiblemente esto se debe, por una parte, a que el ritodrino, que es el betamimético utilizado habitualmente, es un medicamento barato y también a que el médico está muy familiarizado con su manejo y sus efectos secundarios.
El nifedipino, como tocolítico, es objeto de controversia; es un fármaco con buen efecto tocolítico, con menos efectos secundarios que el ritodrino, barato y de fácil administración, pero tiene el inconveniente de que se han descrito efectos secundarios graves y que su prescripción puede plantear problemas legales. Con el nifedipino hay descritos casos puntuales graves de edema agudo de pulmón, de hipoxia materna y de otras graves complicaciones14–16. En una reciente revisión se llega a la conclusión de que casi todos los trabajos con nifedipino se han realizado en gestantes sanas. Basándose en sus propiedades farmacológicas, debe tenerse mucha precaución con su utilización en embarazadas con problemas cardiovasculares, en los casos de infección intrauterina y en gestaciones gemelares17.
Sin duda, el aspecto más polémico es el legal. En la ficha técnica del Adalat®, el bloqueador de los canales del calcio empleado, se señala de forma inequívoca que está contraindicada su utilización durante el embarazo. Ante esta situación, la Internacional Preterm Labour Council18 señala que, en 2002, el Royal College of Obstetricians and Gynecologists se dirigió al laboratorio que comercializa el medicamento preguntándole cuáles eran los argumentos en los que se basaba la contraindicación durante el embarazo. La respuesta del médico director del laboratorio fue la siguiente: «El Adalat® está específicamente contraindicado en el embarazo y, por ende, su uso como tocolítico, y si hubiese algún efecto adverso la responsabilidad será del que haya hecho la indicación». Ante esta situación, es lógico que los tocólogos tengan reticencias para prescribir este medicamento.
A diferencia de los otros dos tocolíticos, con el atosiban se han realizado menos trabajos pero están hechos con mejor metodología y una casuística más numerosa19–21. Es el más utilizado en nuestros hospitales, posiblemente por que tiene una acción tocolítica, al menos igual que la de los otros, por sus pocos efectos secundarios y por ser un fármaco cuya única indicación es la inhibición de las contracciones uterinas. El mayor inconveniente que tiene es que es muy caro.
No existe evidencia de la eficacia de los tocolíticos después de un tratamiento eficaz durante 48h. El metaanálisis más importante realizado en relación con este aspecto no encontró ninguna utilidad al tratamiento tocolítico de mantenimiento22. Otra publicación, que incluye 4 revisiones y 2 trabajos recientes, llega también a la misma conclusión23. A pesar de estos trabajos, el 48,8% de nuestros hospitales realiza tocólisis de mantenimiento y, de ellos, el 40% con betamiméticos y los 12 hospitales restantes con nifedipino o atosiban (tabla 2). En muchas ocasiones, la prescripción de tocólisis de mantenimiento se hace porque la paciente siente molestias que identifica con contracciones o porque le angustia suprimir la medicación.
El pronóstico de los recién nacidos entre la 35 y 36 semanas es prácticamente igual que el de los nacidos a término, por lo que la tocólisis, salvo en casos puntuales, no tiene mucho sentido. Esto explica que ningún hospital realice tocólisis después de la semana 34. Dados los buenos resultados de los cuidados neonatológicos, algunos se cuestionan la eficacia de la tocólisis entre la semana 32 y 3424.
Después de la publicación del National Institutes of Health Consensus Development Conference Statement on Effects of Corticoids for Fetal Maturation on Perinatal Outcomes25 y del metaanálisis Crowley26,27, los beneficios de la administración de corticoides a la madre, en los casos de APP, para mejorar el pronóstico perinatal son aceptados de forma universal. Los hospitales que han participado en la encuesta no son una excepción y todos realizan corticoterapia en estos casos.
La betametasona administrada en 2 dosis de 12mg con un intervalo de 24h se realiza en el 92,7% de los hospitales, mientras que el protocolo de dexametasona (6mg por vía intramuscular cada 12h durante 48h) sólo lo utiliza el 7,3%. La preferencia de uno u otro corticoide ha variado en función de los trabajos que han ido surgiendo. El análisis de trabajos aleatorizados demuestra la eficacia de los dos corticoides26. Dos trabajos posteriores encontraron que la betametasona producía un aplanamiento de los trazados de frecuencia cardíaca fetal28,29. Algunos autores dedujeron que, en los casos de retardo del crecimiento fetal, sería más conveniente utilizar la dexametasona porque, al no tener efectos sobre los trazados de frecuencia, evitaría algunas extracciones fetales innecesaria30. En la actualidad hay argumentos a favor de la utilización de la betametasona como son: a) un metaanálisis en el que se demuestra que sólo la betametasona previene las complicaciones neonatales27; b) la exposición intrauterina a la betametasona se asocia a una disminución de la leucomalacia31; c) la administración antenatal de corticoides a ratones muestra diferencias de comportamiento y aptitudes a favor de la betametasona32, y d) aunque los beneficios sean similares para la dexametasona y la betametasona, esta última tiene la ventaja de su administración: sólo hay que poner 2 inyecciones.
El American College of Obstetricians and Gynecologists recomienda la administración de los corticoides entre la semana 24 y 34. En la encuesta no se preguntó la edad gestacional de comienzo, pero parece lógico pensar que debe estar alrededor de las 24 semanas. Es posible que existan pequeñas variaciones en función de los resultados de los servicios de neonatología de los hospitales. En la actualidad existe la tendencia a utilizarlos antes de la semana 24, aunque no hay evidencia de su eficacia. En cuanto a la fecha límite de las 34 semanas, es aceptada mayoritariamente, como lo demuestra el hecho de que el 95% de los hospitales no realizan corticoterapia después de esta edad gestacional. Los dos hospitales que la realizan después de esa fecha lo hacen en caso puntuales.
A pesar de que se acepta de forma universal la utilidad de la corticoterapia en el parto prematuro y de que se dispone de un protocolo para su realización en todos los hospitales, no se utiliza, cuando está indicada, en el 100% de los casos. Como puede verse en la tabla 3.1, en ninguno de los hospitales se realiza en todos los casos, y hay algunos en los que no se realiza en más del 10% de las APP. Esto pone de manifiesto la necesidad de insistir a los obstetras de guardia sobre la utilidad de la corticoterapia. Como señalan Meadow et al33, siempre hay un desfase entre el porcentaje de cumplimiento del protocolo que los jefes creen que se realiza y el que se cumple en la realidad. Una fórmula que ha demostrado ser eficaz es realizar un seguimiento exhaustivo del protocolo y presentar los resultados en sesiones clínicas.
En los últimos años, se han demostrado efectos beneficiosos de los corticoides durante una semana a partir de las 24h de haber administrado la primera dosis, a pesar de que el parto se haya producido antes de administrar la segunda. Elimian et al34 encontraron que cuando sólo daba tiempo a la administración de la primera dosis, disminuía el porcentaje de recién nacidos tratados con medicamentos vasopresivos, de hemorragias intraventriculares y de muertes neonatales. Los 41 hospitales de la encuesta, conscientes de las ventajas del tratamiento con corticoides, aunque sea incompleto, incluyen en sus protocolos la administración de la primera dosis, aunque se prevea que no habrá tiempo para administrar la segunda dosis. En 19 de nuestros hospitales no es posible realizar el tratamiento completo en el menos del 5% de los casos, y existen 8 en los que el tratamiento incompleto se hace en más del 10% de los casos (tabla 3.2B). Esto demuestra lo convencidos que están los médicos de guardia de la utilidad de la corticoterapia, aunque el tratamiento sea incompleto.
Todos los hospitales que han participado en la encuesta administran la misma dosis de corticoide en los embarazos múltiples que en los con feto único. A pesar de que existen argumentos para sospechar que la dosis de corticoides que se administra en los casos de embarazo múltiple no es suficiente, se sabe que debe existir un valor mínimo de corticoides para ejercer su acción beneficiosa35. Por otro lado, estudios sobre la vida media de la betametasona, en los embarazos gemelares, demuestran una disminución del 20% con relación a los embarazos con feto único36. Todo ello hace pensar que posiblemente la dosis en los casos de embarazos múltiples debe ser mayor, aunque se sabe que a partir de las 31 semanas el índice de madurez pulmonar en los fetos gemelares está aumentada37. En tanto estas facetas se aclaren, parece lógico recomendar la misma dosis de corticoides para los embarazos múltiples.
En relación con las dosis de repetición, se han descrito efectos secundarios en el crecimiento fetal y el desarrollo neurológico. En trabajos de experimentación se han descrito retardo del crecimiento entre el 15 y el 27% de corderos de ovejas tratadas con dosis de repetición de corticoides38. En trabajos retrospectivos, en los hijos de mujeres tratadas con 2 ciclos de corticoides se encontró también una reducción del peso de sus hijos39. En el trabajo de cohorte prospectivo australiano, después de ajustar por edad gestacional, sexo, tabaco, grupo étnico y paridad, se encontró una disminución del 9% en el peso de los hijos de las madres que habían sido tratadas con 3 ciclos de corticoides40. Sin embargo, a los 3 años de vida el peso se igualaba con el peso de los otros niños. Por el contrario, un metaanálisis41 y un trabajo aleatorizado42 no encuentran diferencias en el peso de los dos grupos de niños, los tratados y los no tratados.
En relación con los posibles efectos en el sistema nervioso central, en estudios realizados en ovejas y monas se ha encontrado que la administración de corticoides a las madres produce una reducción del peso del encéfalo de los recién nacidos y una disminución de la mielinización43. En trabajos que siguen a niños entre 3 y 12 años no se ha encontrado diferencias en el área cognoscitiva ni en el seguimiento escolar26. Otros estudios han demostrado una ligera disminución del perímetro cefálico de los recién nacidos de madres tratadas con corticoides, pero a los tres años se igualaba al de los niños del grupo control40. Por último, en un estudio retrospectivo con 883 niños, en los que no habían recibido corticoides se encontró leucomalacia periventricular en el 8,4% frente al 4,4% en los niños cuyas madres habían sido tratadas con corticoides31. En conclusión, si bien parece que en la experimentación animal los corticoides pueden producir un retraso fetal intrauterino, en la especie humana esto no sucede o, si tiene lugar, el crecimiento se iguala al tercer año de vida. De todas formas, las ventajas de la administración de corticoides en la APP superan de forma amplia a los posibles inconvenientes.
El tratamiento en los casos de rotura prematura de membranas plantea problemas en cuanto a la utilización de corticoides, antibióticos y tocolíticos. En los casos de rotura prematura de membranas sin signos de corioamnionitis y contracciones, 34 (82,9%) de los hospitales hacen tocólisis, aunque hay 4 que especifican que la tocólisis la hacen solamente durante el tiempo necesario para realizar el tratamiento (tabla 4). Existe bastante unanimidad para hacer tocólisis en estos casos de rotura prematura de membranas, aunque algunos sólo durante el tiempo necesario para administrar los corticoides. En la literatura médica no existe unanimidad sobre la conveniencia de hacer tocólisis en estos casos. Para algunos la tocólisis, en los casos de rotura prematura de membranas antes de las 34 semanas, disminuye la morbimortalidad perinatal pero incrementa el riesgo de infección del líquido amniótico, sobre todo si el embarazo se prolonga más de una semana44. Para otros, la tocólisis, en estos casos, no prolonga la gestación ni disminuye la morbilidad perinatal45. En una encuesta sobre el manejo de la rotura prematura de membranas realizada entre 1.375 especialistas norteamericanos por el Center for Research in Women's Health, de la Universidad de Alabama, el 73% realizaba tocólisis, la mayoría (88%) durante 48h, tiempo necesario para poder efectuar el tratamiento con corticoides46. En cuanto a la administración de corticoides, en nuestros hospitales existe casi unanimidad en administrarlos si no hay signos de corioamnionitis (97,6%); por el contrario, cuando hay signos de corioamnionitis sólo la mitad de los hospitales administra corticoides (48,9%). Esta reticencia a la administración de corticoides en casos de rotura prematura de membranas con signos de corioamnionitis se debe al riesgo de agravar el cuadro infeccioso. La mayoría de los trabajos confirma este riesgo cuando se realizan tratamientos repetidos47,48. Cada vez hay más acuerdo en ofrecer a las mujeres corticoterapia junto con tratamiento con antibióticos cuando la rotura prematura de membranas se produce antes de la semana 3249,50.
En cuanto a la administración de antibióticos en la rotura prematura de membranas sin signos de corioamnionitis, hubo unanimidad entre todos los hospitales. Esta postura se basa en los datos de la bibliografía en la que se señalan los beneficios de los antibióticos en estos casos. En una reciente revisión de la Cochrane, en la que se incluyeron 19 estudios, se llegó a la conclusión de que la administración de antibióticos en los casos de rotura de membranas antes de las 37 semanas tiene los siguientes beneficios: reduce la incidencia de corioamnionitis; disminuye el número de nacidos en las 48h siguientes, y también disminuye los marcadores de morbilidad neonatal; infección neonatal, uso de surfactante, oxigenoterapia y ecografía cerebral anormal51. En esta revisión se concluye que la combinación de amoxicilina más ácido clavulánico se asoció a un mayor riesgo de enterocolitis necrotizante neonatal. En la actualidad, los antibióticos más frecuentemente utilizados son: penicilinas, eritromicina, cefalosporinas, gentamicina y clindamicina. Cualquiera sea la combinación de antibióticos, debe tener un espectro eficaz contra el estreptococo betahemolítico.