Las enfermedades tiroideas son la segunda alteración endocrina en las mujeres en edad reproductiva después de la diabetes, por lo que es frecuente la asociación entre gestación y disfunción tiroidea.
En este sentido conocemos que1,2:
- -
Tanto el hipertiroidismo como el hipotiroidismo pueden tener su primera manifestación durante el embarazo.
- -
El embarazo influye en la normal función de la tiroides.
- -
Las disfunciones tiroideas pueden afectar la fertilidad de la mujer, el curso del embarazo establecido, la salud fetal y el estado materno y del recién nacido en el posparto.
- -
La función tiroidea materna y la fetal están íntimamente ligadas.
- -
Los cambios gravídicos pueden simular en ocasiones la sintomatología de las alteraciones tiroideas.
- -
Cuadros gestacionales como la hiperémesis gravídica o la mola hidatiforme pueden alterar también la función tiroidea.
Debido a esta influencia recíproca entre gestación y enfermedad tiroidea, es necesaria una buena comunicación entre el endocrinólogo y el obstetra.
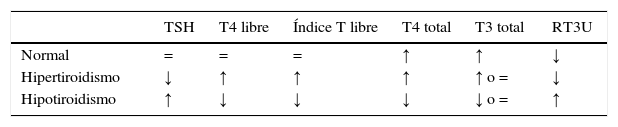
FisiologíaEn la tabla 1 se pueden observar los cambios de la función tiroidea tanto en gestaciones normales como en embarazos complicados con enfermedad tiroidea.
Con respecto al paso transplacentario de las diferentes hormonas tiroideas y de distintas medicaciones que se emplean en el tratamiento de las enfermedades tiroideas hay que señalar lo siguiente3:
- -
TSH materna: no atraviesa la placenta.
- -
Hormona tiroxina (T4)-triyodotironina (T3) maternas: solo pequeñas fracciones atraviesan la placenta.
- -
TRH, yodo, TSI, TBII: cruzan la placenta.
- -
Tionamidas (propiltiouracilo [PTU] y metimazol): cruzan la placenta.
- -
β-bloqueantes adrenérgicos: cruzan la placenta.
La tiroides fetal comienza a concentrar yodo desde la semana 10-122 y tiene el control hipofisario mediante la TSH desde la semana 20 de gestación.
HipotiroidismoEl embarazo influye de forma notable en la función de la glándula tiroidea. Para alcanzar el incremento de la actividad metabólica que requiere este periodo, la tiroides debe aumentar la producción de hormona tiroidea en un 50%, por lo que el aporte de yodo en la dieta debe también incrementarse en un 50% respecto a las recomendaciones preconcepcionales. El tamaño de la glándula se incrementa en un 10% en las gestantes con un aporte de yodo adecuado en la dieta, y entre un 20 y un 40% en las gestantes con una dieta pobre en yodo, dando lugar a la aparición de bocio4.
En resumen, el embarazo es una prueba de estrés para la tiroides. Una tiroides que funciona con normalidad y tiene un aporte de yodo adecuado se adapta a las nuevas necesidades aumentando la producción hormonal. En gestantes con una reserva tiroidea limitada previa (tiroidectomía parcial, radioterapia cervical, hipotiroidismo subclínico previo a la gestación, etc.) o en caso de una dieta deficitaria en yodo, el embarazo puede dar lugar a la aparición de un hipotiroidismo.
DiagnósticoEn ausencia de raras excepciones (tumor hipofisario secretor de TSH, hipotiroidismo central con TSH biológicamente inactiva, etc.), se define hipotiroidismo primario materno ante la presencia de TSH elevada durante el embarazo.
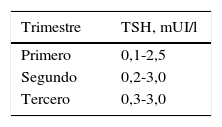
La hCG producida por la placenta tiene un comportamiento biológico similar a la TSH, estimulando la función tiroidea desde etapas precoces del embarazo. El rango normal de referencia de la TSH durante la gestación, bajo la influencia de la hCG, es inferior al rango normal de referencia de la TSH fuera del embarazo. Por ello es muy importante utilizar valores de referencia para TSH específicos para cada trimestre de gestación (tabla 2).
El hipotiroidismo materno tiene efectos adversos graves sobre el feto y se asocia a un aumento de la morbimortalidad perinatal. La gestante con hipotiroidismo no tratada tiene mayor riesgo de complicaciones obstétricas, como preeclampsia, desprendimiento prematuro de placenta, hemorragia posparto y recién nacido de bajo peso. Especialmente preocupante es la relación encontrada en distintas publicaciones entre el hipotiroidismo clínico inadecuadamente tratado en el embarazo y alteraciones en el neurodesarrollo del cerebro fetal, con más probabilidad de tener un hijo con alteración del desarrollo neurológico y con puntuaciones más bajas en los test de inteligencia realizados en la infancia5. El tratamiento con levotiroxina en estas pacientes, iniciado idealmente en el primer trimestre de gestación, ha demostrado disminuir los riesgos asociados al hipotiroidismo en este periodo. Por ello, las gestantes con hipotiroidismo deben recibir tratamiento con hormona tiroidea para normalizar los valores de TSH, idealmente en el primer trimestre de gestación6.
Por esta razón se recomienda que la identificación de gestantes con hipotiroidismo tenga lugar durante la visita prenatal o en el momento del diagnóstico del embarazo.
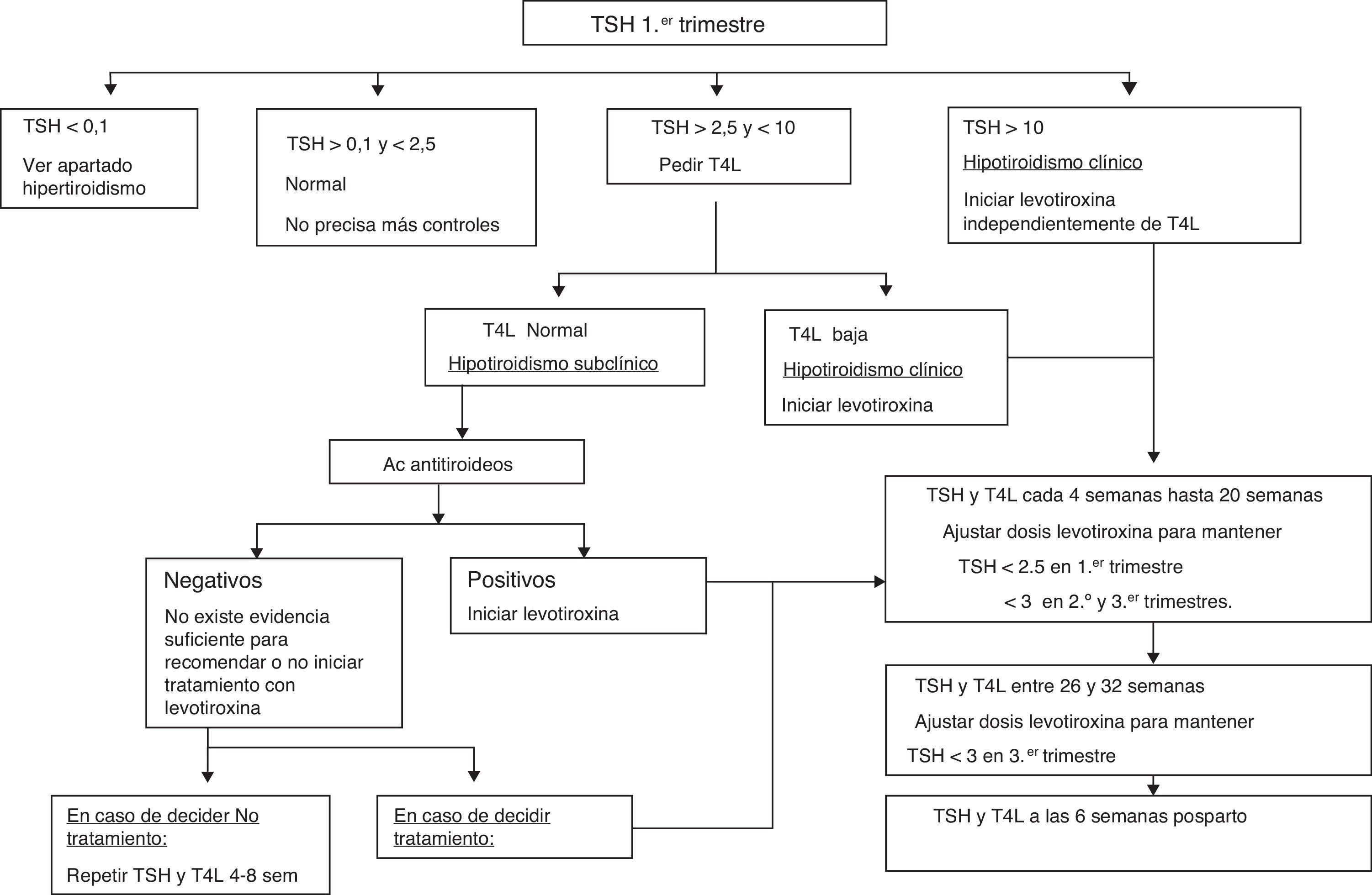
Cuando encontramos una TSH elevada debemos determinar la hormona tiroidea T4 libre (T4L) para clasificar a la gestante como hipotiroidismo clínico si la T4L está disminuida, o hipotiroidismo subclínico si la T4L es normal. La distinción entre hipotiroidismo clínico y subclínico es importante, ya que en todos los trabajos publicados los efectos sobre la madre y el feto atribuibles a la enfermedad tiroidea durante el embarazo son más consistentes para el hipotiroidismo clínico que para el subclínico.
ClínicaLos síntomas clásicos del hipotiroidismo son consecuencia de una reducción de la actividad metabólica. Por ello, la gestante con hipotiroidismo puede presentar astenia, estreñimiento, intolerancia al frío, calambres musculares, caída del cabello, piel seca, reflejos tendinosos con fase de reposo prolongada y síndrome del túnel carpiano. Se estima que un tercio de las gestantes con hipotiroidismo tiene los síntomas clásicos, otro tercio tiene clínica moderada, y el resto de las pacientes están asintomáticas, a pesar de existir una alteración funcional evidente7.
EtiologíaTiroiditis de HashimotoSe caracteriza por la presencia de anticuerpos antiperoxidasa (anti-TPO) (en casi todos los pacientes) y anticuerpos antitiroglobulina (anti-TG) (50-70% de los pacientes)2. Su prevalencia en mujeres en edad genésica es del 8-10%. Sin embargo, el 75-80% de las pacientes con tiroiditis de Hashimoto están eutiroideas2.
Hipotiroidismo postratamiento ablativoEl hipotiroidismo secundario al tratamiento ablativo del hipertiroidismo, tanto con cirugía como con 131I, es la segunda causa de hipotiroidismo en mujeres en edad gestante.
Fármacos- -
Antitiroideos: tionamidas, yoduros, litio.
- -
Inductores enzimáticos que aceleran el aclaramiento de tiroxina2: carbamacepina, fenitoína, rifampicina.
- -
Amiodarona. Inhibe la conversión de T4 en T3 y puede interferir en la acción de la T32.
- -
Hidróxido de aluminio, colestiramina, sulfato ferroso y sucralfato pueden alterar la absorción intestinal de levotiroxina2.
- -
Inmunomoduladores: interferón α y β, interleucina 2.
Importante en zonas endémicas de déficit de yodo, como es España. Muchas gestantes son clínicamente eutiroideas, pero presentan hipotiroidismo subclínico. El diagnóstico se realiza con la determinación de yodurias en orina de 24h.
Otras causasTiroiditis aguda (supurativa, piógena o bacteriana), tiroiditis subaguda dolorosa (granulomatosa, de células gigantes o de De Quervain), tiroiditis silente indolora o linfocitaria transitoria (tiroiditis posparto [TP]).
ManejoHipotiroidismo pregestacionalLos requerimientos de levotiroxina aumentan precozmente, hacia las 4-6 semanas de embarazo, estabilizándose hacia las 16-20 semanas. Por ello es importante el consejo prenatal a las mujeres hipotiroideas en edad fértil.
Se debe aconsejar a estas pacientes un estudio preconcepcional de la función tiroidea, y ajustar el tratamiento de levotiroxina para alcanzar niveles de TSH por debajo de 2,5mUI/l en aquellas mujeres que planean un embarazo.
Otros autores afirman que si el tratamiento de sustitución es de larga duración y se ha ajustado antes del embarazo, para mantener la TSH inferior a 2,5mUI/l no suele precisarse aumento de la dosis8, y que cuando la causa del hipotiroidismo es la ablación de la tiroides, el 75% de las pacientes requieren aumento de dosis, frente al 47% de aquellas pacientes con hipotiroidismo secundario a una tiroiditis de Hashimoto9.
Es conveniente tratar el hipotiroidismo subclínico, especialmente si los anticuerpos antitiroideos son positivos, ya que en este caso es más frecuente la evolución a hipotirodismo franco.
Para ajustar la dosis se deben reevaluar los niveles de hormonas tiroideas cada 4 semanas hasta las 16-20 semanas, y al menos una vez entre las 26 y 32 semanas. El objetivo es mantener los niveles de TSH dentro del rango normal para cada trimestre de la gestación (tabla 2).
Se recomienda separar 4-6h la toma de levotiroxina de algunos suplementos como carbonato cálcico, sulfato ferroso o hidróxido de aluminio, ya que disminuyen la absorción de aquella. La ingesta de levotiroxina debe hacerse con el estómago vacío un mínimo de 30min antes del desayuno.
Tras el parto se debe reducir la dosis de levotiroxina a aquella preconcepcional, y reevaluar los niveles de TSH 6 semanas después.
Mujeres eutiroideas con anticuerpos antitiroideos positivosAquellas mujeres con autoinmunidad conocida previamente al embarazo pero con función tiroidea normal tienen mayor riesgo de evolución a hipotiroidismo en la gestación. Por ello se deben reevaluar mediante determinación de TSH cada 4 semanas hasta la 16-20, y al menos una vez entre la semanas 26 y 324.
Las mujeres con anticuerpos antitiroideos positivos tienen un mayor riesgo de desarrollar una TP. Por eso, se recomienda reevaluar la función tiroidea tras el parto.
Mujeres sin enfermedad tiroidea conocida previaCribado de disfunción tiroideaExiste una conocida controversia entre distintas sociedades científicas, ginecológicas y endocrinológicas respecto a la recomendación o no de que se realice un cribado universal para la detección de disfunción tiroidea durante la gestación.
La guía de la American Thyroid Association de 20114, así como la de la Endocrine Society de 20076, recomiendan el cribado selectivo de pacientes de riesgo en la visita antenatal o en el momento del diagnóstico del embarazo si no se ha realizado antes. Se consideran pacientes de riesgo aquellas que presentan alguna de las condiciones detalladas en la tabla 3.
Pacientes con riesgo de disfunción tiroidea en el embarazo
| Historia personal de disfunción tiroidea, bocio o cirugía de tiroides |
| Historia familiar de disfunción tiroidea |
| Pacientes con anticuerpos antitiroideos u otra enfermedad autoinmune |
| Clínica de hipotiroidismo |
| Diabetes tipo 1 |
| Infertilidad o antecedente de aborto o parto pretérmino |
| Radioterapia previa sobre cabeza o cuello |
| IMC>40kg/m2 |
| Edad igual o superior a 30 años |
| Mujeres tratadas con amiodarona, litio o expuestas a contrastes radiológicos yodados en las 6 semanas previas |
| Embarazada en zonas con yododeficiencia en la dieta |
Sin embargo, estudiar solo a las mujeres embarazadas de alto riesgo podría dejar sin diagnóstico a cerca de un tercio de las mujeres con un hipotiroidismo clínico.
Aunque varios estudios asocian el hipotiroidismo subclínico durante el embarazo con problemas obstétricos y problemas neurocognitivos en los hijos de estas pacientes, no hay evidencia del posible beneficio de su tratamiento con tiroxina. Sin embargo, existe un acuerdo generalizado sobre la necesidad del tratamiento del hipotiroidismo clínico durante la gestación y los riesgos que podría ocasionar la abstención terapéutica. Por tratarse de una enfermedad frecuente, de fácil diagnóstico y para la que se dispone de un tratamiento efectivo y exento de riesgos, la Sociedad Española de Endocrinología y Nutrición (Grupo de Trabajo de Trastornos por Deficiencia de Yodo y Disfunción Tiroidea) y la Sociedad Española de Ginecología y Obstetricia recomiendan que se evalúe precozmente (antes de la semana 10 de gestación) la función tiroidea a todas las mujeres embarazadas10. Para ello se aconseja realizar determinación de TSH en suero antes de la semana 10 de gestación. Ante una TSH elevada, pediremos una determinación de T4L.
Podremos encontrarnos las siguientes situaciones:
Hipotiroidismo subclínico- -
Definición: TSH>2,5mUI/l y<10mUI/l asociada a T4L normal.
- -
Prevalencia: 2-3% de las embarazadas.
La gestante con hipotiroidismo subclínico no tratada tiene más riesgo de desarrollar complicaciones como preeclampsia, desprendimiento prematuro de placenta, hemorragia posparto o recién nacido de bajo peso, así como de tener un hijo con alteración del desarrollo neurológico o con puntuaciones más bajas en las pruebas de inteligencia realizadas en la infancia. Esto ha sido documentado en mujeres con hipotiroidismo subclínico y anticuerpos antitiroideos positivos.
En estudios retrospectivos el tratamiento con levotiroxina en este grupo de pacientes disminuye el riesgo de complicaciones obstétricas, pero no se ha demostrado que modifique el desarrollo neurológico a largo plazo de la descendencia. Sin embargo, dado que existe un potencial beneficio de tratar a estas pacientes, y dado que la medicación no conlleva riesgo para el feto, la mayoría de los autores aconsejan el tratamiento con levotiroxina en estas mujeres. No obstante, es necesario evaluar el beneficio de este tratamiento con ensayos clínicos diseñados con este fin6.
Si los anticuerpos antitiroideos son negativos, no hay evidencia ni a favor ni en contra del tratamiento. La mayoría de los autores recomiendan también el tratamiento de gestantes con hipotiroidismo subclínico con anticuerpos antitiroideos negativos.
Hipotiroidismo clínico- -
Definición: TSH>2,5mUI/l asociada a T4L baja o TSH>10 con independencia de los niveles de T4L.
- -
Prevalencia: 0,3-0,5% de los casos diagnosticados por primera vez en el embarazo.
El tratamiento siempre está indicado.
Dosis de hormonas tiroideasHipotiroidismo clínico: iniciar tratamiento con levotiroxina (2-2,4μg/kg/día, aproximadamente 150μg/día) a dosis altas durante la primera semana, para normalizar rápidamente la función tiroidea, especialmente si el diagnóstico se efectúa durante el primer trimestre. Posteriormente reducir la dosis a 1,6μg/kg/día y reevaluar la TSH cada 4-6 semanas para ajustar dosis hasta la semana 20 y al menos una vez entre la 26 y la 32.
Hipotiroidismo subclínico: iniciar tratamiento con levotiroxina a dosis de 1μg/kg/día y reevaluar la TSH cada 4-6 semanas para ajustar dosis hasta la semana 20 y al menos una vez entre la 26 y la 32.
El objetivo del tratamiento es mantener los niveles de TSH dentro del rango normal para el embarazo, ajustados por trimestre (tabla 2).
Tras el parto, la paciente con hipotiroidismo subclínico diagnosticado en el embarazo suspenderá el tratamiento con levotiroxina y su función tiroidea deberá ser reevaluada 6 semanas después. La paciente con un hipotiroidismo franco diagnosticado durante el embarazo deberá reducir la dosis de levotiroxina en un 30% y reevaluar los niveles de TSH 6 semanas después.
En la figura 1 se sintetiza el protocolo de actuación que recomendamos tras el cribado de disfunción tiroidea en el primer trimestre de la gestación, basado en la guía de la American Thyroid Association para el diagnóstico y tratamiento de la enfermedad tiroidea durante el embarazo y el puerperio4. Debe llevarse a cabo de manera conjunta entre obstetras y endocrinólogos.
Prevención de la deficiencia de yodo4Durante el embarazo se debe aumentar la ingesta de yodo para que la tiroides materna pueda aumentar la síntesis de hormonas y la tiroides fetal pueda producirlas.
La yododeficiencia materna en la dieta tiene como resultado la incapacidad de la tiroides materna de incrementar su producción hormonal, y la deficitaria producción fetal de hormona tiroidea. La síntesis deficitaria de hormonas tiroideas provoca un incremento de la TSH materna y fetal, que actúa sobre la tiroides estimulando su crecimiento, y dando lugar a la aparición de bocio materno y fetal.
La deficiencia de yodo durante el embarazo se asocia a un aumento de la mortalidad perinatal, abortos, fetos muertos anteparto, bajo peso al nacer y alteraciones del neurodesarrollo.
A pesar del uso creciente de sal yodada, durante el embarazo esto no es suficiente para cubrir los requerimientos de yodo de la madre y el feto para una adecuada síntesis de hormonas tiroideas.
En los casos en que tengamos dudas de si la ingesta de yodo está siendo adecuada, disponemos de una test para evaluarlo. Se trata de la medición de la concentración de yodo en orina de 24h. Cuando la ingesta de yodo diaria es adecuada, la concentración de yodo en orina de 24h debería estar entre 150-250μg/l.
Las mujeres en edad de procrear deberían tener una ingesta media de yodo de 150μg/día. En el periodo preconcepcional y durante el embarazo y la lactancia, las pacientes deben incrementar la ingesta de yodo a 250μg/día. Durante toda la lactancia materna se debe mantener una ingesta de yodo de 250μg/día, para asegurar que la leche materna aporta 100μg de yodo al día al lactante. Para lograr este aporte diario de yodo se recomienda complementar la dieta con la administración, una vez al día, de suplementos nutricionales de yodo desde la visita preconcepcional a todas las mujeres, excepto a aquellas con hipertiroidismo activo no controlado.
Dosis recomendada de yoduro potásico:
- -
Mujeres que planifican la gestación: 100μg/día.
- -
Embarazo y lactancia: 150-200μg/día.
- -
Si la gestación es múltiple: 300μg/día.
- -
La dosis nunca debería ser superior a 500μg/día.
La tirotoxicosis se define como el síndrome clínico de hipermetabolismo e hiperactividad resultante del aumento en suero de T4 y/o T311.
Las causas más frecuentes de hipertiroidismo en el embarazo son la enfermedad de Graves y el hipertiroidismo gestacional. La enfermedad de Graves es la causa más común de hipertiroidismo autoinmune en la sociedad, apareciendo en el 0,1-1% (0,4% clínica y 0,6% subclínica) de todos los embarazos y pudiéndose diagnosticar por primera vez en el embarazo o como episodio recurrente de una historia pasada de hipertiroidismo12,13. El hipertiroidismo gestacional se diagnostica en el 1-3% de todas las gestaciones, dependiendo del área geográfica, y es la causa más frecuente de hipertiroidismo en el embarazo14.
DiagnósticoClínicoEl cuadro clínico de la tirotoxicosis se caracteriza por una hiperactividad generalizada: nerviosismo, insomnio, temblor, taquicardia, palpitaciones, aumento del número de deposiciones, hipertensión arterial, aumento de la sudoración, intolerancia al calor, pérdida ponderal, onicolisis, miopatía proximal y linfadenopatía. La enfermedad de Graves añade: exoftalmos y dermopatía (mixedema pretibial).
Debemos sospechar un posible hipertiroidismo en aquellas gestantes que asocien pérdida o falta de ganancia ponderal y taquicardia en reposo (>100lpm) que no disminuye con la maniobra de Valsalva1,2.
AnalíticoLa confirmación diagnóstica es la determinación analítica de un aumento sérico de T4-T3 con descenso de TSH1,2. Valores de TSH<0,05μU/ml son diagnósticos de hipertiroidismo en ausencia de causa productora de hipotiroidismo secundario (enfermedad hipofisaria2, hipotalámica, etc.). En las pocas ocasiones en que hay descenso de TSH con T4 normal, se debe determinar la T32.
El estudio inicial para confirmar un hipertiroidismo debe incluir las determinaciones de TSH y T4L. En los casos en el límite de la normalidad se recomienda repetir la analítica en el plazo de 3-4 semanas, pues tanto la madre como el feto toleran bien esta situación2.
Hay que recordar que los niveles de TSH están disminuidos en el primer trimestre de la gestación (hasta 0,03mIU/ml) como respuesta fisiológica al estímulo de la hCG sobre el receptor de TSH, con un pico de los niveles de hCG entre las semanas 7 a 11 de gestación15.
Diagnóstico diferencialAnte la presencia de valores disminuidos o indetectables de TSH y aumento de la T4 debe hacerse el diagnóstico diferencial entre la enfermedad de Graves y el hipertiroidismo gestacional.
- -
Enfermedad de Graves: presenta frecuentemente, además de la clínica común, bocio y exoftalmos. El hallazgo de unos anticuerpos antitiroideos estimulantes frente al receptor de TSH (TSI) positivos y un aumento de la T3 total nos confirmará el diagnóstico. Los anti-TPO son positivos en un 75-80% de las pacientes con enfermedad de Graves.
- -
Hipertiroidismo gestacional: hipertiroidismo transitorio, limitado a la primera parte del embarazo, en ausencia de anticuerpos antitiroideos. Puede asociarse a hiperémesis gravídica (con pérdida de peso, deshidratación y cetonuria), y más infrecuentemente a otras situaciones asociadas a tirotoxicosis inducidas por hCG, como la gestación múltiple, la mola hidatiforme o el coriocarcinoma16,17.
No se recomienda la realización de una ecografía de tiroides, ni un escáner con yodo radiactivo en el diagnóstico diferencial del hipertiroidismo en el embarazo.
Manejo- -
Enfermedad de Graves: un mal control de la función tiroidea se asocia con complicaciones obstétricas como abortos, hipertensión inducida por el embarazo, prematuridad, crecimiento intrauterino retardado, bajo peso al nacimiento y muerte fetal. Y en la madre, con complicaciones médicas como la crisis tirotóxica, con una mortalidad del 20-25%, y la insuficiencia cardiaca congestiva18. Por tanto, toda gestante diagnosticada de enfermedad de Graves debe recibir tratamiento antitiroideo.
- -
Hipertiroidismo gestacional: depende de la severidad de los síntomas. En mujeres con hiperémesis gravídica lo principal es controlar los vómitos y la deshidratación con sueroterapia intravenosa e ingreso hospitalario. No están indicados los fármacos antitiroideos, ya que los niveles de T4 vuelven a la normalidad entre las semanas 14 y 18 de gestación y no se ha demostrado una mejora en los resultados obstétricos tras su administración19 (nivel de evidencia ia).
Lo idóneo es establecer el diagnóstico y el tratamiento antes de la gestación. Esto permite el uso de isótopos radiactivos en su diagnóstico y el tratamiento con 131I y/o cirugía con menor riesgo. Los resultados gestacionales son mejores con tratamiento y normalización previos al embarazo que cuando se tratan inicialmente durante la gestación2.
El momento óptimo para el embarazo es cuando se haya conseguido una función tiroidea normal. Por tanto, se aconseja el control pregestacional de toda mujer con enfermedad de Graves, recomendándose el uso de anticonceptivos hasta el control de la enfermedad.
Las 2 vías terapéuticas aconsejables son:
Terapia ablativa- -
Cirugía: si desea embarazo en un periodo menor a 2 años y presenta títulos altos de anticuerpos TSI.
- -
Ablación con 131I: se recomienda realizar un test de embarazo 48h antes de este tratamiento para evitar la exposición de yodo al feto. Tras el tratamiento ablativo con 131I se aconseja posponer el embarazo hasta la normalización de la función tiroidea, que suele requerir entre 4 y 6 meses7.
Se debe aconsejar sobre la necesidad de mantener el tratamiento antitiroideo durante el embarazo (con las recomendaciones que se explican más adelante) y la necesidad de controles periódicos de los niveles hormonales (nivel de evidencia ia).
Tratamiento durante la gestaciónFármacos antitiroideos. Tionamidas: metimazol y propiltiouraciloSon los más aconsejados para el tratamiento del hipertiroidismo en el embarazo, ya que ambos inhiben con una eficacia similar la síntesis de hormona tiroidea.
DosisLas dosis de PTU y metimazol son 10:1 a 15:1 (100mg de PTU=7,5 a 10mg de metimazol). La dosis de inicio depende de la severidad de los síntomas y el grado de hipertiroxinemia. En general se aconseja empezar con dosis de metimazol de 5-15mg/día y de PTU de 50-300mg/día dividida en diferentes tomas.
Debido a que metimazol y PTU atraviesan la placenta, para evitar efectos deletéreos sobre el feto el objetivo debe ser mantener unos niveles de T4 justo en el límite superior de la normalidad utilizando la mínima dosis posible de fármacos antitiroideos. Para ello se debe medir la T4L y la TSH cada 2-4 semanas al inicio del tratamiento, y cada 4-6 semanas cuando la paciente esté eutiroidea12,20,21. No se recomienda la monitorización de la T3 en el manejo de la enfermedad de Graves.
Hay que tener especial cuidado con la sobredosificación de fármacos antitiroideos para evitar la tirotoxicosis materna y el bocio e hipotiroidismo fetal2,20.
En el primer trimestre de gestación, algunas mujeres con enfermedad de Graves experimentan una exacerbación de los síntomas. Después, en el segundo y tercer trimestre se produce una mejora de los síntomas y suele disminuirse la dosis de antitiroideos, llegando a suprimirse el fármaco en un 20-30% de los casos hacia las semanas 32-36 de gestación2,22. La excepción son las mujeres con niveles altos de anticuerpos, en las que se mantendrá la terapia hasta el momento del parto23 (nivel de evidencia ib).
La combinación de tionamidas con levotiroxina para asegurar el aporte hormonal al feto no está justificada2,22,24,25.
Efectos secundariosLos más frecuentes son las reacciones alérgicas, como el rash cutáneo26. Más rara (<1%), aunque potencialmente grave, es la aparición de agranulocitosis, generalmente durante los primeros 3 meses de tratamiento. Se debe avisar a la paciente de que ante la aparición de fiebre alta y dolor de garganta debe acudir a Urgencias informando de que está en tratamiento con antitiroideos. Si el hemograma detecta neutropenia o pancitopenia se debe ingresar a la paciente, suspender las tionamidas y planificar de forma individualizada el manejo posterior.
La exposición a metimazol puede producir malformaciones congénitas, fundamentalmente aplasia cutis y el «síndrome de embriopatía por metimazol», que incluye atresia esofágica y de coanas y facies dismórfica, por lo que se desaconseja su uso durante el primer trimestre de embarazo.
El PTU se ha relacionado con hepatotoxicidad en cualquier momento del tratamiento, por lo que se recomienda hacer una monitorización de las enzimas hepáticas y limitar su uso al primer trimestre de gestación27.
Por tanto, la pauta más aconsejada es la administración de PTU en el primer trimestre, seguida de metimazol en el segundo y tercer trimestre.
β-bloqueantes. PropranololSe utilizan para el control de los síntomas hipermetabólicos producidos por las hormonas tiroideas, sobre todo la taquicardia20.
La dosis empleada de propranolol suele ser 20-40mg/8-12h, hasta conseguir una frecuencia cardiaca de 80-90lpm2. Esta dosis debe disminuirse cuando se vayan controlando los síntomas, y suele retirarse a las 2-6 semanas del inicio.
Tratamientos prolongados con propranolol se han asociado a crecimiento intrauterino retardado, bradicardia fetal e hipoglucemia2,28.
YoduroSe utiliza generalmente en el preoperatorio de la tiroidectomía en una solución saturada de yoduro potásico (50-100mg/día) para bloquear la liberación de hormona tiroidea por la tiroides9.
Su empleo durante 7-10 días parece seguro y algunas veces beneficioso en pacientes con tirotoxicosis severa9. El tratamiento no debe superar las 2 semanas. Su uso crónico afecta al feto, induciendo bocio e hipotiroidismo2,20.
En el caso de que se administre de forma accidental 131I a una gestante se debe administrar yoduro para bloquear la tiroides y añadir tionamida. Para ser eficaz, el tratamiento debe ser instaurado en el margen de 7-10 días tras el accidente2.
TiroidectomíaProcedimiento reservado para las pacientes que no respondan al tratamiento médico necesitando altas dosis (metimazol de 30mg/día o PTU de 450mg/día), presenten alergias o no toleren los fármacos antitiroideos1. Se aconseja realizar la cirugía en el segundo trimestre de la gestación (nivel de evidencia ia).
La cirugía no se debe recomendar sin estudio ecográfico completo y punción con aguja fina, para descartar malignidad. Además, se debe realizar una determinación de los niveles de anticuerpos en suero para asesorar sobre el potencial riesgo de hipertiroidismo fetal29.
Se aconseja una preparación corta con betabloqueantes y yoduro potásico en solución (50-100mg/día)29.
Los efectos secundarios del tratamiento son: hipotiroidismo, hipoparatiroidismo (1-2%) y la lesión del nervio laríngeo recurrente (1-2%). En general, se considera que la tiroidectomía tiene un mayor riesgo que en las pacientes no gestantes24.
131IEstá contraindicado durante el embarazo. Se debe contraindicar la gestación hasta 6 meses después del tratamiento con 131I22 (nivel de evidencia ia).
Consideraciones sobre el 131I:
- -
Algunos autores afirman que en exposiciones accidentales antes de la semana 10 de embarazo no se han publicado anormalidades fetales30, pues no ha comenzado su función tiroidea hasta esos momentos9.
- -
Si la exposición es posterior a la semana 10, existe mayor riesgo de aparición de hipotiroidismo congénito, por lo que algunas guías valoran una posible interrupción del embarazo24.
- -
La lactancia está contraindicada hasta pasados 120 días del final del tratamiento.
- -
En caso de exposición accidental al 131I, se puede intentar el tratamiento con altas dosis de yodo con la intención de bloquear la tiroides30. Se puede añadir también PTU durante 10 días9.
Las indicaciones para solicitar una determinación de anticuerpos TSI tras una terapia ablativa, ya sea farmacológica o quirúrgica, son (nivel de evidencia iia):
- -
Madre con hipertiroidismo activo.
- -
Historia previa de tratamiento con yodo radiactivo.
- -
Historia previa de un hijo con hipertiroidismo.
- -
Tiroidectomía previa al embarazo.
- -
Niveles previos elevados de anticuerpos.
Unos títulos altos de anticuerpos TSI entre las semanas 22-26 de gestación son un factor de riesgo para desarrollar hipertiroidismo fetal o neonatal, ya que la concentración de anticuerpos empieza a disminuir hacia la semana 20 de gestación de forma fisiológica31,32. La prevalencia de hipertiroidismo fetal o neonatal es del 1-5% de todas las mujeres con historia actual o pasada de enfermedad de Graves y está asociada a un aumento de la morbimortalidad fetal y neonatal si no se trata. Por tanto, la determinación de TSI entre las semanas 24 y 28 es útil para detectar las gestaciones de riesgo (nivel de evidencia ib).
Control fetalEl bienestar fetal puede verse comprometido ante la presencia de títulos elevados de anticuerpos TSI, hipertiroidismo no controlado y preeclampsia33–35.
Mediante ecografía pueden detectarse signos de hipertiroidismo fetal, como taquicardia (<170lpm persistente durante 10min), crecimiento intrauterino restringido, presencia de bocio fetal (el signo ecográfico más precoz de disfunción tiroidea), maduración ósea acelerada, signos de insuficiencia cardiaca congestiva e hidropesía fetal12,31,35,36.
Por tanto, se recomienda la realización de ecografías seriadas durante el embarazo en gestantes con enfermedad de Graves, sobre todo en aquellas con niveles altos de anticuerpos, para valorar el crecimiento fetal, la cantidad de líquido amniótico, la presencia de malformaciones y la función cardiaca y la tiroides fetales.
La indicación de cordocentesis se debe reservar para casos extremos, cuando se detecte ecográficamente un bocio fetal en mujeres en tratamiento con tionamidas para determinar si el feto está hipo o hipertiroideo31,37. La presencia de anticuerpos TSI positivos no es una indicación para la realización de cordocentesis31 (nivel de evidencia ib).
Tratamiento intrapartoDurante el parto no existen riesgos especiales. Las exacerbaciones, incluida la crisis tirotóxica, son más frecuentes tras el parto.
A todos los recién nacidos de madres con enfermedad de Graves se les debe realizar una analítica para evaluar la presencia de disfunción tiroidea e instaurar tratamiento lo antes posible si fuese necesario (nivel de evidencia ib).
Tratamiento posnatalCuando la causa del hipertiroidismo es autoinmune, el cuadro tiende a empeorar tras el parto.
Si no está determinada la causa, el posparto es un buen momento para estudiar de forma adecuada a la paciente y dar un tratamiento definitivo.
Se debe evaluar al recién nacido para descartar bocio e hipertiroidismo transitorio.
LactanciaEl uso moderado de tionamidas durante la lactancia es seguro, aunque se detecte en pequeñas cantidades en la leche materna.
Se recomienda la administración de metimazol como primera opción debido a la hepatotoxicidad de PTU.
Las tionamidas deben administrarse en dosis divididas varias veces al día, y la toma debe realizarse preferiblemente después de que el neonato haya lactado38 (nivel de evidencia ia).
Tratamiento de la crisis tirotóxicaEs una verdadera urgencia médica. Ocurre en el 1% de los pacientes con hipertiroidismo y presenta una mortalidad del 25%.
Clínicamente suelen presentar fiebre, taquicardia desproporcionada para la fiebre, cambios mentales (agitación, convulsiones), vómitos, diarreas y arritmia cardiaca.
Se debe sospechar ante toda paciente con fiebre y estado mental alterado, se conozca o no su antecedente de hipertiroidismo39.
Suelen presentar un antecedente de infección, cirugía o parto.
El diagnóstico puede ser difícil. Por tanto, cuando se sospeche una crisis tirotóxica, se debe realizar una determinación hormonal (T4, T3, TSH) e iniciar el tratamiento sin esperar la confirmación.
Tratamiento de ataque de la crisis tirotóxica- -
Dosis de carga: PTU 600-800mg oral o metimazol 60-100mg vía rectal.
- -
Dosis de mantenimiento: PTU 150-200mg/4-6h oral o metimazol 10-20mg/8h vía rectal.
- -
Dexametasona 2mg/6h iv o im, repetir 4 dosis.
- -
Propranolol 20-80mg/4-6h oral o 1-2mg/5min iv hasta un máximo de 6mg; entonces 1-10mg/4h iv.
- -
Si la paciente no tolera los β-bloqueantes por un broncoespasmo: reserpina 1-5mg/4-6h im o guanetidina 1mg/kg/12h oral o diltiazem 60mg/6-8h oral.
- -
Fenobarbital 30-60mg/6-8h oral, como tratamiento de la agitación y para inducción enzimática y acelerar en lo posible la metabolización de la hormona tiroidea.
- -
A las 2h del PTU, cualquiera de las siguientes pautas:
- a)
Solución saturada de yoduro potásico 2-5 gotas/8h.
- b)
Yoduro sódico 0,5-1,0mg/8h vía iv.
- c)
Solución de lugol 8 gotas/6h.
- d)
Carbonato de litio 300mg/6h oral.
- a)
- -
Reposición de fluidos y electrolitos.
- -
Antipiréticos: salicilatos, paracetamol, medidas físicas, compresas húmedas frías.
- -
Aporte de calorías. Glucosa.
- -
Tratamiento etiológico de la causa desencadenante. Si es el parto, intentar detenerlo. No dejarlo evolucionar si las indicaciones maternas son más importantes que las fetales.
- -
Oxigenoterapia.
- -
Digoxina para el fallo cardiaco congestivo.
La TP es la aparición de una disfunción tiroidea en el primer año tras un parto en una mujer que previamente era eutiroidea4. Esta disfunción se debe a un trastorno autoinmune asociado a la presencia de anticuerpos antitiroideos (anti-TPO y anti-TG), que da lugar a una infiltración linfocítica de la glándula tiroides con cambios transitorios en la función tiroidea40,41.
PrevalenciaLa TP se presenta en el 5% de las mujeres que no tienen historia de enfermedad tiroidea, aunque varía entre los diferentes estudios8. Las mujeres con otras enfermedades autoinmunes tienen más riesgo de desarrollarla, asociándose a la diabetes tipo 1 (prevalencia del 25%), el lupus eritematoso sistémico (14%) y la enfermedad de Graves (prevalencia del 44%), entre otras41–43. En estas pacientes se recomienda la determinación de TSH a los 3 y 6 meses posparto (nivel de evidencia ib). El riesgo de recurrencia en siguientes embarazos es del 70%.
La posibilidad de desarrollar una TP está en relación con los niveles séricos de anticuerpos antitiroideos. Los anticuerpos anti-TPO están presentes en más del 90% de las pacientes con TP y son, además, marcadores útiles para predecir la aparición de TP, ocurriendo esta casi exclusivamente en mujeres portadoras de anticuerpos antitiroideos44. La presencia de altos títulos de anti-TPO al inicio de la gestación supone una probabilidad del 40-50% de desarrollar TP45.
Clínica y diagnósticoExisten 2 fases clínicas diferenciadas:
Fase de hipertiroidismo (primera fase): debido al aumento de hormonas tiroideas en sangre por la destrucción autoinmune de la glándula. La mayoría de las pacientes están asintomáticas durante esta fase aunque podría aparecer palpitaciones, sudoración, cansancio, etc.
Generalmente ocurre dentro de los primeros 4 meses posparto y se autolimita a 1-2 meses. En esta fase se debe hacer el diagnóstico diferencial con la enfermedad de Graves posparto. Si existen dudas puede realizarse una gammagrafía con I123, donde la captación será normal o baja en la TP comparada con una captación aumentada y difusa en la enfermedad de Graves. Durante la administración de I123 hay que suspender la lactancia.
Fase de hipotiroidismo (segunda fase): aparece entre los 3-8 meses posparto. Aproximadamente entre el 40-50% de las pacientes con TP van a percibir únicamente esta fase de la enfermedad, sin la fase hipertiroidea46,47. En este momento, el síntoma más frecuente es la depresión, aunque también puede aparecer cansancio, aumento de peso, etc.
Aunque no existe clara asociación entre TP y depresión posparto, se debería evaluar la presencia de hipotiroidismo en mujeres con depresión posparto48,49. Sobre todo pasados unos meses y no en el posparto inmediato (nivel de evidencia iia).
Desde el punto de vista analítico existen valores bajos de TSH y altos de T4L en la fase hipertiroidea, así como TSH alta y T4L bajo en la fase hipotiroidea, con los anticuerpos antitiroideos ya comentados positivos2. Cuanto más alto sea el título de anticuerpos, más probable es desarrollar un hipotiroidismo permanente.
TratamientoLa fase hipertiroidea a menudo no requiere tratamiento. Si lo precisa, se basa en el tratamiento sintomático mediante β-bloqueantes. El tratamiento con fármacos antitiroideos (tionamidas) no está indicado ni es eficaz porque no existe neosíntesis de hormona tiroidea1,9,40.
La fase hipotiroidea puede requerir tratamiento sustitutivo con levotiroxina en los casos de hipotiroidismo más prolongado y/o sintomático. Se recomienda mantener el tratamiento durante al menos 6 meses y reevaluar 5-6 semanas tras la retirada de la medicación con una determinación de TSH (posteriormente se realizará anual) para descartar la presencia de un hipotiroidismo permanente, ya que entre el 20-50% de las mujeres lo desarrollarán en el plazo comprendido entre 2-10 años40 (nivel de evidencia ia). Se debe evaluar a la paciente mediante determinación de TSH de forma anual y preconcepcional en los siguientes embarazos para el despistaje de hipotiroidismo4.
La lactancia no está contraindicada salvo en los casos de necesitar el uso de I123. Los antitiroideos como metimazol y PTU son seguros, así como los β-bloqueantes, salvo propranolol, que lo es a dosis bajas-moderadas, y atenolol, que probablemente lo sea, pero no está recomendado por hipotonía y debilidad en el recién nacido40.
ConsideracionesEn aquellas pacientes que conocen su estado de portadoras de anticuerpos antitiroideos, se recomienda una determinación de TSH entre las 6-12 semanas de gestación y a los 6 meses posparto6,50 (nivel de evidencia ia).
En pacientes con el antecedente de TP, asintomáticas y con TSH elevada pero<10UI/l y que no desean gestación no es necesario iniciar tratamiento, siendo recomendable repetir TSH en 4-8 semanas. Si la TSH es>10UI/l, se recomienda iniciar tratamiento sustitutivo con levotiroxina4,6 (nivel de evidencia iia).
Nódulo y cáncer de tiroidesLa presencia de nódulos tiroideos durante la gestación varía entre 3-21%4,51. La probabilidad de malignidad de un nódulo único se estima entre el 5-10%9 y el 5-30%1. La gestación per se no altera el pronóstico del cáncer de tiroides4.
La presencia de un nódulo solitario precisa una evaluación completa de la paciente mediante historia clínica (antecedentes de historia familiar de enfermedad tiroidea, carcinomas familiares, etc.), ecografía y test de función tiroidea (nivel de evidencia ia).
La ecografía tiroidea es la herramienta más útil para determinar el número y las características de los nódulos, permitiendo, además, la evaluación de los ganglios linfáticos locales. Ante la presencia de características ecográficas de malignidad es necesario el análisis citológico mediante punción-aspiración con aguja fina. Es segura durante la gestación y se puede realizar en cualquier momento de la misma. Se debe determinar TSH y T4L para descartar un nódulo tóxico. Las pruebas de función tiroidea suelen ser normales en mujeres con cáncer tiroideo4,52. Los estudios con radioisótopos están contraindicados durante la gestación2.
Los nódulos tiroideos que han sido catalogados como benignos mediante punción-aspiración con aguja fina no requieren cirugía durante la gestación, salvo que presenten un rápido crecimiento o haya cambios ecográficos sospechosos de malignidad (nivel de evidencia ib).
En el caso de nódulos malignos, el tratamiento de elección es la cirugía. En el caso de cáncer de tiroides bien diferenciado la cirugía se puede diferir al puerperio sin que afecte al pronóstico de las pacientes. Si se opta por esta vía, es precisa la realización de ecografía del cuello cada trimestre para valorar el rápido crecimiento del tumor, lo que indicaría la necesidad de cirugía en ese momento (nivel de evidencia ib). En estas pacientes en las que se difiere la cirugía al puerperio hay que considerar el tratamiento con hormona tiroidea que mantenga la TSH entre 0,1-1,5mUI/l. No ocurre así en el carcinoma medular y anaplásico, recomendándose en estos casos la cirugía durante la gestación. El 131I se pospone para el posparto.
Los Protocolos Asistenciales de la Sociedad Española de Ginecología y Obstetricia pretenden contribuir al buen quehacer profesional de todos los ginecólogos, especialmente los más alejados de los grandes hospitales y clínicas universitarias. Presentan métodos y técnicas de atención clínica aceptadas y utilizadas por especialistas en cada tema. Estos protocolos no deben interpretarse de forma rígida ni excluyente, sino que deben servir de guía para la atención individualizada a las pacientes. No agotan todas las posibilidades ni pretenden sustituir a los protocolos ya existentes en departamentos y servicios hospitalarios.
| Clasificación de las recomendaciones en función del nivel de evidencia disponible | |
| Ia | La evidencia científica procede a partir de metaanálisis de ensayos clínicos controlados y aleatorizados |
| Ib | La evidencia científica procede de al menos un ensayo clínico controlado y aleatorizado |
| IIa | La evidencia científica procede de al menos un estudio prospectivo controlado, bien diseñado y sin aleatorizar |
| IIb | La evidencia científica procede de al menos un estudio casi experimental, bien diseñado |
| III | La evidencia científica procede de estudios descriptivos no experimentales, bien diseñados como estudios comparativos, de correlación o de casos y controles |
| IV | La evidencia científica procede de documentos u opiniones de expertos y/o experiencias clínicas de autoridades de prestigio |
| Grados de recomendación | |
| A | Existe buena evidencia en base a la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica ia y ib) |
| B | Existe moderada evidencia en base a la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica iia, iib y III) |
| C | La recomendación se basa en la opinión de expertos o en un panel de consenso. (Recoge el nivel de evidencia IV) |