Grupo Cooperativo Español para el Estudio de la Sensibilidad Antimicrobiana de los Patógenos Urinarios de la Comunidad*
*Todos los investigadores y centros participantes en el estudio se citan al final del artículo.
INTRODUCCIÓN
La importancia de las infecciones del trato urinario (ITU) reside en la elevada frecuencia con la que se presentan en un amplio segmento de la población1. Hay que tener en cuenta que constituyen una de las patologías infecciosas más frecuentes2,3, y que es, sobre todo en mujeres, uno de los principales y más frecuentes motivos de asistencia a las consultas de atención primaria y especializada4,5.
Entre el 10 y el 20% de la población femenina experimenta una ITU baja en algún momento de su vida3. En las mujeres jóvenes no gestantes, la prevalencia de bacteriuria oscila entre el 1 y el 3%6, pero durante el embarazo este porcentaje puede aumentar al 2-7%, lo que dependerá de la edad, paridad y nivel socioeconómico. Además, los episodios recurrentes son muy frecuentes en mujeres embarazadas que tenían bacteriuria documentada al comienzo de la gestación3.
En mujeres gestantes, la importancia de las ITU reside en que conllevan un alto riesgo, tanto para el feto como para la madre1, y se consideran una complicación importante relacionada con el parto prematuro, recién nacidos de bajo peso, la infección y la mortalidad neonatal7-11. Así, Stoll et al7 encontraron que en la actualidad la mayoría de las infecciones neonatales precoces las causan los organismos gramnegativos (60,7%). Escherichia coli fue el patógeno aislado con mayor frecuencia (44% de los casos), y los grampositivos fueron responsables del 36,9% de las infecciones neonatales precoces.
Dentro de los múltiples factores relacionados con la sepsis neonatal precoz, uno a tener en cuenta es la oferta de profilaxis antibiótica que se hace a todas las mujeres con amenaza de parto pretérmino, en las que no está disponible el resultado del cultivo de Streptococcus agalactiae12.
Según los estudios realizados por Schuchat et al, la sepsis de inicio temprano por E. coli fue atribuible en el 69% de los casos a cepas con resistencia a ampicilina, y la mortalidad alcanzó el 40,9%, comparado con la ausencia de fallecimientos en el grupo de niños con E. coli sensible. Sin embargo, los niños con E. coli resistente nacieron, de media, a las 30 semanas de gestación, comparado con las 39 semanas de gestación de los que presentaron infecciones por E. coli sensible, y por ello, la prematuridad puede actuar como sesgo entre resistencia y muerte12.
Por todo ello, con este estudio se pretende conocer la etiología de los principales patógenos urinarios en el grupo específico de la mujer embarazada, la sensibilidad que éstos presentan ante los antibióticos más ampliamente utilizados de forma empírica en el territorio nacional y así, poder evitar la selección de cepas resistentes que puedan ser responsables de procesos sépticos en el recién nacido.
MÉTODOS
Evaluación de muestras de orina de embarazadas obtenidas a partir de un estudio multicéntrico, prospectivo y descriptivo, realizado entre marzo y junio de 2004, en el que se analizaron los aislamientos de microorganismos de pacientes con sospecha de ITU baja adquirida en la comunidad.
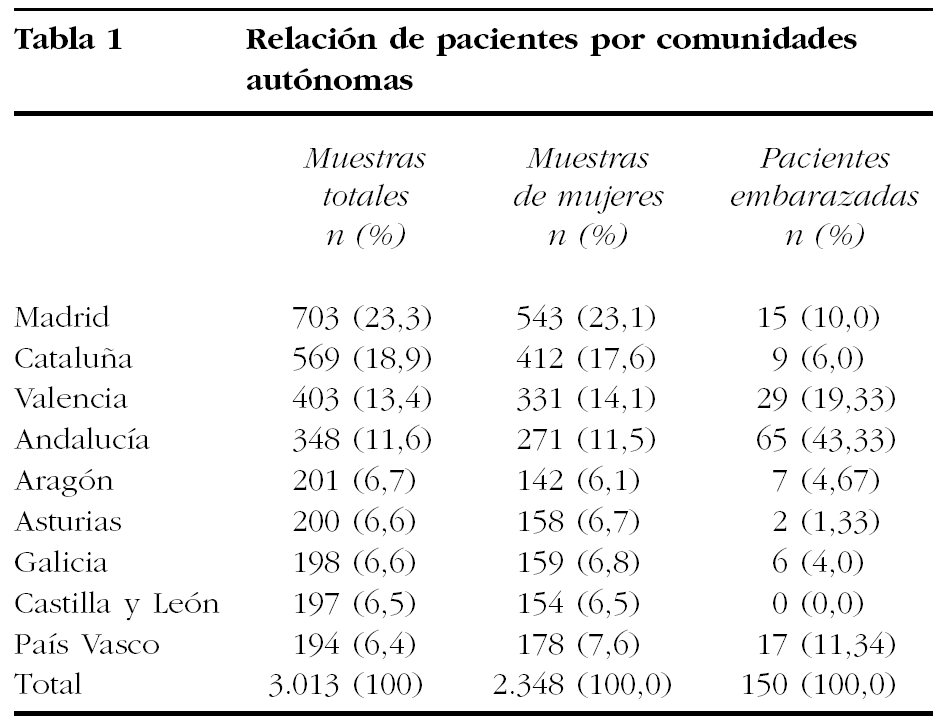
En el estudio participaron un total de 15 laboratorios de microbiología correspondientes a un total de 9 comunidades autónomas. El número de muestras estudiadas en cada una de las diferentes comunidades autónomas se refleja en la tabla 1.
En el global del estudio se obtuvieron muestras de orina procedentes de 3.013 pacientes, sin distinción de sexo ni edad, con confirmación microbiológica de ITU baja adquirida en la comunidad. La muestra de este estudio se reduce al total de mujeres en las que se registró si estaban embarazadas o no. De ellas, el grupo de embarazadas estuvo formado por 150 pacientes (tabla 1).
La determinación de piuria, el urocultivo y la identificación del microorganismo se realizó en cada centro participante en el estudio, para ello se utilizó la metodología específica de cada uno. Se consideró un urocultivo positivo cuando se aislaban en la muestra 1 o 2 microorganismos con un recuento en placa ≥ 105 unidades formadoras de colonias (UFC)/ml, independientemente de la presencia de leucocituria, o recuentos coloniales entre 102 y 105 con recuento leucocitario > 10 leucocitos/mm3.
Las pruebas de sensibilidad a antimicrobianos se realizaron en cada uno de los laboratorios por técnica de disco-difusión o agar-dilución, de acuerdo con las recomendaciones del National Committee on Clinical Laboratory Standards (NCCLS)13 o mediante métodos comerciales de determinación de la concentración mínima inhibitoria (CMI) en medio líquido.
Los antibióticos testados fueron: ampicilina o amoxicilina, amoxicilina-ácido clavulánico, cefixima, cefuroxima, ácido pipemídico o ácido nalidíxico, ciprofloxacino, norfloxacino, cotrimoxazol, fosfomicina y nitrofurantoína.
El análisis estadístico se realizó con el programa Statistical Package Social Science v.12.0 (SPSS, v.12.0, Chicago, Illinois) con el cálculo de valores estadísticos descriptivos. Las diferencias en las proporciones se calcularon mediante la prueba de *2 o bien la prueba exacta de Fisher para las tablas de contingencia con más de un 20% de casillas con una frecuencia esperada < 5. Finalmente, se aceptó un valor de significación estadística (p) ¾ 0,05 para todas las pruebas del estudio.
RESULTADOS
Características de las pacientes
Del total de 3.013 pacientes, 2.348 fueron mujeres (78,2%) y, de ellas, sólo en 1.521 (64,8%) quedó constancia de la existencia o no de gestación en curso, y las mujeres gestantes fueron 150 (9,9%).
La edad media de las gestantes en estudio fue de 28,8 (desviación estándar [DE] = 5,5) años, y el rango de edad con mayor porcentaje de mujeres fue el de 26 a 30 años (34,3%), seguido en menor proporción de las mujeres de 21 a 25 años y 31 a 35 años de edad, respectivamente.
El sedimento urinario fue positivo en el 40,4% de mujeres embarazadas y en el 13,6% de ellas el recuento de colonias bacterianas resultó inferior a 100.000 UFC/ml orina.
Etiología
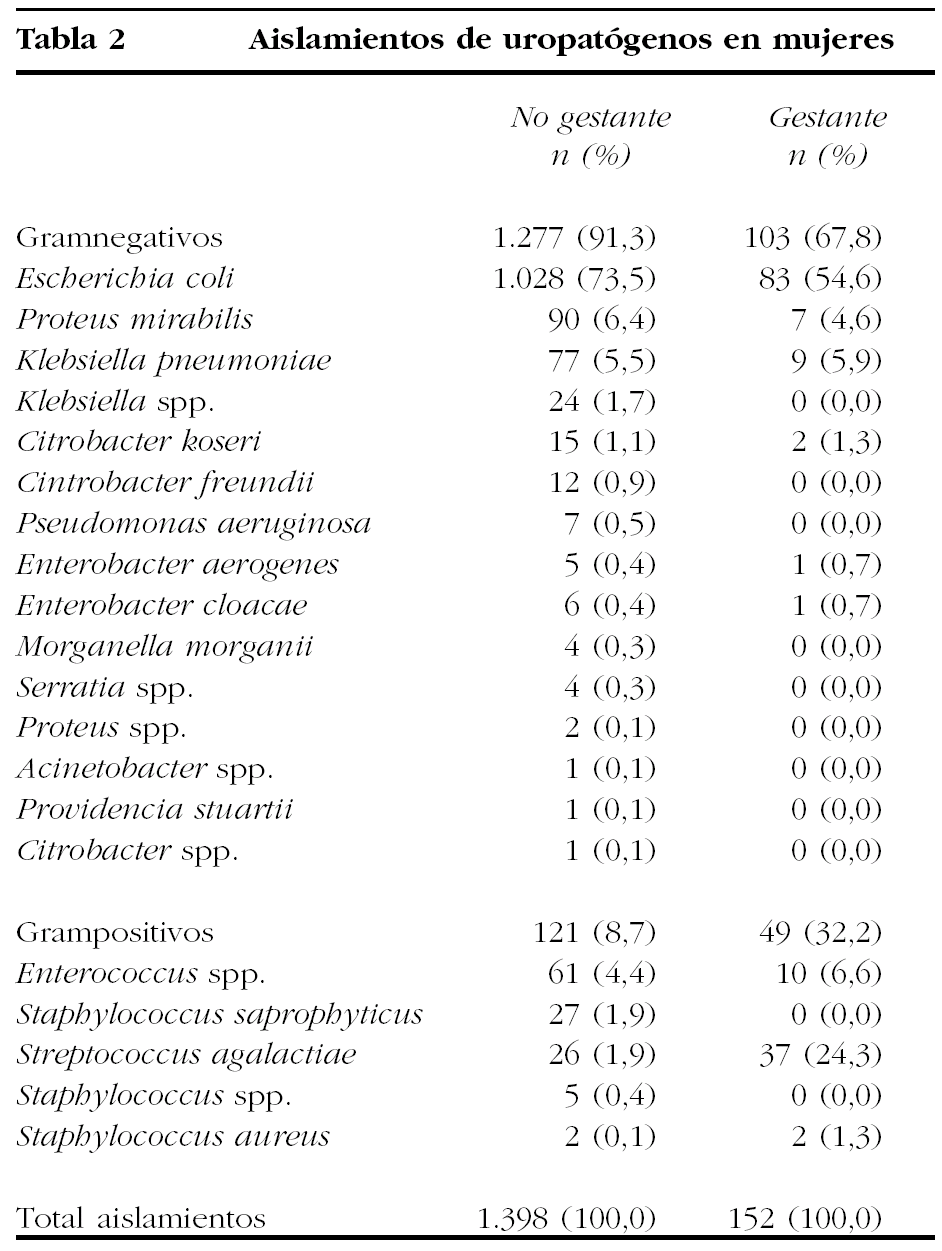
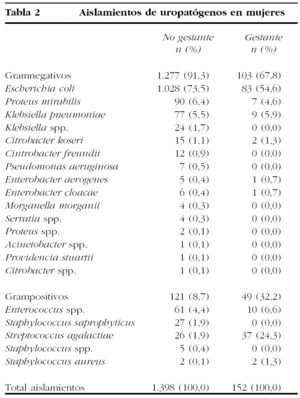
Se aislaron un total de 1.550 cepas en las 1.521 mujeres de la muestra en estudio. De ellas, el 90,1% (n = 1.398) se obtuvo de mujeres no embarazadas, con una distribución entre bacterias gramnegativas del 91,3% (n = 1.277) y un 8,7% de bacterias grampositivas (n = 121).
El número total de aislamientos en mujeres embarazadas fue de 152 cepas (el 9,9% de las mujeres en estudio). En este grupo de gestantes, la distribución por microorganismos gramnegativos descendió al 67,8% (n = 103), siendo la de grampositivos el 32,2% restante (n = 49). Estas diferencias fueron estadísticamente significativas frente a los aislamientos de las mujeres no gestantes (p < 0,001).
En la tabla 2 se encuentran los diferentes microorganismos identificados como patógenos en mujeres en el global de nuestro estudio, así como los aislados exclusivamente en mujeres gestantes. En el estudio de sensibilidades, el número de cepas quedó reducido a 150 por carecer de datos de 2 de ellas (un Staphylococcus aureus y un Enterococcus spp.).
Se apreció un alto porcentaje de aislamientos de E. coli en mujeres gestantes (54,6%), pero inferiores a los detectados en el global de las mujeres (73,5).
Sí llama la atención el elevado número de aislamientos de S. agalactiae (24,3%) en el grupo de mujeres gestantes como agente causante de ITU baja, frente al escaso número de aislamientos producidos en el global de la población femenina incluida en el estudio (1,9%), estas diferencias fueron estadísticamente significativas (p < 0,001). Destacar también la ausencia de aislamientos de Staphylococcus saprophyticus en mujeres gestantes, hecho estadísticamente significativo (p < 0,001).
Sensibilidad a antimicrobianos
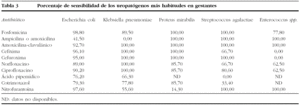
Los datos de sensibilidad frente a antibióticos de uso habitual, que se encontraron en los patógenos aislados con mayor frecuencia en las ITU bajas de mujeres embarazadas en España, se describen en la tabla 3.
Entre los valores más significativos, señalar la alta sensibilidad de E. coli a fosfomicina (98,8%), cefixima (96,5%) y nitrofurantoína (97,6%); también se demuestra una elevada sensibilidad a otros antibióticos de amplio uso terapéutico en la embarazada, como cefuroxima (95,0%) y amoxicilina-ácido clavulánico (92,9%), si bien estos valores entran dentro de la normalidad. Sí es importante la alta tasa de resistencia a ampicilina (58,5%), y aún más los valores de resistencia que presenta E. coli frente a cotrimoxazol (20,7%), ciprofloxacino (9,7%) y norfloxacino (10,9%), inferiores a los que se registran en el conjunto de las muestras de orina aisladas en los 3.013 pacientes del estudio (30% para cotrimixazol y el 20% frente a las fluorquinolonas, que sí son comparables a estudios previos).
El 3,6% (n = 3) de E. coli aislados en embarazadas eran cepas productoras de betalactamasa de espectro extendido (BLEE), valor similar al registrado en el total de las mujeres del estudio, en las que se detectaron 53 cepas de E. coli productoras de BLEE (3,3%).
En el caso de Klebsiella pneumoniae, es de reseñar la gran sensibilidad hallada frente a amoxicilina-ácido clavulánico, cefalosporinas, norfloxacino y ciprofloxacino, y en todos los casos fue del 100%.
Proteus mirabilis se presenta sensible a penicilinas de amplio espectro y cefalosporinas, así como a fosfomicina en el 100% de los aislamientos. Esta situación se encuentra de forma parecida en el caso de S. agalactiae.
Finalmente, Enterococcus spp. muestra la esperada sensibilidad a penicilinas de amplio espectro (100,0%), y es muy reducida en las quinolonas (62,5%). También presenta una alta sensibilidad a nitrofurantoína (100,0%). En este punto habría que matizar que las cepas de Enterococcus spp. aisladas deben corresponder a cepas de Enterococcus faecalis, por la alta sensibilidad que presentan frente a penicilinas de amplio espectro y, por tanto, la ausencia de cepas de Enterococcus faecium, u otros, normalmente resistentes a esta familia de antibióticos.
En el presente estudio sólo se analizaron las diferencias individuales entre comunidades que pudiera haber en la sensibilidad antibiótica de E. coli por tratarse del patógeno más habitual.
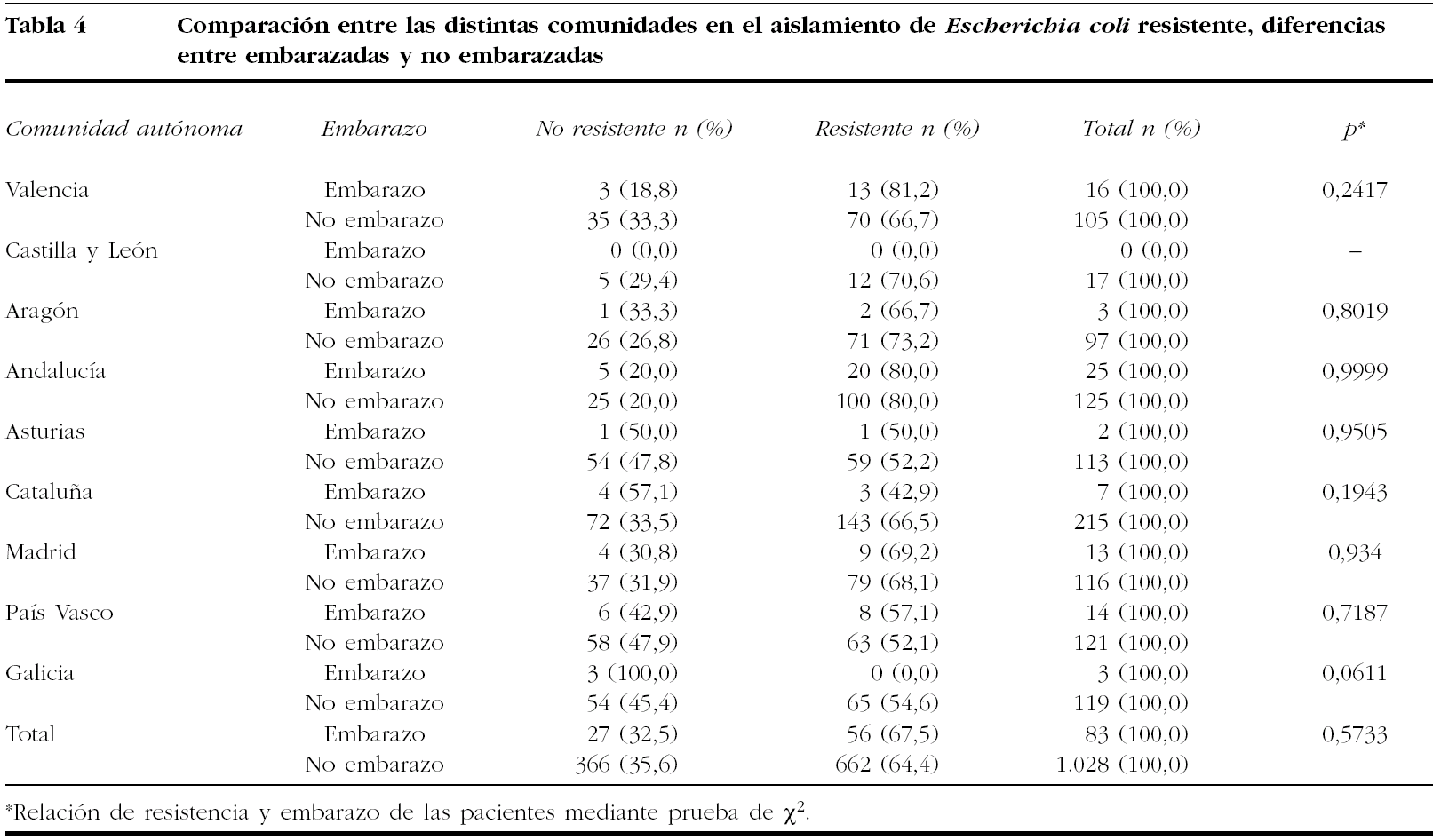
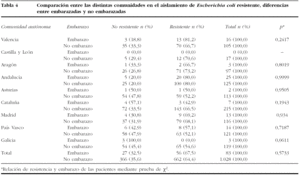
Para hacer el estudio comparativo por comunidades autónomas de las resistencias de E. coli, entre gestantes y no gestantes, se diferencia entre "cepa no resistente", la que no presenta ningún tipo de resistencia a los antibióticos testados, y "cepa resistente", cuando se detecta resistencia frente a alguno de ellos. Estos datos se reflejan en la tabla 4 según las diferentes comunidades autónomas.
No se encuentran diferencias significativas en ninguna de las comunidades autónomas estudiadas, en el nivel de resistencias de las cepas de E. coli, independientemente de que el análisis se haya realizado en mujer embarazada o no.
DISCUSIÓN
En general, en el tratamiento de las ITU bajas no complicadas se admite la aplicación de una terapia empírica de pauta corta (basada en el tratamiento oral durante 3 días o dosis única si el antibiótico lo permite), ya que estas infecciones ocurren normalmente en mujeres jóvenes sin complicaciones de las vías urinarias14. Esta terapia empírica consiste en la administración de un antibiótico a la paciente, sin haber obtenido un cultivo de orina ni un estudio de la sensibilidad del microorganismo causal, e incluso algunas veces sin la realización de estudio de orina15,16.
Se puede considerar que un antibiótico es adecuado para uso empírico cuando presenta una baja prevalencia de resistencias frente a los gérmenes uropatógenos más frecuentemente aislados en las ITU bajas (< 10-20% para considerarlo fármaco de primera elección)16,17; por ello es necesario conocer los agentes etiológicos de las cistitis no complicadas y los patrones de resistencia según el área geográfica en la que nos encontremos18.
Esta situación puede tener aún mayor importancia en el caso de la mujer embarazada debido a la limitación en la administración de determinados antibióticos según el período gestacional, a la importancia de la infección urinaria como posible causa de parto prematuro, bajo peso en el recién nacido y aumento de la mortalidad neonatal8 y las posibles complicaciones de procesos sépticos en el recién nacido1,7-10.
En nuestro estudio, se encontraron ciertas diferencias en la prevalencia de los distintos tipos de microorganismos presentes en las muestras de orina analizadas en mujeres embarazadas respecto al resto de la población femenina. Las mujeres embarazadas presentaban infecciones por microorganismos grampositivos con mayor frecuencia que las no gestantes (el 32,2 frente al 8,7%, respectivamente), y esta diferencia fue estadísticamente significativa (p < 0,001). Además, en las embarazadas, las cepas más frecuentes fueron E. coli, S. agalactiae y Enterococcus spp. (54,6, 24,3 y 6,6%, respectivamente), mientras que para el resto de mujeres las cepas predominantes fueron E. coli, P. mirabilis y K. pneumoniae (73,5, 6,4 y 5,5%, respectivamente). Cabe destacar de entre estos datos la importante diferencia entre la incidencia de E. coli en mujeres gestantes frente a las no gestantes (el 54,6 frente al 73,5%, respectivamente), mientras que los porcentajes del resto de microorganismos gramnegativos fueron prácticamente similares. Llama la atención la ausencia de aislamientos de Staphylococcus saprophyticus, como agente causal de ITU bajas en el grupo de las gestantes (diferencia estadísticamente significativa, p < 0,01), ya que se trata de un microorganismo que clásicamente se ha relacionado con las mujeres sexualmente activas17,19.
Cuando se analizaron las sensibilidades encontradas en los principales microorganismos causantes de ITU bajas en las mujeres, gestantes o no, no se encontraron diferencias significativas. En el caso específico de E. coli tampoco se detectaron estas diferencias cuando se analizaron los resultados según las diferentes comunidades autónomas incluidas en el estudio.
La tasa de E. coli productor de BLEE aislados en mujeres embarazadas es similar a la observada en el total de las mujeres (3,3%) y a las descritas en otros estudios recientes20,21.
En el análisis de los datos de sensibilidad, según los diferentes antibióticos testados, se obtuvieron unos resultados similares a los encontrados en estudios previos en aislados de población general. Así, y centrándonos en el principal patógeno del estudio, E. coli mostró una resistencia frente a ampicilina o amoxicilina del 57,9% en el global de la muestra, y del 58,5% en el subgrupo de las embarazadas. Estos datos son similares a los encontrados por Kahlmeter et al22, que refieren una resistencia en España a ampicilina por E. coli del 53,9%. En este punto, es importante comentar las diferencias encontradas en las sensibilidades de E. coli en las diferentes comunidades autónomas analizadas. Dentro de ellas destacan, por su menor porcentaje de cepas resistentes, el País Vasco y Galicia, con el 44,1 y el 45,6% de resistencias, frente al otro extremo que se encuentra en Aragón, con el 65,9% de las cepas resistentes y Andalucía, donde alcanza el 76,4%, si bien estos datos están analizados en el global de los sujetos participantes en el estudio. Hay que reseñar la ausencia de resistencias en el grupo de las embarazadas infectadas por Enterococcus spp. frente a este antibiótico, aunque sí se detectaron en 3 cepas del total de los aislamientos (1,8%). Otro inconveniente que se podría añadir al tratamiento, con este grupo de antibióticos, es que la terapia corta de 3 días puede ser similar en eficacia al ciclo de 7 días en la erradicación inicial de la bacteriuria, aunque estos ciclos cortos se asocien con aumentos en la incidencia de recurrencias14.
Siguiendo con los antibióticos betalactámicos, amoxicilina-ácido clavulánico presenta una elevada sensibilidad en aislados de mujeres embarazadas (92,8%) similar a la sensibilidad global del 95,7%, y se muestra como una opción válida en el tratamiento de las ITU bajas de las embarazadas. Todas las comunidades incluidas en el estudio mostraron valores de sensibilidad en torno a la media, salvo en el caso de Andalucía, donde las resistencias de E. coli alcanzan el 22,5%, por lo que se debe descartar como alternativa de primera elección en caso de pautar un tratamiento empírico.
Otro grupo de antibióticos administrables a las embarazadas lo constituyen las cefalosporinas. En el presente estudio se evalúan cefixima y cefuroxima, cuyas sensibilidades en mujeres embarazadas fueron similares para ambos antibióticos, con valores de entre el 95 y el 96,1% de cepas sensibles. Todas las comunidades incluidas en el estudio mantienen unos valores de sensibilidad en torno al 95%, salvo, y de nuevo, en la comunidad andaluza, donde la cefixima alcanza una tasa de resistencia del 11,7% y aumenta al 14,4% frente a cefuroxima acetilo.
Fosfomicina, en forma de fosfomicina trometamol de administración en dosis única o pauta corta, es otro de los antibióticos presentados en la bibliografía como alternativa de primera línea para el tratamiento empírico de las ITU bajas no complicadas de la comunidad16, y es una opción válida y segura para el tratamiento de estas infecciones en las embarazadas. Las tasas de resistencias obtenidas frente a este antibiótico oscilan entre el 0,5% presentado por Kahlmeter22 y el 2,1% de Andreu et al18 en el territorio nacional. Nosotros encontramos una tasa global de resistencia de E. coli del 2,2% en consonancia con los datos ofrecidos por Andreu et al y algo inferior, del 1,2%, en el subgrupo de las mujeres gestantes. El resultado ofrecido por el global de las muestras en las diferentes comunidades fue similar al general, pero en esta ocasión Castilla y León presentó valores discretamente más elevados que la media, con un 6,3% de las cepas de E. coli resistentes a fosfomicina. Estos resultados contribuyen a reafirmar que fosfomicina trometamol, por la baja tasa de resistencias bacterianas de E. coli unido a su elevada seguridad y a su pauta de administración, se perfila como alternativa de primera línea en el tratamiento de las ITU bajas no complicadas de la mujer embarazada.
Por otro lado, por lo que respecta al grupo de las quinolonas las resistencias encontradas son importantes. El ácido pipemídico presenta, tanto en el grupo global como en el subgrupo de las embarazadas, unas resistencias del 26,7 y del 23,8%, respectivamente, datos concordantes con los ofrecidos por Kahlmeter22. En lo que respecta a norfloxacino y ciprofloxacino, en el global de los aislamientos, la resistencia encontrada es del 20,2% para ambos antibióticos, ligeramente inferior a la tasa descrita por Andreu et al18, con una resistencia en el territorio nacional del 22,8%. Sin embargo, en el grupo de las embarazadas esta resistencia es sólo del 10,9 y el 9,7%, respectivamente, para cada uno de estos antibióticos, si bien son antibióticos menos seguros durante el embarazo14 por sus posibles efectos sobre el cartílago de crecimiento15, y no se deberían prescribir como primera línea para el tratamiento de las ITU bajas no complicadas en las embarazadas23.
Otro de los antibióticos también estudiados es cotrimoxazol. Al igual que las quinolonas, es un antibiótico que tampoco se debe emplear en el tratamiento de las ITU bajas de las embarazadas14, por sus posibles efectos teratogénicos cuando se utiliza durante el primer trimestre de la gestación y la posibilidad de hiperbilirrubinemia en el neonato cuando se administra en el tercer trimestre de la gestación15. Además, la tasa de resistencias de E. coli registrada, tanto en la muestra global como en el grupo de las mujeres embarazadas, supera el límite del 20%, en línea con los resultados ofrecidos en el estudio realizado por Kahlmeter con un 25,7%22.
Nitrofurantoína ofrece un espectro de sensibilidad muy favorable como opción de tratamiento de las ITU bajas no complicadas, y ofrece un nivel de sensibilidad de las cepas de E. coli aisladas en las gestantes del 97,6%, superior a la observada en el estudio de Andreu et al, que presenta una sensibilidad de E. coli frente a nitrofurantoína del 94,3%18. El problema que presenta su utilización es una pauta de tratamiento prolongada (4 veces al día, durante
7 días)18. Sin embargo, este antibiótico tiene limitado su uso en el embarazo por la posibilidad de producir anemia hemolítica en la madre o el feto si se encuentran afectados por un déficit de la glucosa 6 fosfato deshidrogenasa, e igualmente está contraindicada cuando se acerca el parto (38-42 semanas) o durante éste15.
La baja eficacia de penicilina G, junto con la alta tasa de resistencias de E. coli a ampicilina24, obliga a plantearnos si, en el tratamiento de las ITU bajas en las embarazadas, deberían emplearse antibióticos diferentes a los betalactámicos, siempre que se hayan demostrado eficaces y seguros en este grupo de pacientes, y que ello pueda ayudar a reducir la tasa de resistencia frente a un antibiótico útil en el tratamiento de la sepsis neonatal. En nuestra opinión esto no sólo debería quedar limitado al grupo específico de gestantes, sino a toda mujer en edad de poder serlo. Además, es importante recomendar realizar la profilaxis intraparto frente a S. agalactiae con penicilina G mejor que con ampicilina24, y evitar así la posible selección de cepas resistentes de E. coli implicadas en las sepsis neonatales precoces12.
En conclusión, se encontró que no existen diferencias significativas en el principal agente etiológico de las ITU bajas en mujeres embarazadas respecto del resto de las mujeres del estudio, siendo tanto en unas como en otras E. coli, aunque sí existe una diferencia en el porcentaje de aislamientos. En las embarazadas disminuye la incidencia de ITU bajas producidas por E coli y aumenta el número de infecciones producidas, en segundo lugar, por S. agalactiae, seguido de Enterococcus spp. Hay una importante tasa de resistencias frente a antibióticos de uso habitual en la embarazada como amoxicilina o ampicilina. Por ello, se hace necesario, a nuestro entender, utilizar otras alternativas como fosfomicina trometamol, cefixima, cefuroxima o amoxicilina-ácido clavulánico, válidas para este grupo especial de pacientes, a fin de conseguir la mayor eficacia terapéutica empírica. Además, esta actitud permitiría disminuir la elevada tasa de resistencias de E. coli frente a antibióticos que puedan ser necesarios, en el tratamiento de procesos sépticos precoces del recién nacido de bajo peso, y evitar la selección de cepas resistentes.
AGRADECIMIENTOS
Agradecemos a la Dra. Lourdes Sunyer, del Departamento Médico de Zambon S.A., todo el apoyo operativo, así como la coordinación del trabajo. De igual forma, agradecemos el soporte técnico que ha permitido el análisis estadístico a Biométrica Médica S.A. (Barcelona). Este estudio ha sido subvencionado por Zambon S.A., Barcelona (España).
Relación de investigadores y centros participantes en el estudio
Servicios de microbiología: A. Andreu, G. Prats (Hospital Vall d'Hebron, Barcelona); F. Marco (Hospital Clínic i Provincial, Barcelona); R. Martín (Hospital de Bellvitge, Barcelona); F. de la Torre, I Rodríguez (Hospital Clínico San Carlos, Madrid); J. Martínez-Beltrán (Hospital Ramón y Cajal, Madrid); J.I. Alós (Hospital de Móstoles, Madrid); J.A. García Rodríguez, M.J. Fresnadilla (Hospital Clínico Universitario, Salamanca); E. Perea, M.J. Montero, M. de Cueto (Complejo Hospitalario Virgen Macarena, Sevilla); M. de la Rosa, J.D. Turiño-Luque (Hospital Virgen de las Nieves, Granada); M. Gobernado, J.A. Queipo, M.J. Jiménez, N. Diosdado (Hospital Universitario La Fe, Valencia); A. Guerrero, J. Colomina, M. Vaya, J.E. Peiro, J. Rocher (Hospital de la Ribera, Alzira, Valencia); M.J. Revillo, M.C. Marne (Hospital Miguel Servet, Zaragoza); E. Pérez Trallero, M. Gomáriz (Hospital Donosita, San Sebastián); H. Villar, G. Sierra (Hospital San Agustín, Avilés); P. Alfonso, A. Coira (Complexo Hospitalario Xeral-Calde, Lugo).
Correspondencia:
Dr. J.D. Turiño-Luque.
Servicio de Microbiología.
Hospital Universitario Virgen de las Nieves.
Avda. Fuerzas Armadas, s/n.
18014 Granada. España.
Correo electrónico: jdturino@fundacionhvn.org
Fecha de recepción: 3/6/05
Aceptado para su publicación: 10/1/06