El tejido óseo es un efector de las hormonas gonadales esteroides y de la vitamina D. El recambio óseo es el proceso de renovación del tejido deteriorado y los estrógenos desempeñan un papel significativo en el tejido, la regulación cellular y a nivel molecular. A partir de la menopausia predomina la resorción ósea y aumenta el riesgo de osteoporosis. El sistema endocrino de la vitamina D regula el metabolismo celular óseo a través de receptores específicos y por mecanismos no genómicos. El déficit de vitamina D es un problema muy extendido en la población general que guarda relación con la baja exposición solar y baja ingesta de precursores de la vitamina. El suplemento de vitamina D es una parte importante de las acciones terapéuticas de los tratamientos antirresortivos y para mantener la salud osteomuscular.
Bone tissue responds to gonadal steroid hormones and vitamin D. Bone turnover is the process of replacing deteriorated tissue, and estrogens play a significant role at the tissular, cellular and molecular levels. After menopause, bone resorption predominates and increases the risk of osteoporosis. The vitamin D endocrine system also regulates bone metabolism through specific receptors and non-genomic mechanisms. Vitamin D deficiency is widespread among the general population and has been related to low sun exposure and low dietary intake. Vitamin D supplementation is an important antiresorptive measure and helps to maintain musculoskeletal health.
Las hormonas ováricas condicionan el organismo femenino en la salud y en la enfermedad, y sus efectos o su carencia determinan situaciones de riesgo que el ginecólogo se ve obligado a corregir. Todos asumimos la importancia de las hormonas en la fisiopatología de la ovulación y los trastornos menstruales, en la génesis del cáncer de mama o de endometrio y las respectivas lesiones precursoras, o la repercusión de las fases de amenorrea prolongada. Prácticamente no existe tejido que escape al efecto de las hormonas ováricas y la presencia de receptores hormonales específicos exceden al aparato genital. El sistema osteomuscular no es ajeno a la modulación por las hormonas gonadales. Por otra parte, en los últimos años se ha producido una transformación significativa en el contenido y desarrollo de la obstetricia y ginecología como especialidad. Gran parte de actuación clínica del ginecólogo se centra en preservar la salud femenina: la prevención de riesgos obstétricos ha conducido a obtener mejores resultados perinatales con menos secuelas, determinadas acciones sencillas permiten diagnosticar y tratar lesiones precursoras del cáncer, el diagnóstico y el tratamiento temprano de las infecciones de transmisión sexual reducen las complicaciones genitales y pelvianas, la prevención y corrección de los problemas del suelo pélvico mejoran el control de esfínteres y la calidad de vida, etc.
La osteoporosis posmenopáusica es una de las manifestaciones prevalentes en esa etapa de la vida y tiene una relación significativa con la pérdida permanente de la función ovárica. Por eso, nos hemos preguntado, ¿cómo podemos mejorar la atención sanitaria a la mujer menopáusica para que, con el paso de los años, no sufra una limitación de la independencia locomotriz que desea mantener? Los ginecólogos han comprendido, y están convencidos, que siendo los que atienden a las mujeres periódicamente pueden hacer prevención temprana, detectar factores de riesgo y tratar adecuadamente la osteoporosis posmenopáusica, antes de que se produzcan fracturas. Hasta hace unos años el tratamiento hormonal de la menopausia garantizaba una amplia cobertura preventiva, incluido el tejido óseo, que ha desaparecido como consecuencia de la limitación de su uso en las indicaciones más precisas1-4. Sin embargo, existe un amplio abanico de posibilidades terapéuticas —más allá del tratamiento hormonal— y recomendaciones que el ginecólogo puede utilizar para mejorar la salud de la mujer climatérica con osteoporosis y riesgo de fracturas.
REGULADORES DEL RECAMBIO ÓSEOEl tejido óseo está sometido a recambio continuo gracias a la participación de dos tipos de células, los osteoclastos y los osteoblastos; ambas líneas derivan de células progenitoras que se encuentran en la médula ósea. Los osteoclastos derivan de células hematopoyéticas de la línea monocito-macrófago; los osteoblastos lo hacen de células madre pluripotentes del estroma medular, mientras que los osteocitos se generan a partir de la maduración de osteoblastos. Junto a los componentes celulares hay un sistema de matriz proteica y sales minerales que en conjunto garantizan la resistencia de la estructura. El entramado proteico está constituido esencialmente por colágeno tipo I y, en mucha menor medida, por proteoglucanos y otras proteínas no colagénicas, tales como osteocalcina, osteonectina y otras. El mineral, elemento crucial que garantiza la rigidez, está compuesto por hidroxiapatita, una sal a base de fosfato y calcio.
El recambio óseoEl recambio óseo se desarrolla a partir de la actuación de las denominadas unidades multicelulares básicas, que integran a grupos de osteoclastos primero y de osteoblastos después. Los osteoclastos excavan cavidades en el hueso que luego son reconstituidas por los osteoblastos. El tamaño de esas cavidades es 1–2 mm/0,2-0,4 mm y el número que se encuentra en funcionamiento en un momento determinado es un millón. Su vida media llega a ser de 6–9 meses, durante los cuales se produce en primer lugar la diferenciación de los osteoclastos y, con mucha más lentitud, la de los osteoblastos. Los osteoclastos se distinguen por su carácter de células multinucleadas, seguidas de un frente de osteoblastos que va apareciendo por la superficie opuesta. Dentro del hueso maduro puede apreciarse la presencia de osteocitos.
La matriz ósea está constituida por los elementos proteicos y minerales comentados anteriormente. Las fibras de colágeno están ordenadas para mantener resistencia, que se consigue gracias a puentes de unión garantizados por enlaces covalentes (uniones piridinolínicas). Como consecuencia de la actividad celular de los osteoclastos y osteoblastos se genera una serie de productos (fig. 1) que sirven como marcadores bioquímicos y se emplean en la clínica. Los osteoclastos generan proteasas que destruyen colágeno y fruto de su actividad es la aparición de péptidos aminoterminales (NTx) o carboxiterminales (CTx) del colágeno, así como puentes de unión piridínicos (piridinolina y deoxipiridinolina). Lo mismo puede decirse de otros marcadores, como la fosfatasa alcalina y la osteocalcina, que son indicadores de formación ósea, aunque se elevan secundariamente en el estado de resorción acelerada.
La actividad de los osteoclastos y osteoblastos genera una serie de productos (por destrucción de tejido circundante en el caso de osteoclastos y por la actividad celular propia en el caso de los osteoblastos) que son la base de los marcadores bioquímicos que se emplean en la clínica. Los osteoclastos generan proteasas que destruyen colágeno y fruto de ello es la aparición de péptidos aminoterminales (NTx) o carboxiterminales (CTx) del colágeno, así como puentes de unión piridínicos (piridinolina y deoxipiridinolina). La actividad de los osteoblastos se acompaña de marcadores como fosfatasa alcalina y la osteocalcina.
La actividad de las unidades de recambio óseo se pone en marcha de forma aleatoria a lo largo del conjunto del territorio óseo. Cuando en un área concreta no hay actividad, se dice que se encuentra en fase quiescente; en esta situación, está alrededor del 90% del tejido óseo en un momento determinado. El ciclo de recambio óseo se inicia por la fase de resorción, responsabilidad de los osteoclastos. La fase de reversión marca el agotamiento de la función osteoclástica y el inicio de la osteoblástica, cuyo papel se completa con la formación ósea (fig. 2). Terminada ésta, el tejido entra en fase quiescente, hasta una eventual activación posterior5.
El ciclo de recambio óseo: la actividad de las unidades de recambio óseo se pone en marcha deforma aleatoria a lo largo del conjunto del territorio óseo. Cuando en un área concreta no hay actividad, se dice que se encuentra en fase quiescente; esa es la situación en alrededor del 90% del territorio óseo en un momento determinado. La activación se inicia por la fase de resorción, responsabilidad de los osteoclastos; la fase de reversión marca el agotamiento de la función osteoclástica y el inicio de la osteoblástica, cuyo papel se completa con la formación ósea. Terminada ésta, el tejido entra en fase quiescente, hasta una eventual activación posterior. Tomada de Ralston5.
La osteoporosis condiciona la fragilidad ósea sobre la base de una masa ósea reducida. El capital óseo, es decir, la masa ósea total de un individuo, se adquiere en el primer tercio de la vida; luego se administra de manera que puede perderse de forma más o menos rápida en función de la actuación de una serie de reguladores del metabolismo óseo. El capital óseo que se adquiere viene determinado principalmente por factores genéticos, responsables (aproximadamente) de hasta un 80% de éste. La genética de la osteoporosis es compleja y todavía insuficientemente conocida6-8. Además, una serie de reguladores añaden variabilidad individual, tanto en la aposición como en la pérdida de hueso. Estos factores pueden ser sistémicos, tales como estrógenos, parathormona (PTH), calcitonina o vitamina D, o factores locales, tales como los mediadores de inflamación, como prostaglandinas o citocinas, o factores de crecimiento. Estudios en gemelos han demostrado que los factores genéticos explican no sólo la masa ósea, sino otros reguladores de la resistencia ósea, tales como las propiedades ultrasónicas, la geometría o incluso el riesgo de fractura9. Estudios en animales de experimentación, así como investigaciones poblacionales en humanos, han contribuido a identificar locus de cromosomas que albergan genes reguladores de la enfermedad. Además, los estudios de ciertas enferme dades que confieren osteoporosis o de polimorfismos de ciertos genes han permitido proponer una larga lista de genes candidatos8-10.
Un buen ejemplo de la influencia de la genética lo ofrece el estudio de polimorfismos del colágeno tipo 1. La sustitución de guanosina por timidina en la región reguladora del gen define un alelo denominado COLIA1 s. Estudios poblacionales en distintos países, que comparan la frecuencia de distribución del alelo en cuestión y la de fracturas de cadera, muestran una clara relación. Incluso más, la asociación del polimorfismo del gen COLIA1 con el riesgo de fracturas demostró que ese riesgo era mayor que lo que podía esperarse a partir de los cambios observados en la densidad mineral ósea (DMO), ceso, con la contribución de otro mediador, el factor macrofágico estimulante de colonias (M-CSF). Junto a la diferenciación de osteoclastos, por lo que se sospechó que pudiera haber un efecto de la genética sobre la propia calidad del hueso. De hecho, estudios bioquímicos han confirmado diferencias en la composición proteica del colágeno tipo 1 de individuos normales (SS) frente a los que presentan el polimorfismo (Ss)11. Esta diferencia genética influye en la composición del colágeno y la calidad del tejido —por tanto, en su resistencia— y en el riesgo de fracturas. En un metaanálisis de 26 estudios sobre los alelos de COLIA1 se encontró que el genotipo influye tanto en la DMO como en el riesgo de fracturas osteoporóticas, especialmente las vertebrales12.
También el peso al nacer se ha mostrado como un determinante de masa ósea; así, a mayor peso al nacer, mayor contenido mineral óseo, lo que demuestra que, no sólo la genética, sino también los factores ambientales intrauterinos, influyen en la masa ósea que un individuo alcanza a lo largo de la vida. El valor de la DMO del esqueleto del recién nacido no guarda relación, sin embargo, con los valores séricos de 25-hidroxivitamina D3 [25(OH) D3] en el neonato o en la madre13,14.
Los estrógenos en el huesoLos estrógenos figuran entre los reguladores fisiológicos de más relevancia para el metabolismo óseo, cuyo papel queda demostrado por la aceleración en la pérdida ósea que experimentan las mujeres en la menopausia. Los efectos de los estrógenos en el hueso se manifiestan en el órgano y el tejido, pero también a nivel celular y molecular. En el tejido, afectan a muchas facetas del metabolismo óseo: controlan la resorción limitando la frecuencia de activación de las unidades multicelulares básicas y, por ende, el desequilibrio en el recambio, que se expresa en la menopausia por una aceleración mayor en la actividad osteoclástica que en la osteoblástica. También regulan el crecimiento y la maduración del hueso, pues en la pubertad el despertar gonadal es el mecanismo que determina el tirón del crecimiento puberal, probablemente a través de una activación del péptido factor de crecimiento insulínico 1 (IGF-1) y la hormona de crecimiento. Posteriormente, influyen en la diferencia que hay entre varones y mujeres en el proceso de maduración y consolidación ósea. Menos claro, aunque hay indicios que apuntan a que puede ser una realidad, está el papel de los estrógenos en la osteoformación17-19.
El patrón de crecimiento de un individuo con carencia de aromatasa es un buen modelo para reconocer qué ocurre a los huesos en ausencia completa de estrógenos. El crecimiento se sostiene, sin cerrarse las epífisis, hasta que se administra estradiol. El estudio radiológico de la mano, antes y después del tratamiento, pone de manifiesto que no se produce una adecuada maduración ósea hasta que se administra el estrógeno20.
En las células, los estrógenos bloquean la osteoclastogénesis. Esto puede observarse en experiencias con líneas celulares de precursores de osteoclastos. Al administrar PTH se induce su diferenciación a osteoclastos, pero esto queda limitado de una forma dependiente de la dosis si se administra al mismo tiempo estradiol21. Los estrógenos no sólo limitan la osteoclastogénesis, sino que también entorpecen la capacidad funcional de los osteoclastos y, a la vez, estimulan su desaparición vía apoptosis22. La acción estrogénica alcanza incluso a la viabilidad de osteocitos. En un estudio con tejido obtenido mediante biopsia de cresta ilíaca de mujeres tratadas con análogos de la GnRH a causa de endometriosis, se observó una reducción de la viabilidad de los osteocitos al comparar con el estado previo al tratamiento23.
La diferenciación de osteoclastos a partir de células tipo osteoclastos se produce a partir de células de la familia monocito-macrófago procedentes de distintos territorios; a mayor abundancia de este tipo de células, mayor diferenciación de osteoclastos identificados por el número de células positivas para fosfatasa alcalina tartrato-resistente (TRAP). Esta observación llevó a pensar que, puesto que estas células tipo monocito-macrófago secretan y son a la vez reguladas por citocinas y otros mediadores de inflamación, tales mediadores también podrían estar implicados en la modulación de la diferenciación y actividad de células óseas24. Distintos estudios posteriores así lo confirmaron y existe una lista de moduladores que han demostrado su participación en la regulación del metabolismo óseo, incluidos citocinas, factores de crecimiento y prostaglandinas25. De hecho, hace ya algún tiempo se observó que la deprivación estrogénica induce un aumento en la producción de prostaglandinas en las células óseas26.
También a nivel molecular se conoce la acción de 103 los estrógenos en las células óseas. Éstas disponen de receptores específicos, tanto a y p en osteoblastos y en osteoclastos27. La observación clínica confirma el papel de los receptores de estrógenos en el metabolismo de las células óseas: en un varón con una mutación inactivante del receptor estrogénico, la administración de estrógenos fue incapaz de controlar la falta de cierre de las epífisis (crecimiento sostenido), así como la maduración ósea evaluada en las radiografías de la mano28. Por tanto, en contra del caso de déficit de aromatasa (hay receptores estrogénicos funcionantes pero no estrógenos), donde el aporte estrogénico soluciona el problema, no hay solución en el caso presente por más estrógeno que se administre. Igualmente, el caso ilustra que los andrógenos, normales en este varón, no ejercen un papel relevante en el control metabólico del hueso si no hay receptores estrogénicos funcionantes.
Otro aspecto de interés sobre la acción de los estrógenos a nivel molecular consiste en la confirmación de acciones no genotrópicas en la regulación del metabolismo óseo, actuando a través receptores de membrana y de enzimas tipo proteincinasas. Experiencias con osteoblastos murinos muestran que la capacidad de protección frente a la apoptosis se consigue con estradiol, pero también con estren, una sustancia sintética que sólo actúa sobre receptores estrogénicos de membrana29. Lo mismo se observa en el caso de los osteoclastos, aunque aquí el efecto es de inducción y no de rescate de apoptosis.
Todos estos estudios —y otros— ponen de manifiesto la gran importancia de los estrógenos sobre el metabolismo óseo, a un nivel similar de otros efectores tradicionales como la glándula mamaria o el endometrio.
Nuevos reguladores del recambio óseoLas fases finales de la diferenciación de osteoclastos han sido desveladas hace pocos años e implican a sustancias de la familia de una citocina, el factor de necrosis tumoral (TNF). Las células precursoras expresan un receptor en la membrana, denominado receptor para la activación del factor nuclear kappa B (RANK). Al mismo tiempo, las células del estroma de la médula ósea expresan un ligando para RANK (RANK-L). La unión de ambos desencadena el proceso, con la contribución de otro mediador, el factor macrofágico estimulante de colonias (M-CSF). Junto a la diferenciación de osteoclastos, RANK-L ha demostrado ejercer efectos inductores sobre la activi dad y la supervivencia osteoclásticas (fig. 3). El sistema posee sus elementos de regulación, dado que una proteína denominada osteoprotegerina es capaz de competir con RANK por RANK-L, de forma que la unión de osteoprotegerina supone un bloqueo del proceso y un freno en el camino de la diferenciación osteoclástica30,31. Distintos reguladores del metabolismo óseo, tales como las prostaglandinas, interleucinas, vitamina D o PTH, también actúan sobre las células del estroma. También el osteoblasto sigue su propio proceso de formación. Las células precursoras de la médula poseen cierta totipotencialidad, de manera que pueden diferenciarse también en adipocitos, condrocitos y miocitos. La presencia de una proteína, el factor de transcripción denominado cbfa1, es determinante para la expresión de una serie de genes que llevan la célula hacia su diferenciación en osteoblasto. Una vez llegada a esta fase, inicia una serie de efectos característicos, resumidos en los contenidos señalados en la figura 4. Agotada su vida útil, los osteoblastos son englobados en la matriz osteoide que ellos mismos han generado y se convierten en osteocitos, o bien quedan en la superficie cortical, como células aplanadas que originan el epitelio de revestimiento32.
Las fases finales de la diferenciación de osteoclastos implican a sustancias de la familia de una citocina, el factor de necrosis tumoral. Las células precursoras expresan un receptor en la membrana, denominado RANK. Al mismo tiempo, las células del estroma de la médula ósea expresan un ligando para RANK (RANK-L). La unión de ambos desencadena el proceso, con la contribución de otro mediador, el factor macrofágico estimulante de colonias (M-CSF). Junto a la diferenciación de osteoclastos, RANK-L ha demostrado ejercer efectos inductores en la actividad y la supervivencia osteoclásticas. El sistema posee sus elementos de regulación a través de la proteína osteoprotegerina (OPG), que es capaz de competir con RANK por RANK-L, deforma que la unión de OPG supone un bloqueo del proceso y un freno en el camino de la diferenciación osteoclástica. Distintos reguladores del metabolismo óseo, tales como las prostaglandinas (PGE2), interleucinas (IL-11), vitamina D (1,25(OH)2D3) o parathormona (PTH), actúan sobre las células del estroma.
Las células precursoras de la médula poseen cierta totipotencialidad, pues pueden diferenciarse también en adipocitos, condrocitos y miocitos. La presencia de una proteína, el factor de transcripción denominado cbfal, es determinante para la expresión de una serie de genes que llevan la célula hacia su diferenciación en osteoblasto. Una vez llegado a esta fase, inicia una serie de efectos característicos, resumidos en los contenidos señalados por las dos puntas de flecha. Agotada su vida útil, los osteoblastos son englobados en la matriz osteoide que ellos mismos han generado y dan lugar a osteocitos, o bien quedan en la superficie cortical, como células aplanadas que originan el epitelio de revestimiento. Tomada de Rizzoli 32 .
El potencial de estos mediadores en la regulación del metabolismo óseo puede evaluarse en modelos animales a los que se silencia la expresión de un gen determinado. Cuando se consigue silenciar al RANK, los osteoclastos no se diferencian y se traduce por aumento de la DMO33-35. Estos datos fueron la base para estudios clínicos. Así, la osteoprotegerina se ha usado en forma inyectable en una población de 52 mujeres para evaluar los efectos en los marcadores bioquímicos de recambio óseo al cabo de 6 semanas [2] . En estas condiciones, la osteoprotegerina consiguió una reducción dependiente de la dosis de los marcadores de recambio óseo (resorción en este caso).
SISTEMA HORMONAL DE LA VITAMINA D Y METABOLISMO ÓSEOLa vitamina D forma parte de un complejo sistema endocrino que afecta no sólo al metabolismo óseo, sino que también regula la diferenciación celular. En la actualidad, se está analizando su utilización terapéutica en campos tan diversos como la artritis reumatoidea, las enfermedades autoinmunitarias, la diabetes, la hipertensión, la psoriasis y diversas neoplasias (próstata, mama, colon, leucemia, cáncer cutáneo). La vitamina D2 (o ergocalciferol) está presente en las plantas y los hongos, mientras que la vitamina D3 (o colecalciferol) es de origen animal. En el organismo humano se encuentra en sangre circulante el precursor 25 hidroxivitamina D3 (25-hidroxicolecalciferol, 25(OH)D3 o calcidiol), que se transforma en el riñón en la hormona activa 1a,25 dihidroxivitamina D3 (1a,25 didhidroxicolecalciferol, 1,25(OH)2D3, o calcitriol). La estructura bioquímica de estos compuestos está claramente emparentada con el colesterol y los esteroides sexuales y suprarrenales.
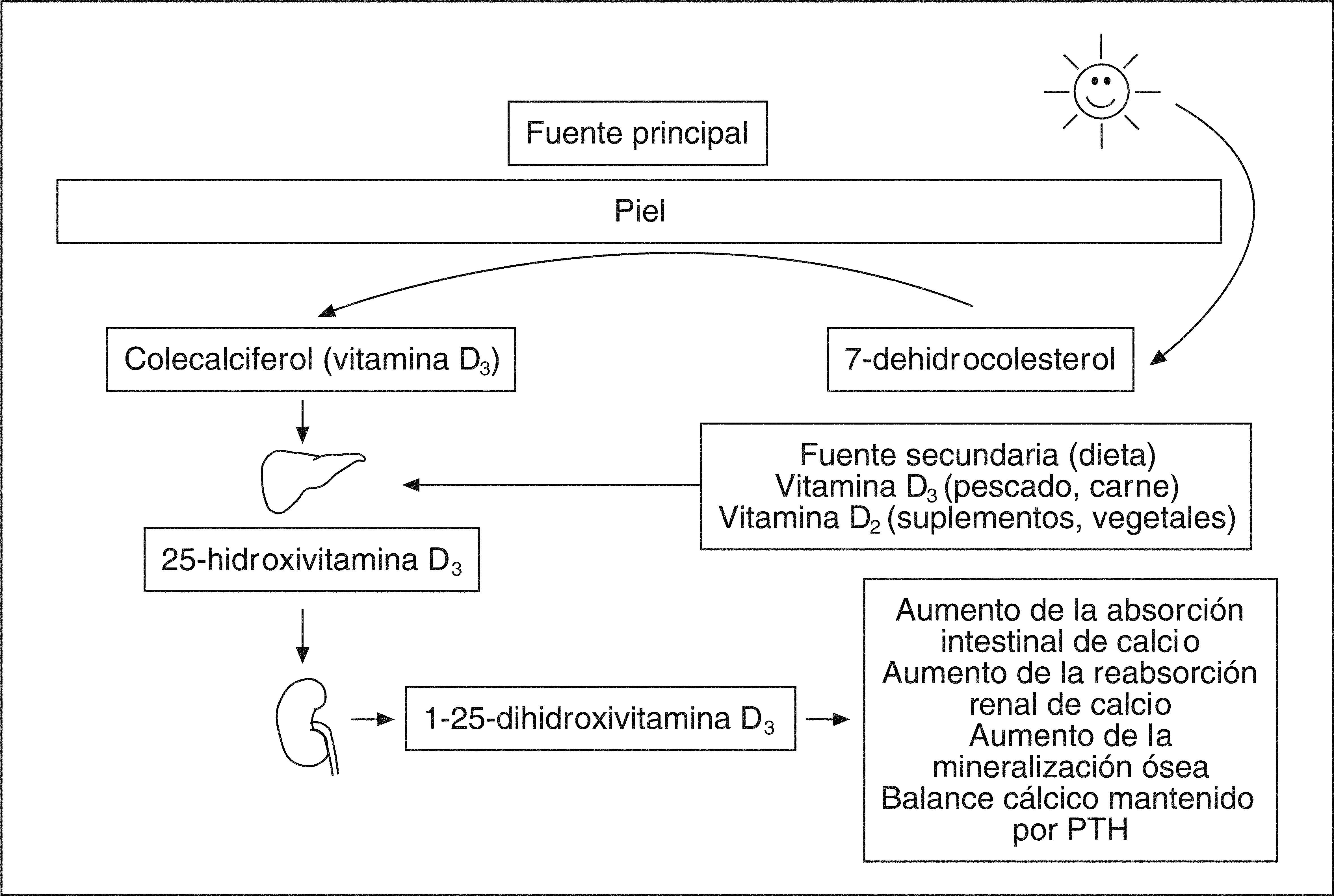
Síntesis, metabolismo y degradación de la vitamina DEl primer componente de la familia hormonal vitamina D es el colecalciferol, que es biológicamente inerte y se sintetiza por la acción de los rayos ultravioleta sobre el 7 dehidrocolesterol de la piel. El colecalciferol y el resto de los esteroides del sistema de la vitamina D circulan en la sangre, un 85% ligado a una proteína específica de transporte (DBP) y un 15% a la albúmina. Las vitaminas D y D experimentan la 25 hidroxilación en el hígado (formación de 25(OH)D3) y posteriormente la 1-a hidroxilación en el riñón para producir la hormona activa la 1,25(OH)2D3 (fig. 5)14.
Sistema endocrino de la vitamina D. Los rayos ultravioleta del sol favorecen la conversión de 7-dehidrocolesterol a colecalciferol (vitamina D3). En el hígado se produce la transformación de la vitamina D sintetizada y la ingerida con la dieta en 25-hidroxivitamina D que, a su vez, sirve como precursor de la hormona activa 1,25dihidroxivatmina D3 formada en el riñón y en otros tejidos. Tomada de Pérez-López14.
La 25(OH)D3 tiene una vida media plasmática de aproximadamente 2 o 3 semanas, por lo que sus concentraciones son muy estables e informan del estado del sistema endocrino D. Su importancia radica en que es el precursor directo de su síntesis renal y en otros tejidos, y su concentración plasmática permite catalogar a las pacientes como deficientes, insuficientes o con concentraciones adecuadas de vitamina D. La potencia biológica de 25(OH)D3 es unas 1.000 veces menor que la hormona activa 1,25(OH)2D3. La degradación de la vitamina D se hace mediante la 24-hidroxilación, a través de una 24-hidroxilasa que se expresa en el túbulo renal y en todos los tejidos donde está presente el receptor de la vitamina D. La afinidad de la hidroxilasa es más alta por la 1,25(OH)2D3 que por la 25(OH)D3, y constituye un mecanismo de seguridad para controlar la toxicidad de la 1,25(OH)2 D . En este caso, el es3 ácido calcitroico que se forma es hidrosoluble y se elimina fácilmente por el riñón.
A partir de los 50 años la capacidad de producir previtamina D3 es la mitad que en la época fértil, y a partir de los 70 años sólo del 25%. Finalmente, la producción cutánea de vitamina D3 depende del tipo de piel, la contaminación ambiental y la estación del año, existiendo un nadir durante el invierno.
Receptor de la vitamina D y efectos no genómicos de la vitamina DEl receptor de la vitamina D (RVD) forma parte de la superfamilia de receptores esteroideos, que engloba unas 150 proteínas detectadas prácticamente en todas las especies, desde gusanos hasta insectos y seres humanos. Dentro de esta familia, junto al RVD encontramos los esteroides sexuales (estrógenos, progesterona y andrógenos), así como para los gluco y mineralcorticoides, hormonas tiroideas y ácido retinoico. Una vez introducida la hormona en la estructura espacial del RVD, cambia la conformación de éste, mediante plegamiento y desplegamiento estructural. Tras la conformación del RVD, se liga al receptor X del ácido retinoico (RXR) para formar un heterodímero, RVD-RXR, que es imprescindible para poder actuar sobre la región del gen que constituye el elemento de respuesta a la vitamina D (ERVD). La fijación de la vitamina D al ERVD induce la transcripción génica y la síntesis de ARN mensajero que viaja al citoplasma y, en contacto con los ribosomas, produce la síntesis de la proteína específica. La acción sobre los genes sensibles a la vitamina D provoca un amplio abanico de respuestas, con la aparición de numerosas proteínas; algunas de ellas tienen relación con la fisiología ósea, pero otras muchas ejercen su acción sobre el metabolismo, o incluso sobre la proliferación y diferenciación celular. El sistema hormonal de la vitamina D interacciona con numerosos genes que tienen relación con la producción de neoplasias. En cultivos de tejidos y en estudios epidemiológicos se ha relacionado la vitamina D con el cáncer de mama, colon y próstata, y con la diferenciación de queratinocitos y células del sistema nervioso37.
Déficit de vitamina DNo existe consenso sobre los valores óptimos de vitamina D, aunque la mayoría de las publicaciones establecen que valores inferiores a 30 ng/ml de 25(OH)D3 se asocian a una disminución en la absorción de calcio y elevación de PTH. La clasificación de McKenna y Freaney38, aceptada ampliamente, considera valores inadecuados de vitamina D entre 20 y 30 ng/ml; la insuficiencia queda definida entre 20 y 10 ng/ml, y la deficiencia se asocia a cifras inferiores a 10 ng/ml. En mujeres posmenopáusicas se han relacionado los valores plasmáticos de 1,25(OH)2D y PTH; en líneas generales, cuanto menores son las tasas plasmáticas de 1,25(OH)2D3 más probabilidad de ascenso de PTH. El hiperparatiroidismo secundario se asocia a un aumento del recambio óseo y pérdida de tejido óseo39-43. Además, los valores inadecuados de vitamina D reducen la absorción intestinal de calcio que se asocia a la liberación de PTH, produciéndose la movilización de calcio a partir del hueso y la reducción de la DMO43. Esta respuesta homeostática a los valores inadecuados de vitamina D puede aumentar el riesgo de fracturas. Otra consecuencia importante es la alteración de la función neuromuscular y el aumento del número de caídas44-48.
La insuficiencia de vitamina D es un problema global actual que no respeta fronteras, nivel socioeconómico ni edad, y guarda relación con la baja exposición a la luz solar y las carencias de vitamina D en la dieta49. Para corregir esta situación se han tomado diversas iniciativas para incrementar el grado de concienciación sobre el papel esencial que desempeña la vitamina D en el manejo de la osteoporosis. En España, 10 sociedades científicas interesadas en el tratamiento de la osteoporosis, entre ellas la Asociación Española para el Estudio de la Menopausia, han realizado la Declaración Española sobre la Vitamina D con la finalidad de sensibilizar a los profesionales sobre la importancia de optimizar los valores de vitamina D en la población50.
El aporte exclusivamente nutricio para cubrir las necesidades de vitamina D es difícil, prácticamente imposible de conseguir sin producir serias alteraciones en la dieta. Por ejemplo, sería preciso ingerir diariamente 20 huevos, o varios litros de leche, o 2 raciones completas de pescado graso al día para lograr las necesidades diarias de vitamina D. En los países nórdicos se compensa la baja insolación y el prolongado invierno con la fortificación sistemática de los alimentos51. Las autoridades sanitarias de la Unión Europea aconsejan la administración rutinaria de suplementos de 400 U/diarios a las personas mayores de 65 años con el objetivo de compensar los bajos niveles de vitamina D, y establecen un límite máximo de seguridad de 2.000 U/ día. La Fundación Nacional de la Osteoporosis aconseja suplementar con 400–800 U/día a los menores de 50 años, y con 800–1.000 U/día a partir de los 50 años52.