En el mercado español se dispone de diversas gonadotropinas utilizadas en los programas de reproducción asistida. El objetivo de esta revisión es determinar las diferencias entre ellas y establecer las ventajas y los inconvenientes de cada una en base a su origen, seguridad y eficacia clínica. Desde el punto de vista técnico, las gonadotropinas recombinantes presentan ventajas técnicas y mayor pureza, actividad específica y homogeneidad entre lotes. Desde el punto de vista de la seguridad, aunque hay diferencias claras en el origen, y por tanto en los riesgos de transmisión de enfermedad infecciosa, todas las gonadotropinas disponibles han mostrado ser seguras. Es desde el punto de vista de la eficacia donde es más difícil establecer diferencias. Muchos de los estudios disponibles son pequeños y no siempre los parámetros de evaluación han sido comparables. La mayoría de los estudios no han podido establecer diferencias, por lo que existen en la literatura científica diversos metaanálisis que tratan de responder básicamente a dos aproximaciones: saber si las FSH recombinantes (FSHr) son mejores que las urinarias y si la hormona recombinante es mejor que la gonadotropina menopáusica humana.
Los datos no permiten demostrar que las urinarias o la hMG, solas o en combinación, sean más eficaces que la FSHr, mientras que, por el contrario, las recombinantes han mostrado ser más eficaces que las urinarias purificadas agrupadas.
In Spain, several different gonadotrophins are available for assisted reproductive techniques. The present review aims to determine the differences between these gonadotrophins and to establish the advantages and limitations of each in terms of their origin, safety, and efficacy. From the technical point of view, recombinant gonadotrophins have enhanced purity, specific activity and greater consistency. From the safety point of view, there are clear differences in the origin and manufacturing process and consequently in the risk of infectious diseases; however, to date, all gonadotropins have been demonstrated to be safe.
Differences in efficacy are more difficult to establish. Many trials have compared preparations but, because of their small size and variations in study design, the results have been variable. Most of the studies have failed to detect any differences and consequently several meta-analyses have aimed to determine whether recombinant folliclestimulating hormone (FSH) gonadotrophins are preferable to urinary-derived FSH and whether recombinant hormone is superior to human menopausal gonadotropin (hMG).
The published results do not demonstrate that urinary-derived FSH or hMG, alone or when data are pooled, are more effective than recombinant FSH. In contrast, recombinant gonadotrophins have been shown to be more effective than urinaryderived gonadotrophins as a whole.
En los últimos años la importancia de la medicina reproductiva ha ido en aumento en todo el mundo y también en España. Se estima que 1 de cada 6 parejas en edad reproductiva sufre problemas de fertilidad; ello supone que en España hasta 800.000 parejas no consiguen tener hijos de forma natural.
No en todos los casos se pueden identificar las causas de este aparente aumento de la infertilidad en los últimos años, pero a las causas bien conocidas, como la obesidad extrema, la anorexia nerviosa, el abuso de drogas, alcohol, tabaco y medicamentos, los tratamientos de quimioterapia anticancerosa, o ciertas enfermedades de transmisión sexual, se pueden haber unido otras causas más difíciles de establecer con claridad, como la contaminación medioambiental, el uso de aditivos alimentarios y pesticidas, los estrógenos exógenos que podemos ingerir con el agua o los alimentos u otros factores tóxicos. El hecho es que entre el 30 y el 40% de todos los casos de infertilidad se debe a enfermedades en el varón; la causa principal es la azoospermia o la oligospermia, mientras que la enfermedad femenina causa de un 40 a un 50% de los casos de infertilidad en las parejas y la causa más frecuente son las alteraciones en la ovulación.
Actualmente, los avances científicos en el conocimiento de la reproducción humana han permitido el desarrollo de múltiples técnicas dirigidas a permitir la unión de los gametos y el posterior embarazo, procesos como la inducción medicamentosa de la ovulación, la inseminación artificial, la transferencia intratubárica de gametos (TIG), la fertilización in vitro (FIV), la inyección ovular intracitoplasmática de espermatozoides (ICSI) o la inyección de espermatozoides bajo la zona pelúcida de un óvulo (ZUSI) y otros constituyen lo que hoy entendemos como técnicas de reproducción asistida (TRA). La pieza básica de todos estos procesos es el desarrollo de varios folículos. Esta superovulación es fundamental para el éxito de los programas de reproducción asistida porque tiene como objetivo aumentar el número de óvulos maduros que puedan recogerse y, por consiguiente, aumentar las tasas de embarazo al incrementar la posibilidad de elección de los embriones. Pues bien, en esta inducción de la ovulación son esenciales las gonadotropinas exógenas.
En los últimos años, y de acuerdo con la teoría de 2 células, 2 gonadotropinas, se ha venido utilizando la hormona foliculostimulante (FSH) y la hormona luteinizante (LH) para el desarrollo folicular normal y para la esteroidogénesis1. La administración de FSH sin LH en mujeres hipogonadotróficas provoca menores concentraciones de estradiol, menores tasas de fecundación de oocitos2,3 y ausencia de embarazos a término que cuando se tratan con FSH exclusivamente. Sin embargo, en mujeres normogonadotróficas sólo son necesarias cantidades muy bajas de LH para producir desarrollo folicular oocitario4. Más recientemente, se ha propuesto la utilización conjunta de agonistas de la hormona liberadora de gonadotropinas (GnRHa), para suprimir la función hipofisaria, y FSH para controlar mejor la hiperestimulación ovárica en la fecundación in vitro.
Es difícil determinar el número de ciclos de TRA que se realizan en España, aunque es seguro que se ha incrementado notablemente durante las dos últimas décadas. Una estimación indirecta basada en el uso de gonadotropinas y de material de laboratorio indica que en 2003 se iniciaron en España entre 27.000 y 30.000 ciclos de FIV-ICSI, aunque la cifra real puede ser muy superior, ya que en realidad sólo el 30-35% de las unidades de reproducción españolas comunican sus registros a la Sociedad Española de Fertilidad5.
MEDICAMENTOS UTILIZADOS EN MEDICINA DE LA REPRODUCCIÓNComo hemos señalado, para lograr suficiente calidad y cantidad de ovocitos, es necesario diseñar un protocolo de estimulación ovárica adecuado a cada paciente y a cada procedimiento, en el que se pueden utilizar diversas gonadotropinas: la FSH, la LH y la gonadotropina coriónica (hCG).
También se ha venido utilizando clomifeno, pero hace ya años que se demostró que los preparados gonadotrópicos proporcionan mejores resultados.
Este período inicial de superovulación requiere un incremento mantenido de la concentración de FSH que evite el proceso de selección de un único folículo e induzca el desarrollo de varios folículos; de este modo, se dispone de una serie de ovocitos maduros útiles para la fecundación o en otras técnicas de reproducción asistida.
La superovulación se lleva a cabo siempre mediante tratamiento adyuvante con un agonista o con un antagonista de la GnRH. Ya que se ha demostrado que este tratamiento adyuvante permite el crecimiento gradual de una amplia cohorte de folículos y evita el pico espontáneo de LH, que, en épocas anteriores, originaba hasta un 20% de cancelaciones de los ciclos de estimulación ovárica.
La FSH humana es secretada por las células gonadotróficas de la hipófisis por el estímulo de la GnRH y cumple un papel biológico muy importante, tanto en varones como en mujeres. En varones es esencial para la espermatogénesis, donde actúa sinérgicamente con los andrógenos y la LH, y en las mujeres regula el crecimiento folicular y actúa también en colaboración con los estrógenos y la LH. En los testículos actúa sobre las células de Sertoli favoreciendo la maduración de los túbulos seminíferos. En los ovarios actúa sobre las células de la granulosa activando la conversión de los andrógenos producidos en la teca en estrógenos, estimulando la proliferación de las células de la granulosa, induciendo un aumento considerable de receptores de la LH y de la prolactina, y activando las enzimas esteroidogénicas necesarias para la biosíntesis de progesterona.
La LH es otra gonadotropina producida por la hipófisis (junto a la FSH) cuya función en las mujeres es inducir la maduración final folicular, la ovulación y la luteinización en los ovarios con folículos previamente desarrollados, así como estimular la producción de hormonas masculinas en los testículos de los varones. Ambas se utilizan conjuntamente en el proceso de estimulación del desarrollo folicular en pacientes con déficit importante de LH y FSH.
La hCG se utiliza tras la estimulación del desarrollo folicular para provocar una maduración folicular final y la luteinización en las técnicas de reproducción asistida.
Estructuralmente, la FSH es una hormona glucoproteica formada por 2 subunidades, alfa y beta, unidas entre sí por 2 enlaces no covalentes. La subunidad alfa está formada por 92 aminoácidos y tiene dos complejos glucídicos enlazados con los residuos de asparagina en las posiciones 52 y 78. La subunidad beta la integran 111 aminoácidos y tiene también otros dos complejos glucídicos unidos a Asn-7 y a Asn-24.
La masa molecular de la subunidad alfa es de 14 kD, y la de la beta, de 17 kD. La secuencia de aminoácidos de la subunidad alfa de la FSH es la misma que la de la subunidad alfa de otras hormonas glucoproteicas, como la LH, la tirotropina (TSH) y hCG. La subunidad beta, en cambio, es única y es responsable de la especificidad fisiológica de la hormona. Gran parte de la actividad biológica de la hormona depende de la presencia de las cuatro cadenas glucídicas unidas a las dos subunidades peptídicas alfa y beta. Estas 4 cadenas condicionan, además, otra característica relevante en la actividad de la hormona folicular humana. Ambas subunidades se expresan por genes diferentes y experimentan, antes de la secreción, algunos cambios, como la adhesión de las cadenas glucídicas, pues bien, el contenido en ácido siálico y la disposición de estas 4 cadenas glucídicas son diferentes entre unas isoformas y otras y ello condiciona su potencia biológica, su vida media de eliminación y su inmunorreactividad6. Se piensa que la FSH natural consta de una mezcla microheterogénea de 20 o más de estas isoformas7.
La FSH suministrada al comienzo del ciclo, en la fase folicular temprana, actúa sobre la cohorte de folículos reclutados en los últimos días de la fase lútea del ciclo anterior, permitiendo la selección de un mayor número de folículos que puedan evolucionar como dominantes.
La LH sirve de soporte del crecimiento folicular iniciado por la FSH, proveyendo el sustrato androgénico para la aromatasa de las células de la granulosa que sintetizará estradiol. En el período preovulatorio, con el pico de LH se estimula la meiosis oocitaria, madura el cúmulo oóforo y se produce el estallido folicular con la expulsión del óvulo y la formación del cuerpo lúteo. Durante el resto del ciclo, la LH será el soporte de ese cuerpo lúteo.
Hace ya muchos años que se vienen usando las gonadotropinas para favorecer la ovulación; los primeros intentos se hicieron con gonadotropinas provenientes del suero de yegua preñada, que aunque eficaz producía muchos efectos indeseables, como la aparición de anticuerpos antigonadotropina. A finales del los años cincuenta se utilizaron gonadotropinas procedentes de hipófisis humanas, que pronto fueron también abandonadas ante el riesgo de desarrollar la enfermedad de Creutzfeldt-Jakob (ECJ).
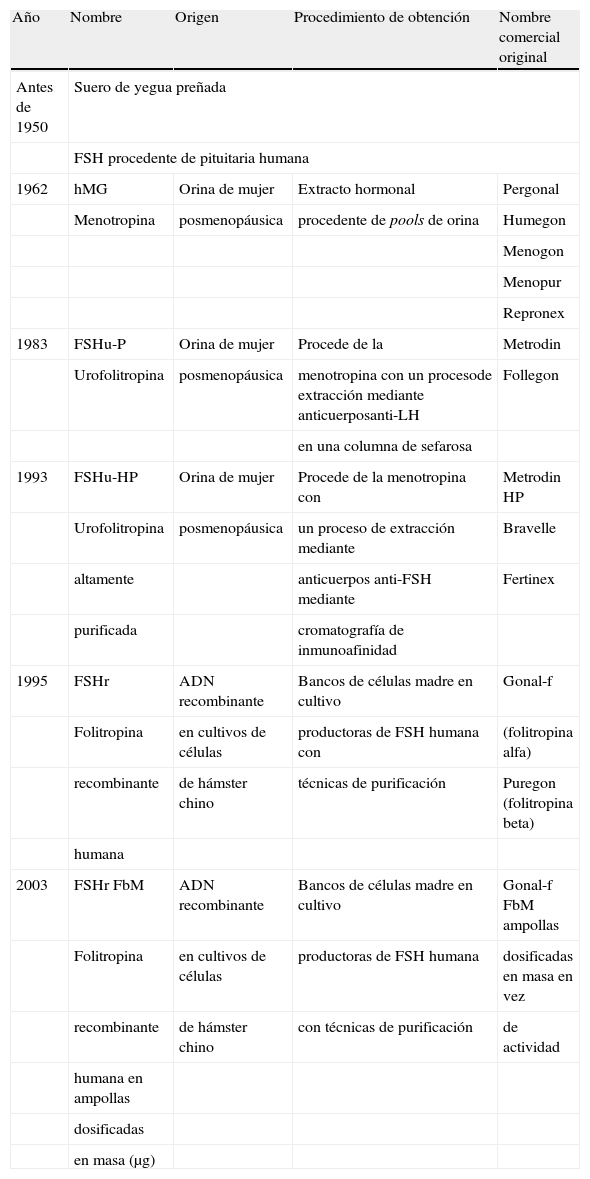
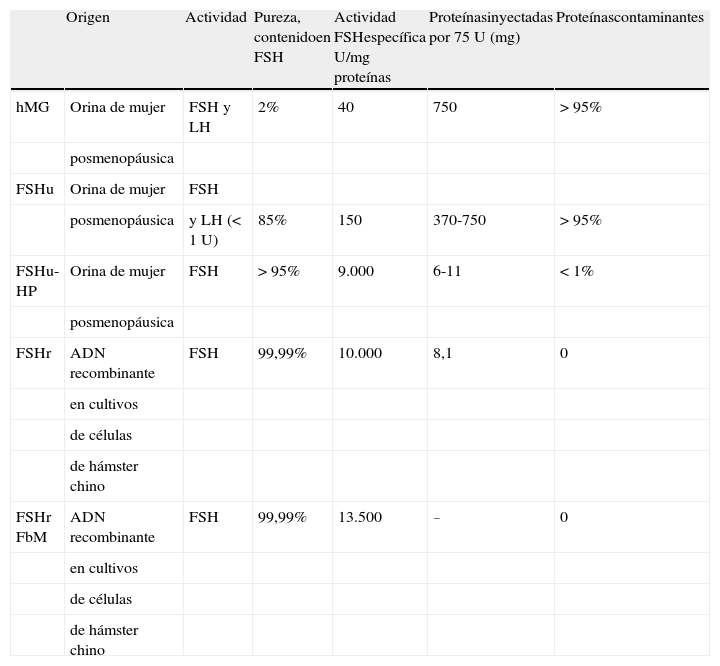
No fue hasta 1960 cuando comenzó el desarrollo farmacológico de las gonadotropinas mediante el aislamiento y la producción industrial de FSH procedente de la orina de mujeres posmenopáusicas (tabla 1). Este producto, conocido como extracto purificado de gonadotropina menopáusica humana o menotropina (hMG), produjo su primer embarazo en 1962. En aquellos años este material contenía, además de FSH, una significativa actividad LH, así como otras proteínas contaminantes. En realidad, la cantidad de hormona no era superior al 5% y la actividad específica podía ser tan baja como 40 U de FSH/mg de proteína; además había importantes variaciones en la relación FSH/LH de un lote a otro (tabla 2).
Gonadropinas disponibles y su origen
| Año | Nombre | Origen | Procedimiento de obtención | Nombre comercial original |
| Antes de 1950 | Suero de yegua preñada | |||
| FSH procedente de pituitaria humana | ||||
| 1962 | hMG | Orina de mujer | Extracto hormonal | Pergonal |
| Menotropina | posmenopáusica | procedente de pools de orina | Humegon | |
| Menogon | ||||
| Menopur | ||||
| Repronex | ||||
| 1983 | FSHu-P | Orina de mujer | Procede de la | Metrodin |
| Urofolitropina | posmenopáusica | menotropina con un procesode extracción mediante anticuerposanti-LH | Follegon | |
| en una columna de sefarosa | ||||
| 1993 | FSHu-HP | Orina de mujer | Procede de la menotropina con | Metrodin HP |
| Urofolitropina | posmenopáusica | un proceso de extracción mediante | Bravelle | |
| altamente | anticuerpos anti-FSH mediante | Fertinex | ||
| purificada | cromatografía de inmunoafinidad | |||
| 1995 | FSHr | ADN recombinante | Bancos de células madre en cultivo | Gonal-f |
| Folitropina | en cultivos de células | productoras de FSH humana con | (folitropina alfa) | |
| recombinante | de hámster chino | técnicas de purificación | Puregon (folitropina beta) | |
| humana | ||||
| 2003 | FSHr FbM | ADN recombinante | Bancos de células madre en cultivo | Gonal-f FbM ampollas |
| Folitropina | en cultivos de células | productoras de FSH humana | dosificadas en masa en vez | |
| recombinante | de hámster chino | con técnicas de purificación | de actividad | |
| humana en ampollas | ||||
| dosificadas | ||||
| en masa (μg) | ||||
FSHr: hormona foliculostimulante recombinante; FSHu-HP: urofolitropina altamente purificada; FSHu-P: urofolitropina; FbM: filled by mass; hMG: gonadotropina menopáusica humana o menotropina.
Características de los preparados de gonadotropinas
| Origen | Actividad | Pureza, contenidoen FSH | Actividad FSHespecífica U/mg proteínas | Proteínasinyectadas por 75 U (mg) | Proteínascontaminantes | |
| hMG | Orina de mujer | FSH y LH | 2% | 40 | 750 | > 95% |
| posmenopáusica | ||||||
| FSHu | Orina de mujer | FSH | ||||
| posmenopáusica | y LH (< 1 U) | 85% | 150 | 370-750 | > 95% | |
| FSHu-HP | Orina de mujer | FSH | > 95% | 9.000 | 6-11 | < 1% |
| posmenopáusica | ||||||
| FSHr | ADN recombinante | FSH | 99,99% | 10.000 | 8,1 | 0 |
| en cultivos | ||||||
| de células | ||||||
| de hámster chino | ||||||
| FSHr FbM | ADN recombinante | FSH | 99,99% | 13.500 | – | 0 |
| en cultivos | ||||||
| de células | ||||||
| de hámster chino |
FSHr: hormona foliculostimulante recombinante; FSHu-HP: urofolitropina altamente purificada; FSHu-P: urofolitropina; FbM: filled by mass; hMG: gonadotropina menopáusica humana o menotropina; LH: hormona luteinizante.
En 1983 se pudo mejorar el proceso de extracción y purificación a partir de la orina de mujeres posmenopáusicas y se consiguió que la LH se separara con un anticuerpo en una columna de sefarosa. Este producto, llamado urofolitropina (FSHu-P), mantiene al término de este proceso un 85-100% de la actividad inicial de FSH y muy poca actividad LH (< 1 U). La actividad específica se aproxima a 150 U de FSH/mg de proteína, pero aun así más del 95% de las proteínas sigue siendo contaminante8,9.
El siguiente paso fue aumentar la actividad intrínseca del preparado y disminuir la cantidad de proteínas contaminantes que causaban efectos adversos y anticuerpos. Ello se consiguió mediante técnicas de purificación con anticuerpos monoclonales anti-FSH para extraer la FSH de la hMG a granel mediante cromatografía de inmunoafinidad. El producto así aislado se llamó urofolitropina altamente purificada (FSHu-HP), y se comercializó en 1993. Este preparado contiene más de un 95% de FSH pura, con una actividad específica de 9.000 U/mg de proteína en comparación con la actividad específica de 150 U/mg de proteína de la menotropina y de la urofolitropina, y menos de un 5% de proteínas contaminantes. Además, este producto ofrecía un preparado farmacéutico más homogéneo y estandarizado, con una escasa variabilidad entre lotes. No obstante, FSHu-HP sigue teniendo origen en la orina de mujeres posmenopáusicas y, por tanto, está sujeta a algunos de los problemas propios que presentan las demás gonadotropinas urinarias, en particular el suministro y la calidad de la materia prima.
El gran avance en los últimos años ha sido la utilización de técnicas de ingeniería genética aplicadas a la producción de las denominadas gonadotropinas recombinantes, FSHr (FSH recombinante) y LHr (LH recombinante). Se pudieron obtener en 1995 tras aislar los genes que codifican las cadenas alfa y beta de LH y FSH, e introducirlos mediante un vector en células huésped de mamífero, en concreto de ovario de hámster chino, que producen las cadenas alfa y beta clonándose en medios nutrientes especiales y secretando las proteínas extracelularmente. Una vez purificada, la FSHr contiene 10.000 U de FSH/mg de proteína y la LHr 20.000 a 30.000 U de LH/mg de proteína, sin otras proteínas contaminantes10.
El último avance ha sido la posibilidad de dosificar la gonadotropina alfa en unidades de masa (en μg) en vez de utilizar las unidades de bioactividad (unidades internacionales) como venía siendo habitual desde el inicio de la investigación con gonadotropinas. La actividad de las preparaciones se refería siempre a unidades internacionales, de acuerdo con un sistema de medición de la actividad en un bioensayo en ovario de rata. Este sistema, internacionalmente aceptado, tiene una baja precisión y, como consecuencia, una alta variabilidad en las preparaciones de FSH. Los avances en diversos procesos de fabricación (cromatografía de alta resolución con exclusión por tamaño, enfoque isoeléctrico o mapeo de glicanos) han permitido a los fabricantes de folitropina alfa ofrecer una alta consistencia en el perfil de las isoformas, en el contenido de glicanos y entre distintos lotes del producto11. Todo ha dado como resultado la posibilidad de cuantificar el producto en base al contenido en masa, en μg, en vez de en actividad, en unidades internacionales, lo que a su vez ha permitido al médico administrar dosis conocidas y reproducibles12.
Existen dos preparados de folitropina recombinante obtenidos y purificados por métodos distintos: la folitropina alfa, cuantificada en unidades de masa, y la folitropina beta, medida en unidades de bioactividad13.
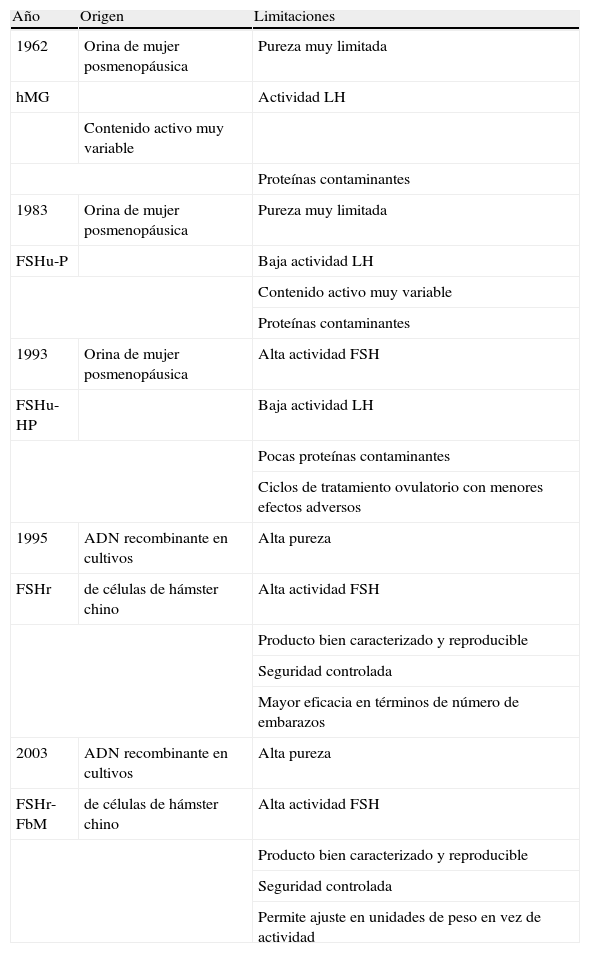
EL RIESGO DE TRANSMISIÓN DE INFECCIONES CON EL USO DE LAS GONADOTROPINASAsí pues, la evolución histórica en el desarrollo de las gonadotropinas ha permitido avanzar en varios aspectos relevantes (tabla 3):
- –
Aumentar significativamente la pureza de los preparados.
- –
Aumentar de manera drástica la actividad específica.
- –
Aumentar la homogeneidad de los lotes y con ello permitir una mejor dosificación.
- –
Disminuir el contenido en proteínas contaminantes.
- –
Disminuir el riesgo de transmisión de infecciones.
- –
Disminuir la frecuencia de efectos adversos.
- –
Aumentar la eficacia en término de número de embarazos.
Evolución histórica y mejoras realizadas en gonadotropinas utilizadas
| Año | Origen | Limitaciones |
| 1962 | Orina de mujer posmenopáusica | Pureza muy limitada |
| hMG | Actividad LH | |
| Contenido activo muy variable | ||
| Proteínas contaminantes | ||
| 1983 | Orina de mujer posmenopáusica | Pureza muy limitada |
| FSHu-P | Baja actividad LH | |
| Contenido activo muy variable | ||
| Proteínas contaminantes | ||
| 1993 | Orina de mujer posmenopáusica | Alta actividad FSH |
| FSHu- HP | Baja actividad LH | |
| Pocas proteínas contaminantes | ||
| Ciclos de tratamiento ovulatorio con menores efectos adversos | ||
| 1995 | ADN recombinante en cultivos | Alta pureza |
| FSHr | de células de hámster chino | Alta actividad FSH |
| Producto bien caracterizado y reproducible | ||
| Seguridad controlada | ||
| Mayor eficacia en términos de número de embarazos | ||
| 2003 | ADN recombinante en cultivos | Alta pureza |
| FSHr-FbM | de células de hámster chino | Alta actividad FSH |
| Producto bien caracterizado y reproducible | ||
| Seguridad controlada | ||
| Permite ajuste en unidades de peso en vez de actividad | ||
FSHr: hormona foliculostimulante recombinante; FSHu-HP: urofolitropina altamente purificada; FSHu-P: urofolitropina; FbM: filled by mass; hMG: gonadotropina menopáusica humana o menotropina; LH: hormona luteinizante. Tomado de Giudice et al9.
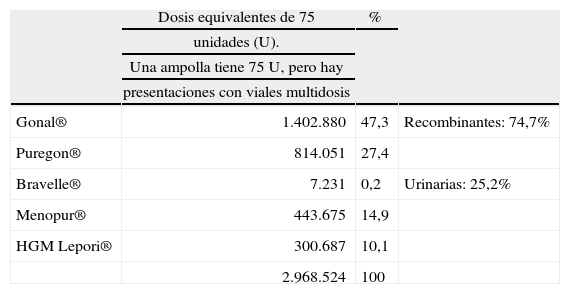
Aun permanecen disponibles en el mercado preparaciones procedentes de orina y hormonas recombinantes, que se han usado y siguen usándose ampliamente. En España, durante el año 2006, se han utilizado diversas preparaciones de FSH (tabla 4).
Preparaciones de FSH utilizadas en España durante 2006
| Dosis equivalentes de 75 | % | ||
| unidades (U). | |||
| Una ampolla tiene 75 U, pero hay | |||
| presentaciones con viales multidosis | |||
| Gonal® | 1.402.880 | 47,3 | Recombinantes: 74,7% |
| Puregon® | 814.051 | 27,4 | |
| Bravelle® | 7.231 | 0,2 | Urinarias: 25,2% |
| Menopur® | 443.675 | 14,9 | |
| HGM Lepori® | 300.687 | 10,1 | |
| 2.968.524 | 100 |
Cada preparación farmacéutica tiene distintas presentaciones en dosis y número de envases, por lo que a fin de compararlas en la tabulación se han ajustado al equivalente de 75 unidades.
Cada preparación farmacéutica tiene distintas presentaciones en dosis y número de envases, por lo que a fin de compararlas en la tabulación se han ajustado al equivalente de 75 unidades internacionales.
Desde 1959 y hasta 1988ha estado disponible para la inducción de la ovulación la FSH humana procedente de extractos de adenohipófisis de cadáveres. Lógicamente, la dificultad de obtención, y sobre todo el riesgo de que pudiera estar asociada al síndrome de Creutzfeldt-Jacob, motivó su retirada, aunque se estima que ha podido ser utilizada en unos 1.300 tratamientos.
Es obvio que esa retirada y todas las posteriores medidas precautorias están en clara relación con el brote de encefalitis espongiforme bovina que apareció en el Reino Unido en los años ochenta y la demostración de que podía afectar en forma de una variante de la ECJ (vECJ) a la especie humana14.
No son muchos los datos existentes respecto del riesgo de transmisión de la enfermedad a partir de muestras de orina o de productos farmacéuticos obtenidos de orina animal o humana. Existe un estudio que ha demostrado que se puede preparar un prion definido como uPrPsc a partir de la orina de hámsteres, del ganado o de humanos afectados con encefalitis espongiforme transmisible15, aunque este prion aislado en orina tiene una isoforma diferente de la del prion detectado en el cerebro (PrPsc), de manera que no podemos saber si es realmente infeccioso. Por otra parte, estos resultados no han podido ser reproducidos, por lo que son muy cuestionados en la comunidad científica16. Más recientemente se ha demostrado que en animales infectados experimentalmente con homogeneizado de cerebro enfermo de scrapie se produce la transmisión de la enfermedad, y en aquellos animales con nefritis linfofolicular hay eliminación de priones infecciosos por vía urinaria17.
En todo caso, estos hallazgos no dejan de ser datos experimentales de laboratorio y hasta la fecha no existe prueba concluyente alguna de que la orina pueda ser una vía de transmisión de enfermedad por priones entre humanos. Es más, la Agencia Europea de Evaluación de Medicamentos (EMEA) ha señalado que la evidencia epidemiológica en los últimos 25 años, en los que se han utilizado ampliamente gonadotropinas derivadas de muestras de orina, no sugiere que exista riesgo de padecer una ECJ18. En este mismo documento, la EMEA señala que, por el momento, no existen indicaciones para proceder a la exclusión de posibles donantes de orina, salvo que existan razones personales de riesgo de presentar ECJ, estando dispuesta a cambiar este criterio ante nuevas informaciones. Por el contrario, el documento señala como muy importantes la medidas precautorias respecto de las muestras de sangre, por ejemplo con los donantes de sangre para producción de hemoderivados, recomendando la exclusión de donantes por razones geográficas18. De similar opinión es la Organización Mundial de la Salud, que señala que la transmisión de ECJ por orina jamás se ha probado y que resulta altamente improbable19.
Hay que señalar que, como consecuencia del brote de encefalitis espongiforme bovina que apareció en el Reino Unido y la transmisión de una vECJ en la especie humana, todas las autoridades sanitarias del mundo han regulado y extremado las medidas para disminuir el riesgo de transmisión de priones en productos de uso humano, y en particular para los medicamentos. Las autoridades reguladoras ya han establecido los requisitos necesarios para poder utilizar productos derivados de animales, estableciendo el nivel de riesgo, definiendo los métodos necesarios para asegurar la no infectabilidad de los materiales producidos y comprobando los diferentes pasos de fabricación para garantizar el resultado final20–22.
El proceso industrial de extracción de las gonadotropinas a partir de la orina de donantes está bien establecido y controlado; se realizan diferentes procesos de extracción (adsorción con caolina, precipitación con acetona, extracción con etanol y cuatro fases de cromatografía) antes de una concentración final dirigidas a maximizar la pureza14,23. Sin embargo, las condiciones de obtención de muestras de orina para la extracción de gonadotropina urinaria ha cambiado mucho en los últimos años. Hasta finales de los años ochenta las muestras se obtenían de no más de 600-1.000 mujeres bien controladas médicamente y donantes habituales23. Durante un año se podían recoger y tratar unos 120.000l de orina, suficientes para tratar la infertilidad con amenorrea hipofisaria, pero a medida que las indicaciones de uso se fueron ampliando hizo falta recoger más cantidad de muestra, y a principios de este siglo ya hacían falta 600.000 donantes. Al incluir donantes de países como Corea, China, India o Argentina, además de los países europeos, se hizo mucho más difícil garantizar la seguridad basada en la recolección individualizada.
Es por ello que aún existen riesgos, ya que es imposible garantizar el origen de la muestra, asegurar su trazabilidad, comprobar la calidad durante el transporte, o hacer un cribado en la detección inicial de donantes enfermas23,24.
Quizás por ello, y a pesar de que el riesgo es extremadamente bajo, algunos países han hecho recomendaciones y tomado decisiones prudenciales. La Unión Europea define este principio precautorio como la toma de decisiones en el manejo de situaciones de riesgo cuando se aprecian efectos potencialmente peligrosos sin que se pueda evaluar el riesgo con suficiente certeza25. Así, en virtud de este principio, el Comité de Seguridad de Medicamentos del Reino Unido solicitó a Serono, en 2003, la retirada voluntaria de Metrodin HP del mercado británico una vez publicado el primer caso de muerte por una vECJ en Italia, un país de donde procede parte de la orina utilizada por Serono en algunos de sus productos26,27.
Francia, en 1996, y Suiza, en 2003, solicitaron a los fabricantes que incluyeran en el prospecto un aviso para los usuarios indicando el origen urinario humano de las gonadotropinas y señalando la imposibilidad de excluir completamente el riesgo de transmisión de enfermedades infecciosas conocidas o desconocidas; además la autoridad suiza solicitó que se indicara también el país de origen de las muestras de orina utilizadas en el proceso de fabricación28. Australia fue más lejos y ya en 1996 el Comité de Evaluación de Medicamentos Australiano reemplazó las gonadotropinas urinarias por las recombinantes, a la vista de su pureza y seguridad29.
En todo caso, también hay que señalar que con el uso de las gonadotropinas recombinantes también existe un riesgo, muy remoto, y teórico. Durante el proceso de fabricación, hay dos momentos en que las células están en contacto con material bovino, las líneas celulares de hámster de ovario chino se mantienen en un cultivo al que se le añade suero fetal de ternera, al igual que las líneas celulares de hibridoma productoras de los anticuerpos utilizados en la purificación14. Ni que decir tiene que si se han establecido herramientas de control para garantizar la seguridad en las gonadotropinas de origen urinario, a pesar de la consideración de la orina como un producto de bajo riesgo de transmisión20, muchas más se han tomado con el material biológico procedente de animales21,22,30. Es más, los fabricantes están procediendo a la retirada de cualquier material de origen bovino en la producción de gonadotropinas recombinantes, y desde 2007 la gonadotropina recombinante alfa se fabrica ya sin contacto con suero de ternera fetal.
La evaluación del riesgo de transmisión de enfermedades infecciosas en el uso de gonadotropinas, tanto urinarias como recombinantes, en protocolos de estimulación ovárica es bajísimo, casi teórico, máxime si se considera la cantidad administrada y la duración del tratamiento. Aunque parece razonable pensar que dadas las dificultades para asegurar los procesos de obtención y transporte de las muestras de orina, quizás pueda existir un mayor riesgo en las gonadropinas urinarias. Hasta el momento no ha habido ningún caso de transmisión de infección en mujeres en tratamiento con técnicas de fertilización in vitro.
Así pues, las diferencias han de buscarse con otros criterios, en particular, eficacia, beneficio/riesgo y farmacoeconomía.
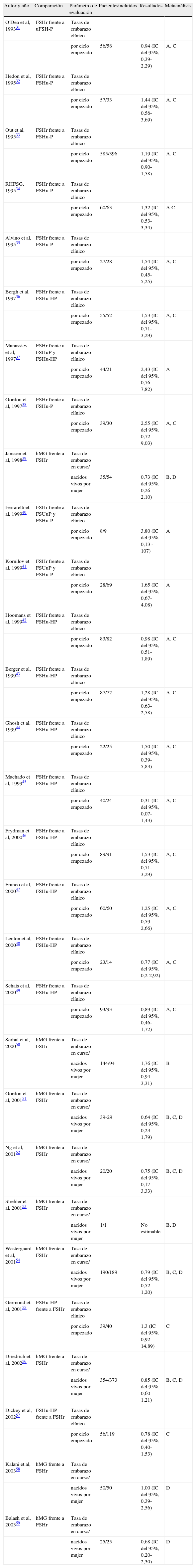
CARACTERÍSTICAS DIFERENCIALES DE LAS HORMONAS FOLICULOSTIMULANTES EXISTENTESDesde el primer embarazo conseguido con gonadotropina recombinante en 1993 se han desarrollado muchos estudios comparativos entre la gonadotropina recombinante y las demás en aras ha establecer sus diferencias en términos de eficacia. Una gran parte de estos estudios aparecen en la tabla 5. Como se puede apreciar, entre ellos hay muchos ensayos que podríamos llamar pequeños, no más de 3 o 4 tienen tamaños muestrales con más de 120 pacientes. Quizás ello haya podido contribuir a que, con los resultados de los autores en la mano, ninguna FSH que esté disponible, la gonadotropina menopáusica humana (hMG), la FSHu-P, la FSHu-HP y la FSHr, ha demostrado ser estadísticamente diferente en términos de eficacia de cualquier otra (tabla 5). Por ello, diversos autores han intentado analizar conjuntamente estos estudios en un intento por ganar tamaño y poder estadístico para hacer comparaciones.
Ensayos clínicos publicados e incluidos en los diferentes metaanálisis que comparan diferentes gonadotropinas
| Autor y año | Comparación | Parámetro de evaluación | Pacientesincluidos | Resultados | Metaanálisis |
| O'Dea et al, 199331 | FSHr frente a uFSH-P | Tasas de embarazo clínico | |||
| por ciclo empezado | 56/58 | 0,94 (IC del 95%, 0,39-2,29) | A, C | ||
| Hedon et al, 199532 | FSHr frente a FSHu-P | Tasas de embarazo clínico | |||
| por ciclo empezado | 57/33 | 1,44 (IC del 95%, 0,56-3,69) | A, C | ||
| Out et al, 199533 | FSHr frente a FSHu-P | Tasas de embarazo clínico | |||
| por ciclo empezado | 585/396 | 1,19 (IC del 95%, 0,90-1,58) | A, C | ||
| RHFSG, 199534 | FSHr frente a FSHu-P | Tasas de embarazo clínico | |||
| por ciclo empezado | 60/63 | 1,32 (IC del 95%, 0,53-3,34) | A C | ||
| Alvino et al, 199535 | FSHr frente a FSHu-P | Tasas de embarazo clínico | |||
| por ciclo empezado | 27/28 | 1,54 (IC del 95%, 0,45-5,25) | A, C | ||
| Bergh et al, 199736 | FSHr frente a FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 55/52 | 1,53 (IC del 95%, 0,71-3,29) | A, C | ||
| Manassiev et al, 199737 | FSHr frente a FSHuP y FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 44/21 | 2,43 (IC del 95%, 0,76-7,82) | A | ||
| Gordon et al, 199738 | FSHr frente a FSHu-P | Tasas de embarazo clínico | |||
| por ciclo empezado | 39/30 | 2,55 (IC del 95%, 0,72-9,03) | A, C | ||
| Janssen et al, 199839 | hMG frente a FSHr | Tasa de embarazo en curso/ | |||
| nacidos vivos por mujer | 35/54 | 0,73 (IC del 95%, 0,26-2,10) | B, D | ||
| Ferraretti et al, 199940 | FSHr frente a FSUuP y FSHu-P | Tasas de embarazo clinico | |||
| por ciclo empezado | 8/9 | 3,80 (IC del 95%, 0,13 -107) | A | ||
| Kornilov et al, 199941 | FSHr frente a FSUuP y FSHu-P | Tasas de embarazo clinico | |||
| por ciclo empezado | 28/69 | 1,65 (IC del 95%, 0,67-4,08) | A | ||
| Hoomans et al, 199942 | FSHr frente a FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 83/82 | 0,98 (IC del 95%, 0,51-1,89) | A, C | ||
| Berger et al, 199943 | FSHr frente a FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 87/72 | 1,28 (IC del 95%, 0,63-2,58) | A, C | ||
| Ghosh et al, 199944 | FSHr frente a FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 22/25 | 1,50 (IC del 95%, 0,39-5,83) | A, C | ||
| Machado et al, 199945 | FSHr frente a FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 40/24 | 0,31 (IC del 95%, 0,07-1,43) | A, C | ||
| Frydman et al, 200046 | FSHr frente a FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 89/91 | 1,53 (IC del 95%, 0,71-3,29) | A, C | ||
| Franco et al, 200047 | FSHr frente a FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 60/60 | 1,25 (IC del 95%, 0,59-2,66) | A, C | ||
| Lenton et al, 200048 | FSHr frente a FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 23/14 | 0,77 (IC del 95%, 0,2-2,92) | A, C | ||
| Schats et al, 200049 | FSHr frente a FSHu-HP | Tasas de embarazo clínico | |||
| por ciclo empezado | 93/93 | 0,89 (IC del 95%, 0,46-1,72) | A, C | ||
| Serhal et al, 200050 | hMG frente a FSHr | Tasa de embarazo en curso/ | |||
| nacidos vivos por mujer | 144/94 | 1,76 (IC del 95%, 0,94-3,31) | B | ||
| Gordon et al, 200151 | hMG frente a FSHr | Tasa de embarazo en curso/ | |||
| nacidos vivos por mujer | 39-29 | 0,64 (IC del 95%, 0,23-1,79) | B, C, D | ||
| Ng et al, 200152 | hMG frente a FSHr | Tasa de embarazo en curso/ | |||
| nacidos vivos por mujer | 20/20 | 0,75 (IC del 95%, 0,17-3,33) | B, C, D | ||
| Strehler et al, 200153 | hMG frente a FSHr | Tasa de embarazo en curso/ | |||
| nacidos vivos por mujer | 1/1 | No estimable | B, D | ||
| Westergaard et al, 200154 | hMG frente a FSHr | Tasa de embarazo en curso/ | |||
| nacidos vivos por mujer | 190/189 | 0,79 (IC del 95%, 0,52-1,20) | B, C, D | ||
| Germond et al, 200155 | FSHu-HP frente a FSHr | Tasas de embarazo clinico | |||
| por ciclo empezado | 39/40 | 1,3 (IC del 95%, 0,92-14,89) | C | ||
| Driedrich et al, 200256 | hMG frente a FSHr | Tasa de embarazo en curso/ | |||
| nacidos vivos por mujer | 354/373 | 0,85 (IC del 95%, 0,60-1,21) | B, C, D | ||
| Dickey et al, 200257 | FSHu-HP frente a FSHr | Tasas de embarazo clínico | |||
| por ciclo empezado | 56/119 | 0,78 (IC del 95%, 0,40-1,53) | C | ||
| Kalani et al, 200358 | hMG frente a FSHr | Tasa de embarazo en curso/ | |||
| nacidos vivos por mujer | 50/50 | 1,00 (IC del 95%, 0,39-2,56) | D | ||
| Balash et al, 200359 | hMG frente a FSHr | Tasa de embarazo en curso/ | |||
| nacidos vivos por mujer | 25/25 | 0,68 (IC del 95%, 0,20-2,30) | D |
El punto de corte representa la tasa o proporción de la comparación principal, de manera que valores superiores a 1 implican que hay ventaja de la gonadotropina recombinante y menos de 1, que hay ventaja de la otra gonadotropina en comparación, excepto en 3 estudios, en que es al revés50,58,59. El intervalo de confianza (IC) viene a representar la significación estadística de los resultados, de tal manera que si entre ambos extremos se incluye el 1, los resultados no tienen significación estadística.
A corresponde al metaanálisis de Daya y Gunby60 de 2001; B, al metaanálisis de Van Wely et al61 de 2003; C, al metaanálisis de Al-Inany et al62 de 2003, y D, al metaanálisis de Al-Inany et al63 de 2005.
FSHr: hormona foliculostimulante recombinante; FSHu-HP: urofolitropina altamente purificada; FSHu-P: urofolitropina; hMG: gonadotropina menopáusica humana o menotropina.
Ya en 1995 Daya et al64 y en 2000 Agrawal et al65 publicaron 2 metaanálisis que comparaban FSHu con hMG. Los resultados fueron contrapuestos, los resultados de Daya et al64 favorecían a la FSHu y los de Agrawal et al64 a la hMG.
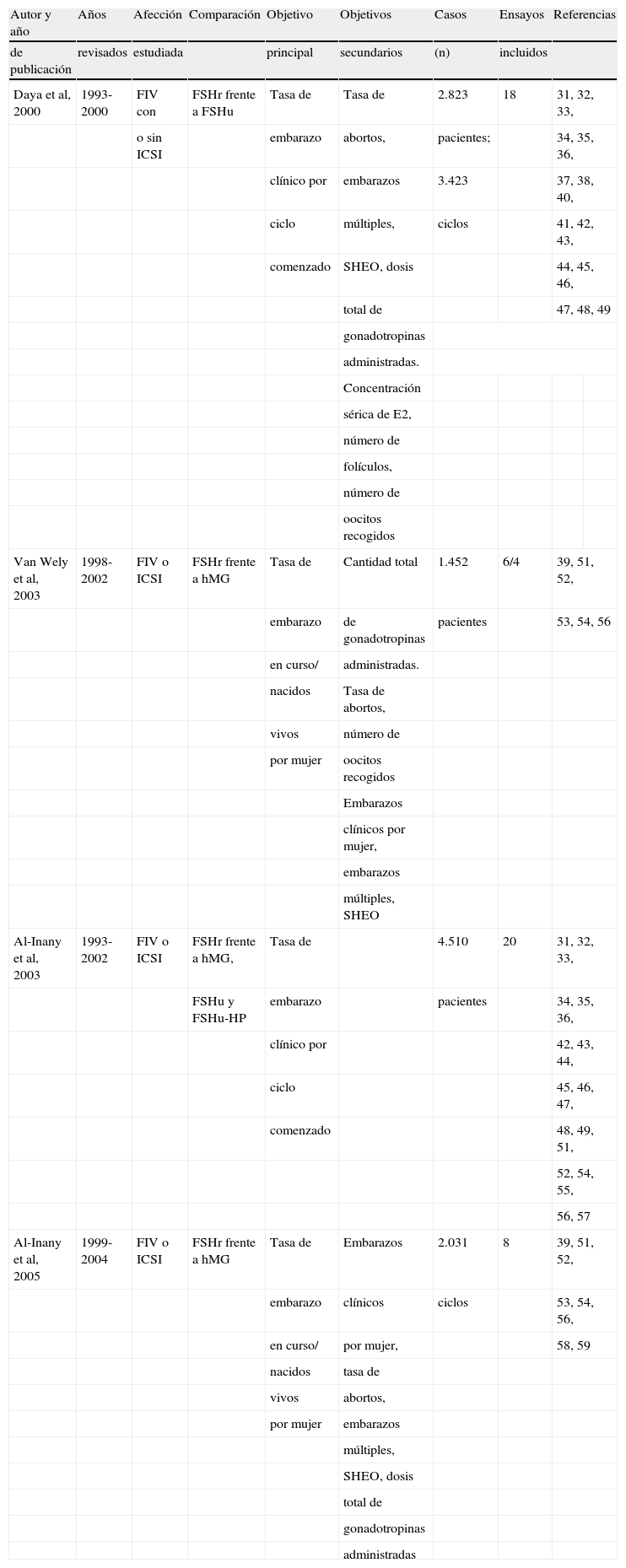
Centrándonos en los estudios con FSHr, Daya y Gunby60 publicaron, en 2000, en la biblioteca Cochrane, un metaanálisis que actualizaron posteriormente en 200266. Este metaanálisis recogía los artículos publicados entre 1993 y 2000, seleccionados según unos criterios de búsqueda bastante habituales; en particular, tenían que ser ensayos clínicos aleatorizados, o con distribución de tratamientos casi aleatorizada, y que estuvieran publicados o en forma de abstracts con información completa. Los autores seleccionaron los artículos que tenían datos suficientes para analizar los resultados de eficacia y seguridad, según unos objetivos primarios y secundarios (tabla 6).
Metaanálisis sobre la comparación de la eficacia de las gonadotropinas. Características
| Autor y año | Años | Afección | Comparación | Objetivo | Objetivos | Casos | Ensayos | Referencias | |
| de publicación | revisados | estudiada | principal | secundarios | (n) | incluidos | |||
| Daya et al, 2000 | 1993-2000 | FIV con | FSHr frente a FSHu | Tasa de | Tasa de | 2.823 | 18 | 31, 32, 33, | |
| o sin ICSI | embarazo | abortos, | pacientes; | 34, 35, 36, | |||||
| clínico por | embarazos | 3.423 | 37, 38, 40, | ||||||
| ciclo | múltiples, | ciclos | 41, 42, 43, | ||||||
| comenzado | SHEO, dosis | 44, 45, 46, | |||||||
| total de | 47, 48, 49 | ||||||||
| gonadotropinas | |||||||||
| administradas. | |||||||||
| Concentración | |||||||||
| sérica de E2, | |||||||||
| número de | |||||||||
| folículos, | |||||||||
| número de | |||||||||
| oocitos recogidos | |||||||||
| Van Wely et al, 2003 | 1998-2002 | FIV o ICSI | FSHr frente a hMG | Tasa de | Cantidad total | 1.452 | 6/4 | 39, 51, 52, | |
| embarazo | de gonadotropinas | pacientes | 53, 54, 56 | ||||||
| en curso/ | administradas. | ||||||||
| nacidos | Tasa de abortos, | ||||||||
| vivos | número de | ||||||||
| por mujer | oocitos recogidos | ||||||||
| Embarazos | |||||||||
| clínicos por mujer, | |||||||||
| embarazos | |||||||||
| múltiples, SHEO | |||||||||
| Al-Inany et al, 2003 | 1993-2002 | FIV o ICSI | FSHr frente a hMG, | Tasa de | 4.510 | 20 | 31, 32, 33, | ||
| FSHu y FSHu-HP | embarazo | pacientes | 34, 35, 36, | ||||||
| clínico por | 42, 43, 44, | ||||||||
| ciclo | 45, 46, 47, | ||||||||
| comenzado | 48, 49, 51, | ||||||||
| 52, 54, 55, | |||||||||
| 56, 57 | |||||||||
| Al-Inany et al, 2005 | 1999-2004 | FIV o ICSI | FSHr frente a hMG | Tasa de | Embarazos | 2.031 | 8 | 39, 51, 52, | |
| embarazo | clínicos | ciclos | 53, 54, 56, | ||||||
| en curso/ | por mujer, | 58, 59 | |||||||
| nacidos | tasa de | ||||||||
| vivos | abortos, | ||||||||
| por mujer | embarazos | ||||||||
| múltiples, | |||||||||
| SHEO, dosis | |||||||||
| total de | |||||||||
| gonadotropinas | |||||||||
| administradas | |||||||||
FIV: fertilización in vitro; FSHr: folitropina recombinante; FSHu: folitropina de origen urinario, lo que incluye FSHu (folitropina purificada) y FSHu-HP (folitropina altamente purificada); ICSI: inyección ovular intracitoplasmática de espermatozoides; hMG: gonadotropina menopáusica humana o menotropina.
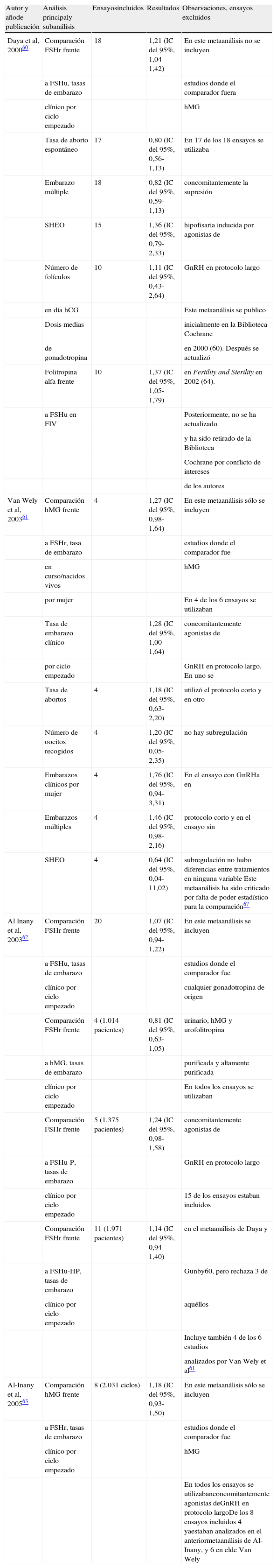
Decidieron incluir a los ensayos que hubieran utilizado una folitropina de origen urinario purificada o altamente purificada en comparación con una FSHr, pero sin incluir estudios con hMG. Además, de acuerdo con la práctica más habitual, incorporaron estudios en los que se utilizaba supresión hipofisaria inducida con agonistas de GnRH con protocolo largo. Con todos estos condicionantes, se incluyeron un total de 18 ensayos que se metaanalizaron conjuntamente para alcanzar un total de 3.423 ciclos. El principal resultado del metaanálisis fue que la hormona recombinante era mejor en términos de número de embarazos clínicos por ciclo empezado que las dos urinarias agrupadas. La ventaja era pequeña, pero estadísticamente significativa 1,21 (intervalo de confianza [IC] del 95%, 1,04-1,42), lo que traducido a términos clínicos significa que la diferencia real entre ambas folitropinas es del 3,7%, o lo que es igual, por cada 19 mujeres tratadas se obtiene un embarazo más con FSHr que con FSH de origen urinario67.
Los resultados secundarios del estudio permitieron además establecer que la folitropina alfa era mejor que las urinarias en términos de embarazos clínicos por ciclo empezado en técnicas de FIV (1,37 [IC del 95%, 1,05-1,79]) y no consiguieron demostrar diferencias entre las FSH comparadas para ninguna otra variable, es decir no demostraron diferencias en términos de embarazos clínicos por oocito recogido, embarazo clínico por embrión transferido, abortos espontáneos, embarazos múltiples, síndrome de hiperestimulación ovárica (SHEO) o número de folículos mayores de 10mm recogidos, aunque algunos estudios demostraron algunas diferencias individualmente67. Tampoco la folitropina recombinante alfa fue superior a las urinarias en FIV más ICSI (tablas 6 y 7).
Metaanálisis sobre la comparación de la eficacia de las gonadotropinas. Resultados
| Autor y añode publicación | Análisis principaly subanálisis | Ensayosincluidos | Resultados | Observaciones, ensayos excluidos |
| Daya et al, 200060 | Comparación FSHr frente | 18 | 1,21 (IC del 95%, 1,04-1,42) | En este metaanálisis no se incluyen |
| a FSHu, tasas de embarazo | estudios donde el comparador fuera | |||
| clínico por ciclo empezado | hMG | |||
| Tasa de aborto espontáneo | 17 | 0,80 (IC del 95%, 0,56-1,13) | En 17 de los 18 ensayos se utilizaba | |
| Embarazo múltiple | 18 | 0,82 (IC del 95%, 0,59-1,13) | concomitantemente la supresión | |
| SHEO | 15 | 1,36 (IC del 95%, 0,79-2,33) | hipofisaria inducida por agonistas de | |
| Número de folículos | 10 | 1,11 (IC del 95%, 0,43-2,64) | GnRH en protocolo largo | |
| en día hCG | Este metaanálisis se publico | |||
| Dosis medias | inicialmente en la Biblioteca Cochrane | |||
| de gonadotropina | en 2000 (60). Después se actualizó | |||
| Folitropina alfa frente | 10 | 1,37 (IC del 95%, 1,05-1,79) | en Fertility and Sterility en 2002 (64). | |
| a FSHu en FIV | Posteriormente, no se ha actualizado | |||
| y ha sido retirado de la Biblioteca | ||||
| Cochrane por conflicto de intereses | ||||
| de los autores | ||||
| Van Wely et al, 200361 | Comparación hMG frente | 4 | 1,27 (IC del 95%, 0,98-1,64) | En este metaanálisis sólo se incluyen |
| a FSHr, tasa de embarazo | estudios donde el comparador fue | |||
| en curso/nacidos vivos | hMG | |||
| por mujer | En 4 de los 6 ensayos se utilizaban | |||
| Tasa de embarazo clínico | 1,28 (IC del 95%, 1,00-1,64) | concomitantemente agonistas de | ||
| por ciclo empezado | GnRH en protocolo largo. En uno se | |||
| Tasa de abortos | 4 | 1,18 (IC del 95%, 0,63-2,20) | utilizó el protocolo corto y en otro | |
| Número de oocitos recogidos | 4 | 1,20 (IC del 95%, 0,05-2,35) | no hay subregulación | |
| Embarazos clínicos por mujer | 4 | 1,76 (IC del 95%, 0,94-3,31) | En el ensayo con GnRHa en | |
| Embarazos múltiples | 4 | 1,46 (IC del 95%, 0,98-2,16) | protocolo corto y en el ensayo sin | |
| SHEO | 4 | 0,64 (IC del 95%, 0,04-11,02) | subregulación no hubo diferencias entre tratamientos en ninguna variable Este metaanálisis ha sido criticado por falta de poder estadístico para la comparación67 | |
| Al Inany et al, 200362 | Comparación FSHr frente | 20 | 1,07 (IC del 95%, 0,94-1,22) | En este metaanálisis se incluyen |
| a FSHu, tasas de embarazo | estudios donde el comparador fue | |||
| clínico por ciclo empezado | cualquier gonadotropina de origen | |||
| Comparación FSHr frente | 4 (1.014 pacientes) | 0,81 (IC del 95%, 0,63-1,05) | urinario, hMG y urofolitropina | |
| a hMG, tasas de embarazo | purificada y altamente purificada | |||
| clínico por ciclo empezado | En todos los ensayos se utilizaban | |||
| Comparación FSHr frente | 5 (1.375 pacientes) | 1,24 (IC del 95%, 0,98-1,58) | concomitantemente agonistas de | |
| a FSHu-P, tasas de embarazo | GnRH en protocolo largo | |||
| clínico por ciclo empezado | 15 de los ensayos estaban incluidos | |||
| Comparación FSHr frente | 11 (1.971 pacientes) | 1,14 (IC del 95%, 0,94-1,40) | en el metaanálisis de Daya y | |
| a FSHu-HP, tasas de embarazo | Gunby60, pero rechaza 3 de | |||
| clínico por ciclo empezado | aquéllos | |||
| Incluye también 4 de los 6 estudios | ||||
| analizados por Van Wely et al61 | ||||
| Al-Inany et al, 200563 | Comparación hMG frente | 8 (2.031 ciclos) | 1,18 (IC del 95%, 0,93-1,50) | En este metaanálisis sólo se incluyen |
| a FSHr, tasas de embarazo | estudios donde el comparador fue | |||
| clínico por ciclo empezado | hMG | |||
| En todos los ensayos se utilizabanconcomitantemente agonistas deGnRH en protocolo largoDe los 8 ensayos incluidos 4 yaestaban analizados en el anteriormetaanálisis de Al-Inany, y 6 en elde Van Wely |
Los datos de esta tabla son los realizados por los propios autores. En el metaanálisis de Daya y Gunby60 de 2000 > 1 implica un mejor resultado para la FSH recombinante, y < 1 para el comparador, al igual que en el metaanálisis de Al-Inany et al62 en 2003. Por eso los resultados globales son parecidos, 1,21 (IC del 95%, 1,04-1,42) y 1,07 (IC del 95%, 0,94-1,22).
En el metaanálisis de Van Wely et al61 de 2003 y Al-Inany et al63 de 2005 los autores representan las cifras en sentido contrario; > 1 implica un mejor resultado para la hMG y < 1, para la FSH recombinante. Por eso 1,27 (IC del 95%, 0,98-1,64) y 1,18 (IC del 95%, 0,93-1,50) sugieren una ventaja a favor de hMG sin llegar a ser significativa. El 1,27 (IC del 95%, 0,98-1,64) de Van-Wely et al63 de 2003 es igual al 0,81 de Al-Inany et al62 de 2003 expresados inversamente, ya que corresponden a los mismos 4 ensayos agrupados. FIV: fertilización in vitro; FSHr: folitropina recombinante; FSHu: folitropina de origen urinario; FSHu-HP: folitropina altamente purificada; FSHu-P: folitropina purificada; hCG: gonadotropina coriónica; hMG: gonadotropina menopáusica humana o menotropina; SHEO: síndrome de hiperestimulación ovárica.
En 2003, Van Wely et al61 publicaron, también en la Biblioteca Cochrane, otro metaanálisis. Pero éste era fundamentalmente distinto. Se recogieron estudios entre 1993 y 2002, se comparó FSHr y hMG y se estudió como parámetro principal de evaluación la tasa de embarazos en marcha o la tasa de nacidos vivos por mujer. En este análisis, y de acuerdo con los criterios de búsqueda, se encontraron 9 ensayos clínicos, pero se incluyeron en el metaanálisis sólo 6 para el análisis principal39,51–54,56–67 (tablas 6 y 7) y 7 para un análisis secundario50.
Los resultados de los 4 estudios realizados con protocolos largos de supresión hipofisaria inducida con agonistas de GnRH señalan una diferencia, en términos de embarazos en marcha o la tasa de nacidos vivos por mujer, favorable a la hMG de 1,27 (IC del 95%, 0,98-1,64), no significativa estadísticamente. En cuanto a los parámetros de evaluación secundarios, el metaanálisis tampoco demostró diferencias entre FSHr y hMG en cuanto a abortos por mujer, embarazos múltiples por mujer, promedio de oocitos recuperados por mujer o SHEO por mujer. Sí encontró una diferencia marginal en embarazos clínicos por mujer de 1,28 (IC del 95%, 1,00-1,64)61. En este caso, por cada 18 mujeres tratadas con HMG se obtendría un embarazo más que con FSHr. En todo caso, este metaanálisis debe considerarse con precaución, ya que establece sus conclusiones a partir de sólo 4 estudios verdaderamente aleatorizados y tiene ciertamente un poder estadístico muy bajo para sus comparaciones68.
Otro punto importante para reseñar aquí es que los metaanálisis de Daya y Gunby60,64 y Van Wely et al61 no se pueden comparar entre sí; uno compara FSHr y folitropinas urinarias, purificada y altamente purificada, y el otro compara FSHr y hMG. Este tema es importante, ya que es práctica común combinar la supresión hipofisaria inducida por agonistas o antagonistas de GnRH con la FSH en la hiperestimulación ovárica controlada en la reproducción asistida. Esta regulación provoca concentraciones circulantes de LH más bajas que en ciclos normales69, y según algunos autores pueden ser la causa de que algunas mujeres tengan niveles endógenos de LH demasiado bajos para el desarrollo folicular70. En estas circunstancias, que en todo caso no se pueden prever de antemano, la utilización de hMG, que tiene una importante actividad LH, podría ser de utilidad frente a la FSHr, libre de ella.
También en 2003 Al-Inany et al62 publicaron otro metaanálisis que comparaba FHSr con todas las FSHu en conjunto, y por separado, incluyendo en el análisis FSHu-P, FSHu-HP y hMG. El parámetro principal de evaluación fue la tasa de embarazos clínicos por ciclo comenzado (como en el metaanálisis de Daya y Gunby60), sin que en la publicación aparezcan otros parámetros secundarios metaanalizados. En este análisis, y de acuerdo con los criterios de búsqueda, se encontraron 20 ensayos clínicos, de los cuales 15 estaban también incluidos en el metaanálisis de Daya y Gunby60; 3 ensayos de los incluidos en aquel metaanálisis se excluyeron, bien por no ser aleatorizados37, no usar protocolo largo de supresión hipofisaria inducida con agonistas de GnRH40 o utilizar un parámetro de evaluación principal distinto41. En el metaanálisis también se incluyen otros 4 estudios51,52,54,56 que coinciden con los del metaanálisis anteriormente citado de Van Wely et al61. Los resultados del metaanálisis completo, con los 20 ensayos seleccionados, y a pesar de incluir 4.610 ciclos, resultaron en una pequeña ventaja a favor de la FHSr: 1,07 (IC del 95%, 0,94-1,22), pero sin diferencias estadísticamente significativas. Los autores hicieron también comparaciones directas según las gonadotropinas utilizadas (tabla 7), sin que en ningún caso se encontraran diferencias estadísticamente significativas. Los datos respecto de la comparación frente a hMG son los mismos que los de Van Wely et al61 y las otras dos comparaciones, las referentes a las folitropinas urinarias (5 ensayos en FSHu-P y 11 ensayos con FSHu-HP) muestran una tendencia favorable a FSHr sin alcanzar la significación estadística (tabla 7), probablemente por que el poder estadístico de la comparación de la muestra por separado sea menor que en el metaanálisis de Daya y Gunby60.
Los mismos autores han publicado otro metaanálisis en 200563. En este caso sólo analizan la comparación FSHr frente a hMG, incluidos sólo ciclos con supresión hipofisaria inducida con agonistas de GnRH con protocolo largo y estudiando como parámetro principal de evaluación la tasa de embarazos en marcha o la tasa de nacidos vivos por mujer, criterios iguales a los utilizados por Van Wely et al61 en su metaanálisis. Los autores incluyen 8 ensayos clínicos con 2.031 ciclos; 6 son iguales a los incluidos por Van Wely39,51–54,56 y 4 son iguales a los incluidos en el anterior metaanálisis de los mismos autores51,52,54,56. De manera que sólo incrementan el metaanálisis en otros 2 estudios pequeños58,59. Los resultados muestran de nuevo una tendencia favorable a hMG: 1,18 (IC del 95%, 0,93-1,50), sin alcanzar la significación estadística (tabla 7). En cuanto a los parámetros de evaluación secundarios, embarazos clínicos por mujer, embarazos múltiples por mujer o SHEO por mujer, tampoco se pudo demostrar diferencias entre FSHr y hMG.
Daya68, en una publicación de 2003, señala que tiene en preparación un nuevo metaanálisis con 40 ensayos en los que analiza gonadotropinas, protocolo de regulación con agonistas de GnRH, día de transferencia del embrión y tipo de TRA. Aunque en la publicación informa de algunos resultados, no hemos podido encontrar el metaanálisis completo publicado (no aparecen referencias a este nuevo estudio en su publicación de 200467), por lo que no lo hemos incluido en esta revisión.
En resumen, los metaanálisis realizados corresponden básicamente a dos aproximaciones (el actualizado en 2002 por Daya y Gunby60 y el realizado en 2003 por Al-Inany et al62), buscan saber si las FSHr son mejores que las urinarias, todas (Al-Inany et al62) o solo las purificadas (Daya y Gunby60). Esta aproximación sugiere en un estudio y demuestra en el otro que la FSHr es mejor que las demás en términos de número de embarazos clínicos por ciclo empezado.
La segunda comparación importante es la que enfrenta a la hormona recombinante con la hMG61,63; en este caso, los dos metaanálisis, el de Van Wely y el segundo de Al-Inany, muestran, en términos de embarazos en marcha o tasa de nacidos vivos por mujer, una tendencia no estadísticamente significativa favorable a la hMG, por lo que no se puede concluir que sea mejor que la FSHr.
Quizás, después de tanto esfuerzo, las conclusiones puedan parecer pobres, probablemente porque las diferencias sean, si existen, pequeñas. Aunque hay otra forma de ver las cosas, los ensayos han demostrado que todas las folitropinas disponibles son eficaces, que nunca las urinarias o la hMG, solas o en combinación, han demostrado ser más eficaces que la FSHr, mientras que, por el contrario, las recombinantes sí han mostrado ser más eficaces que las urinarias purificadas agrupadas.
Los ensayos y los metaanálisis revisados también nos pueden dar información sobre algunos aspectos de seguridad. El SHEA es la complicación más importante de la estimulación ovárica en la infertilidad o en procesos de concepción asistida. El desarrollo de un SHEO es imprevisible, pero se entiende que la juventud de la paciente, la exposición a LH/hCG, los protocolos con agonistas de GnRH, el desarrollo de folículos múltiples o la presencia de ovarios poliquísticos actúan como factores de riesgo.
La tasa de SHEO en FIV oscila entre 1-10%, y es mayor cuando se combinan gonadotropina y agonistas GnRH. Pueden ocurrir casos graves hasta en un 0,25-2% de los ciclos de FIV71. Pues bien, en ninguno de los metaanálisis comentados se ha podido demostrar diferencias en cuanto a la frecuencia de aparición de SHEO entre las FSH utilizadas.
En algunos estudios las pacientes se han quejado de diversos efectos adversos (dolor abdominal, náuseas, vómitos y cefalea), probablemente en relación con el aumento de estrógenos circulantes. Otro efecto adverso frecuente es el dolor o las molestias en el lugar de la inyección de FSH.
En este sentido, hay algunos estudios en que se demuestra que la folitropina alfa se asocia menos frecuentemente a reacciones locales que otras folitropinas72; igualmente hay datos que sugieren que la folitropina alfa origina menos quemazón o dolor que la folitropina beta73,74, y menos aún si se trata de folitropina alfa dosificada según masa75.
Una última pieza del rompecabezas puede ser la aproximación farmacoeconómica. Hay dos características que definen la evaluación económica: una es la medida de los costes y de las consecuencias de la actividad desarrollada y la otra tiene que ver con el objetivo de cualquier evaluación: la elección76. Obviamente, no es necesario hacer muchas aproximaciones farmacoeconómicas cuando el medicamento o procedimiento en estudio es el más eficaz y a la vez el más barato, o al revés, el más caro y menos eficaz; en ambas situaciones la decisión es clara. El problema aparece cuando el medicamento más caro es a la vez el más eficaz; como es habitual, en este caso el objetivo es determinar si esos costes añadidos se compensan con la consecución de más objetivos. Estos objetivos pueden ser de eficacia en la práctica real, y entonces llamamos a estos análisis estudios de coste-efectividad, o con objetivos de utilidad, y los llamamos estudios de coste-utilidad.
Este tipo de aproximaciones no es fácil, ya que exige tener bien establecida la eficacia comparativa, así como todos los costes involucrados. En este capítulo hay que señalar que en los estudios farmacoeconómicos hay que prestar atención, y no siempre se hace, a diferentes tipos de costes, costes directos, costes indirectos y costes intangibles. Son costes directos médicos y no médicos los costes de la medicación, por ejemplo, las gonadotropinas en las TRA y los de cada uno de los procesos médicos involucrados, por ejemplo la obtención de óvulos, la congelación o la implantación, pero también los costes en personal de todos los actores involucrados y el coste de recuperación de efectos adversos, por ejemplo. Son costes indirectos aquellos que derivan de la enfermedad pero no están directamente relacionados con el procedimiento, por ejemplo los relacionados con los cambios de capacidad productiva y la mengua en los ingresos económicos de la baja laboral. Los costes intangibles son aún más difíciles establecer; por ejemplo, es un coste intangible el dolor por la pérdida de un embarazo. En la práctica, muchos de estos datos son difíciles de establecer, de manera que en la mayoría de los ensayos clínicos hay pocos datos de evaluación de costes.
En los estudios comparativos entre gonadotropinas y en los metaanálisis publicados en este tema apenas se informa de otra cosa que no sea el consumo total de gonadotropinas o el número medio de ciclos utilizados33,36,37,46,48,49,61–63,66. Es, por tanto, frecuente que los estudios farmacoeconómicos publicados se limiten a considerar la eficacia a partir de datos de un estudio, generalmente pequeño, o de un metaanálisis, y los datos económicos de los gastos médicos directos (costes de pruebas, exploraciones o procedimientos) de tablas estándar publicadas por instituciones o sistemas de salud. En el caso de los tratamientos para la infertilidad, existen además muchas más variables que se deben considerar, como el número de ciclos de estimulación ovárica, y diversas consecuencias o desenlaces después de cada procedimiento, por ejemplo, la transferencia de embriones frescos o congelados, la ausencia/presencia de fecundación, el embarazo/no embarazo, la aparición/no aparición de un SHEO y el aborto/no aborto. Para analizar todas estas variables, se ha venido utilizando un modelo computarizado, basado en un modelo de Markov77, que considera todas estas variables, acoplado a una simulación informática que repite al azar todas las posibilidades existentes (modelo Monte-Carlo) en función de unas frecuencias preestablecidas78,79 y que nos proporciona al final una estimación de los costes finales totales de acuerdo con las tasas de eficacia demostradas en los ensayos o en los metaanálisis.
En la literatura científica se pueden encontrar publicaciones que han utilizado esta aproximación para realizar estimaciones de coste-efectividad en diversos países y situaciones. Todas ellas utilizan como fuente de datos para establecer la eficacia y la cantidad de gonadotropinas utilizadas el metaanálisis de Daya y Gunby60, en el que la FSHr se demuestra superior a las FSH urinarias purificadas combinadas, extrayendo los datos de costes de procedimientos y las probabilidades de las distintas evoluciones posibles de fuentes locales. De esta manera, diversos estudios, uno británico80, uno italiano81, otro griego82, uno norteamericano83 y dos españoles79,84, concluyen que la FSHr es más coste-efectiva que las FSH urinarias purificadas.
Recientemente se ha publicado otro análisis de coste-efectividad con datos de un país en desarrollo donde, siguiendo el mismo modelo computarizado de Markov y el mismo proceso de análisis de las diversas posibilidades de evolución en las mujeres en programa de fertilización in vitro, se ha comparado el coste de la FSHr con la hMG. Los datos de eficacia y consumo de gonadotropinas se han tomado del metaanálisis de Al-Inany et al63, que no demostraba diferencias entre ambas gonadotropinas. En Egipto, la diferencia en costes farmacéuticos entre ambas preparaciones de FSH es muy importante, por lo que el análisis concluye que a igualdad de eficacia la hMG es más coste-efectiva85.
CONCLUSIONES- 1.
Las FSH de origen recombinante presentan ventajas sobre las otras hormonas presentes en el mercado de índole técnica, tienen mayor pureza, mayor actividad específica y gran homogeneidad entre lotes. En el caso de la folitropina alfa, como consecuencia de su dosificación en base a masa, se puede alcanzar un mejor ajuste de dosis, y quizás, por su mayor homogeneidad, mejor tolerancia local.
- 2.
Todas las folitropinas presentes en el mercado son seguras. Nunca ha habido casos de transmisión de enfermedades infecciosas por la utilización de FSH presentes en el mercado. Ahora bien, el proceso de fabricación de las hormonas recombinantes está regulado de tal manera que se puede garantizar absolutamente cada proceso desde el principio hasta el final. Las FSH de origen urinario se obtienen por procesos regulados y garantizados, pero no se puede asegurar la trazabilidad de la muestra inicial, por lo que siempre quedará la duda sobre la salud de las donantes.
- 3.
Los ensayos clínicos han demostrado que todas las folitropinas disponibles son eficaces, aunque nunca las de origen urinario o la hMG, solas o en combinación, han demostrado ser más eficaces que la recombinante. Por el contrario, las recombinantes sí han mostrado ser más eficaces en un metaanálisis que las urinarias purificadas agrupadas.
El autor ha recibido una ayudad docente no condicionada para la revisión de este tema por parte de Merck-Serono.