La hemofilia A adquirida (HAA) posparto es una entidad extremadamente infrecuente (100 casos descritos en la literatura) y potencialmente grave. Se caracteriza por la aparición de anticuerpos antifactor viii (FVIII) circulante, que producen clínica hemorrágica en el puerperio, sin afectar al feto. Por lo general, los anticuerpos desaparecen espontáneamente en las primeras semanas o meses y no se reproduce en gestaciones posteriores.
Pese a que el retraso en el diagnóstico puede ser fatal, la HAA posparto presenta buena respuesta al tratamiento procoagulante e inmunosupresor, siendo de mejor pronóstico que otras causas de hemofilia A. Por esta razón, ante síntomas como metrorragia incoercible sin causa obstétrica que lo justifique y signos como pruebas de coagulación alteradas, debemos sospechar esta enfermedad y realizar las pruebas diagnósticas de confirmación para instaurar sin demora el tratamiento sintomático y etiológico.
Postpartum acquired hemophilia A is an extremely rare (100 cases in the literature) and potentially serious disease. Anti-circulating factor viii (FVIII) antibodies develop in the puerperium, leading to hemorrhagic symptoms without fetal danger. In general, the antibodies disappear spontaneously in the first few weeks or months after delivery and do not recur in subsequent pregnancies.
Even though a delay in diagnosis can be fatal, postpartum hemophilia A has a good response to treatment and a better prognosis than other causes of hemophilia A. Consequently, it is important to suspect this disease in the presence of symptoms such as intractable vaginal bleeding without underlying obstetric disorders and signs such as abnormal coagulation tests. The correct diagnostic tests must be carried out to establish symptomatic and etiologic treatment without delay.
La hemofilia A adquirida (HAA) es un trastorno hemorrágico causado por anticuerpos policlonales (normalmente IgG tipo 4 y menos frecuentemente tipo 1) contra el FVIII da la coagulación1. Su incidencia es de 0,2-1 por millón de personas por año2, de los cuales sólo un 7-11% corresponde a HAA posparto.
La HAA es idiopática en el 50% de los casos y en el resto está asociada a enfermedades autoinmunes, trastornos inmunoproliferativos, tumores sólidos o ingesta de algunos fármacos (fenitoína, penicilina o metildopa), desarrollándose frecuentemente en pacientes de edad avanzada2.
La HAA posparto se presenta con mayor frecuencia en mujeres primigestas, comenzando con complicaciones hemorrágicas en el puerperio, que pueden desarrollarse hasta 12 meses tras el parto, o muy raramente durante el embarazo1. Las manifestaciones hemorrágicas varían desde sangrado leve por heridas cutáneas hasta grandes hematomas subcutáneos y musculares, e incluso episodios de hemorragia sistémica de gran riesgo vital, aunque la mayoría son oligosintomáticas, presentando como único síntoma metrorragia posparto.
En estos casos, es importante tener un alto índice de sospecha de HAA posparto, puesto que la inespecífica sintomatología puede llevar a un retraso en el diagnóstico y suponer un importante riesgo para la paciente.
A continuación, presentamos un caso de HAA posparto cuya única manifestación clínica fue la hemorragia.
Caso clínicoPresentamos el caso de una paciente primípara de 33 años, que 21 días después de un parto eutócico comenzó con una intensa metrorragia puerperal, por lo que fue sometida a 2 legrados en el puerperio, realizados de forma extraclínica, sin mejoría sintomática.
En la exploración física, se evidenció metrorragia activa de moderada cantidad, sin objetivarse desgarros en el canal blando de parto. El cérvix se encontraba permeable y el útero bien involucionado. El abdomen era blando y depresible, sin signos de irritación peritoneal. Las constantes vitales fueron normales.
Las pruebas complementarias revelaron los siguientes datos:
- –
Ecografía transvaginal: útero regular con endometrio lineal, sin restos placentarios.
- –
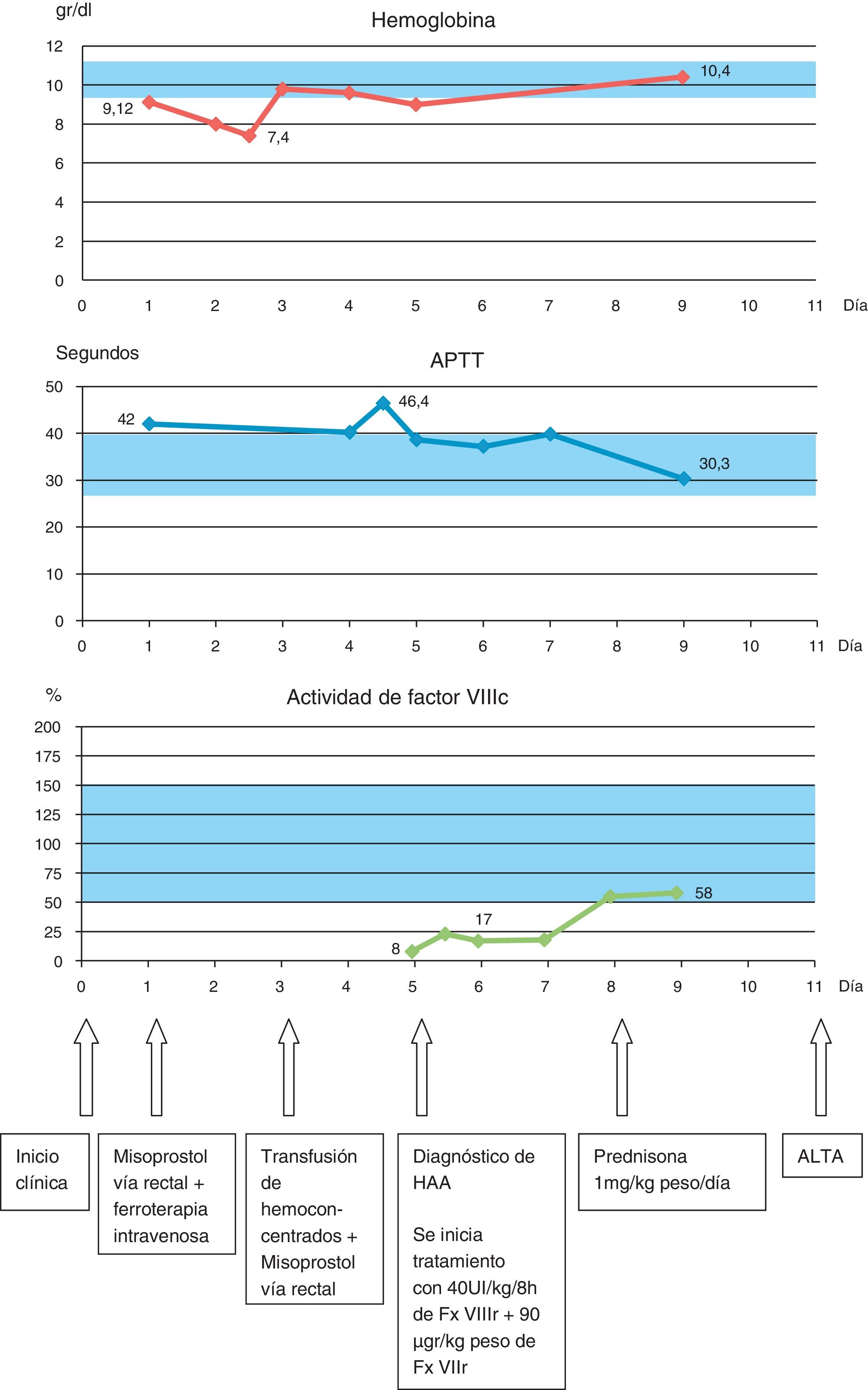
Hemograma: hemoglobina 9,2 g/dl, con recuento plaquetario normal (332.000/μL). TTPA alargado, 42 s (26,5 a 39,5 s). Resto de las pruebas de coagulación, normales.
En las horas sucesivas, persistió y empeoró la metrorragia anemizante, llegando a precisar prostaglandinas por vía rectal, ferroterapia por vía intravenosa y transfusión de 4 concentrados de hematíes.
Dada la ausencia de afección orgánica del aparato genital, se consultó al Servicio de Hematología por el hallazgo de TTPA alargado, iniciándose un estudio de factores de coagulación y diagnosticando, a los 4 días del inicio de la clínica, un déficit severo de factor viii(FVIII).
Se inició tratamiento sustitutivo con FVIII recombinante a una dosis de 40 U/kg cada 8 h y FVIII recombinante, 90 μg/kg, repartido en 2 dosis, cesando la metrorragia a partir de la segunda dosis. Se consolidó el tratamiento con FVIII de origen plasmático precisando solo una dosis.
Ante la sospecha de la existencia de inhibidores del FVIII, se administró prednisona 1mg/kg de peso.
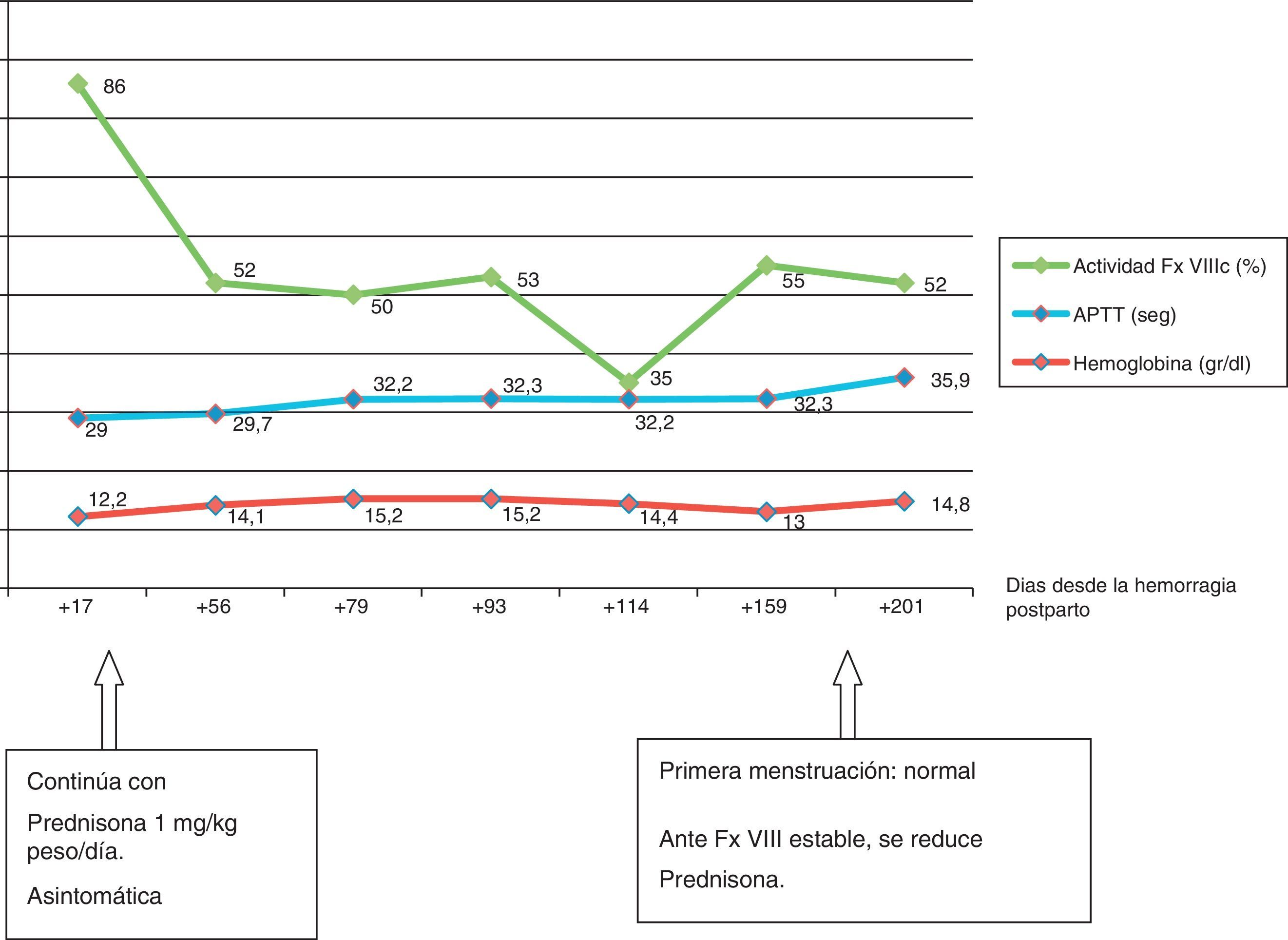
A los 4 días de iniciar el tratamiento, los niveles de FVIII ascendieron y se estabilizaron en 55%; la paciente se encontraba asintomática, por lo que se decidió alta hospitalaria, realizando tratamiento ambulatorio con controles semanales (fig. 1).
El seguimiento se ha realizado durante 6 meses hasta el momento actual, encontrándose la paciente asintomática, aunque continúa tratamiento con prednisona 60mg/día y en pauta descendente (fig. 2).
DiscusiónLa HAA por desarrollo de inhibidores de FVIII de la coagulación es una causa rara pero grave de hemorragia puerperal en mujeres previamente sanas, con niveles normales de anticuerpos hasta el posparto3. El riesgo de desarrollar la enfermedad es mayor en mujeres primíparas4, aunque se han descrito casos de aparición de inhibidores durante la gestación y en multíparas3. Los síntomas comienzan normalmente en los primeros 3 meses tras el parto (tal es el caso de nuestra paciente, que desarrolló la clínica en el vigésimo día posparto), pero pueden aparecer hasta 12 meses después3.
Debemos sospechar HAA posparto en pacientes que durante el puerperio presentan metrorragia sin causa obstétrica aparente y en ausencia de historia previa de diátesis hemorrágica2,5. Las manifestaciones clínicas no suelen correlacionarse con los niveles de inhibidores2. Aunque hay casos descritos en la literatura, no es frecuente que aparezcan equimosis dramática, grandes hematomas de tejidos blandos ni hemartrosis (a diferencia de la hemofilia congénita)2. La HAA posparto tampoco se asocia normalmente a trastornos inmunológicos, como otras causas de HAA, que suceden en personas de mayor edad.
Sin embargo, tanto en trastornos inmunitarios como en el embarazo normal, se conoce que existe una alteración de la reactividad del sistema inmunológico, por lo que el desarrollo de la HAA posparto se podría explicar como una alteración temporal de la tolerancia materna a su propio FVIII6.
El diagnóstico se realiza mediante pruebas de hematología y coagulación. Un tiempo parcial de tromboplastina activada alargado con un tiempo de protrombina normal indica un defecto en la vía intrínseca de la coagulación3. A diferencia del defecto congénito de FVIII, estos parámetros no se corrigen con la adición de plasma normal en proporción 1:12,3. La hemofilia A se diagnostica cuando el FVIII está disminuido pero todas las medidas de factor von Willebrand (antígeno de FVIII y actividad del cofactor de ristocetina) son normales7. La cuantificación de niveles de inhibidor de FVIII se realiza por los métodos Bethesda o New Oxford8, y permitirá establecer el tratamiento y seguir la evolución de la paciente.
El manejo de la HAA posparto tiene como objetivos detener la hemorragia, aumentar los niveles de FVIII endógeno y disminuir los niveles del inhibidor9.
Lo más importante es evitar que la hemorragia ponga en riesgo vital a la paciente, por lo que de manera urgente se debe restaurar el sistema de coagulación. A pesar de que en casos leves se podría mantener una actitud expectante hasta la remisión espontánea del cuadro, el riesgo de hemorragia persiste hasta que se negativizan los niveles del inhibidor y las consecuencias de no instaurar tratamiento pueden ser fatales, por lo que si existe mala tolerancia por parte de la paciente consideramos justificado el tratamiento.
Actualmente, el tratamiento de primera línea son los agentes con efecto by-pass (Factor Eight Inhibitor Bypassing Agent, FEIBA®) y el FVIII recombinante activado, que estimulan la cascada de la coagulación, evitando el efecto del inhibidor10. Los agentes con efecto bypass se han asociado a efectos secundarios, como trombosis, infarto o hemorragia debida a coagulación vascular diseminada11. Los concentrados de complejos de protrombina o el FVIII porcino también dan buenos resultados, en caso de no disponibilidad de los agentes de primera línea. El FVIII porcino es altamente efectivo incluso con niveles altos de inhibidos, aunque al ser una proteína de origen animal puede provocar reacciones alérgicas y anafilaxis.
Si los niveles de inhibidor son elevados (> 10 unidades Bethesda) y la respuesta a los fármacos anteriores baja, la plasmaféresis con o sin inmunoabsorción extracorpórea puede ser necesaria. En cambio, si los niveles anteriores son bajos, la respuesta a concentrados de FVIII humano a altas dosis suele ser buena2, sin necesidad de recurrir a los agentes de primera elección, mucho más costosos.
El tratamiento etiológico pretende disminuir los niveles de inhibidor del FVIII, para lo cual se utilizan fármacos inmunosupresores, como corticoides, ciclofosfamida o azatioprina, e incluso inmunoglobulina G por vía intravenosa. Aunque la probabilidad de desaparición espontánea de los inhibidores es prácticamente del 100%, el tratamiento con inmunosupresores se asocia a un menos tiempo de remisión2.
En el caso de nuestra paciente, el tratamiento se realizó con FVIII recombinante a dosis de 40 U/kg cada 8-12h, FVIII humano y prednisona 90mg/día. La evolución clínica fue favorable, cediendo los síntomas hemorrágicos a las 18 horas de instaurar tratamiento.
Como conclusión, la HAA posparto debe ser sospechada en cualquier puérpera con metrorragia de causa no obstétrica. Las pruebas básicas de coagulación permitirán orientar el diagnóstico, que se confirmará por la presencia de inhibidores de FVIII plasmático. Aunque la remisión suele ser espontánea, el tratamiento procoagulante e inmunosupresor puede ser necesario para evitar las graves complicaciones de esta enfermedad. El pronóstico a largo plazo es bueno y la tasa de recurrencia prácticamente nula.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.